中国白酒作为世界上著名的六大蒸馏酒之一,因其悠久的历史、独特的风格特征和丰富的文化内涵而深受广大消费者喜爱[1-2]。中国白酒包含不同的种类或品系,如酱香型白酒、浓香型白酒、清香型白酒等十二大香型白酒[3-5]。其中,酱香型白酒是现存白酒酿造工艺最为复杂,也是风味最为丰富的一种香型,具有“四高两长”的工艺特点,即高温制曲、高温堆积、高温发酵、高温流酒以及生产周期长、贮藏时间长等特点[6]。高温大曲的制备是其品质和风格形成的关键工艺之一[7-8]。
高温大曲因其制曲过程中环境因素的空间差异形成了不同特征的大曲。在堆放过程中,不同的空间位置(如曲房中堆放的位置、堆放的内层和外层)局部环境(如温度、水分、氧浓度等)存在差异,从而形成不同特征的成品曲,且在颜色上差异明显[9]。如果发酵前期温度适宜,发酵后期干燥充分,会出现黄色大曲;发酵前期温度过低,发酵后期干燥差,会出现白色大曲;在发酵前期由于升温较快且后期干燥不充分会导致大曲发黑,出现黑色大曲[10]。生产中常通过经验将上述不同颜色的曲搭配使用,以最佳配比使高温大曲在整体上达到优质曲的生产效果。
高温大曲作为酱香白酒重要的发酵剂和糖化剂,含有丰富的微生物和各种酶类,是酱香型白酒酿造过程中的内在驱动力[11-12]。其中以茅台地区的高温大曲最为典型,因为地处赤水河谷地,贵州高原最低点,年降水量800~900 mm,年无霜期326 d,持续高温5个月(35~39 ℃),一年当中长达1 400 h的阳光照射,长期的高湿、高温环境孕育了优良的功能微生物,从而为酿造优质的酱香型白酒奠定了先天优势,这也是茅台地区的白酒品质保持稳定性和独特性的重要原因[13]。目前对于高温大曲的研究多集中于解析高温大曲的微生物构成以及功能微生物的筛选和初步应用[14]。如报道有高温大曲中常见的细菌有芽孢杆菌、乳酸菌、醋酸菌等[15-16];常见的真菌有酿酒酵母、假丝酵母、产酯酵母、米根霉、黑曲霉等[17-18]。此外,也有关于不同地区、不同厂家的高温大曲在微生物的种类及丰度上存在差异研究[19-20]。然而,对于同一厂家同一批次的高温大曲因局部环境差异引起的微生物分布差异,以及特征不同的高温大曲搭配使用工艺等的相关研究鲜有报道。
本研究采用理化分析结合高通量测序技术对不同高温大曲的理化特征和微生物群落结构进行分析,旨在为酱香型白酒企业配曲工艺提供理论指导,促进酱香型白酒智能化制曲应用。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
同批次的五种高温大曲:普通曲、优质曲、白曲、黄曲、黑曲,每个样品取样量为1 kg粉碎后备用,其中优质曲、普通曲是根据长期的生产经验和数据积累进行定义,优质曲的配比为黄曲(85%)、黑曲(10%)、白曲(5%),普通曲的配比为黄曲(30%)、黑曲(35%)、白曲(35%)。以上样品均由贵州无忧酒业(集团)有限公司提供。
1.1.2 化学试剂
无水乙醇、浓硫酸、氢氧化钠、酚酞等(均为分析纯):天津市福晨化学试剂厂;乙酸乙酯、己酸乙酯等标准品(均为色谱纯):美国Sigma-Aldrich公司;TAE缓冲液:北京索莱宝科技有限公司;引物:上海生物工程股份有限公司;脱氧核糖核酸(deoxyribonucleic acid,DNA)Marker:日本Takara公司;琼脂糖:南京生兴生物技术有限公司;核酸染料Gengreen:上海赛百盛有限公司;土壤DNA提取试剂盒(E.Z.N.A.Soil DNA Kit):美国Omega Bio-Tek公司。
1.2 仪器与设备
CP1502电子天平:上海奥豪斯仪器有限公司;HH-S6A电热恒温水浴锅:北京利伟永兴仪器有限公司;PX2型聚合酶链式反应(polymerase chain reaction,PCR)仪:上海赛默生物科技有限公司;DYY5稳压电泳仪:北京六一仪器厂;GeI Image System Tanon 1600凝胶成像仪:上海天能科技有限公司;ND-ONEC-U微量分光光度计:赛默飞世尔科技(中国)有限公司;Agilent 1200高效液相色谱仪(紫外检测):安捷伦科技(中国)有限公司;AutoSystem XL气相色谱仪、Clarns 600气相色谱-质谱联用仪:珀金埃尔默(中国)股份有限公司;ICS-3000离子色谱仪:戴安(中国)有限公司。
1.3 实验方法
1.3.1 高温大曲理化指标的测定
不同类型高温大曲的理化指标(糖化力、液化力、酯化力、发酵力、酸度等)依据QB/T 4257—2011《酿酒大曲通用分析方法》测定[21]。
糖化力单位:在35 ℃、pH4.6条件下,1 g大曲1 h转化可溶性淀粉生成葡萄糖的毫克数为一个单位(U),以“mg/(g·h)”表示。
液化力单位:在35 ℃、pH4.6条件下,1 g绝干曲1 h能液化淀粉的克数为一个单位(U),以“g/(g·h)”表示。
酯化力单位:每50g大曲在35℃,经过7d催化己酸和乙醇合成己酸乙酯的毫克数为一个单位(U),以“mg/(50 g·7 d)”表示。
发酵力单位:在30 ℃,72 h内0.5 g大曲利用可发酵糖类所产生的二氧化碳克数为一个单位(U),以“g/(0.5 g·72 h)”表示。
1.3.2 大曲总DNA的提取及测序
(1)总DNA的提取[22-23]
称取不同类型高温大曲5 g用液氮速冻后迅速研磨。大曲总DNA提取方法按照土壤DNA提取试剂盒(E.Z.N.A.Soil DNA Kit)操作说明书。为了保证所提取的基因组的浓度及纯度对其进行PCR扩增及产物纯化,对细菌16S rRNA基因的V3-V4高变区进行扩增,引物为338F/806R(5'-ACTCCTACGGGAGGCAGCA-3'/5'-GGACTACHVGGGTWTCTAAT-3');对真菌的内部转录间隔区(ITS1)进行扩增,所用引物为ITS5F/ITS1R(5'-GGAAGTAAAAGTCGTAACAAGG-3'/5'-GCTGCGTTCTTCATCGATGC-3')。扩增后用1%琼脂糖凝胶电泳进行检测。
(2)高通量测序
将检测合格样品送往天津诺和致源生物信息科技有限公司,通过高通量测序(Illumina Miseq PE250)平台进行高通量测序,细菌使用SILVA138数据库进行物种注释,真菌使用Unit(v8.2)数据库进行物种注释,以上均使用Nova Seq6000进行上机测序,测序策略PE250。
1.3.3 数据分析
每个样品至少3次重复,实验数据以“平均数±标准差”表示,显著性差异以P<0.05为标准。典范对应分析(canonical correspondence analysis,CCA)和冗余分析(redundancy analysis,RDA)采用CAVOCO 4.5软件。
2 结果与分析
2.1 不同高温大曲理化特征分析
理化指标是评价高温大曲品质的重要依据[24-25],对五种不同高温大曲的糖化力、液化力、酯化力、发酵力和酸度等理化指标进行分析,结果见表1。
表1 不同高温大曲的理化指标
Table 1 Physicochemical indexes of different high-temperature Daqu
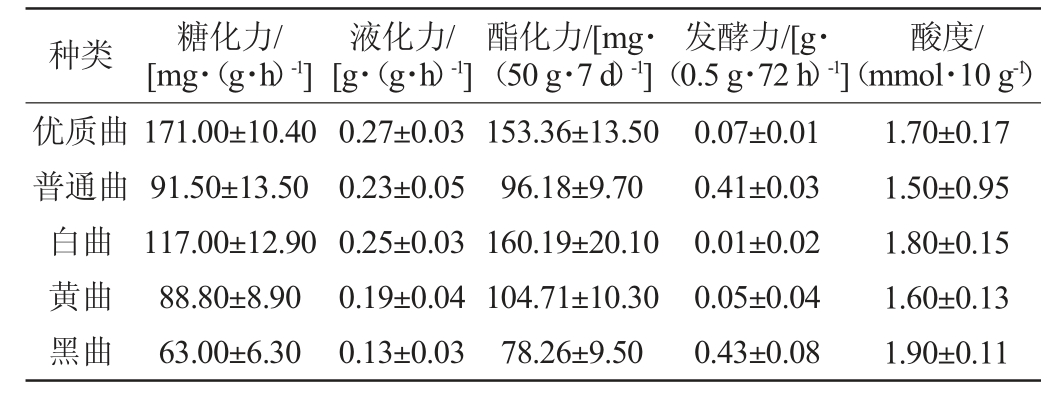
由表1可知,五种高温大曲的糖化力在63.0~171.0 mg/(g·h)之间,其中优质曲的糖化力(171.0 mg/(g·h))最大,黑曲的糖化力(63.0 mg/(g·h))最小,糖化力大小的顺序依次为优质曲>白曲>普通曲>黄曲>黑曲。五种高温大曲的液化力范围为0.13~0.27 g/(g·h),其中优质曲的液化力最高(0.27 g/(g·h)),黑曲的液化力最低(0.13 g/(g·h)),五种曲的液化力大小顺序为优质曲>白曲>普通曲>黄曲>黑曲,这与糖化力的大小顺序一致。在酯化力指标上,五种曲的酯化力范围是78.26~160.19 mg/(50 g·7 d),其中白曲的酯化力(160.19 mg/(50 g·7 d))最大,黑曲的酯化力最小(78.26 mg/(50 g·7 d)),五种曲的酯化力大小顺序为白曲>优质曲>黄曲>普通曲>黑曲。五种曲的发酵力大小处于0.01~0.43 g/(0.5 g·72 h)之间,其中黑曲的发酵力最大(0.43 g/(0.5 g·72 h)),白曲的发酵力最小(0.01 g/(0.5g·72h)),五种曲的发酵力大小顺序为黑曲>普通曲>优质曲>黄曲>白曲。五种曲的酸度范围为1.5~1.9mmol/10g,其中黑曲的酸度(值为1.9 mmol/10 g)最大,普通曲的酸度(值为1.5mmol/10 g)最小,五种曲的酸度大小顺序为黑曲>白曲>优质曲>黄曲>普通曲。
综上,优质曲的糖化力和液化力数值均高于其他种类的曲,糖化力和液化力较高是其最大特点。白曲的发酵力在几种曲中最低,远低于其他几种高温大曲,但白曲的酯化力最高,因此,白曲以发酵力弱、酯化力强为特点;而优质曲的发酵力处于中等水平、酯化力仅次于白曲。黄曲的糖化力、液化力、酯化力、发酵力和酸度几种理化指标均处于五种曲形成的理化范围之内,与其他几种曲相比各理化指标适中。黑曲的发酵力数值均大于其他几种曲,发酵力突出,且其糖化力、液化力、酯化力均是几种曲中最低,具有发酵力高,糖化力、液化力、酯化力低的特点,此外,其酸度也高。
2.2 不同高温大曲细菌群落结构分析
2.2.1 细菌群落多样性分析
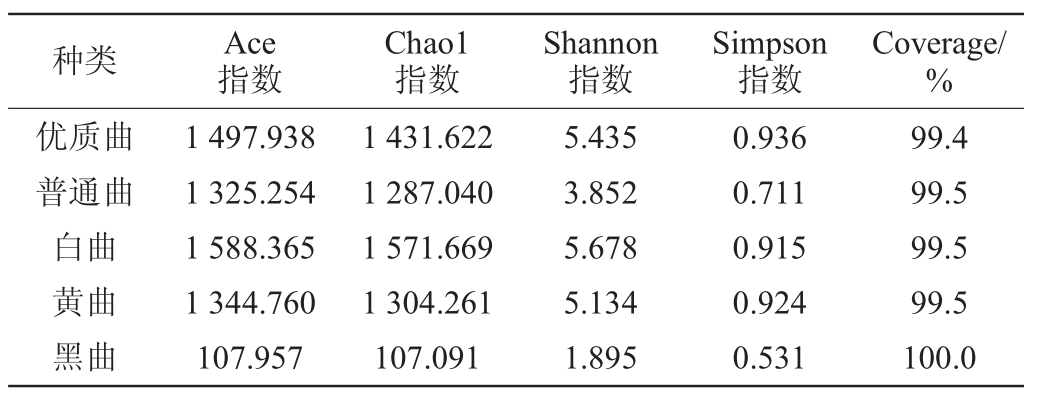
采用高通量测序(16S rRNA)技术对不同高温大曲中的细菌进行分析,α多样性指数分析结果见表2。由表2可知,α指数多样性分析显示五种高温大曲的Coverage均在99%以上,样品的测序覆盖率高,测序结果能够真实性反映样品中的微生物群落结构[26]。Shannon指数和Simpson指数显示,五种高温大曲的群落多样性可分为三个等级,其中,优质曲、黄曲和白曲的两种指数的数值较大,且这三种曲的两指数数值相差不大;其次是普通曲,两指数最小的是黑曲,因此,优质曲、黄曲和白曲的群落多样性较高,其次是普通曲,群落多样性最低的是黑曲。Chao1指数和Ace指数显示,五种高温大曲按照这两种指数的数值大小进行排序,体现群落丰富度的两指数的大小顺序一致,因此,五种高温大曲的群落丰富度大小依次为:白曲>优质曲>黄曲>普通曲>黑曲,其中黑曲的Chao1指数和Ace指数数值均远小于其他种类的曲。
表2 不同高温大曲细菌α多样性指数分析结果
Table 2 Results of alpha diversity indexes of bacteria in different high-temperature Daqu
采用韦恩图(图1)对五种大曲的群落丰富度进一步分析,结果显示,五种大曲中共检测到2 238个操作分类单元(operational taxonomic units,OTU),不同高温大曲中OTU的个数分别为:优质曲(1 275)、普通曲(1 164)、白曲(1 426)、黄曲(1 188)和黑曲(88)。其中,白曲的OTU个数最多,黑曲的OTU个数最少,这说明白曲的群落丰富度最高,黑曲的群落丰富度最低,与Chao1指数和Ace指数分析得出的群落丰富度的结果一致。
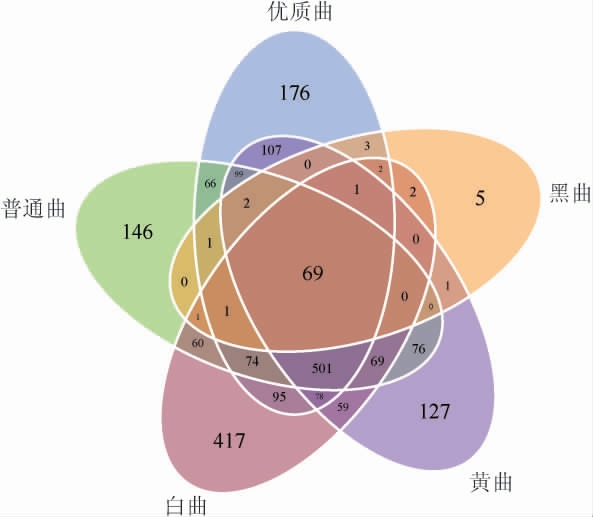
图1 不同大曲细菌OTU分析结果韦恩图
Fig.1 Venn diagram of bacterial OTU analysis results of different Daqu
2.2.2 细菌群落结构分析
五种高温大曲样品中细菌的种类及相对丰度在属水平上的分析结果见图2。由图2可知,在属水平上,五种高温大曲涉及的主要细菌(占比>1%)有:Unidentified Mitochondria、芽孢杆菌属(Bacillus)、大洋芽孢杆菌属(Oceanobacillus)、乳杆菌属(Lactobacillus)、高温放线菌属(Thermoactinomyces)、Kroppenstedtia、魏斯氏菌属(Weissella)、片球菌属(Pediococcus)、链球菌属(Streptococcus)、醋杆菌属(Acetobacter)等。
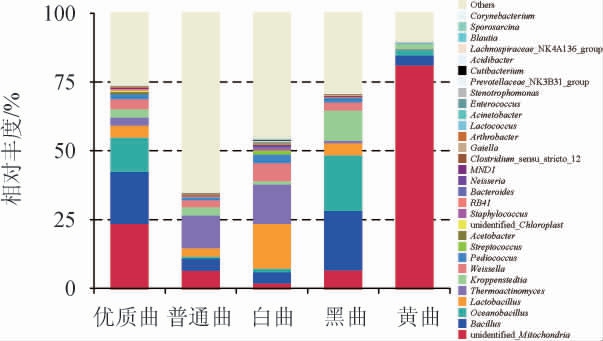
图2 不同高温大曲在属水平上的细菌菌群结构
Fig.2 Bacterial community structure of different high-temperature Daqu at genus level
在不同样品中,细菌的种类、丰度等方面的菌群结构特征不同[27]。不同高温大曲属水平主要细菌(占比>1%)占比结果见表3。
表3 不同高温大曲属水平主要细菌占比
Table 3 Main bacteria proportion in different high temperature Daqu at genus level%
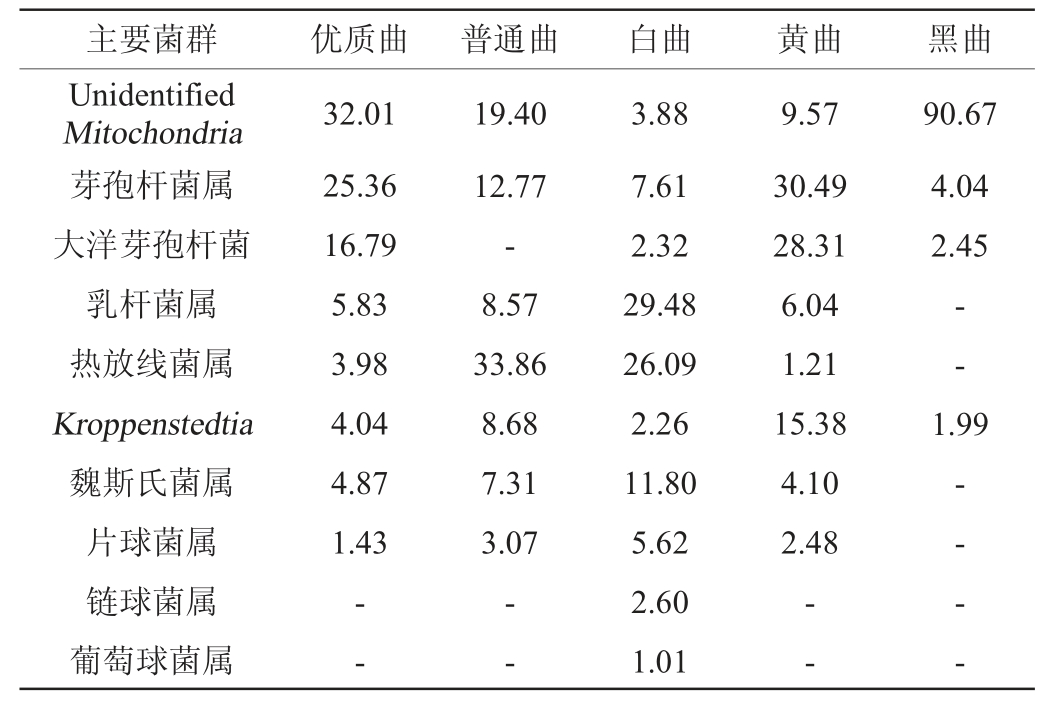
注:“-”表示无该类菌。下同。
由表3可知,细菌群落丰富度大小依次为:白曲>优质曲>黄曲>普通曲>黑曲,白曲丰富度最高,其次是黄曲,黑曲丰富度最低。Unidentified Mitochondria、芽孢杆菌属是优质曲的优势细菌菌群;Unidentified Mitochondria、高温放线菌属是普通曲的优势细菌菌群;乳杆菌属、高温放线菌属是白曲的优势细菌属;芽孢杆菌属、大洋杆菌属是黄曲的优势细菌属;Unidentified Mitochondria是黑曲的优势细菌属。根据不同颜色大曲在优质曲中的配比,黄曲是优质曲中的主体,优质曲的丰富度与黄曲接近,这与细菌群落丰富度分析结果一致。优质曲制备过程中,作为主体的黄曲中添加群落丰富度更高的白曲,使得优质曲的群落丰富度高于黄曲,介于黄曲和白曲之间。
2.3 不同高温大曲真菌群落结构分析
2.3.1 真菌群落多样性分析
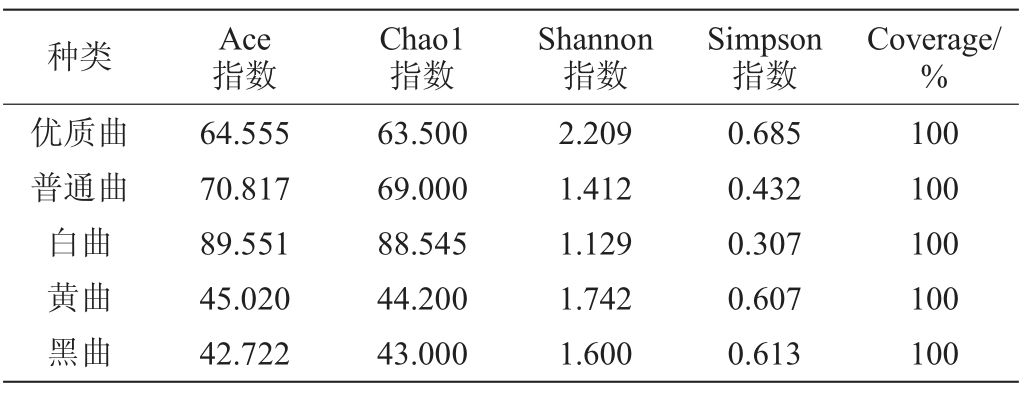
采用高通量测序技术对不同高温大曲中的真菌进行分析,真菌α多样性指数分析结果见表4。结果表明,五种高温大曲的Coverage均在100%,样品的测序覆盖率高,测序结果能够真实性反映样品中的微生物群落结构。Shannon指数和Simpson指数显示,五种高温大曲的真菌群落多样性也可分为三个等级,其中,优质曲的两种指数的数值最大;其次是黄曲和黑曲,两指数较小的是普通曲和白曲,因此,优质曲的群落多样性最高,其次是黄曲和黑曲,群落多样性较低的是普通曲和白曲。基于Chao1指数和Ace指数的五种高温大曲群落丰富度的大小顺序一致,依次为:白曲>普通曲>优质曲>黄曲>黑曲。
表4 真菌α多样性指数分析结果
Table 4 Analysis results of alpha diversity indexes of fungus
采用不同大曲真菌OTU分析的韦恩图(图3)对五种大曲中真菌的群落丰富度进一步分析,结果显示,五种大曲中真菌共检测到139个OTU,不同高温大曲中真菌OTU的个数分别为:优质曲(64)、普通曲(62)、白曲(87)、黄曲(41)和黑曲(35)。其中,白曲的OTU个数最多,黑曲的OTU个数最少,这说明白曲的群落丰富度最高,黑曲的群落丰富度最低,与Chao1指数和Ace指数分析得出的群落丰富度的结果一致。
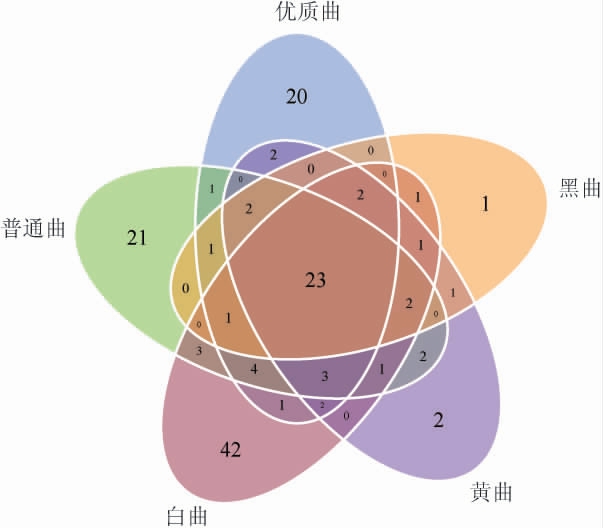
图3 不同大曲真菌OTU分析结果韦恩图
Fig.3 Venn diagram of fungal OTU analysis of different Daqu
2.3.2 真菌群落结构分析
在不同高温大曲样品中,真菌的种类、丰度等方面的群落结构不同[28]。不同高温大曲在属水平上的真菌群落结构见图4,不同高温大曲属水平主要真菌(占比>1%)的测定结果见表5。
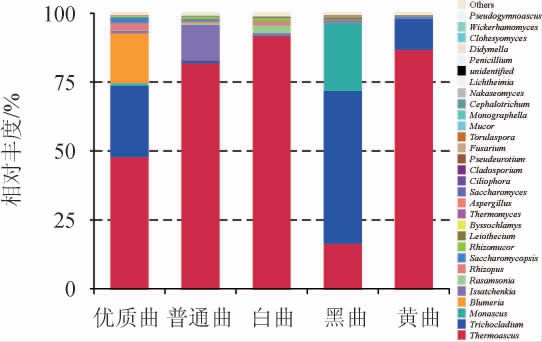
图4 不同高温大曲在属水平上的真菌群落结构
Fig.4 Fungal structure of different high temperature Daqu at genus level
表5 不同高温大曲属水平主要真菌占比
Table 5 Main fungus proportion of different high temperature Daqu at genus level%
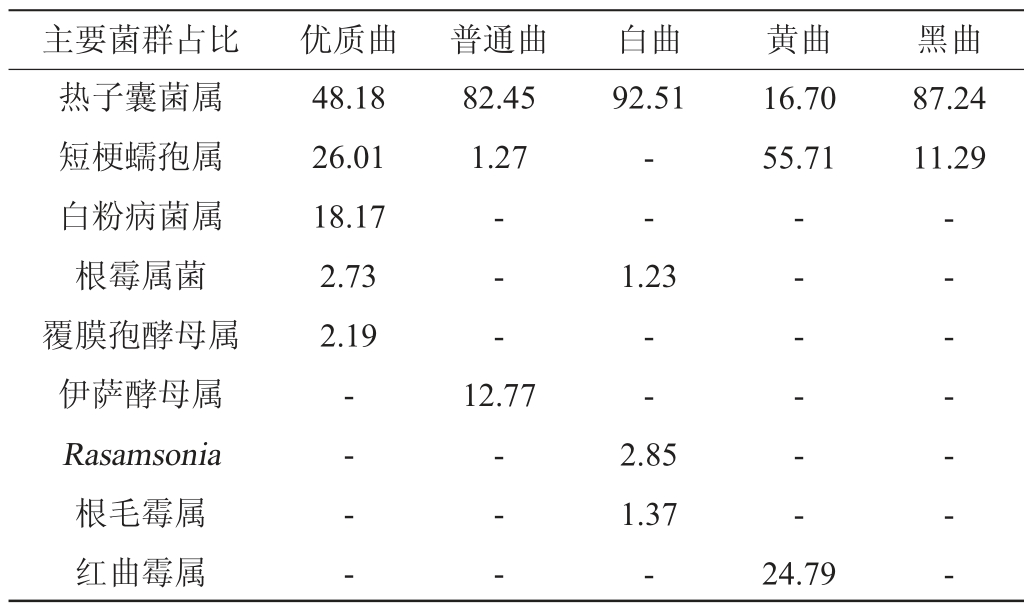
属水平上的真菌种类分布显示,真菌群落丰富度大小依次为:白曲>普通曲>优质曲>黄曲>黑曲,白曲、黄曲、黑曲和优质曲的丰富度特征与细菌群落一致,其中,热子囊菌属(Thermoascus)是优质曲、普通曲、白曲、黑曲的主要优势真菌群落结构;而短梗蠕孢属(Trichocladium)是黄曲的优势真菌群落结构。因此,优质曲通过不同大曲的合理搭配,优化了微生物群落多样性。白曲、黄曲和黑曲在普通曲中的配比在30%~35%,比例接近,没有显示出突出特征,群落丰富度在白曲和黑曲之间波动。
2.4 高温大曲理化特征与微生物群落结构关联性分析
2.4.1 细菌与理化特征典范对应分析
采用CCA方法分析不同高温大曲的理化特征与细菌之间的关联性,结果见图5。由图5可知,五种高温大曲较为分散,相互之间细菌群落结构可能差异较大。对样品与理化之间的对应关系进行分析表明,酯化力、糖化力和液化力三者可能对白曲和优质曲的影响最大,发酵力和酸度可能对黑曲的影响最大,而普通曲和黄曲可能受各项理化特征的影响不突出,以上分析与表1中对理化特征分析具有一致性。样品与微生物之间的对应关系分析显示,可能对普通曲和黄曲产生较大影响的细菌排序依次为大洋芽孢杆菌属>Kroppenstedtia>芽孢杆菌属>醋杆菌属,可能对优质曲和白曲产生较大影响的细菌排序依次为链球菌属>热放线菌属>乳杆菌属>魏斯氏菌属>片球菌属,而可能对黑曲产生较大影响的细菌为立克次氏体。这些可能对各种曲产生较大影响的细菌大多为对应曲种的优势菌群。因此,样品与理化特征、细菌之间的对应分析显示该方法能够准确反映大曲的理化特征和细菌群落结构。进一步分析理化特征与微生物之间的对应关系,结果显示,可能对酯化力、糖化力和液化力产生较大影响的细菌排序依次为链球菌属>热放线菌属>乳杆菌属>魏斯氏菌属>片球菌属,可能对发酵力和酸度产生较大影响的细菌为立克次氏体,而大洋芽孢杆菌、Kroppenstedtia、芽孢杆菌属和醋杆菌属与几种理化特征的相关性不大。
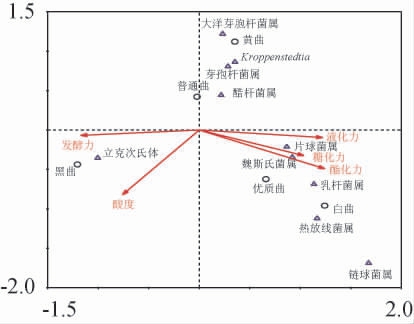
图5 典范对应分析结果
Fig.5 Results of canonical correspondence analysis
2.4.2 真菌与理化特征冗余分析
采用RDA的方法分析理化特征与真菌之间的关联性,结果见图6。由图6可知,五种高温大曲中,优质曲、白曲和黑曲三者在真菌群落结构上较为相近,普通曲和黄曲真菌的群落结构与其他几种曲相差较大。对样品与理化指标之间的对应关系进行分析,理化指标中与普通曲相关性较大的是发酵力,其他理化指标与普通曲的相关性不明显。黄曲与各理化特征的相关性均不明显。理化指标与优质曲、白曲和黑曲的相关性较为一致,相关性大小排序依次为酸度>酯化力>糖化力>液化力>发酵力。对样品与微生物之间的对应关系进行分析,结果显示,酯化力、糖化力和液化力三者可能对白曲和优质曲的影响最大,发酵力和酸度可能对黑曲的影响最大,而普通曲和黄曲可能受各项理化特征的影响不突出,以上分析与表1中对理化特征分析具有一致性。RDA结果(图6)表明,热子囊菌属与优质曲的糖化力、液化力和酯化力相关性较强,且该属是优质曲的优势菌群,因此,该属对优质曲的糖化力、液化力和酯化力产生重要影响。同样地,该属也是白曲和黑曲的优势菌群且与三种曲相关性较强,对白曲、黑曲的糖化力、液化力和酯化力均产生重要影响,如热子囊菌属可能是形成糖化力、液化力和酯化力等理化特征的关键功能微生物,这将有利于后期功能微生物的分离筛选和应用。
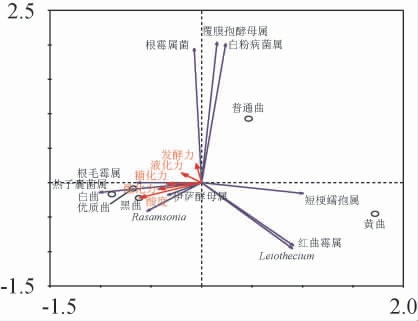
图6 冗余分析结果
Fig.6 Results of redundancy analysis
2.5 讨论
在以经验为指导的生产中,品质较好的酱香型白酒常将不同大曲(白曲、黄曲和黑曲)进行适当搭配,配制呈适合高品质酱香型白酒酿造的优质曲。通过群落结构中多样性分析显示,细菌群落丰富度大小依次为:白曲>优质曲>黄曲>普通曲>黑曲;真菌群落丰富度大小依次为:白曲>普通曲>优质曲>黄曲>黑曲,可以看出白曲、黄曲、黑曲和优质曲的丰富度特征与细菌、真菌群落是一致的。因此,优质曲通过不同大曲的合理搭配,优化了微生物群落多样性。白曲、黄曲和黑曲在普通曲中的配比在30%~35%,比例接近,没有显示出突出特征,群落丰富度在白曲和黑曲之间波动。
进一步地,对构成群落多样性的微生物种类和丰度进行剖析,根据不同大曲中细菌的群落结构分析,优质曲的三种优势菌群分别是黄曲、白曲和黑曲中的优势菌群,因此,搭配工艺使黄曲、白曲和黑曲中的其中三种细菌构成优质曲的细菌优势菌群,并和各曲的其他细菌构成优质曲特殊的细菌群落结构;真菌的群落结构分析显示,通过向黄曲中添加白曲和黑曲,使得形成的优质曲中热子囊菌属的占比相对于主体黄曲大幅提高,而普通曲以Unidentified Mitochondria、热放线菌属为优势细菌,以热子囊菌属为优势真菌,与白曲、黄曲和黑曲的优势菌群对比观察可得,普通曲的优势细菌和优势真菌多数包含在白曲、黄曲和黑曲组成的优势菌群集合之内,不具有与某一颜色大曲突出相似的特征。
理化特征分析显示,优质曲以糖化力和液化力较高为特征。是因为黄曲中添加糖化力、液化力和酯化力最强的白曲,使得优质曲的糖化力和液化力突出,酯化力提高到仅次于白曲。黄曲中添加发酵力最强的黑曲,提高了优质曲的发酵力。关联性分析显示出影响各大曲理化特征的潜在功能微生物,CCA结果显示了大曲的理化特征与细菌群落结构,链球菌属、热放线菌属等可能对大曲酯化力、糖化力和液化力产生较大影响,Unidentified Mitochondria则对大曲的发酵力和酸度产生影响较大,而大洋芽孢杆菌、Kroppenstedtia、芽孢杆菌属和醋杆菌属与几种理化特征的相关性不大;RDA分析显示热子囊菌属与优质曲的糖化力、液化力和酯化力相关性较强,且该属是优质曲的优势菌群,因此,该属对优质曲的糖化力、液化力和酯化力产生重要影响。同样地,该属也是白曲和黑曲的优势菌群且与三种曲相关性较强,因此,对白曲、黑曲的糖化力、液化力和酯化力产生重要影响。热子囊菌属也是黄曲的优势菌群,但相对白曲和黑曲相对丰度较低,因此,黄曲中加入热子囊菌属相对丰度较高的白曲和黑曲,提高了优质曲中的该属的相对丰度,形成了优质曲的优势菌群和理化特征。这样,优质曲通过不同颜色的大曲合理搭配,将影响各自理化特征的优势菌群富集在一起,形成优质曲独特的优势菌群和群落结构,最终提高其理化特征。此外,通过关联性分析,揭示了影响各大曲理化特征的潜在功能微生物。
因此,样品与理化特征、细菌之间的对应分析显示该方法能够准确反映大曲的理化特征和细菌群落结构。进一步分析理化特征与微生物之间的对应关系,结果显示,可能对酯化力、糖化力和液化力产生较大影响的细菌排序依次为链球菌属>热放线菌属>乳杆菌属>魏斯氏菌属>片球菌属,可能对发酵力和酸度产生较大影响的细菌为立克次氏体,而大洋芽孢杆菌、Kroppenstedtia、芽孢杆菌属和醋杆菌属与几种理化特征的相关性不大。
3 结论
白曲、黄曲和黑曲的合理搭配提高了优质曲中微生物的群落多样性,以及优化了高温大曲整体的理化特性。具体地,不同颜色大曲的最佳配比形成了以芽孢杆菌属(Bacillus)、热放线菌属(Thermoactinomyces)、Unidentified Mitochondria和热子囊菌属(Thermoascus)为优势菌群的特殊的群落结构,以糖化力、液化力突出,酯化力较高,发酵力适中的优质高温大曲。优质曲和普通曲的群落结构特征和理化特征分析显示,不同颜色大曲的配比对形成新产品大曲的群落结构和理化性质至关重要。
[1]XIU L K.GUO H.Determination of microbial diversity in Daqu,a fermentation starter culture of Maotai liquor,using nested PCR-denaturing gradient gel electrophoresis[J].World J Microbiol Biotechn,2012,28(6):2375-2381.
[2]胡景辉,尉嘉眙,刘永贵,等.不同馏分清香型白酒感官质量与风味构成相关性分析[J].酿酒科技,2020,6(5):32-37.
[3]沈怡方.白酒生产技术全书[M].北京:白酒生产技术全书,1998:19.
[4]马蓉,李德林,杨艳,等.不同发酵容器对大曲清香型白酒酿造的影响研究[J].酿酒科技,2017(7):42-51.
[5]LIU H,SUN B.Effect of fermentation processing on the flavor of Baijiu[J].J Agr Food Chem,2018,66(22):5425-5432.
[6]左乾程,黄永光,郭敏,等.酱香型白酒机械化制曲发酵细菌群落的演替[J].食品科学,2021,42(18):150-156.
[7]YAO M,WANG J G,et al.Research progress on flavor compounds and microorganisms of maotai flavor Baijiu[J].J Food Sci,2019,84(1-3):6-18.
[8]张建敏.酱香白酒酿造过程放线菌的筛选与风味研究[D].贵阳:贵州大学,2015.
[9]BAN S X,WANG H U,BAO D,et al.Hydrolyzing enzymes in Jiangxiang Daqu[J].Liquor Making Sci Technol,2015,250:13-19.
[10]GAN S H,YANG F,HU S K,et al.Deciphering the composition and functional profile of the microbial communities in Chinese moutai liquor starters[J].Front Microbiol,2019,10:1-14.
[11]张守财.堆积发酵对酱香型白酒风味形成的作用及其控制[J].福建轻纺,2006(11):17-18.
[12]李聪聪,熊康宁,苏孝良,等.贵州茅台酒独特酿造环境的研究[J].中国酿造,2017,36(1):1-4.
[13]DENG L,MAO L,LIU D,et al.Comparative analysis of physicochemical properties and microbial composition in high-temperature Daqu withdifferent colors[J].Front Microbiol,2020,11:1-13.
[14]申孟林,张超,王玉霞.白酒大曲微生物研究进展[J].中国酿造,2016,35(5):1-5.
[15]张宗启.酱香型白酒大曲中功能微生物菌群及其酶系研究进展[J].酿酒科技,2021(3):8.
[16]BRAMORSKI A,CHRISTEN P,RAMIREZ M,et al.Production of volatile compounds by the edible fungus Rhizopus oryzae during solid state cultivation on tropical agro-industrial substrates[J].Biotechnol Lett,1998,20(4):359-362.
[17]陈笔.酱香型白酒酿造过程中霉菌群落结构以及霉菌与酵母相互作用的研究[D].无锡:江南大学,2014.
[18]LI K,ZHANG Q,ZHONG X T,et al.Microbial diversity and succession in the chinese Luzhou-flavor liquor fermenting cover lees as evaluated by SSU rRNA Profiles[J].Ind J Microbiol,2013.53(4):425-431.
[19]谭崇尧,徐军.高通量测序法对不同地域浓香型大曲微生物结构的分析[J].酿酒科技,2018(9):118-122.
[20]中国轻工业联合会.QB/T 4257—2011酿酒大曲通用分析方法[S].北京:中华人民共和国工业化信息化部,2011.
[21]WANG X,HAI D,YAN Z,et al.Environmental microbiota drives microbial succession and metabolic profiles during Chinese liquor fermentation[J].Appl Environ Microbiol,2017,84(4):AEM.02369-17.
[22]王海燕.PCR-DEGG技术对清香型汾酒微生物群落结构演变规律的研究[D].无锡:江南大学,2014.
[23]彭璐,明红梅,董异,等.不同曲层中高温大曲质量差异性研究[J].食品与发酵工业,2020,46(3):58-64.
[24]印丽,邱树毅,曹文涛,等.酱香型白酒核心产区大曲的梅西分析[J].现代食品科技,2021,37(3):89-96.
[25]王宗敏.镇江香醋醋酸发酵阶段菌群结构变化与风味物质组成之间的相关性研究[D].无锡:江南大学,2016.
[26]姚粟.芝麻香型白酒高温大曲细菌群落多样性研究[D].北京:北京林业大学,2013.
[27]郭敏.基于高通量测序对酱香大曲制曲微生态多样性的研究[D].贵阳:贵州大学,2018.