蓝莓又称越橘,为杜鹃花科(Ericaceae)越橘属(Vaccinium spp.)浆果类植物,果实富含维生素、有机酸、多酚等营养物质,因而被誉为“浆果之王”[1]。蓝莓既可鲜食又可深加工为果汁、果酱、果酒等产品[2]。蓝莓酒中的单宁、花色苷等酚类物质赋予其复杂的口感和抗氧化功效,使其在众多深加工产品中深受消费者喜爱[3-4]。单宁主要存在于蓝莓果皮和籽中[5],在酿造初期释放到蓝莓酒中。然而,从果皮或籽中释放出的单宁会被酒体中悬浮的细胞壁不溶物、多糖、蛋白质等物质吸附形成沉淀,导致蓝莓酒中单宁的损失,影响酒的感官品质[6-8]。
壳聚糖是一种天然高分子聚合物,在pH 6.5以下带正电荷,它由甲壳素(chitin)经脱乙酰作用而制得[9]。2010年欧盟允许来源于黑曲霉的真菌壳聚糖应用于果酒酿造以改善其品质。COLANGELO D等[10]的研究表明,壳聚糖与蛋白质之间的相互作用减少了葡萄酒中酚类物质的损失。FILIPE-RIBEIRO L等[11]研究发现,壳聚糖以0.1 g/L添加到葡萄酒中,在未降低酒体中挥发性酚类物质含量的情况下增加葡萄酒的果香和花香。PICARIELLO L等[12]研究发现,壳聚糖在葡萄酒后发酵阶段添加减少了酒体中单宁与蛋白质的结合。这些结果表明,壳聚糖的添加量与添加时间会对酒体中单宁的含量产生一定的影响。
酵母甘露聚糖是一种具有生物活性的多糖,其主链是由多个甘露糖分子以α-1,6糖苷键连接而成的单链,并通过N-糖肽键和O-糖肽键与蛋白质相连,又称之为甘露糖蛋白[13-14]。OSETE-ALCARAZ A等[7]研究发现,酿造初期添加酵母甘露聚糖,使葡萄酒中单宁的含量提高14.5%,并增加酒体的圆润度和醇厚感。研究表明,多糖的添加可以减少不溶性单宁-蛋白质复合物的形成[15],增强酒体中多酚的稳定性,对葡萄酒的口感产生积极的影响[16]。
壳聚糖和酵母甘露聚糖多在苹果酸-乳酸发酵后陈酿前进行添加,以改善葡萄酒的品质,而应用于蓝莓酒的酿造还有待进一步研究。因此该研究将壳聚糖和酵母甘露聚糖分别添加到蓝莓汁中进行发酵,探究这两种多糖对蓝莓酒单宁特性及感官品质的影响,为其在蓝莓酒酿造中的应用提供理论参考。
1 材料与方法
1.1 材料与试剂
蓝莓(品种:灿烂):云南省玉溪市蓝莓种植基地;壳聚糖(食品级,脱乙酰度≥85%):大连中科格莱克生物科技有限公司;酿酒酵母(Saccharomyces cerevisiae)RV002、酵母甘露聚糖:安琪酵母股份有限公司;果胶酶(EC 3.2.1.15,30 000 U/g)、纤维素酶(EC 3.2.1.4,25 000 U/g)、甲基纤维素(黏度1 500 cP)、福林酚试剂、环己酮(纯度99.5%)、甲醇、磷酸(均为色谱级)、草酸、奎尼酸、苹果酸、乳酸、柠檬酸、酒石酸、琥珀酸(均为分析纯):上海阿拉丁生物科技股份有限公司;白砂糖:市售;其他试剂均为分析纯。
1.2 仪器与设备
e2695高效液相色谱(high performance liquid chromatography,HPLC)仪:美国Waters公司;8890-7000D气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)仪、HP-5MS弹性石英毛细管柱(30 m×0.25 mm,0.25 μm):美国Agilent公司;CTC多功能自动进样器:瑞士Zwingen公司;50/30 μm固相微萃取头(DVB/CAR/PDMS):美国Supelco公司;YX280型高压蒸汽灭菌锅:上海三申医疗器械有限公司;SPX-250B生化培养箱:天津市泰斯特仪器有限公司;UV-1700紫外-可见光分光光度计:日本岛津公司;3-18K高速冷冻离心机:德国Sigma公司。
1.3 方法
1.3.1 蓝莓酒发酵工艺流程及操作要点
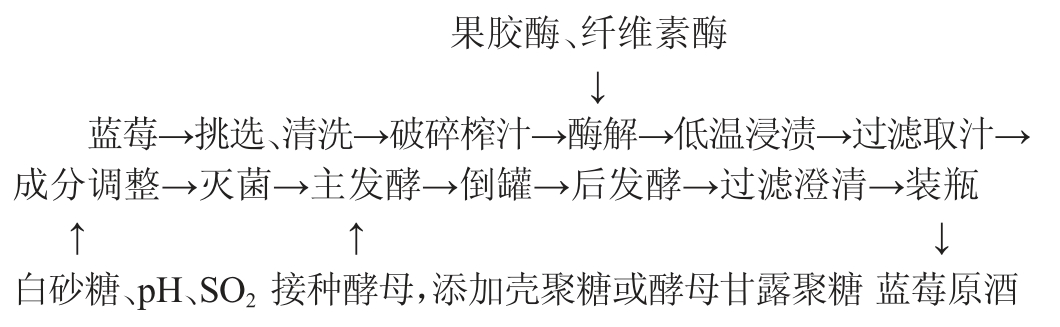
操作要点:
原料处理:挑选成熟良好且无机械破碎的蓝莓10 kg,洗净晾干后倒入榨汁机中打成匀浆。
酶解:添加果胶酶和纤维素酶各60 mg/L,45 ℃恒温水浴酶解1 h。
低温浸渍:酶解后的匀浆置于4 ℃环境中浸渍24 h[17]。
成分调整:将浸渍后的匀浆用4层纱布过滤取得蓝莓汁,按50 mg/L向蓝莓汁中添加偏重亚硫酸钾;pH用碳酸钙调至3.5;添加白砂糖将初始糖度调至22°Bx[18]。
灭菌:按400 mL/瓶的量将蓝莓汁分装,以65 ℃恒温水浴35 min。
酵母活化:将0.2 g酿酒酵母RV002加至10 mL 1%的白砂糖温水中,37 ℃活化20 min。
主发酵:将活化后的酵母按0.5%的接种量接种到蓝莓汁中,设置三个不同的实验组:将添加0.2 g/L壳聚糖和酵母甘露聚糖的组分别命名为壳聚糖组和酵母甘露聚糖组;未添加多糖的组为对照组;每组设置3个重复。将3组发酵瓶置于27 ℃恒温培养箱中静置发酵10 d左右,待还原糖含量≤10 g/L后结束主发酵[19]。
后发酵:将倒罐后的蓝莓酒样放入18 ℃恒温培养箱中后发酵15 d,然后将后发酵结束的蓝莓酒样通过4层纱布过滤并澄清,取上清液在-20 ℃条件下储存备用。
1.3.2 理化指标的测定
采用甲基纤维素沉淀法[20]测定单宁含量;采用丁醇-盐酸结合香草醛-乙酸法[21]测定单宁的平均聚合度;采用pH示差法[22]测定花色苷;参照GB/T 15038—2006《葡萄酒、果酒通用分析方法》测定酒精度、总酸和还原糖;采用福林酚法[17]测定总酚。所有指标重复分析3次,结果取平均值。
1.3.3 柔和指数的测定
参照ZHAO H F等[23]的方法,按下式计算柔和指数(suppleness index,SI):
蓝莓酒样柔和指数=A-(T+C)
式中:A为酒精度,%vol;T为单宁含量,g/L;C为总酸含量,g/L。
1.3.4 有机酸含量的测定
参照徐玉涛等[24]的方法,测定蓝莓酒中的有机酸含量。样品的制备:分别取5.0 mL蓝莓酒样进行离心(6 000×g,15 min),将上清液用0.22 μm滤膜过滤后打入进样小瓶。流动相的制备:配制0.05 mol/L的磷酸二氢钾水溶液并用色谱级磷酸调pH至2.0,用0.45 μm滤膜过滤后备用。
高效液相色谱条件:色谱柱为Agilent ZORBAX SB-AQ C18柱(4.6 mm×250 mm,5 μm);等梯度洗脱:流速0.4 mL/min;流动相为100%的0.05 mol/L的磷酸二氢钾水溶液;检测器为光电二极管阵列检测器(photodiode arraydetector,PAD);检测波长215 nm;温度30 ℃;进样体积5 μL。
1.3.5 挥发性成分的测定
使用顶空固相微萃取结合气相色谱-质谱联用技术对蓝莓酒香气成分进行分析[25]。酒样制备:取5.0 mL蓝莓酒样于顶空瓶中,加入1.0 g 氯化钠及20.0 μL内标物环己酮(0.95 g/L),并于60 ℃萃取35 min。
气相色谱条件:HP-5MS弹性石英毛细管柱(30 m×0.25 mm,0.25 μm);进样口温度:230 ℃,解吸10 min,不分流进样,载气为高纯氦气(He);流速1.0 mL/min;程序升温:初始温度40 ℃,恒温5 min,以3 ℃/min升温至160 ℃,再以8 ℃/min升温至220 ℃,保持10 min。
质谱条件:电子电离(electron ionization,EI)源,传输线温度240 ℃,离子源温度230 ℃,电子能量70 eV,质量扫描范围40~550 u。
定性定量方法:香气成分利用检测到的色谱保留时间、质谱信息与美国国家标准及技术研究所(national institute of standards and technology,NIST)08标准谱库进行对比定性,实验结果保留匹配程度>80的鉴定结果。以环己酮为内标物(质量浓度为0.91 μg/L),采用内标法定量。
1.3.6 感官分析
蓝莓酒感官分析根据尹宁宁等[26]描述的方法略有调整。使用9分结构化数值尺度进行量化,评分标准见表1。
表1 蓝莓酒感官评价标准
Table 1 Sensory evaluation standards of blueberry wine

评价小组由10名感官评价人员组成,在标准品尝室进行,从涩感、醇厚感、圆润度、酸度、颜色强度、香气浓郁度、清澈度及整体评分8个方面对各蓝莓酒样进行品评,其中整体评分由感官评价人员依据蓝莓酒样的整体感官品质进行打分,经标准化处理后绘制雷达图。
1.3.7 数据统计与分析
数据表示为“平均值±标准差”,每个数据平行测量3次。采用SPSS 22.0软件对结果进行方差分析(analysis of variance,ANOVA),然后用Duncan检验进行组间多重比较来分析数据之间的显著性差异(P<0.05),使用Origin 2018软件作图。
2 结果与分析
2.1 不同多糖对蓝莓酒主发酵阶段还原糖含量变化的影响
蓝莓酒主发酵过程中还原糖含量的动态变化结果见图1。由图1可知,随着主发酵时间的增加,发酵液中还原糖含量呈现逐渐下降趋势。从第5天开始,还原糖含量下降趋势逐渐平缓,这说明主发酵过程趋于完成。发酵进行至第9天,三个不同实验组发酵液中还原糖的含量均低于10 mg/mL,表明蓝莓酒主发酵过程已经完成[19],壳聚糖和酵母甘露聚糖的添加对蓝莓酒主发酵结束时还原糖的含量没有显著影响。
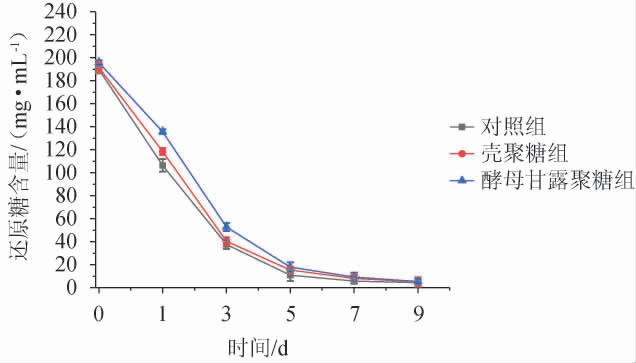
图1 蓝莓酒主发酵过程中还原糖含量的动态变化
Fig.1 Dynamic changes of reducing sugar contents during main fermentation process of blueberry wine
2.2 不同多糖对蓝莓酒主发酵阶段单宁含量变化的影响
蓝莓酒主发酵过程中单宁含量的动态变化结果见图2。由图2可知,三个不同实验组中单宁的含量在主发酵期间均呈现逐渐下降趋势。在主发酵过程中,壳聚糖组和酵母甘露聚糖组中单宁含量均显著高于对照组,酵母甘露聚糖组中单宁含量显著高于壳聚糖组。相比于对照组,壳聚糖的添加显著增加蓝莓酒中单宁的含量,这可能是壳聚糖通过静电相互作用结合酒体中的果胶和蛋白质[27],减少单宁通过疏水相互作用或氢键与果胶和蛋白质结合形成沉淀的几率[28-29],进而增加酒体中单宁的含量。CASTRO-LOPEZ L R等[28]研究表明,果胶对单宁具有较高的亲和力,去除果胶可以显著增加溶液中单宁的含量。酵母甘露聚糖组中单宁的含量显著高于对照组,这是由于酵母甘露聚糖能与单宁形成可溶性复合物[7],这可能限制酒体中悬浮的不溶性细胞壁成分对单宁的吸附及单宁-蛋白质沉淀的形成,进而减少蓝莓酒中单宁的损失。壳聚糖组中单宁的含量低于酵母甘露聚糖组,这可能是壳聚糖吸附少量的单宁形成沉淀,而酵母甘露聚糖则与单宁形成可溶性复合物保留在蓝莓酒中。
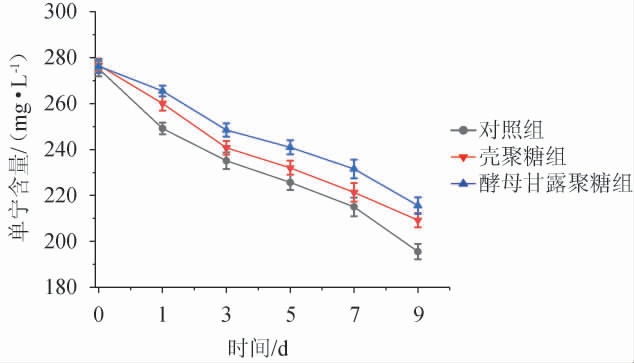
图2 蓝莓酒主发酵过程中单宁含量的动态变化
Fig.2 Dynamic changes of tannin content during main fermentation process of blueberry wine
2.3 不同多糖对蓝莓酒主发酵阶段单宁平均聚合度变化的影响
由图3可知,试验组中单宁的平均聚合度在发酵过程中均高于对照组,发酵液中单宁的平均聚合度随着发酵时间的增加呈现逐渐降低的趋势,这可能是发酵液中高聚合度的单宁优先被细胞壁吸附或与蛋白质结合形成沉淀[30],而低聚合度的单宁则保留在溶液中。发酵液中各组之间单宁的平均聚合度降低速率不同,这可能是由于多糖的添加影响了酵母的生长繁殖[4,31],进而改变了酵母吸附单宁的能力和平均聚合度降低的速率。因此,发酵液中剩余的高聚合度单宁越少,说明发酵液中单宁的含量越低,这与发酵液中单宁含量的结果一致。壳聚糖和酵母甘露聚糖的添加均增加发酵液中单宁的平均聚合度,这可能是当添加可溶性多糖时,它们与细胞壁和蛋白质竞争结合发酵液中的高聚合度单宁[7,32],从而减少高聚合度单宁与细胞壁和蛋白质结合形成沉淀,进而提高蓝莓酒中单宁的平均聚合度。
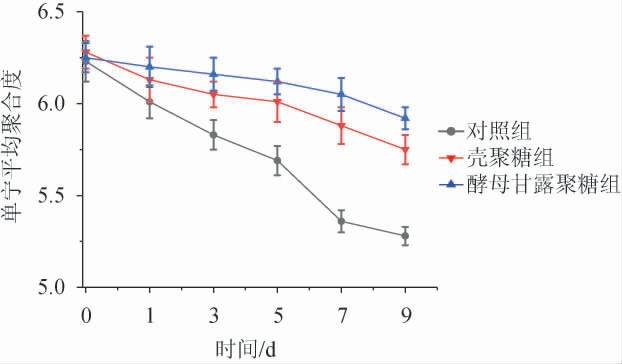
图3 蓝莓酒主发酵过程中单宁平均聚合度的动态变化
Fig.3 Dynamic changes of tannin mean degree of polymerization during main fermentation process of blueberry wine
2.4 蓝莓酒后发酵结束时的理化指标
由表2可知,与对照组相比,壳聚糖和酵母甘露聚糖的添加均显著提高蓝莓酒中的总酚含量、花色苷含量和酒精度(P<0.05),而显著降低其总酸含量(P<0.05)。相比于对照组,壳聚糖组和酵母甘露聚糖组中单宁的质量浓度分别提高了25.70%、34.73%,单宁的平均聚合度分别增加了1.46%、6.89%。在所有试验组中,酵母甘露聚糖组蓝莓酒中单宁的含量和平均聚合度均最高,这与前人报道的结果一致[7]。
表2 后发酵结束时蓝莓酒理化指标的测定结果
Table 2 Determination results of physicochemical indexes of blueberry wine at the end of post-fermentation
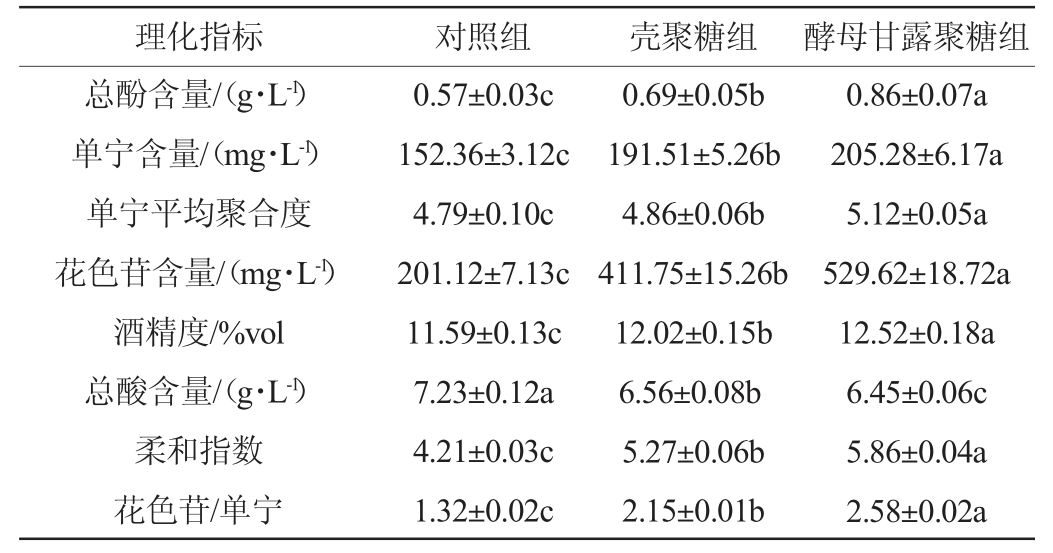
注:同行不同小写字母表示差异显著(P<0.05)。
柔和指数(SI)可对酒体的口感、平衡感和收敛程度进行数字化衡量。SI<5的酒体瘦弱粗重,口感较差;SI>5的酒体口感绵柔,较为柔和;SI>6的酒体口感圆润,较为平衡[26]。由表2可知,与对照组相比,壳聚糖和酵母甘露聚糖的添加分别使蓝莓酒的柔和指数提高了25.18%和39.20%,表明壳聚糖和酵母甘露聚糖的添加均能改善蓝莓酒的口感,且添加酵母甘露聚糖比添加壳聚糖的蓝莓酒口感更加柔和协调。RINALDI A等[33]研究发现,随着花色苷/单宁比例的增加,单宁所引起的苦涩感随之减弱。在所有组中,酵母甘露聚糖组蓝莓酒中花色苷/单宁的比例最高,为2.58,这表明可能添加酵母甘露聚糖的蓝莓酒苦涩感最弱。当花色苷较多时,酵母甘露聚糖可能对单宁的沉淀和解聚具有一定的保护作用,促进稳定宏观结构的形成,这些结构对唾液蛋白的反应性较低[33],因而所引起的苦涩感减弱。这可能解释了花色苷/单宁比例越高而苦涩感越弱的原因。
2.5 蓝莓酒后发酵结束时有机酸含量
有机酸的组成和含量不仅影响蓝莓酒的风味,同时还对蓝莓酒的口感产生重要影响。由图4可知,蓝莓酒中的各有机酸含量在后发酵结束时均有显著差异(P<0.05),其中柠檬酸含量最高,乳酸含量次之,其次为苹果酸、酒石酸和琥珀酸等有机酸。
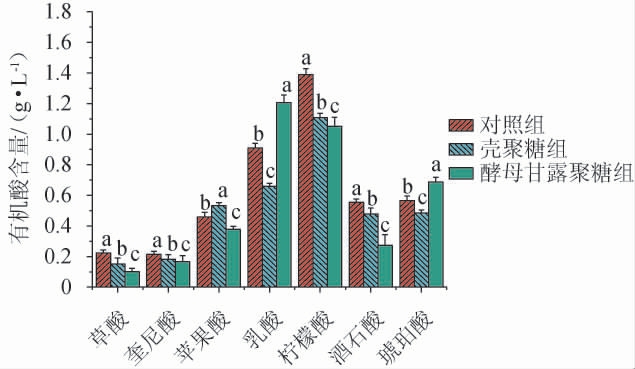
图4 后发酵结束时蓝莓酒中有机酸含量
Fig.4 Organic acid content of blueberry wine at the end of post-fermentation
在三个不同实验组中,蓝莓酒中苹果酸的含量为壳聚糖组>对照组>酵母甘露聚糖组,而乳酸的含量为酵母甘露聚糖组>对照组>壳聚糖组,这可能是壳聚糖的添加能够改变微生物细胞膜的通透性而影响乳酸菌的生长[31],从而抑制苹果酸-乳酸发酵;酵母甘露聚糖的添加可能吸收了酒精发酵阶段产生抑制乳酸菌生长的中链脂肪酸而促进苹果酸-乳酸发酵[4]。因此,酵母甘露聚糖的添加降低了蓝莓酒中苹果酸的含量,而增加其乳酸的含量,这可能减弱蓝莓酒的酸涩感而增强其乳香和柔和感。蓝莓酒中柠檬酸和酒石酸的含量为对照组>壳聚糖组>酵母甘露聚糖组,这可能是壳聚糖的添加吸附了一部分的柠檬酸和酒石酸[10],进而降低其含量;酵母甘露聚糖的添加促进苹果酸-乳酸发酵的进程,从而降低柠檬酸和酒石酸的含量[34],这表明壳聚糖和酵母甘露聚糖的添加均能减弱柠檬酸和酒石酸引起的尖锐酸味及苦味,且添加酵母甘露聚糖比添加壳聚糖效果较好。因此,壳聚糖和酵母甘露聚糖的添加均能降低蓝莓酒的酸涩感,且添加酵母甘露聚糖的效果较好,但需进一步的感官分析验证。
2.6 蓝莓酒后发酵结束时挥发性成分分析
蓝莓酒的挥发性香气成分及含量见表3。由表3可知,对照组、壳聚糖组和酵母甘露聚糖组测得挥发性香气成分分别为24种、33种和35种,总含量分别为130.58 mg/L、142.55 mg/L和205.65 mg/L。酵母甘露聚糖组的挥发性香气成分主要是醇类和酯类,含量较多的是异戊醇、苯甲醇、α-松油醇、乙酸乙酯、癸酸乙酯、月桂酸乙酯等。此外,酵母甘露聚糖组中萜烯类物质含量最高,特有香茅醇、香叶醇、D-柠檬烯、1,3,8-对薄荷三烯,壳聚糖组中特有己酸乙酯和辛酸。
表3 后发酵结束时蓝莓酒的挥发性香气成分及含量
Table 3 Volatile aroma components and contents of blueberry wine at the end of post-fermentation

续表
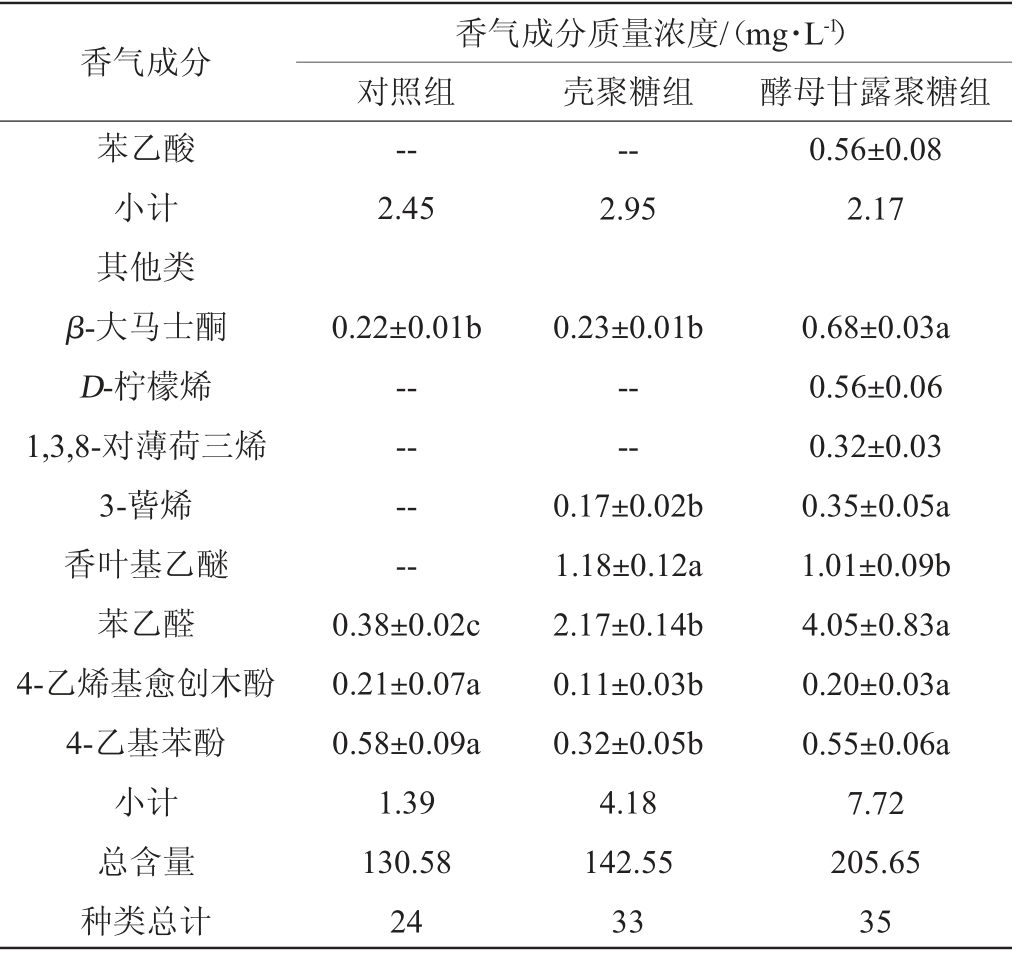
注:“--”表示未检出;同行不同小写字母表示存在显著性差异(P<0.05)。
醇类物质是蓝莓酒酿造过程中酵母代谢所产生的一种次级代谢产物,也是酒中主要的挥发性香气物质之一。与对照组相比,酵母甘露聚糖的添加显著提高蓝莓酒中醇类物质的含量(P<0.05),且其含量低于300 mg/L,这使得蓝莓酒的香气更加复杂[35]。相比于对照组,酵母甘露聚糖组中异戊醇的含量显著降低(P<0.05),且低于其阈值(65 mg/L)[36],表明酵母甘露聚糖的添加能够降低蓝莓酒的化学溶剂气味,这与SCANSANI S等[37]的研究结果一致。
酯类物质可以赋予蓝莓酒浓郁的花香和果香。己酸乙酯是一种特殊的香气化合物,当其质量浓度超过0.005 mg/L时,能够给蓝莓酒增添草莓、香蕉果香[38]。壳聚糖组中特有己酸乙酯,且其含量为0.35 mg/L,这表明壳聚糖组的蓝莓酒中果香味可能更加丰富复杂。与壳聚糖组相比,酵母甘露聚糖组含有较高的乙酸乙酯、癸酸乙酯、月桂酸乙酯等物质,这些物质能够赋予蓝莓酒浓郁的花香、果香和甜香味,增加酒体的香气馥郁性,这与尹宁宁等[26]利用酵母甘露聚糖酿造蛇龙珠干红葡萄酒的结果一致。
在三组蓝莓酒中,壳聚糖组蓝莓酒中辛酸的含量超过其阈值(0.5 mg/L),这可能带来不良的腐败酸味[38],而酵母甘露聚糖组中特有的苯乙酸能够增加蓝莓酒的玫瑰花香味。萜烯类物质能够赋予酒体花果香[26],对提高蓝莓酒的品质具有一定的贡献。与对照组相比,壳聚糖组中橙花醇含量较低,且低于其阈值(0.4 mg/L)[10],α-松油醇和β-大马士酮均无显著差异,这表明壳聚糖的添加可能会引起萜烯类物质含量的减少,减弱蓝莓酒的花果香。与酵母甘露聚糖组相比,壳聚糖的添加显著降低挥发性酚类物质4-乙烯基愈创木酚及4-乙基苯酚的含量(P<0.05),这可能是壳聚糖与挥发性酚类物质的结合而降低其含量[11],进而减弱蓝莓酒的不良风味。
2.7 蓝莓酒感官分析
蓝莓酒感官分析雷达图结果见图5。由图5可知,酵母甘露聚糖组的整体评分最高,其次为壳聚糖组、对照组。从涩感、醇厚度和圆润度来分析,与试验组相比,对照组的涩感较强而醇厚度和圆润度较弱;与对照组相比,酵母甘露聚糖组的涩感较弱而醇厚度和圆润度较强,这可能是酵母甘露聚糖与蓝莓酒中的单宁形成可溶性复合物,减少了单宁与唾液蛋白的结合[32],进而降低酒体的涩感,增加蓝莓酒的醇厚度和圆润度。从酸度分析,壳聚糖和酵母甘露聚糖的添加均降低蓝莓酒的酸度。从颜色强度分析,对照组的颜色强度均低于试验组,可能是由于多糖与酚类物质结合[26],减少了酚类物质的分解,进而维持蓝莓酒的颜色稳定。从清澈度分析,壳聚糖组的评分最高,这可能是壳聚糖的澄清作用增加蓝莓酒的清澈度。从香气浓郁度和整体评分分析,对照组的香气浓郁度和整体评分最低,而酵母甘露聚糖组最高,具有浓郁的花香和果香,这与挥发性香气成分测定结果相符,表明添加酵母甘露聚糖的蓝莓酒品质较高。
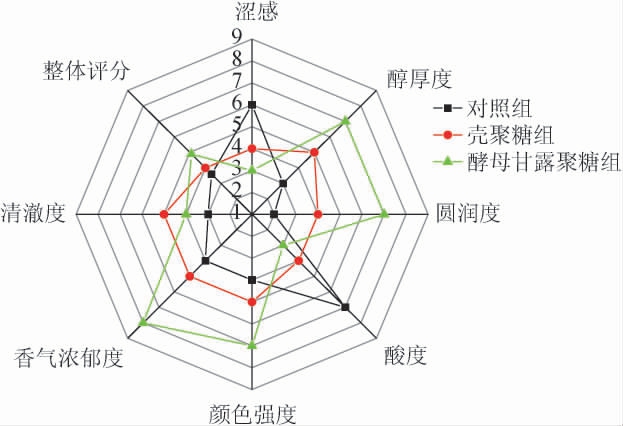
图5 蓝莓酒感官分析雷达图
Fig.5 Radar map of sensory analysis of blueberry wine
3 结论
本研究在蓝莓酒酿造初期通过添加壳聚糖和酵母甘露聚糖进行发酵,分析其对蓝莓酒单宁特性、理化指标、挥发性成分及感官品质的影响。结果表明,在主发酵阶段,壳聚糖和酵母甘露聚糖的添加均提高蓝莓酒中单宁的含量及平均聚合度,且添加酵母甘露聚糖效果最佳。在后发酵结束时,与对照组相比,壳聚糖和酵母甘露聚糖的添加,显著提高蓝莓酒中单宁含量和柔和指数,降低其酸度。添加酵母甘露聚糖提高了蓝莓酒中乳酸的含量,降低柠檬酸、苹果酸和酒石酸的含量,增强蓝莓酒的柔和感,减弱其酸涩感。添加壳聚糖和酵母甘露聚糖均能增加蓝莓酒中香气成分的种类和质量浓度,增加酒体的香气复杂性。感官分析表明酵母甘露聚糖组的涩感最弱,醇厚度、圆润度、香气浓郁度及整体评分最高。本研究为提高蓝莓酒中单宁的含量,改善蓝莓酒的感官品质提供理论参考。在后续研究中,可进一步探究多糖与单宁之间的相互作用机制。
[1]QIU H T,QIU Z Z,CHEN Z Y,et al.Antioxidant properties of blueberry extract in different oleogel systems[J].LWT-Food Sci Technol,2020,137(10):110364-110373.
[2]黄克霞,祝义伟,陈秋生,等.蓝莓果汁发酵工艺优化及挥发性风味物质分析[J].中国酿造,2021,40(12):109-114.
[3]徐青柳,张杰,赵洋溢,等.蓝莓酒酿造关键技术研究进展[J].食品与发酵工业,2020,46(20):287-293.
[4]SUN X Y,YAN Z C,ZHU T,et al.Effects on the color,taste,and anthocyanins stability of blueberry wine by different contents of mannoprotein[J].Food Chem,2018,279(11):63-69.
[5]SANTOS R O,TRINDADE S C,MAURER L H,et al.Physicochemical,antioxidant and sensory quality of Brazilian blueberry wine[J].An Acad Bras Cienc,2016,88(3):1557-1568.
[6]OSETE-ALCARAZ A,BAUTISTA-ORTIN A B,ORTEGA-REGULES A,et al.Elimination of suspended cell wall material in musts improves the phenolic content and color of red wines[J].Am J Enol Vitic,2019,70(2):201-204.
[7]OSETE-ALCARAZ A,BAUTISTA-ORTIN A B,GÓMEZ-PLAZA E.The role of soluble polysaccharides in tannin-cell wall interactions in model solutions and in wines[J].Biomolecules,2019,10(1):36-58.
[8]SPRINGER L F,CHEN L A,STAHLECKER A C,et al.Relationship of soluble grape-derived proteins to condensed tannin extractability during red wine fermentation[J].J Agr Food Chem,2016,64(43):8191-8199.
[9]LOGITHKUMAR R,KESHAVNARAYABN A,DHIVYA S,et al.A review of chitosan and its derivatives in bone tissue engineering[J].Carbohydr Polym,2016,151(5):172-188.
[10]COLANGELO D,TORCHIO F,FAVERI D M,et al.The use of chitosan as alternative to bentonite for wine fining:Effects on heat-stability,proteins,organic acids,colour,and volatile compounds in an aromatic white wine[J].Food Chem,2018,264(12):301-309.
[11]FILIPE-RIBEIRO L,COSME F,NUNES F M.Reducing the negative sensory impact of volatile phenols in red wine with different chitosans:Effect of structure on efficiency[J].Food Chem,2017,242(5):591-600.
[12]PICARIELLO L,RINALDI A,BLAIOTTA G,et al.Effectiveness of chitosan as an alternative to sulfites in red wine production[J].Eur Food Res Technol,2020,246(9):1795-1804.
[13]赵国群,申崇宇,季小莉,等.低分子量酵母甘露聚糖的制备及其抗氧化性研究[J].食品工业科技,2020,41(13):202-206.
[14]徐婷婷,刘艳,张子健,等.高效液相色谱法测定酵母细胞壁中甘露聚糖和β-葡聚糖[J].中国酿造,2016,35(7):180-183.
[15]MATEUS N,CARVALHO E,LUS C,et al.Influence of the tannin structure on the disruption effect of carbohydrates on protein-tannin aggregates[J].Anal Chim Acta,2004,513(1):135-140.
[16]CHONG H H,CLEARY M T,DOKOOZLIAN N,et al.Soluble cell wall carbohydrates and their relationship with sensory attributes in cabernet sauvignon wine[J].Food Chem,2019,298(11):1-9.
[17]朱艳霞,杨佳荟,王沙沙,等.低温浸渍对‘关口葡萄’干白葡萄酒风味物质的影响[J].食品科学,2020,41(4):199-206.
[18]李安,刘小雨,张惟广.发酵及贮藏条件对蓝莓果酒花色苷稳定性的影响及其抗氧化性研究[J].中国酿造,2020,39(2):146-151.
[19]刘彩婷,周鸿翔.不同发酵工艺对蓝莓果酒品质的影响[J].食品与发酵工业,2020,46(4):172-179.
[20]SARNECKI S C J,DAMBERGS R G,JONES P,et al.Quantification of condensed tannins by precipitation with methyl cellulose:development and validation of an optimized tool for grape and wine analysis[J].Aust J Grape Wine Res,2006,12(1):39-49.
[21]LERMA-HERRERAMA,NUNEZ-GASTELUMJA,ASCACIO-VALDES J,et al.Estimation of the mean degree of polymerization of condensed tannins from the kernel and shell of Carya illinoinensis by HPLC/MS and spectrophotometric methods[J].Food Anal Meth,2017,10(9):3023-3031.
[22]刘雪可,苏梦飞,杨宁,等.不同提取方法对蓝靛果果渣花色苷提取效率的影响[J].食品研究与开发,2018,39(24):44-48.
[23]ZHAO H F,FANG Z,DZIUGAN P,et al.Development of organic acids and volatile compounds in cider during malo lactic fermentation[J].Czech J Food Sci,2014,32(1):69-76.
[24]徐玉涛,李珂珂,王贺新,等.高效液相色谱法对蓝莓果实中8个有机酸含量的测定[J].食品科学,2015,36(18):127-131.
[25]MENDES-FERREIRA A,COELHO E,BARBOSA C,et al.Production of blueberry wine and volatile characterization of young and bottle-aging beverages[J].Food Sci Nutr,2019,7(2):617-627.
[26]尹宁宁,许引虎,李敏,等.不同酵母多糖对蛇龙珠干红葡萄酒品质的影响[J].食品与生物技术学报,2018,37(6):646-654.
[27]WANG H,SUN H Y,HE J Y.Formation of polyelectrolyte complex colloid particles between chitosan and pectin with different degree of esterification[J].Iop Con,2017,275(6):12012-12020.
[28]CASTRO-LOPEZLR,GOMEZ-PLAZAE,ORTEGA-REGULESA,et al.Role of cell wall deconstructing enzymes in the proanthocyanidin-cell wall adsorption-desorption phenomena[J].Food Chem,2016,196(8):526-532.
[29]FREITAS D V,MATEUS N.Protein/polyphenol interactions:past and present contributions.mechanisms of astringency perception[J].Curr Org Chem,2012,16(6):724-746.
[30]BAUTISTA-ORTÍN A.B,ABDALLAH R B,CASTRO-LÓPEZ L,et al.Technological implications of modifying the extent of cell wall-proanthocyanidin interactions using enzymes[J].Int J Mol Sci,2016,17(1):123-128.
[31]ELMACI S B,GULGOR G,TOKATLI M,et al.Effectiveness of chitosan against wine-related microorganisms[J].Anton Leeuw,2015,107(3):675-686.
[32]BRANDO E,SILVA M S,GARCÍA-ESTÉVEZ I,et al.The role of wine polysaccharides on salivary protein-tannin interaction:A molecular approach[J].Carbohydr Polym,2017,177(6):77-85.
[33]RINALDI A,GONZALEZ A,MOIO L,et al.Commercial mannoproteins improve the mouthfeel and colour of wines obtained by excessive tannin extraction[J].Molecules,2021,26(14):4133-4146.
[34]SARTOR S,TOALDO I M,PANCERI C P,et al.Changes in organic acids,polyphenolic and elemental composition of rosé sparkling wines treated with mannoproteins during over-lees aging[J].Food Res Int,2019,124(8):34-42.
[35]LIU P T,LU L,DUAN C Q,et al.The contribution of indigenous non-Saccharomyces wine yeast to improved aromatic quality of Cabernet Sauvignon wines by spontaneous fermentation[J].LWT-Food Sci Technol,2016,71(6):356-363.
[36]LAN Y B,XIANG X F,QIAN X,et al.Characterization and differentiation of key odor-active compounds of 'Beibinghong' icewine and dry wine by gas chromatography-olfactometry and aroma reconstitution[J].Food Chem,2019,287(2):186-196.
[37]SCANSANI S,RAUHUT D,BREZINA S,et al.The impact of chitosan on the chemical composition of wines fermented with Schizosaccharomyces pombe and Saccharomyces cerevisiae[J].Foods,2020,9(10):1423-1434.
[38]张文静,杨诗妮,杜爽,等.本土毕赤克鲁维酵母与酿酒酵母混合发酵葡萄酒的增香潜力分析[J].食品科学,2020,41(12):84-90.