慢性肾脏疾病(chronic kidney disease,CKD)指肾脏结构、持续性功能异常超过3个月[1],其发病率呈现出日益升高,年轻化的趋势。据2019年发布的《中国肾脏病网络(CK-NET)年度数据报告》显示,中国CKD患者中男性占比达58.9%,且CKD高龄患者(60岁及以上)达到50%以上。
肾小球过滤能力下降、肾小管间质炎症等都会造成肾脏重吸收以及排泄有害物质等功能受损,体内有毒废物开始蓄积,肾脏排泄压力逐步加重,CKD逐步发展,长期以往最终会发展为终末期肾脏疾病(end-stage renal disease,ESRD)(尿毒症)。治疗及消除导致肾脏功能衰退的因素,是改善CKD的基础和前提,也是有效缓解肾脏功能衰退以及保护剩余肾脏功能的重中之重[2]。针对CKD,现有的治疗手段大致包括以下几个方面(见图1):(1)针对原发疾病和加重因素的治疗;(2)饮食、药物等一体化治疗[3](低蛋白饮食治疗、降低血压及其他方面治疗);(3)代替肾脏功能治疗[4](血液透析、腹膜透析、肾脏移植)。但是,以上治疗手段仍存在不少问题,如CKD患者在经过长时间的低蛋白饮食等一体化治疗后,会出现营养摄入不均衡的问题;吸附剂具有生物相容性差、吸附量少、成本高的劣势;腹膜透析容易引起伤口感染;肾脏移植后产生免疫反应,且没有可靠的方法来解决,只能通过长时间的使用免疫抑制剂,其结果也导致患者抵抗感染和肿瘤的免疫力降低;供体肾脏匮乏。
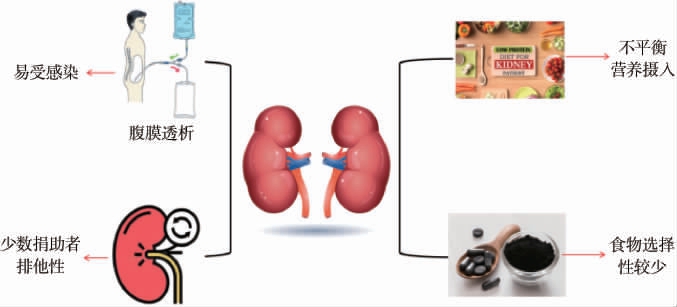
图1 慢性肾脏疾病常用治疗方式
Fig.1 Common treatment methods of chronic kidney disease
鉴于现有治疗和预防慢性肾病的现状,医学、营养学和食品科学等不同领域的专家学者,从不同的角度寻求更加安全可靠、毒副作用小、成本低的治疗和预防方法。近些年,通过益生菌调整肠道菌群结构治疗CKD的方法被人们逐步重视,因而本文总结了近些年来国内外通过调整肠道菌群结构治疗CKD的研究进展。
1 肠道内环境紊乱对人体肾脏的影响
正常人体的肠道包含了超过千种微生物种类,主要为约64%的厚壁菌门(Firmicutes)和23%的拟杆菌门(Bacteroidetes)。肠道菌群中的微生物互相生存与制约,形成了一种微生态平衡[5],并发挥着重要作用,主要包括(1)维持肠道紧密连接结构,与病原菌竞争肠道表皮细胞结合位点;(2)促进肠道免疫功能,促进免疫调节及细胞分化;(3)产生大量对肠道健康及机体健康发挥重要作用的代谢产物,如对人体有益的乳酸,以及丁酸等短链脂肪酸(short chain fattyacids,SCFAs),还有对人体有害的硫酸吲哚酚(indoxylsulfate,IS)、硫酸对甲酚(p-cresol sulfate,pCS)等肠源性尿毒症毒素。
肠道菌群的生态平衡与人类健康息息相关。不良饮食习惯、滥用抗生素以及感冒或者经常性憋尿等因素都会破坏肠道菌群的生态平衡,使得人体肠道内环境紊乱[6],而肠道内环境紊乱往往会促进CKD的发生及发展。
1.1 肠道内环境紊乱导致机体微炎症
肠道菌群平衡被打破,不仅会造成肠上皮屏障通透性增加,还会造成肠道蠕动不规律,从而导致清除有毒废物能力降低,通过肠道排泄的尿酸、尿素、肌酐等尿毒症毒素蓄积,然后以其为底物的条件致病菌数量增加。伴随条件致病菌的增加,脂多糖透过肠上皮屏障进入血液循环形成内毒素[7],内毒素是革兰氏阴性细菌外膜的主要成分,其可以通过依赖Toll样受体-4(toll-like receptor 4,TLR4)激活核因子κB(nuclear factor kappa-B,NF-KB)通路,促进更多的炎症因子释放(见图2),使得人体处于一种微炎症状态。长期以来,脂多糖进入血液形成内毒素引起炎症反应被认为是造成肾脏负担逐渐加的重要原因。吕晨萧等[8]对69名健康人群以及29名CKD 5期透析人群和24名CKD 5期非透析人群的粪便进行脱氧核糖核酸(deoxyribonucleic acid,DNA)测序发现,与健康对照组的肠道菌群相比,CKD5-NHD组在门水平上,厚壁菌门丰富度高;在属水平上,双歧杆菌属(Bifidobacterium)、链球菌属(Streptococcus)、瘤胃球菌属(Ruminococcus)、柯林斯氏菌属(Collinsella)等丰富度高;CKD5-HD组在门水平上,厚壁菌门、放线菌门丰富度高,而这些细菌的增多,导致了丁酸盐产生菌的显著减少,而丁酸盐可以为肠壁细胞供能维持肠道黏膜屏障,这也意味着CKD患者肠道通透性增加,尿毒素以及菌群移位引发机体炎症以及肾脏负担加重。同时炎症反应还与Treg细胞有关,有学者[9]利用白色假丝酵母菌喂养小鼠,使其肠道菌群发生紊乱,然后观察空白组与服用白色假丝酵母菌组小鼠的肾脏免疫细胞Treg的变化,得出实验组小鼠肾脏Treg细胞数量显著提高,而肾脏Treg细胞数量与肾脏炎症有关。
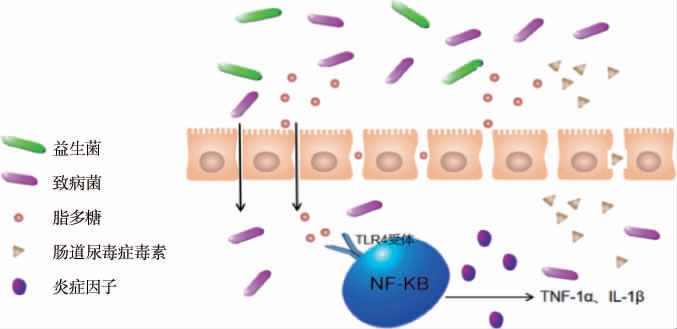
图2 肠道菌群改变对慢性肾脏疾病发展的影响
Fig.2 Effect of gut microflora change on the development of chronic kidney disease
1.2 肠道内环境紊乱导致菌群及肠源性尿毒症毒素移位
伴随条件致病菌比例增加,人体摄入的蛋白质被其酵解产生有机代谢废物包括酚类、吲哚类、氨类等的数量也会增加(见图2),这些有机代谢废物统称为肠源性尿毒症毒素。其中氨类物质增加,导致肠道内pH的增加,使得肠道黏膜蛋白主要包括occurludin、claudin及ZO蛋白的表达下降,肠道上皮细胞紧密连接结构破坏[8],肠道黏膜屏障受损,有研究表明,不仅肠道内存在细菌,而且血液循环中也存在相同种类细菌[10](见图2),从而猜测细菌可以通过受损的肠道屏障进入血液循环,在被人体免疫系统攻击分解后形成内毒素,产生大量促炎因子,刺激肾小球表面黏膜细胞产生炎症因子,进一步导致肾小球炎症反应,加快肾小管上皮细胞凋亡及肾间质纤维化程度;同时还有研究表明,除了常见的尿素、肌酐等尿毒症毒素,像硫酸吲哚酚(IS)和硫酸对甲酚(pCS)等酚类、吲哚类肠源性尿毒症毒素也可通过受损的肠道屏障进入血液循环,引起人体炎症反应,并且由于两者是蛋白结合毒素均不能通过透析去除,BARRIOS C等[11]通过对4 439例CKD早期患者体内的尿毒症毒素水平研究,发现其体内pCS和IS水平与肾功能下降呈正相关。
2 慢性肾脏疾病对肠道菌群的影响
肾脏作为人体重要的排泄代谢废物的器官,起着至关重要的作用,血液经过肾小球时,血液中的水、无机盐以及含氮代谢废物会被过滤到肾小囊中,借此将代谢废物排出体外;同时,肾脏还可以分泌激肽,血液中的α-球蛋白经专一蛋白酶作用后释放出的活性多肽,对于维持人体正常血压和血流通畅起重要作用,肾脏的这些功能,保证了人体新陈代谢的顺利进行[12]。
慢性肾脏疾病发生时,一方面,人体的新陈代谢功能降低,肾脏的代谢功能受损,肾脏功能逐步衰退减弱,导致排泄代谢废物的能力逐步减弱,人体内代谢废物在血液中蓄积,代谢废物在血液中浓度逐步升高,产生大量促炎因子,进而引起机体炎症反应,破坏肠道黏膜屏障,然后通过肠道表皮毛细血管进入肠道内部,破坏肠道菌群的生态平衡,微生物数量、组成、分布上发生明显改变(见图3),例如,乳酸杆菌(Lactobacillus)、双歧杆菌(Bifidobacterium)等有益菌的数量明显减少,肠杆菌科(Enterobacteriaceae)等致病菌数量显著增加[13]。
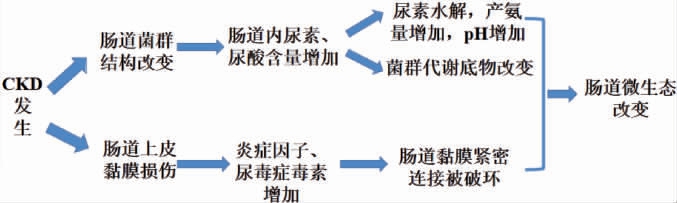
图3 慢性肾脏疾病的发生对肠道菌群的影响
Fig.3 Effect of chronic kidney disease on gut microflora
另一方面,由于CKD患者的肾脏功能不完整,为防止肾脏功能进一步遭到破坏,饮食需要调整和控制,因而需要限制蛋白质以及K+的摄入,减少包含膳食纤维在内的部分营养素的摄入,长此以往导致膳食纤维摄入量不足,使得体内摄入的蛋白利用率增加,进一步增加肠道内含氮代谢废物的蓄积,肠道菌群生态平衡由此受到影响而改变。已有研究表明,低蛋白摄入量会导致入球小动脉的收缩,降低肾小球压力,保护残余肾功能损坏[14],同时低蛋白摄入量还会降低含氮废物如尿素的产生,但是还有研究发现,通过摄入膳食纤维可以改善CKD患者体内炎症状态以及减弱蛋白质分解[15],同时,膳食纤维除了被肠道细菌糖酵解产生乙酸、丁酸等SCFAs,SCFAs可以为肠壁细胞提供能量维持肠道黏膜屏障的正常功能;膳食纤维还可以通过被肠道细菌分解与结肠中氨基酸结合到细菌蛋白质中从粪便排出,而不是发酵为肠源性尿毒症毒素,以此改善肠道菌群的组成,减少吲哚类和酚类等肠源性尿毒症毒素的产生与蓄积[16],如JIANG S等[17]通过对65名CKD患者和20名健康人群粪便菌群进行研究发现,罗氏菌属(Rothia)和普拉氏梭杆菌(Faecalibacterium prausnitzii)与肾脏功能呈负相关,得出产生丁酸盐的微生物消耗可能与CKD炎症以及进展有关,丁酸盐可以作为CKD进展的“微生物标志物”。WANG S等[18]对127名CKD患者和63名健康人群的SCFAs水平进行对比研究,发现健康人群血清中SCFAs水平显著高于CKD患者(P<0.05),同时健康人群体内丁酸盐含量[(3.44±2.12)μmol/L]达到CKD患者体内丁酸盐含量[(1.48±0.60)μmol/L]的2倍多;还通过对CKD小鼠模型补充丁酸盐的实验,验证了丁酸盐在延缓CKD发展中发挥重要作用。
3 基于调节肠道菌群治疗CKD的益生菌疗法
现有的研究表明,CKD发展程度与肠道菌群生态变化相互联系,相互影响(见图4)。当CKD发生时,除了肾脏损伤引起的血液中尿毒症毒素的积累会通过受损肠道黏膜屏障进入肠道,改变菌群微生态,治疗药物的使用以及饮食结构的改变也会引起肠道菌群结构的改变;反之,当菌群结构改变,以尿酸等尿毒症毒素为底物的条件致病菌大量繁殖,条件致病菌以及肠源性尿毒症毒素通过受损肠道黏膜屏障进入血液,引起肾脏炎症反应,最终加重CKD患者残余肾脏功能代谢压力。
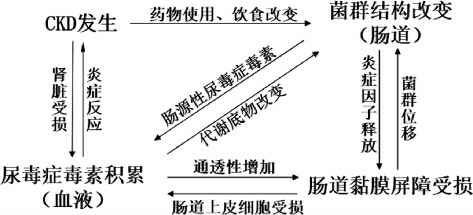
图4 慢性肾脏疾病与肠道菌群相互影响
Fig.4 Chronic kidney disease interacts with intestinal flora
正常人体肠道中含有一定比例的益生菌,而CKD患者因肠道菌群结构被破坏,益生菌的比例降低,同时,鉴于益生菌具有可以促进有益菌生长、释放生物活性物质和免疫调节因子[19],在营养物质消化、调节肠道功能中发挥作用的有益功能[20-21]。因此,通过补充益生菌或益生元(促进益生菌生长繁殖)改善CKD患者疾病逐渐被关注。益生菌在CKD的发展过程中发挥着重要的益生作用。
3.1 调节肠道菌群
肠道内环境紊乱往往会促进CKD的发生及发展,补充益生菌可以通过改善慢性肾脏疾病患者的肠道菌群的构成来缓解慢性肾脏疾病的发展[22],LEE Y J等[23]通过研究Pm1(副干酪乳杆菌(Lactobacillus paracasei)BCRC12188、嗜热链球菌(Streptococcus thermophilus)BCRC 13869、植物乳杆菌(Lactobacillus plantarum)BCRC 12251)对顺铂诱导的慢性肾脏疾病兰屿猪模型盲肠中菌群的调节作用,发现模型组中类杆菌和梭杆菌的丰度显著增加,而经Pm1干预治疗后,盲肠中微生物组成朝着空白组的菌群结构发展,强调了通过调节宿主、微生物群和代谢物之间的关系来预防慢性肾病的特殊益生菌干预的重要性;除此之外,HUANG H等[24]在腺嘌呤诱导的慢性肾脏疾病小鼠模型中应用体外降解IS、pCS等肠源性尿毒症毒素能力强的乳酸杆菌(植物乳杆菌MFM30-3、副干酪乳杆菌MFM18)进行体内验证,同样得出了筛选得到的乳酸菌可以通过逆转肠道生态失调,进一步改变肠道内共生细菌,尤其是SCFAs产生菌的丰度,减少尿毒症毒素的产生。
3.2 调节免疫功能
益生菌还可通过肠上皮细胞与肠道免疫系统发生相互作用[25-27],如激活免疫细胞(树突状细胞、巨噬细胞、自然杀伤细胞、淋巴细胞)引发宿主机体对病原微生物产生免疫反应[28];增强免疫耐受性[29];调节肠黏膜表面的修饰作用等[30]。已有研究表明,益生菌可以通过调节炎症反应以此缓解CKD,起到保护肾脏功能的作用[31-32]。姚颖等[33]通过研究益生菌L.casei Zhang对小鼠肾脏缺血再灌注损伤所引起的慢性肾损伤模型中细胞簇的影响,得出益生菌L.casei Zhang可以通过其相关代谢产物免疫调节巨噬细胞和肾小管上皮细胞,减少炎症反应发生。ZHU H等[34]通过研究服用益生菌干酪乳杆菌(Lactobacillus casei)Zhang后小鼠肾脏缺血再灌注损伤所引起的慢性肾损伤模型中代谢物的变化,发现服用益生菌L.casei Zhang后可以促进肾脏中烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD+)生物合成的激活,从而达到保护小鼠缺血性肾脏损伤。胡文兴等[35]通过对78例维持性血液透析慢性肾脏疾病患者进行随机临床双盲试验,对照组进行原有治疗,实验组在原有治疗的基础上服用益生菌颗粒,结果表明实验组内毒素水平较对照组下降水平更加显著,同时,有研究表明CKD患者肾脏衰竭程度与内毒素水平呈正相关,内毒素可以通过激活相关通路产生白细胞介素1(interleukin-1,IL-1)激活巨噬细胞,加重对肾脏的免疫损失,因而降低体内内毒素的含量对于保护CKD患者残余肾脏功能具有重要作用[36]。
3.3 增强肠上皮细胞屏障作用
对于慢性肾脏疾病患者,补充益生菌,一方面可以通过益生菌细胞壁的特殊组分磷壁酸同肠道黏膜细胞紧密结合,形成一个保护肠道以防止条件致病菌入侵及定植的生物学屏障,贺丽娟等[37]通过对5/6肾切除小鼠分别灌胃108 CFU/d双歧杆菌和104 CFU/d乳酸杆菌测定血液中D-乳酸含量的变化,得出双歧杆菌和乳酸杆菌可以维持慢性肾衰竭肠黏膜的正常通透性,从而达到抑制病原菌在肠道中的生长繁殖的效果。
另一方面,肠道益生菌产生的细胞外糖苷酶可降解肠黏膜上皮细胞的复杂多糖产生乙酸、丁酸等SCFAs[38],SCFAs可以为肠壁细胞供能,提供营养,维持肠道黏膜屏障,还可通过代谢产生乳酸降低肠道pH[39],或者产生某些抗菌化合物[40](抗菌肽),既可以抑制条件致病菌生长繁殖,减少致病菌利用蛋白发酵产生IS、pCS等肠源性尿毒症毒素,也可以降低肠道内氨的吸收,从而减少肠道内尿素的生成(见图5),促进肠道蠕动,有利于肠道内代谢产物排泄[41]。如GUIDA B等[42]通过对30例未经透析的终末期肾病患者进行随机双盲临床试验,实验组口服益生菌制剂,对照组口服安慰剂,结果表明,口服益生菌制剂可以显著降低血液中pCS以及IS的水平;NATARAJAN R等[43]通过对经过接受透析治疗的终末期肾病(end-stage renal disease,ESRD)患者进行了一项随机、双盲、安慰剂对照交叉研究实验,实验组口服特异性益生菌制剂,对照组口服安慰剂,结果表明,口服特异性益生菌制剂的ESRD患者血液中炎症因子水平下降以及氧化应激反应减轻;HUANG H等[24]在腺嘌呤诱导的慢性肾脏疾病小鼠模型中进行验证,得出了乳酸菌可以调整SCFAs产生菌的丰度来调节代谢产物丁酸的产生防止肠屏障破坏,还可以通过减少肾损伤和纤维化相关蛋白、调节氧化应激、促炎活性和免疫反应,显著改善肾功能。
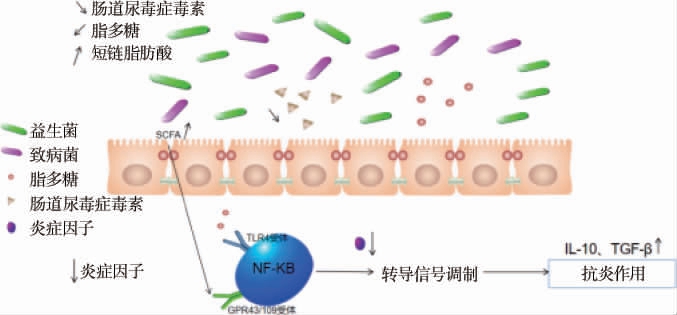
图5 益生菌干预的优点
Fig.5 Advantages of probiotics intervention
4 结论
以肠道菌群为切入点通过补充益生菌、益生元调节肠道菌群,可以恢复肠道运动,促进SCFAs的产生修复受损的肠道黏膜屏障,以及刺激抗炎因子的产生,均能有效延缓CKD发展,为临床治疗CKD提供了新的治疗思路与方式。但是还应该强调肠道菌群的局限性以及具体作用机制、研究样本量小及基线水平的差异、临床试验中的具体数据反映等,有待更加深入和系统的研究。
同时,未来的研究不仅要关注益生菌能否通过胃肠道存活的数量发挥效果,还更应该关注益生菌的菌株特异性,深入探索不同益生菌发挥作用的具体机制,通过基因组学技术验证并确定CKD患者和肠道菌群的相互关系,明确不同益生菌相关基因的上下游通路机制,以此进行CKD患者的治疗以及预后。
[1]BURSSELMANS A.ISN Biennal Report 2015-2017[R].International Society of Nephrology,2017.
[2]RASK-MADSEN C,KING G L.Vascular complications of diabetes:Mechanisms of injury and protective factors L[J].Cell Metab,2013,17(1):2033.
[3]CHERREZ-OJEDA I,FELIX M,MATA V L,et al.Preferences of ICT among patients with chronic kidney disease undergoing hemodialysis:An ecuadorian cross-sectional study[J].Healthc Inform Res,2018,24(4):292-299.
[4]JANSZ T T,VAN REEKUM F E,ZYILMAZ A,et al.Coronary artery calcification in hemodialysis and peritoneal dialysis[J].Am J Nephrol,2018,48(5):369-377.
[5]TOMASELLO G,MAZZOLA M,LEONE A,et al.Nutrition,oxidative stress and intestinal dysbiosis:Influence of diet on gut microbiota in inflammatory bowel diseases[J].Biomed Pap Med Fac UnivOalacky Olomouc Czech Repub,2016,160(4):461-466.
[6]MARIÑO E.The gut microbiota and immune-regulation:the fate of health and disease[J].Clin Translat Immunol,2016,5(11):e107.
[7]MCDERMOTT A J,HUFFNAGLE G B.The microbiome and regulation of mucosal immunity[J].Immunology,2014,142(1):24-31.
[8]吕晨萧,李洋,高颖,等.慢性肾脏病5期患者的肠道菌群变化[J].山东大学学报,2019,57(7):72.
[9]WHIBLEY N,MACCALLUM D,VICKERS M,et al.Expansion of Foxp3+T-cell populations by Candida albicans enhances both Th1-cell responses and fungal dissemination after intravenous challenge[J].Eur J Immunol,2014,44(4):1069-1083.
[10]HU J,LUO H,WANG J,et al.Enteric dysbiosislinked gut barrier disruption triggers early renal injury induced by chronic high salt feeding in mice[J].Exp Mol Med,2017,49(8):e370.
[11]BARRIOS C,BEAUMONT M,PALMISTER T,et al.Gut-microbiotametabolite axis in earlyrenal function decline[J].PLoS One,2015,10(8):e0134311.
[12]上海慢性肾脏病早发现及规范化诊治与示范项目专家组,高翔,梅长林.慢性肾脏病筛查诊断及防治指南[J].中国实用内科杂志,2017,37(1):28-34.
[13]FOOLADI A A I,YAZDI M H,POURMAND M R,et al.Th1 cytokine production induced by Lactobacillus acidophilus in BALB/c mice bearing transplanted breast tumor[J].Jundishapur J Microbiol,2015,8(4):e17354.
[14]MASSIMO C,CINZIA L,DANIELA C,et al.Protein intake and kidney function in the middle-age population:Contrast between crosssectional and longitudinal data[J].Nephrol Dial Transpl,2014,29(9):1733-1740.
[15]EVENEPOEL P,MEIJERS B K.Dietary fiber and protein:Nutritional therapy in chronic kidney disease and beyond[J].Kidney Int,2012,81(3):227-229.
[16]CASES A,CIGARRÁN-GULDRÍS S,MAS S,et al.Vegetable-based diets for chronic kidney disease? it is time to reconsider[J].Nutrients,2019,11(6):1263.
[17]JIANG S,XIE S,LV D,et al.A reduction in the butyrate producing species Roseburia spp.and Faecalibacterium prausnitzii is associated with chronic kidney disease progression[J].Anton Leeuw,2016,109(10):1389-1396.
[18]WANG S,LV D,JIANG S,et al.Quantitative reduction in short-chain fatty acids,especially butyrate,contributes to the progression of chronic kidney disease[J].Clin Sci,2019,133(17):1857-1870.
[19]HAN Z,WILLER T,PIELSTICKER C,et al.Differences in host breed and diet influence colonization by Campylobacter jejuni and induction of local immune responses in chicken[J].Gut Pathog,2016,8:56.
[20]AGUS A,PLANCHAIS J,SOKOL H.Gut microbiota regulation of tryptophan metabolism in health and disease[J].Cell Host Microbe,2018,23(6):716-724.
[21]KURASHIMA Y,KIYONO H.Mucosal ecological network of epithelium and immune cells for gut homeostasis and tissue healing[J].Annu Rev Immunol,2017,35:119-147.
[22]SIVAMARUTHI B S,KESIKA P,CHAIYASUT C.Effect of probiotics supplementations on health status of athletes[J].Int J Environ Res Publ Health,2019,16(22):4469.
[23]LEE Y J,LI K Y,WANG P J,et al.Alleviating chronic kidney disease progression through modulating the critical genus of gut microbiota in a cisplatin-induced Lanyu pig model[J].J Food Drug Anal,2020,28(1):103-114.
[24]HUANG H,LI K,LEE Y,et al.Preventive effects of Lactobacillus mixture against chronic kidney disease progression through enhancement ofbeneficial bacteria and downregulation of gut-derived uremic toxins[J].J Agr Food Chem,2021,69(26):7353-7366.
[25]SALVO C D,BUERA K A,PIZARRO T T.Cytokine-mediated regulation of innate lymphoid cell plasticity in gut mucosal immunity[J].Front Immunol,2020,https://doi.org/10.3389/fimmu.2020.585319.
[26]陈宗文.肠道微生物群对宿主免疫系统发育和功能的调节[J].医药前沿,2019,9(29):130-131.
[27]TURCK D,CASTENMILER J,HENAUW S D,et al.Bi-07 contributes to increasing lactose digestion:evaluation of a health claim pursuant to article 13(5)of regulation(EC)No 1924/2006[J].EFSA J,2020,18(7):201-206.
[28]马欣,王丽,沈宏春,等.益生菌对慢性肾脏病大鼠肾功能及肠道屏障功能的防治作用研究[C]//中国中西医结合学会肾脏疾病专业委员会.中国中西医结合学会肾脏疾病专业委员会2015年学术年会资料汇编.中国中西医结合学会肾脏疾病专业委员会:中国中西医结合学会,2015:631-632.
[29]PARADA V D,DE LA FUENTE M K,LANDSKRON G,et al.Short chain fatty acids(SCFAs)-mediated gut epithelial and immune regulation and its relevance for inflammatory bowel diseases[J].Front Immunol,2019,10:277.
[30]KOPPE L,MAFRA D,FOUQUE D.Probiotics and chronic kidney disease[J].Kidney Int,2015,88(5):958-966.
[31]WANG I K,WU Y Y,YANG Y F,et al.The effect of probiotics on serum levels of cytokine and endotoxin in peritoneal dialysis patients:a randomised,double-blind,placebo-controlled trial[J].Benef Microbes,2015,6(4):423-430.
[32]尚邦娟,唐莉.益生菌对于慢性肾衰竭血液透析患者血红蛋白影响的随机临床研究[J].中国中西医结合肾病杂志,2018,19(10):894-896.
[33]姚颖,朱菡.益生菌L.casei Zhang对小鼠肾脏缺血再灌注损伤的保护作用及其机制的研究[C]//中国营养学会第十三届全国营养科学大会暨全球华人营养科学家大会论文汇编,2017:27-28.
[34]ZHU H,CAO C,WU Z,et al.The probiotic L.casei Zhang slows the progression of acute and chronic kidney disease[J].Cell Metab,2021,33(10):1926-1942.
[35]胡文兴,刘敏.益生菌对维持性血液透析慢性肾脏病患者肠道菌群失调的影响[J].中国微生态学杂志,2020,32(11):1323-1326.
[36]蒋也平,沈颖,刘小荣.慢性肾脏病5期维持性血液透析患儿营养状态的评估[J].中国当代儿科杂志,2018,20(3):189-194.
[37]贺丽娟,蒋云生,熊文,等.乳酸菌对肠黏膜通透性及中小分子尿毒素清除的影响[J].中国血液净化,2008,7(2):78-80.
[38]LUO X S,KONG Q,WANG Y M,et al.Colonization of Clostridium butyricum in rats and its effect on intestinal microbial composition[J].Microorganisms,2021,9(8):1573.
[39]杨红初,纪孙瑞,龚月生,等.益生菌的研究进展及其在畜禽生产中的应用[J].饲料博览,2008(5):8-11.
[40]王宝东.益生菌的生物学功效及其在动物生产中的应用[J].饲料博览,2022(2):27-30.
[41]佚名.益生菌类保健食品申报与审评规定(试行)[J].中国食品卫生杂志,2005,17(4):369-370.
[42]GUIDA B,GERMANÒ R,TRIO R,et al.Effect of short-term synbiotic treatment on plasma p-cresol levels in patients with chronic renal failure:a randomized clinical trial[J].Nutr Metab Cardiovasc Dis,2014,24(9):1043-1049.
[43]NATARAJAN R,PECHENYAK B,VYAS U,et al.Randomized controlled trial of strain-specific probiotic formulation(Renadyl)in dialysis patients[J].Biomed Res Int,2014,2014:568-571.