猕猴桃(Actinidia chinensis Planch)又名藤梨、羊桃、木子,为侧膜胎座目,猕猴桃科,猕猴桃属,猕猴桃种,落叶藤本植物[1-3],猕猴桃果汁多、风味宜人,富含维生素C(vitamin C,VC)、氨基酸、多糖、挥发性风味物质等多种营养成分[4-5],具有提升免疫功能、治疗肝脏疾病、消化不良、抑制肿瘤等功效,对人体健康具有促进作用[6],因此深受消费者喜爱。果农为提高猕猴桃产量,农药在其生长过程中被广泛应用于病、虫、草害等防治,因存在农药不合理使用的问题,猕猴桃中存在农药污染风险。因此,建立猕猴桃中农药残留量的快速检测方法,对于保证猕猴桃的质量安全具有重要作用。
有机磷农药是我国目前使用范围最广、药用最大的农药。作为杀虫剂、除草剂、杀真菌剂[7-8],有机磷农药具有广谱、高效、用量小以及作用方式多、使用方便、半衰期短等优点,广泛应用于农业、工业、医药等领域,但与此同时产生的环境问题也日益严重。目前,有机磷农药的检测方法主要有拉曼光谱法、免疫分析法、气相色谱法、液相色谱-质谱法(liquid chromatography-mass spectrometry,LC-MS)和气相色谱-串联质谱法(gas chromatography-tandem mass spectrometry,GC-MS/MS),其中LC-MS和GC-MS/MS技术应用最广[9-10],其具有分析范围广、分离能力强、检测限低、分析时间快和自动化程度高等优点,已成为农药残留分析的重要方法之一。较传统农药残留检测方法,QuEchERS(quick,easy,chenp,effective,rugged,safe)前处理方法具有净化效果好、重复性强、灵敏度高等优势,能有效消除基质干扰,减少假阳性的检出率,简化样品的前处理,降低分析成本。近年来,国内外已有关于QuEChERS方法作为农兽药残留检测的前处理方法的文献报道,蒋晓勤等[11]采用QuEChERS法萃取-气相色谱-三重四级杆串联质谱法快速测定果蔬中58种农药残留;王兴宁等[12]采用超高效液相色谱-四级杆/静电场轨道阱高分辨质谱(ultra-high performance liquid chromatography-quadrupole/electrostatic field orbitrap high resolution mass spectrometry,UHPLC-Q-Orbi trap HRMS)法快速检测果蔬中84种除草剂残留;HAN M等[13]采用QuEChERS-气相色谱-串联质谱法测定蔬菜中48种农药残留。
目前,关于猕猴桃农药残留检测报道主要以NY/T761—2008《蔬菜和水果中有机磷、有机氯、拟除虫菊酯和氨基甲酸酯类农药多残留的测定》的气相色谱法为主,还鲜见以气相色谱-串联质谱法分析检测猕猴桃中的农药残留的文献报道。因此,本研究通过对猕猴桃样品中15种有机磷农药的提取、净化条件进行考察和优化以改良QuEchERS前处理法,并结合气相色谱-串联质谱(GC-MS/MS)法,建立了同时快速检测猕猴桃中15种有机磷农药残留的方法,并将其应用于市售猕猴桃样品的筛查检测,为确保猕猴桃质量安全提供有效的检测方法。
1 材料与方法
1.1 材料与试剂
猕猴桃(六盘水红心猕猴桃)(编号为1#~20#):市售。乙腈、甲苯(均为色谱纯):德国Merck公司;丙酮、正己烷、乙酸乙酯(均为色谱纯):美国Fisher公司;无水硫酸钠、氯化钠(均为分析纯):广州化学试剂有限公司;乙二胺-N-丙基硅烷(primary secondary amine,PSA)、十八烷基硅烷键合硅胶(C18)、石墨化碳黑(graphitized carbon black,GCB)(均为分析纯):日本Shimadzuac公司;环氧七氯(1 000 μg/mL,1.0 mL)、敌敌畏、对硫磷、喹硫磷、苯硫磷、治螟磷、三唑磷、久效磷、速灭磷、益棉磷、保棉磷、乙拌磷、除线磷、灭线磷、丙溴磷、毒死蜱标准品(均为100 μg/mL,1.2 mL):北京坛墨质检科技股份有限公司。
1.2 仪器与设备
GC-MS/MS-TQ8040三重四极杆气质联用仪(配AOC-20i+s自动进样器):日本岛津公司;Q24RC快速组织低温破碎匀浆仪:北京昊诺斯科技有限公司;XPR分析天平:瑞士梅特勒-托利多公司;XH-B旋涡混合器:上海鸿志实验仪器有限公司;MultifugePro高性能通用台式离心机:赛默飞世尔科技实验室产品;RE-5220旋转蒸发器:济南禾普仪器设备有限公司;WIGGENS氮吹仪:维根技术(北京)有限公司。
1.3 方法
1.3.1 样品的制备及QuEChERS样品前处理
于20份猕猴桃样品中随机选取无腐烂的猕猴桃,用研磨仪粉碎成猕猴桃汁后装入洁净的盛样容器中,放入2~4 ℃环境中备用。
QuEChERS前处理:称取10.0 g(精确至0.001 g)猕猴桃汁于50mL离心管中,加入10mL乙腈-乙酸乙酯(1∶1,V/V),旋涡振荡提取10 min,加入氯化钠10 g,再旋涡振荡提取5 min,将离心管放入离心机,以6 000 r/min离心8 min,取上清液5 mL,加入称有最佳配比的PSA、GCB、C18、无水硫酸镁的离心管中,旋涡振荡混匀,以8 000 r/min离心10 min。取全部上清液于试管中置于38 ℃氮吹至近干,加入0.1 mL质量浓度为10 μg/mL的环氧七氯内标溶液,用乙酸乙酯定容至1 mL,过0.22 μm有机相微孔滤膜,供GC-MS/MS分析。
1.3.2 标准溶液的配制
环氧七氯内标溶液的配制:准确量取100 μL于10 mL容量瓶中,用正己烷定容至刻度,即得质量浓度为10 μg/mL的环氧七氯储备液,于2~4 ℃冷藏保存。
15种混合农药标准储备液的配制:分别随机选取10种农药,各量取1 mL于10 mL容量瓶中并于38 ℃氮吹至近干后,再量取剩余5种农药各1 mL于容量瓶中,并用正己烷定容至刻度,即得质量浓度为10 μg/mL混合农药标准储备液,于2~4 ℃冷藏保存。
15种农药基质混合标准工作溶液的配制:按照1.3.1方法前处理不含目标农药的“空白”猕猴桃样品,即得空白基质提取液,分别精密移取10 μg/mL混合农药标准储备液于进样瓶中,加入环氧七氯内标液,用空白基质提取液定容,得到稀释至质量浓度为0.05μg/mL、0.10μg/mL、0.20μg/mL、0.50 μg/mL和1.00 μg/mL的系列混合标准工作溶液,其中分别含内标环氧七氯1 μg/mL。
1.3.3 气相色谱-三重四级杆串联质谱分析条件
色谱条件:Rxi-5SilMS色谱柱(30 m×0.25 mm×0.25μm);载气为高纯氦气(He)(纯度≥99.999%);柱温的升温程序为初始温度50 ℃,保留1 min,以25 ℃/min升温至150 ℃,保留3 min,再以10 ℃/min升温至300 ℃,保留7 min;载气控制方式为恒线速度;不分流进样;进样口温度280 ℃;线速度19.45 cm/s;溶剂延迟时间3 min;柱流量1.78 mL/min,进样量1 μL。
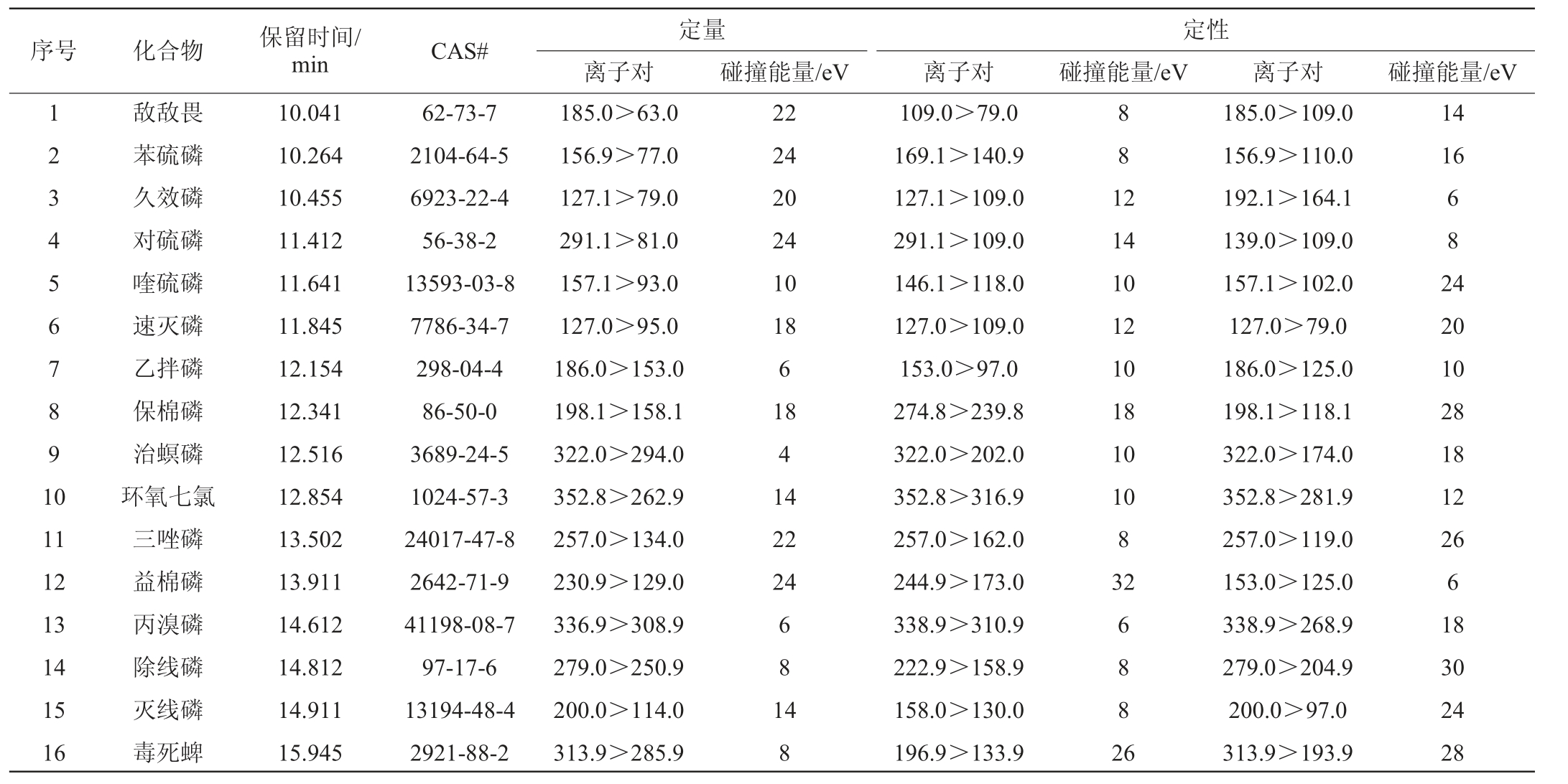
质谱条件:电离方式为电子电离(electronic ionization,EI)源;电子能量70 eV;接口温度290 ℃;碰撞气为氩气(Ar)(纯度≥99.999%);检测器电压(相对于调谐结果)0.5 kV;扫描模式为多反应监测(multiple reaction monitoring,MRM)模式,具体参数见表1。
表1 环氧七氯及15种农药组分的CAS号和多反应监测参数
Table 1 CAS number and multiple response monitoring parameters of heptachlor epoxy and 15 pesticide components
1.3.4 不同提取溶剂对各组分回收率的影响
农药种类繁多,根据不同农药的性质选择不同提取溶剂对分析结果的准确性至关重要[14-18]。因一些样品成分复杂,用单一溶剂提取样品中农药残留效果不佳,需要几种溶剂混合提取才能满足农药分析。以回收率为考察指标,按照QuEChERS前处理方法对农药常用提取溶剂(二氯甲烷、乙腈、乙腈-乙酸乙酯(1∶1,V/V))的提取效果进行考察。
1.3.5 不同净化方法对各组分回收率的影响
农药残留检测中常用到的净化剂有乙二胺-N-丙基甲硅烷(PSA)、十八烷基硅烷键合硅胶(C18)、石墨化碳黑(GCB)、无水MgSO4等[19-21]。由于猕猴桃样品基质比较复杂,富含糖类、蛋白质、色素等成分,本试验选取3种组合吸附剂作为猕猴桃样品提取液净化剂,分别为25 mg PSA+50 mg C18+10 mg GCB+100 mg无水MgSO4(A组)、50 mg PSA+100 mg C18+20 mg GCB+200 mg无水MgSO4(B组)、100 mg PSA+200 mg C18+40 mg GCB+300 mg无水MgSO4(C组)作对比试验,考察净化剂对农药回收率的影响。
1.3.6 基质效应考察
在农药残留分析中基质效应普遍存在,会对农药残留分析方法的准确度、灵敏度、重复性等产生影响,表现为基质抑制或增强效应,基质效应越接近1,则基质效应对检测结果影响越小,反之亦然。以目标物(农药)的质量浓度与内标物(环氧七氯)质量浓度的比值和对应目标物(农药)峰面积与内标物(环氧七氯)峰面积的比值绘制标准曲线,以峰面积比(y)为纵坐标,以质量浓度比(x)为横坐标,绘制标准曲线,分别得到基质匹配校准线性方程和溶剂标准线性方程。基质效应的计算[22-24]公式如下:
1.3.7 方法的检出限与定量限
以标准曲线最低点工作液稀释10倍后上机分析,以3倍信噪比(S/N=3)计算检出限[25],以信噪比为10(S/N=10)计算定量限[26]。
1.3.8 方法的加标回收率与精密度试验
选取空白猕猴桃样品基质进行加标回收试验,分别准确添加5 μg/kg、50 μg/kg和100 μg/kg的3个水平浓度的15种有机磷农药混合标准溶液,按照1.3.1 QuEChERS前处理,每个添加水平做6次重复试验,计算其加标回收率、相对标准偏差(relative standard deviation,RSD)。
2 结果与分析
2.1 环氧七氯内标及15种有机磷农药混标溶液GC-MS分析总离子流色谱图
环氧七氯内标及15种混合农药标准品、猕猴桃样品中环氧七氯及15种混合农药的GC-MS分析总离子流色谱图(total ions chromatogram,TIC)见图1。
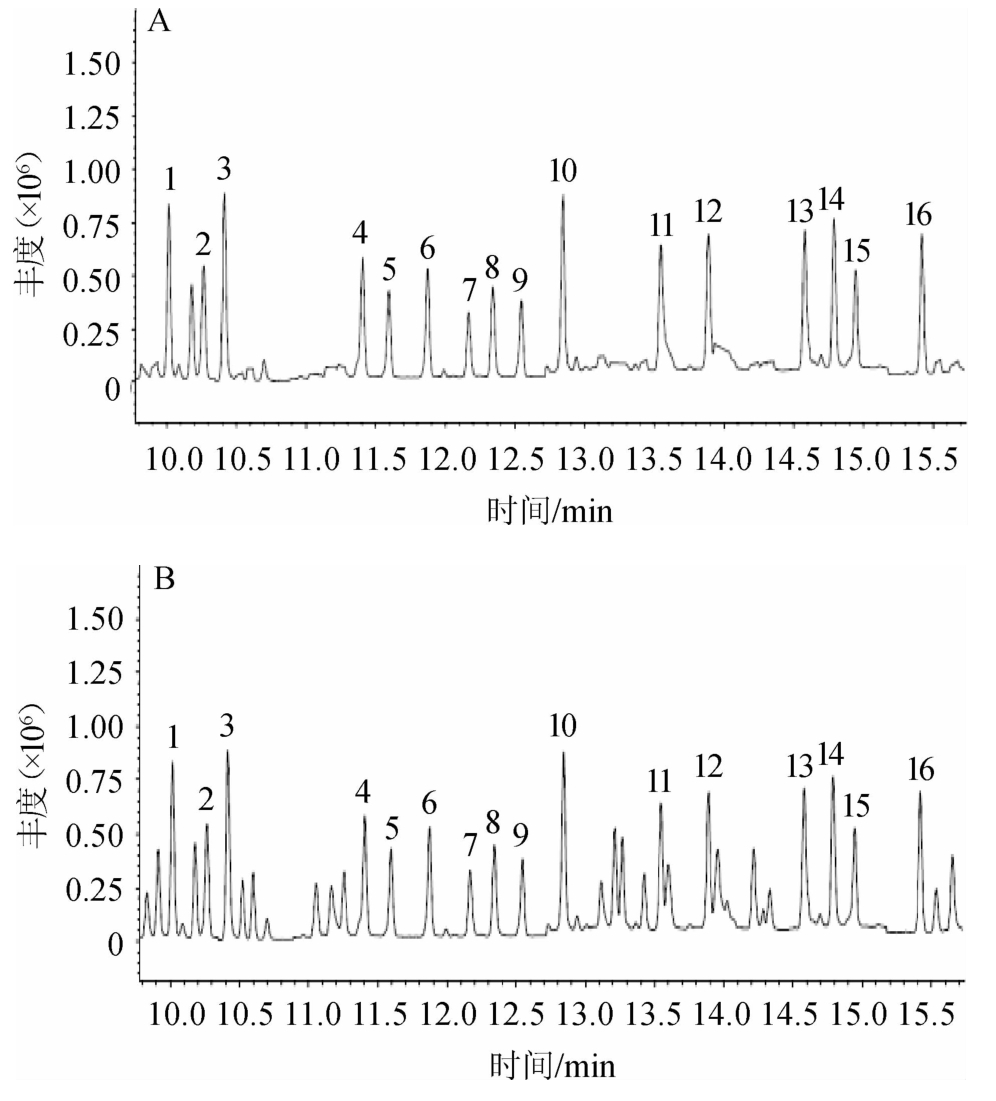
图1 环氧七氯及15种农药标准品(A)、猕猴桃样品中环氧七氯及15种农药(B)的GC-MS分析总离子流色谱图
Fig. 1 Total iron chromatogram of heptachlor epoxy and 15 pesticides standards (A),heptachlor epoxy and 15 pesticides in kiwifruit samples (B) analyzed by GC-MS
1.敌敌畏;2.苯硫磷;3.久效磷;4.对硫磷;5.喹硫磷;6.速灭磷;7.乙拌磷;8.保棉磷;9.治螟磷;10.环氧七氯;11.三唑磷;12.益棉磷;13.丙溴磷;14.除线磷;15.灭线磷;16.毒死蜱。
2.2 提取溶剂的选择
不同提取溶剂对15种农药回收率的影响见图2。由图2可知,以乙腈、二氯甲烷、乙腈-乙酸乙酯(1∶1,V/V)分别作为QuEChERS法萃取溶剂时,其平均回收率分别是83.91%、86.72%、91.93%,均满足农药残留痕量分析要求。研究表明,二氯甲烷毒性相对较大,长期接触不利于实验人员的健康;单一溶剂乙腈提取效果没有混合溶剂乙腈-乙酸乙酯(1∶1,V/V)提取效果好,所以选择乙腈-乙酸乙酯(1∶1,V/V)作为QuEChERS前处理法的提取溶剂。
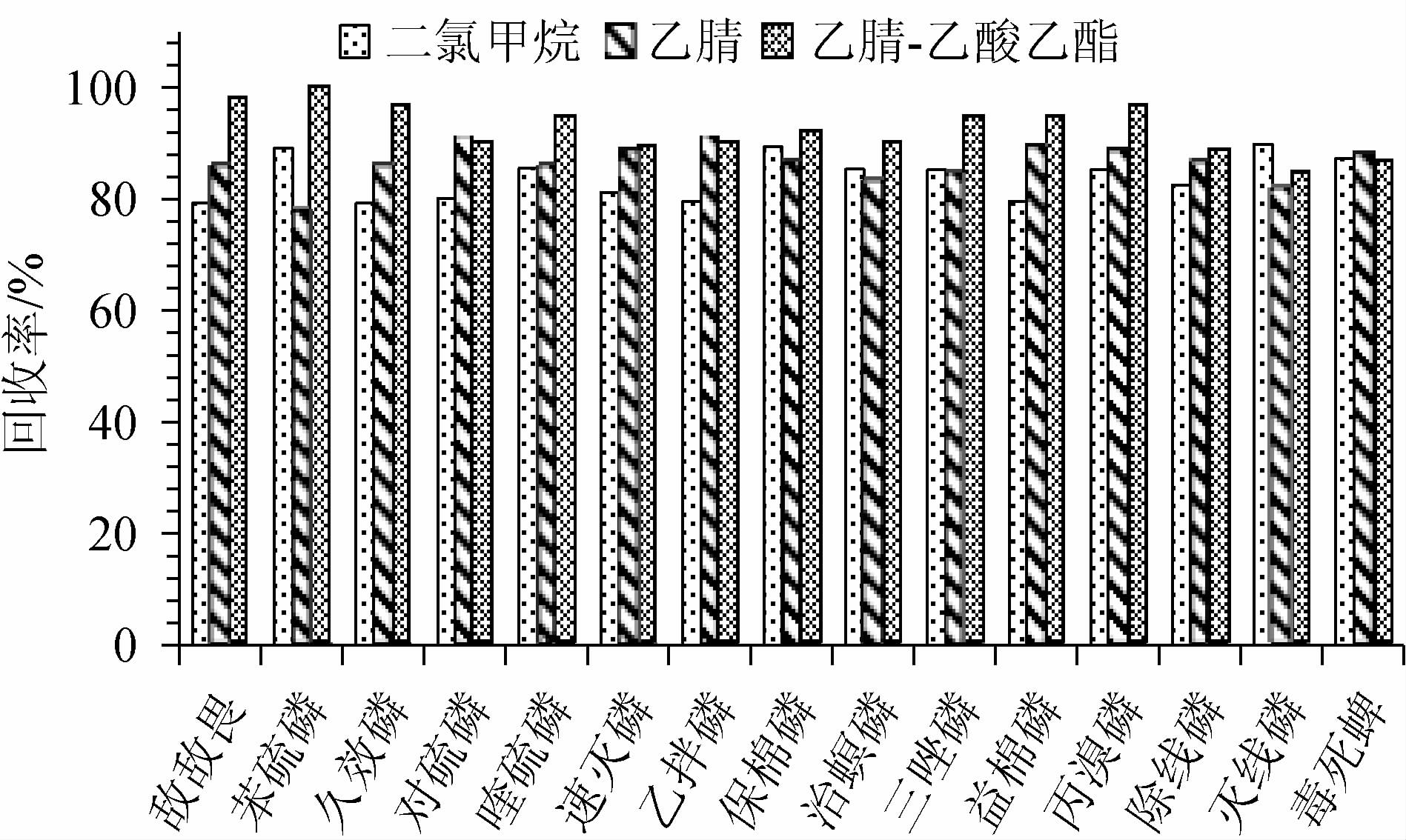
图2 不同提取溶剂对15种农药回收率的影响
Fig. 2 Effect of different extraction solvents on recovery rate of 15 pesticides
2.3 净化方法的选择
不同净化方法对15种农药回收率的影响见图3。由图3可知,随着净化剂用量的增加,猕猴桃中15种农药的回收率逐渐增大,其中A组、B组、C组的平均回收率分别为84.85%、87.47%、93.63%,且C组净化样品溶液越清澈,对仪器色谱柱及离子源污染较小,所以选择C组(100 mg PSA+200 mg C18+40 mg GCB+300 mg无水MgSO4)的净化剂配比进行样品净化。

图3 不同净化方法对15种农药回收率的影响
Fig. 3 Effect of different purification methods on recovery rate of 15 pesticides
2.4 基质效应
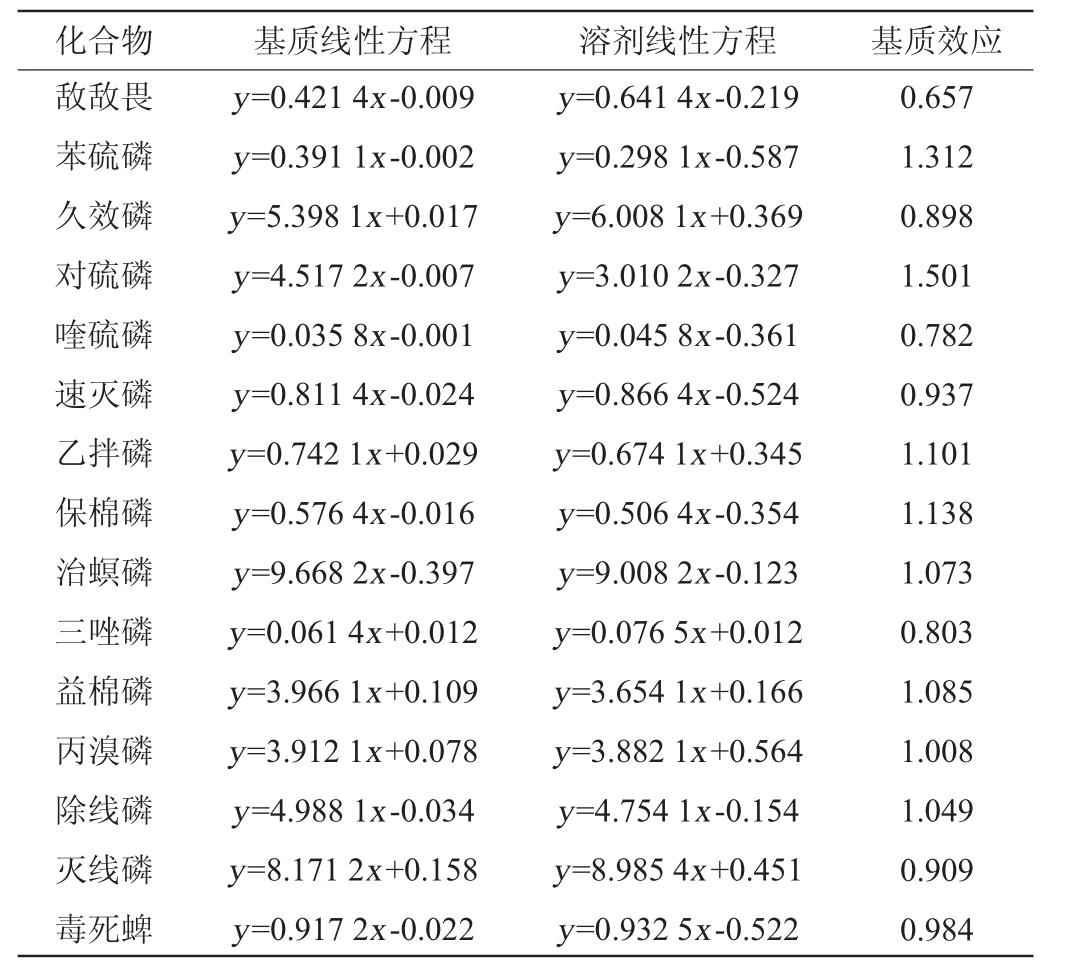
15种农药在猕猴桃中的基质效应见表2。由表2可知,基质效应对治螟磷、益棉磷、丙溴磷、除线磷、毒死蜱分析结果影响较小,但对其他农药分析结果存在基质抑制或增强效应,为了避免基质效应对农药分析结果产生影响,试验中可采用空白基质溶液匹配标准曲线,加入分析保护剂、盐析等方法降低基质效应对试验结果的影响[27-28]。本试验采用基质匹配标准曲线法降低基质效应的影响。
表2 15种农药在猕猴桃中的基质效应
Table 2 Matrix effect of 15 pesticides in kiwifruit
2.5 方法学考察
2.5.1 方法的线性回归方程、检出限及定量限
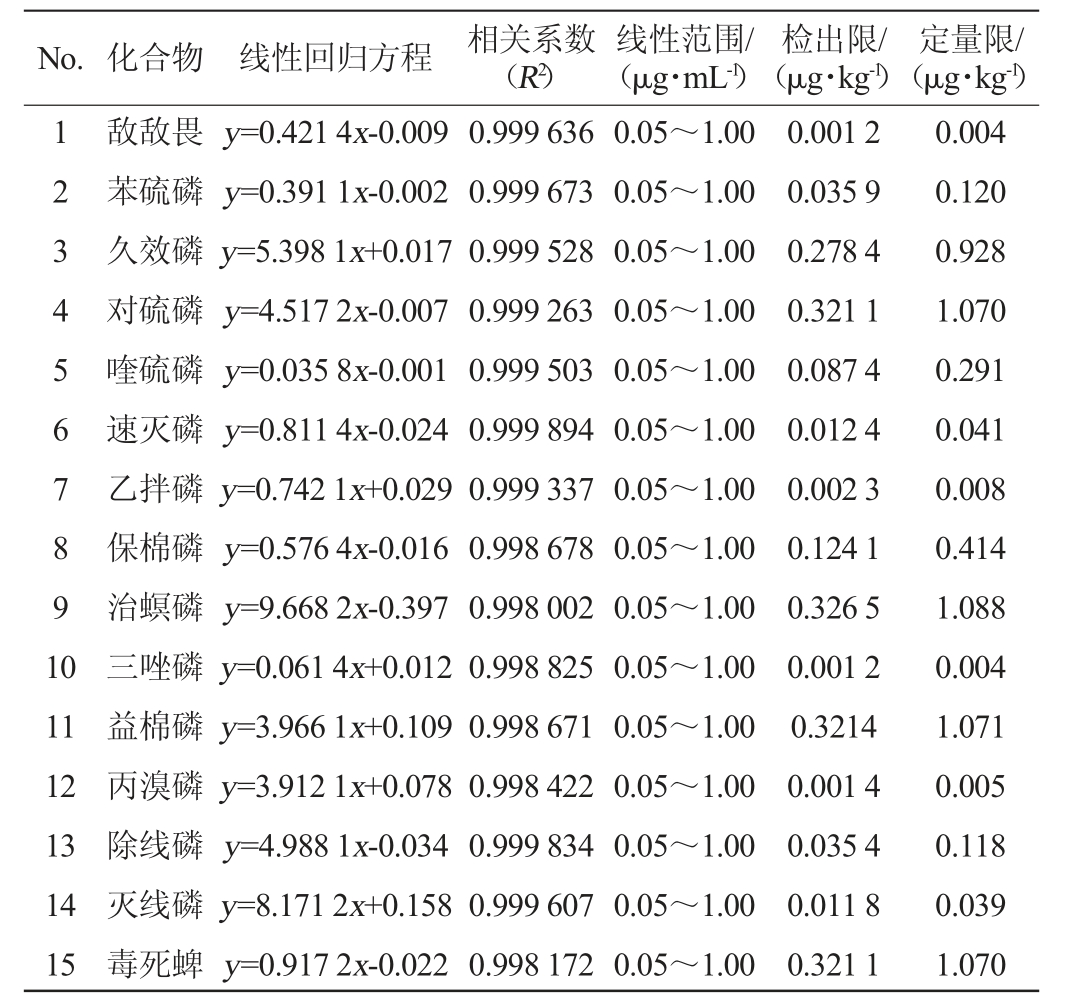
15种农药的标准曲线的线性回归方程、检出限及定量限见表3。由表3可知,15种农药在质量浓度0.05~1.00 μg/mL范围内线性关系良好,相关系数R2≥0.998,方法检出限为0.001 2~0.326 5 μg/kg;方法定量限为0.004~1.088 μg/kg。符合GB/T27404—2008《实验室质量控制规范食品理化检测》及农业部公告2386号《农药残留检测方法国家标准编制指南》中相应参数要求,表明所建立的检测方法科学可行,可用于实际样品的检测。
表3 15种农药的线性回归方程、检出限及定量限
Table 3 Linear regression equation,detection limit and quantification limit of 15 pesticides
2.5.2 方法加标回收率及精密度试验结果
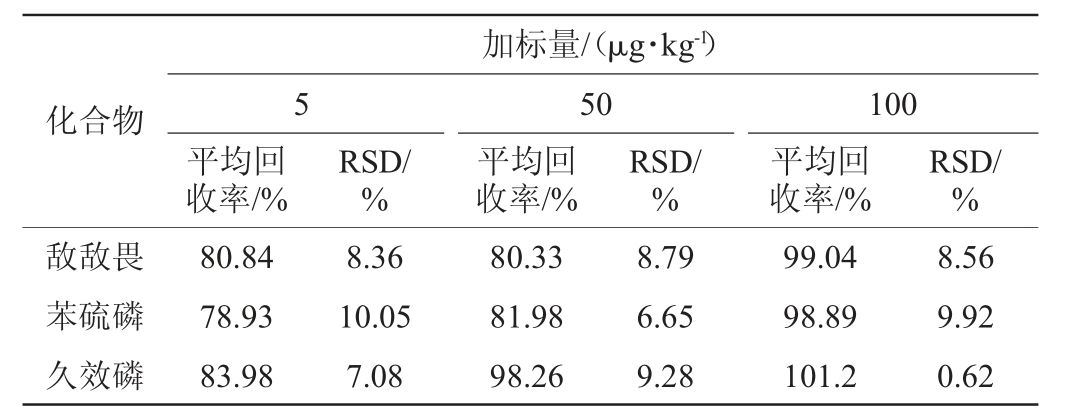
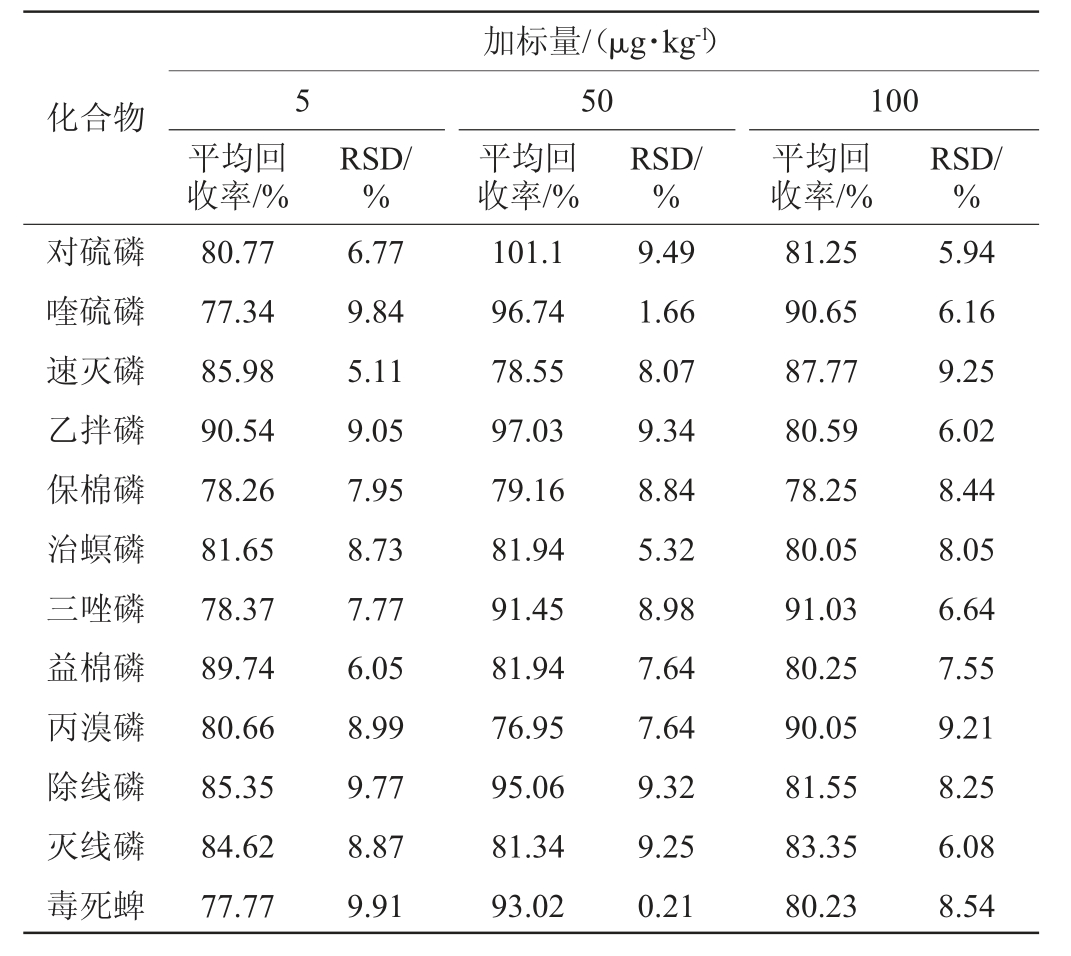
由表4可知,空白猕猴桃样品中15种农药的平均加标回收率为76.95%~101.2%,精密度试验结果相对标准偏差(RSD)为0.21%~10.05%,符合GB/T 27404—2008《实验室质量控制规范食品理化检测》痕量残留分析要求。
表4 加标回收率及精密度试验结果(n=6)
Table 4 Results of spiked recovery rate and precision tests (n=6)
续表
2.6 猕猴桃样品的检测结果
以上述建立的方法检测20份市售猕猴桃中的15种农药残留,结果见表5。由表5可知,共有15个猕猴桃样品中检出了14种农药残留。根据国标GB 2763—2021《食品安全国家标准食品中农药最大残留限量》中规定农药最大残留限量(maximum residue limits,MRLs)对检测结果进行判定。15种农药残留中,有10种农药在国标GB 2763—2021中有农药最大残留限量值的相应规定,这10种农药虽在不同猕猴桃样品中有检出呈阳性,但其值均未超过相应国标规定最大残留限量值(MRLs);剩余5种农药未有最大残留限量值(MRLs)规定的农药品种不作判断。其中苯硫磷在20份猕猴桃样品均未检出。
表5 猕猴桃样品中15种农药的检测结果
Table 5 Determination results of 15 pesticides in kiwifruit samples
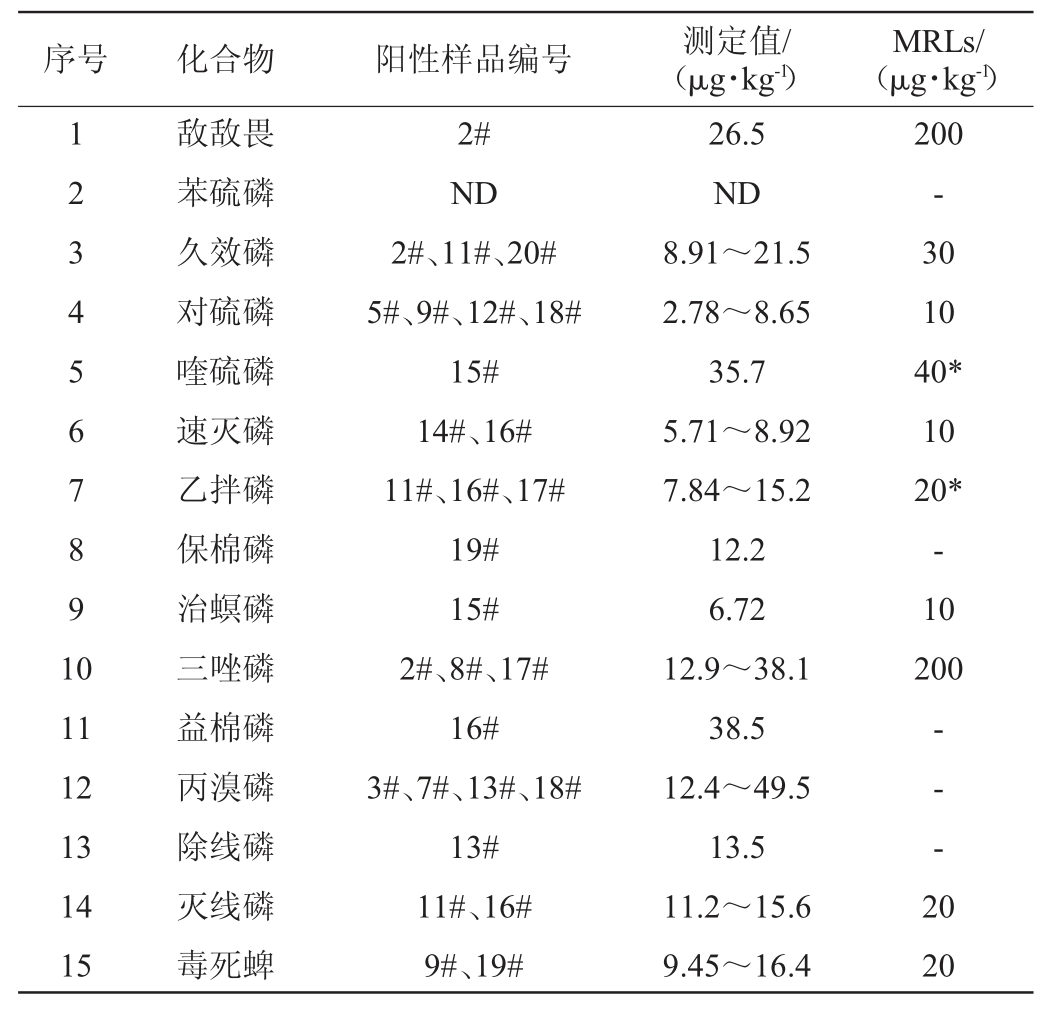
注:“ND”表示未检出,“*”表示临时限量值,“-”相应标准中未有最大残留限量值(MRLs)。
3 结论
本研究以猕猴桃为检测对象,建立了改良QuEChERS法结合气相色谱-三重四极杆串联质谱(GC-MS/MS)法快速检测猕猴桃中15种有机磷农药残留的分析检测方法,通过对试验条件的选择和优化,最终采用乙腈-乙酸乙酯(1∶1,V/V)作为提取溶剂,净化条件为100 mg PSA+200 mg C18+40 mg GCB+300 mg无水MgSO4(C组),空白基质配标,保留时间、特征离子及其相对丰度定性,内标法定量。在此优化前处理条件下,其平均加标回收率为76.95%~101.2%,精密度试验结果的相对标准偏差(RSD)为0.21%~10.05%,方法检出限为0.001 2~0.326 5 μg/kg,定量限为0.004~1.088 μg/kg。该方法具有净化效果好、重复性强、灵敏度高等优势,在分析猕猴桃等复杂样品时,能有效消除基质干扰,减少假阳性的检出率,简化样品的前处理,降低分析成本,可以满足批量猕猴桃样品中多农药残留检测的要求。
[1]刘旸旸,周波,王司卉,等.响应面法优化超声辅助提取软枣猕猴桃叶多酚工艺[J].粮食与油脂,2021,34(10):100-103.
[2]杨勇,陈露,陈成,等.环剥对红阳猕猴桃果实品质及糖代谢的影响[J].江苏农业科学,2021,49(19):156-163.
[3]崔淼,李云成,孟凡冰,等.猕猴桃果汁乳酸菌发酵工艺优化及品质评价[J].食品科技,2021,46(9):66-72.
[4]赵治兵,谢国芳,曹森,等.基于主成分分析评价不同基地“贵长”猕猴桃品质特性[J].保鲜与加工,2019,19(5):144-148.
[5] ZHANG A D,ZHANG Q Y,LI J Z,et al.Transcriptome co-expression network analysis identifies key genes and regulators of ripening kiwifruit ester biosynthesis[J].BMC Plant Biol,2020,20(10):4129-4134.
[6]BURDON J,MARTIN P,IRELAND H,et al.Transcriptomic analysis reveals differences in fruit maturation between two kiwifruit cultivars[J].Sci Hortic,2021,286(15):137-147.
[7]CHANSI,BHARDWAJ R,RAO R P,et al.Layered construction of nano immuno-hybrid embedded MOF as an electrochemical sensor for rapid quantification of total pesticides load in vegetable extract[J]. J Electroanal Chem,2020,12(21):239-245.
[9] MUSARURWA H,TAVENGWA N T.Extraction and electrochemicalsensing of pesticides in food and environmental samples by use of polydopamine-based materials[J].Chemosphere,2021,266:129222.
[10]刘志荣,张明童,谢楠,等.改进QuEChERS-超高效液相色谱-串联质谱法同时测定甘草中86种农药残留[J].质谱学报,2020,41(6):624-636.
[11]蒋晓勤,袁荷芳,程妍,等.QuEChERS法萃取-气相色谱-三重四级杆串联质谱法快速测定果蔬中58种农药残留[J].分析仪器,2022(1):29-35.
[12]王兴宁,李志,唐亚峰,等.同位素内标-QuEChERS结合UHPLC-QOrbitrap HRMS法快速检测果蔬中84种除草剂残留[J].贵州师范大学学报(自然科学版),2022,40(1):68-79,100.
[13]HAN M,HOU X,QIU S T,et al.Determination of 48 pesticide residues in vegetables by QuEChERS-gas chromatography-tandem mass spectrometry[J].China Test,2020,46(5):65-71,76.
[14]李燕妹.QuEChERS-气相色谱-三重四极杆质谱法测定蜂蜜中15种农药残留[J].食品安全质量检测学报,2020,11(20):7466-7471.
[15]张群,马晨,秦安丽,等.QuEChERS-气相色谱-串联质谱法同时测定豇豆中6种菊酯农药残留[J].中国测试,2021,47(2):63-67.
[16]杨亚静,张相春.QuEChERS-HPLC-MS/MS法检测谷类杂粮制品中4种真菌毒素[J].中国酿造,2020,39(10):172-175.
[17]黄小兰,周祥德,何旭峰,等.QuEChERS结合气相色谱-三重四极杆串联质谱法快速测定地参中63种农药残留[J].中国酿造,2021,40(3):170-176.
[18]韩梅,侯雪,邱世婷,等.QuEChERS-超高效液相色谱-四极杆/静电场轨道阱高分辨质谱测定蔬菜中61种农药残留[J].农药,2020,59(10):743-749.
[19]郑坤明,陈冬花,徐佳,等.QuEChERS-高效液相色谱-串联质谱法测定豇豆中吡蚜酮残留和消解动态[J].农药学学报,2020,22(6):1104-1108.
[20]韩梅,侯雪,邱世婷,等.QuEChERS-气相色谱-串联质谱法测定蔬菜中48种农药残留[J].中国测试,2020,46(5):65-71.76.
[21]田金凤,尚远宏.QuEChERS-UPLC-MS/MS法测定热带和亚热带水果中5种三唑类杀菌剂[J].中国酿造,2021,40(3):177-180.
[22]李洁,梁艺馨,王兴宁,等.全自动QuEChERS样品制备系统-同位素稀释-气相色谱-串联质谱法测定水果蔬菜中的三苯锡残留[J].食品科技,2020,45(9):321-325.
[23]李志,冉茂乾,张馨允,等.QuEChERS-GC-MS/MS法同时测定刺梨中15种有机氯农药残留[J].中国酿造,2020,39(3):166-171.
[24]刘沛明.气相色谱法测定水产品中氯氰菊酯、氰戊菊酯和溴氰菊酯[J].分析仪器,2020(5):23-26.
[25]傅群,曾远,李华勇,等.QuEChERS-气质法测定蔬菜水果中的甲基异柳磷含量[J].食品工业,2020,41(9):318-320.
[26]李常雄,邹海民,胡晓科,等.超高效液相色谱法测定果蔬中4种双酰肼类农药残留[J].中国测试,2020,46(3):59-63.
[27]赵馨.QuEChERS方法在HPLC测定豇豆中灭蝇胺残留量的应用研究[J].福建农业科技,2020(8):7-12.
[28]董榕贵,周红,陈朝欢,等.QuEChERS结合GC-MS/MS法测定果蔬汁中21种农药残留[J].中国酿造,2020,39(2):200-205.