哈密瓜(Cucumis melo L.)在国内外被广泛种植,总产量高达2 700万t[1],其中新疆地区年产85万t[2]。由于哈密瓜成熟期相对集中[3-4]、含酸量低[5]、内生微生物丰富[6]等原因,哈密瓜浪费严重,商品率仅有70%[7]。为减少浪费,提高附加值,将过剩的水果加工成相应的蒸馏酒,是被广泛采用的深加工方式[8-9]。因此,将哈密瓜加工成蒸馏酒具有可行性和重要意义。
水果蒸馏酒的挥发性物质是影响其品质的重要因素[8],受到水果品种[10]、原料产地[11]、生产工艺[7]等因素的影响。基于此,为保持风味的独特性,著名的白兰地干邑(Cognac)对其原料的品种和产地以及蒸馏方式等生产因素做出限制性规定[8,11]。国内外对哈密瓜的研究多集中在热处理异味[3,7]、非热灭菌[12]、保鲜[1,6]、哈密瓜风味形成[13-15]等方向。目前对哈密瓜蒸馏酒的研究有一些报道,LUIS F H等[16]的研究结果表明,清汁发酵和壶式蒸馏酒有更好的感官评价,原苗苗等[17-18]的研究表明,挥发性物质随蒸馏过程在酒头或酒尾集中,不同商用酵母的蒸馏酒挥发性物质不同。但基于工业规模的生产因素影响哈密瓜蒸馏酒挥发性物质的研究鲜见报道。
因哈密瓜品种与种植区域以及加工辅料等生产因素的差异,对哈密瓜蒸馏酒产品一致性的保持提出挑战。本研究拟利用顶空固相微萃取结合气相色谱-质谱联用(headspace solid phase microextraction-gas chromatographymass spectrometer,HS-SPME-GC-MS)技术分析不同生产因素(原料品种、原料产地、酵母、氮源)对哈密瓜蒸馏酒挥发性物质的影响,并对结果进行主成分分析(principal component analysis,PCA)。基于工业生产规模生产因素进行研究,更能反映工业生产的真实情况,以期为保持哈密瓜蒸馏酒产品的一致性提供科学依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与菌株
西州蜜哈密瓜:产地为哈密大南湖、伊吾淖毛湖;银蒂哈密瓜:产地为瓜州南岔镇;金花蜜哈密瓜:产地为伊吾淖毛湖;哈密瓜原料均为成熟的、无霉烂的商品级哈密瓜。酵母(Saccharomyces cerevisiae)K1、KD:法国拉曼集团。
1.1.2 试剂
乙酸乙酯、辛酸乙酯等51种标准品(纯度均>98%)、4-甲基-2-戊醇(色谱纯):阿拉丁试剂(上海)有限公司;正构烷烃混合物(C5~C25):安普(中国)有限公司;无水乙醇、氯化钠(均为分析纯):国药集团(上海)有限公司;有机氮源Fermaid O:法国拉曼集团。
1.2 仪器与设备
DVB/CAR/PDMS萃取头(50/30 μm):美国Supelco公司;7890A-5977B气相色谱质谱(GC-MS)联用仪、DB-WAX色谱柱(60 m×0.32 mm×0.25 μm):美国安捷伦公司;PAL RSI 85自动进样器:瑞士CTC公司;20 t-套型前处理设备:新乡丰润公司;30 t不锈钢发酵罐:泰安鲲鹏公司;2.5 t双釜蒸馏设备:烟台诚达蒸馏设备有限公司。
1.3 方法
1.3.1 哈密瓜蒸馏酒的生产工艺流程及操作要点
哈密瓜挑选→清洗→破碎→去籽→压汁→接种→发酵→蒸馏→成品蒸馏酒
操作要点:
原料前处理:挑选无霉烂,表面没有明显破损的哈密瓜作为原料。挑选后的哈密瓜置入前处理设备进行清洗、破碎、去籽、压汁。
接种与发酵:将获得的哈密瓜汁注入发酵罐,接种酵母(0.2 g/L),室温(17~25 ℃)下发酵,当发酵液没有明显气泡产生且比重降低至0.995后,发酵结束。
蒸馏:将发酵结束的哈密瓜原料酒置入蒸馏釜中进行蒸馏。蒸馏方式参照之前研究,采用双釜串联法[19],截取酒精度>55%vol的酒心,即得哈密瓜蒸馏酒成品。
1.3.2 不同哈密瓜蒸馏酒样的制备
参照哈密瓜蒸馏酒的生产工艺,采用不同原料品种、原料产区、酵母及氮源添加制备哈密瓜蒸馏酒样品(表1),每种处理3个重复。
表1 不同生产因素哈密瓜蒸馏酒样品
Table 1 Hami melon spirits samples with different production factors

1.3.3 挥发性物质的测定
样品前处理:将4 990 μL酒精度稀释至12%vol的样品和2.5 g NaCl置入15 mL的萃取瓶中,加入10 μL内标4-甲基2-戊醇(质量浓度为0.819g/L)。37℃预加热15min,然后将固相微萃取针插入萃取瓶中萃取30 min,解吸时间10 min。
气相色谱条件:DB-WAX色谱柱(60 m×0.32 mm×0.25 μm);初始温度45 ℃,然后以3 ℃/min的速度升至220 ℃,维持3 min;载气为高纯氦气(He),恒定流速1 mL/min;进样器温度250 ℃,不分流进样。
质谱条件:检测器温度220 ℃;电离方式为电子电离(electronic ionization,EI)源,电子能量70 eV;离子源温度230 ℃;质谱采集类型为全扫描模式,扫描范围40~420 m/z。
定性分析:通过与美国国家标准技术研究所(national institute of standards and technology,NIST)11标准谱库(https://www.nist.gov/)进行比较初步判定,再结合保留指数(retention index,RI)对蒸馏酒的挥发性化合物进行定性。
定量分析:有标准品的挥发性物质采用外标法定量;没有标准品的挥发性物质,用内标进行半定量分析。
1.3.4 数据分析
试验结果以“平均值±标准差”表示。用方差分析(analysis of variance,ANOVA)对挥发性物质进行差异性分析,并采用Dunnett多重比较进行差异判断。当P<0.05时,被判定为差异显著。使用主成分分析(PCA)来确定不同样品之间的关系,包括全部样品及检测到的挥发性物质。ANOVA和PCA均使用SPSS 19.0进行分析,用Origin Pro 9.5制图。
2 结果与分析
2.1 哈密瓜蒸馏酒挥发性物质GC-MS分析
不同生产因素哈密瓜蒸馏酒样的挥发性化合物含量见表2。由表2可知,不同生产因素哈密瓜蒸馏酒样共检测出挥发性物质76种,其中酯类23种,占30.26%;醇类12种,占15.79%,萜烯类8种,占10.52%,醛酮类5种,占6.58%,酸类4种,占5.26%,呋喃类4种,占5.26%,含硫化合物3种,占3.95%,其他2种,占2.63%。其中12种化合物在各蒸馏酒中均有检出,包括异丁醇、异戊醇、1-壬醇、顺-3-壬烯-1-醇、2,6-二甲基-4-庚酮、乙酸乙酯、乙酸异戊酯、己酸乙酯、壬酸乙酯、癸酸乙酯、月桂酸乙酯、二甲基二硫。
表2 不同生产因素哈密瓜蒸馏酒样品挥发性化合物含量检测结果
Table 2 Determination results of volatile compounds contents in Hami melon spirits samples with different production factors

续表
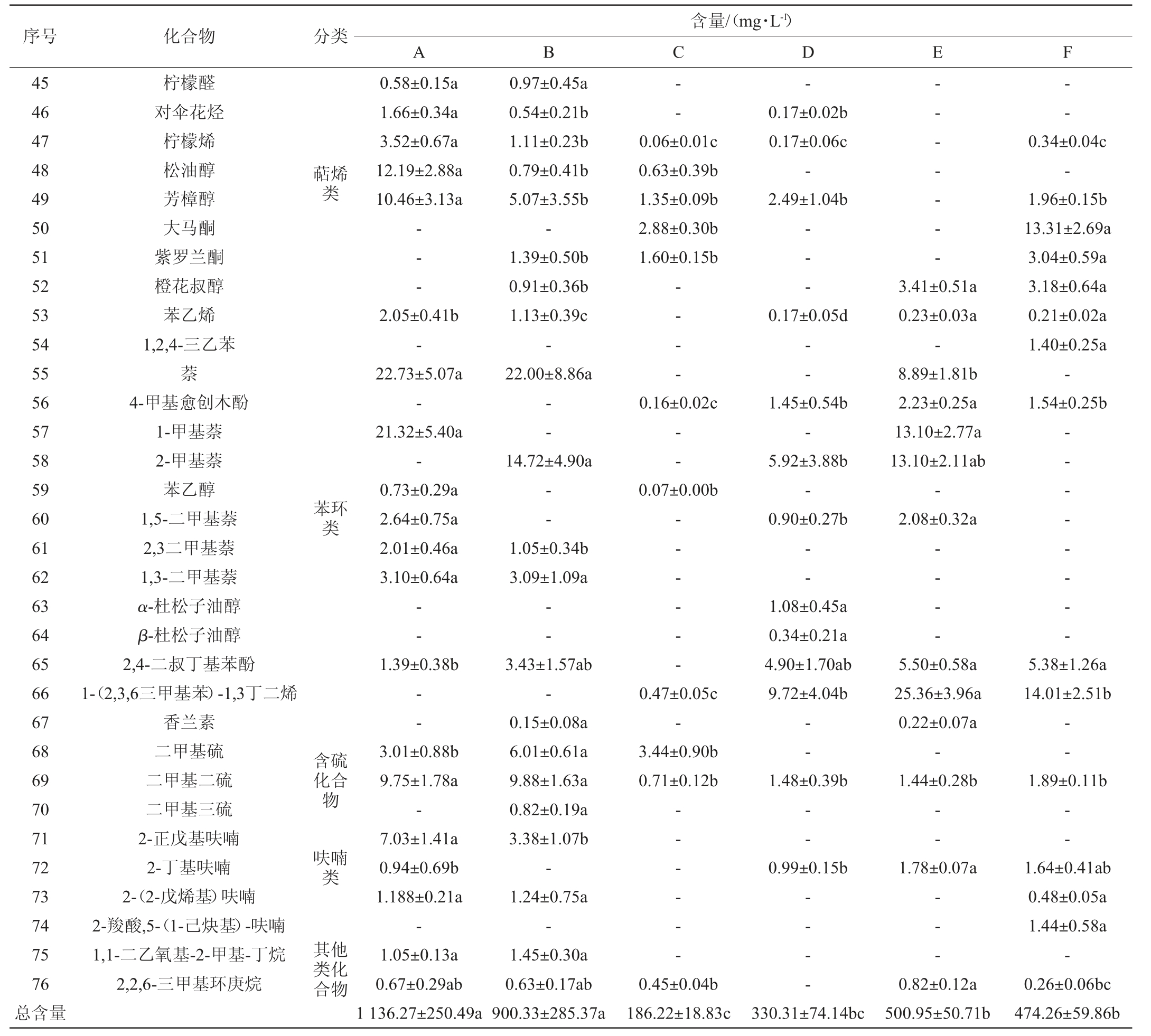
注:同行小写字母相同表示差异不显著(P>0.05);小写字母不同表示差异显著(P<0.05)。“-”表示未检出。
在哈密瓜蒸馏酒中检测到10种风味物质,分别是1-壬烯-3-醇、顺-6-壬烯-1-醇、(3E,6Z)-壬二烯-1-醇、顺-3-壬烯-1-醇、1-壬醇、壬醛、2-壬烯醛、乙酸壬酯、壬酸乙酯、乙酸壬-3-烯酯。这些物质均是具有9个碳原子的醇和其衍生物,有研究结果表明,这10种物质为哈密瓜中的关键香气物质[13-14],与哈密瓜脂肪酸代谢相关[1,13,15],通常被描述为青瓜味、黄瓜味、甜瓜味或生青味[13,20]。这些物质可能也是哈密瓜蒸馏酒的关键风味物质,需要进一步研究。
2.2 不同哈密瓜蒸馏酒挥发性物质比较
不同哈密瓜蒸馏酒样中各类挥发性物质总量比较结果见图1。
2.2.1 醇类
由图1a可知,在不同哈密瓜蒸馏酒样品中,与样品B相比,样品A的醇类物质含量下降,但是差异不显著(P<0.05),因此,有机氮源的添加不会显著影响醇类物质含量。高级醇通常由酒精发酵的次级代谢产物或氨基酸埃里希反应生成。在酒中的含量较少时,高级醇可以增强风味的复杂性,而含量较多时,影响风味的优雅与细腻[8,21]。由于其在蒸馏过程中的回收率高达90%[8],酒中高级醇含量应予以特别关注。由表1可知,不同的生产因素使得样品中高级醇的种类和含量差异较大。其中共有的物质仅有异丁醇、异戊醇、1-壬醇、顺-3-壬烯-1-醇,且这4种物质也是哈密瓜蒸馏酒中含量最高的高级醇。异丁醇与异戊醇,通常对蒸馏酒风味有负面影响[8]。
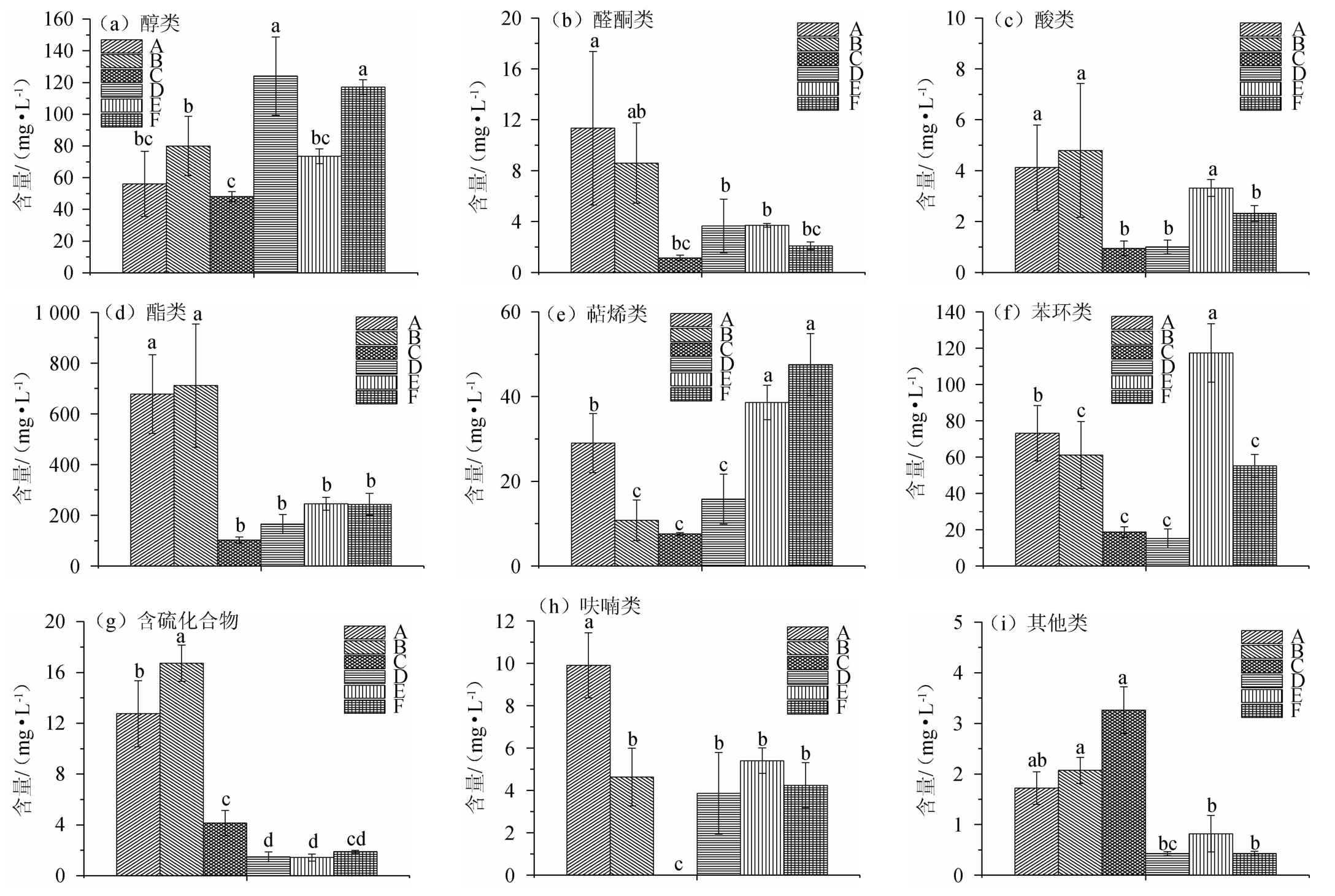
图1 不同生产因素哈密瓜蒸馏酒样中各类挥发性物质总含量的比较
Fig. 1 Comparison of total contents of various types compounds in Hami melon spirits samples with different production factors
不同字母表示差异显著(P<0.05)。
氮源的添加可能影响了氨基酸埃里希反应,使得高级醇总含量下降29.8%,然而并未显著影响异丁醇与异戊醇的含量。推测异丁醇、异戊醇的主要生成途径不是埃里希反应。另外,酵母KD的使用使得异丁醇和异戊醇含量分别提高5倍和7倍。在相同酵母条件下,西州蜜(A、B、C)蒸馏酒中两种杂醇的含量也普遍高于银蒂(D)和金花蜜(E)。特别的是,哈密瓜关键风味物质1-壬醇、顺-3-壬烯-1-醇的含量[13],受到品种的影响,其在银蒂(D)蒸馏酒中含量普遍高于西州蜜(A、B、C)和金花蜜(E、F)蒸馏酒。由图1可知,产区差异并未影响A、C蒸馏酒中总高级醇含量,而酵母差异影响显著,F蒸馏酒中的总高级醇含量显著高于E蒸馏酒(P<0.05)。
2.2.2 醛酮类
由1b可知,样品A与样品B相比,醛酮类物质含量有差异,但不显著(P>0.05),而样品A醛酮类物质含量(11.34 mg/L)显著高于样品C(1.15 mg/L),可见氮源和产地可以影响醛酮类物质含量。样品C与样品E相比以及样品E与样品F相比醛酮类物质含量没有显著差异(P>0.05),因此品种和酵母对醛酮总量的影响不显著。
由表1可知,不同哈密瓜蒸馏酒醛酮类的含量和种类差异较大,仅有2,6-二甲基-4-庚酮为全部蒸馏酒共有。2,6-二甲基-4-庚酮通常被描述为有薄荷和新鲜青叶气味[22],含量不受到品种和酵母的影响,而不同产区的西州蜜蒸馏酒(A、C)中2,6-二甲基-4-庚酮差异显著(P<0.05)。另外,壬醛、2-壬烯醛被描述为纸壳或青草味[21],壬醛在西州蜜(B)蒸馏酒中含量最高(4.38 mg/L),2-壬烯醛也仅在样品B中被检出,表明不添加氮源有助于两种醛的生成。具有牛奶和蘑菇气味的3-辛酮,受哈密瓜品种和产区的影响,仅在哈密大南湖的西州蜜蒸馏酒(A、B)中检测到。
2.2.3 酸类
由图1c可知,金花蜜蒸馏酒(F)产酸量(2.32 mg/L)相较于金花蜜蒸馏酒(E)(3.32 mg/L)显著降低(P<0.05),酵母对酒中的挥发酸总量产生了显著影响,这与前人研究相一致[23]。因此,酵母KD导致其含量较低。挥发性酸类物质通常具有刺激性的异味,与酵母代谢以及细菌的活动有关。样品C与样品E的挥发酸总量差异显著(P<0.05),样品A与样品C的挥发酸总量差异显著(P<0.05),因此,品种和产区对挥发酸总量也产生了一定的影响,可能由于不同产区或品种的哈密瓜本身的细菌含量差异导致的[6]。
2.2.4 酯类
由图1d可知,大南湖西州蜜蒸馏酒(A、B)酯类总量显著高于淖毛湖西州蜜蒸馏酒(C)(P<0.05)。除大南湖西州蜜以外,其他产区和品种的哈密瓜蒸馏酒(C、D、E、F)酯类总量差异不显著(P>0.05)。由表1可知,酯类是哈密瓜蒸馏酒中含量最高的挥发性物质,乙酸乙酯、己酸乙酯、壬酸乙酯、癸酸乙酯、月桂酸乙酯、乙酸异戊酯6种常见风味物质在全部酒样中均被检出。样品A的酯类物质总量(678.09 mg/L)显著高于样品C(102.19 mg/L)(P<0.05),受产区的影响,而品种、酵母和氮源对酯类总量没有影响。
其中含量较高的乙酸乙酯是清香型白酒的主要风味物质[24],然而在水果蒸馏酒中或葡萄酒中有溶剂的气味,呈现负面影响[8]。样品A的乙酸乙酯含量(78.54 mg/L)低于样品B(142.04 mg/L),氮源的添加显著降低了乙酸乙酯含量(P<0.05)。此外,氮源的添加显著增加了壬酸乙酯的含量(P<0.05),且增加具有果香的乙酸壬酯含量,或对蒸馏酒风味有积极影响[23]。另外,乙酸壬-3-烯酯只在哈密大南湖蒸馏酒(A、B)有检出。
2.2.5 萜烯类
萜烯类物质通常以前体物质存在,糖苷键经酸水解或酶水解成为游离状态而呈现风味活性。萜烯类物质的阈值较低,在水果和酒精饮料中起到重要作用[8,10]。由图1e可知,金花蜜蒸馏酒(E、F)萜烯类物质含量高于其他样品。比较蒸馏酒A和蒸馏酒C,以及蒸馏酒A和蒸馏酒B可知,哈密大南湖产区以及氮源的添加均有助于萜烯类物质的产生。
其他各生产因素对萜烯含量也有影响,由表1可知,具有甜橙香和柠檬气味的柠檬醛[25],仅在哈密大南湖的西州蜜蒸馏酒(A、B)中有检出。松油醇只在西州蜜蒸馏酒(A、B、C)中被检出。大马酮、橙花叔醇、紫罗兰酮、芳樟醇等常见萜烯类物质在不同样品中含量不同,但是未表现受生产因素影响的规律。
2.2.6 苯环类
检测出的苯环类物质以甲基苯和萘类物质为主,也有少量酚类物质,通常呈现烟熏味、中药味[24]。苯环类物质的种类及含量都受到了生产因素的影响。由图1f可知,样品F较样品E降低了苯环类物质的总含量,样品A较样品C提高了苯环类物质总含量,氮源的添加可以提高苯环类物质的总含量。
由表1可知,苯乙醇仅在样品A和C中检出,呈现玫瑰香和甜香,通常对酒的风味有积极的影响[25]。1-(2,3,6三甲基苯)-1,3丁二烯存在于葡萄和葡萄叶中,具有强烈的生青味,被确定为葡萄酒重要的异味物质[26],在哈密瓜及相关加工产品中首次检出。除了哈密大南湖产地蒸馏酒(A、B)没有检出外,其余酒样均有检出,值得特别关注。4-甲基愈创木酚也叫焦油酚,具有烟熏味和丁香味[24],在淖毛湖西州蜜、银蒂和金花蜜蒸馏酒(C、D、E、F)中均有检出,但是大南湖西州蜜蒸馏酒(A、B)中没有检出。而α-杜松子油醇和β-杜松子油醇的含量受到品种的影响,仅在银蒂蒸馏酒(D)中检出。
2.2.7 含硫化合物
不同哈密瓜蒸馏酒中共检测出3种含硫化合物,均呈现烂白菜气味,是加热后的哈密瓜汁异味的重要来源[3,27]。其中二甲基硫,由蛋氨酸亲核取代反应生成,而二甲基二硫、二甲基三硫的生成由蛋氨酸产生的甲硫醇经氧化和降解生成,有研究表明,其在果皮较厚的瓜中含量较高[3,27]。由图1g可知,样品A、B的总硫含量高于其他样品(P<0.05),其原因可能是,西州蜜的果皮比银蒂与金花蜜更厚,这与前人研究结果相同[3,27]。
2.2.8 呋喃类
呋喃类化合物通常具有温和的木头或化学试剂味[25]。由图1h可知,除在样品C中未检测到外,在其他酒样中都有检出。酒样A中含量最高(9.91 mg/L),显著高于其他样品(P<0.05)。样品B、D、E、F中呋喃类物质的总含量差异不显著(P>0.05)。
2.2.9 其他类物质
其他类物质主要由烯烃类和杂环类物质组成,均未见有关风味方面报道。由图1i可知,也未表现出受生产因素影响的规律。
2.3 哈密瓜蒸馏酒样的挥发性风味成分主成分分析
对全部样品中检出挥发性物质进行PCA,结果见图2。
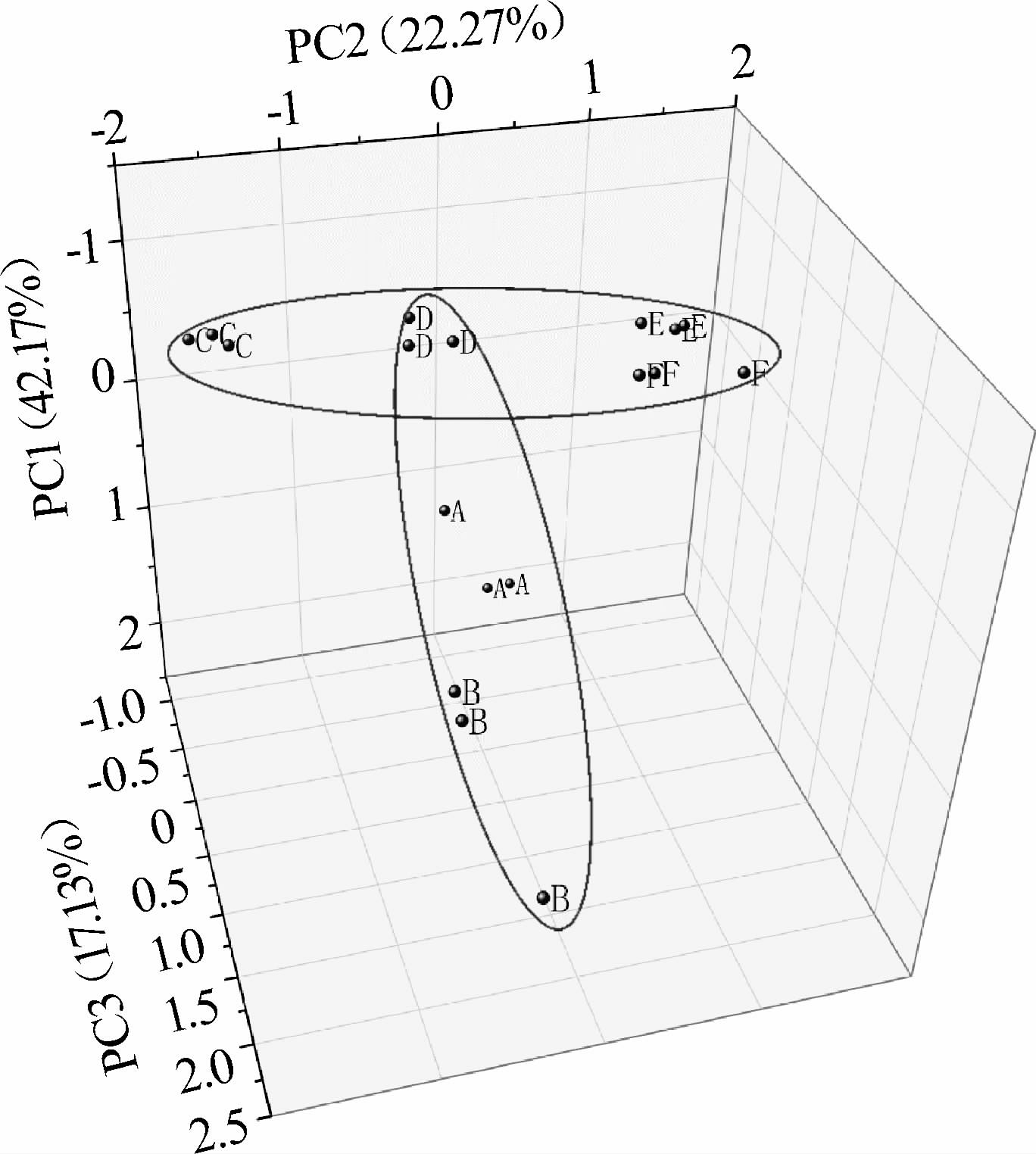
图2 不同生产因素哈密瓜蒸馏酒样品挥发性物质主成分分析结果
Fig. 2 Principal component analysis results of the volatiles in Hami melon spirits samples with different production factors
由图2可知,前3个主成分的总方差贡献率达81.57%,其中PC1方差贡献率42.17%,PC2方差贡献率22.27%,PC3方差贡献率17.13%。相同生产因素的蒸馏酒被聚集在一起,证明实验重复性较好。另外,酒样A、B、D在PC1上进行了聚集,酒样C、D、E、F在PC2上进行了聚集,证明产区对哈密瓜蒸馏酒影响最大,在这两个主要成分上首先被区分。在地区差异性上,哈密大南湖与伊吾淖毛湖差异较大,瓜州南岔镇产地介于两者之间。相同产地下,品种、酵母的种类及氮源的添加对酒样成分的影响也有显著差异(P<0.05)。在品种的差异上,西州蜜与金花蜜之间差异较大,银蒂介于两者之间。
3 结论
本研究从工业生产规模水平上探究了哈密瓜品种、产区、酵母品种以及外加氮源4个生产因素对哈密瓜蒸馏酒的挥发性物质的影响。结果表明,共检出76种挥发性物质,包括酯类23种、醇类12种、萜烯类8种、醛酮类5种、酸类4种、苯环类15种、呋喃类4种、含硫化合物3种、其他类化合物2种。各生产因素对挥发性物质的种类及含量均有显著影响(P<0.05)。其中产区影响最为显著(P<0.05),品种、酵母、氮源也对挥发性物质有一定影响。为保持蒸馏酒产品的一致性,应注重不同产区、品种及不同生产辅料的蒸馏酒的相互勾兑工作。另外,生产因素对蒸馏酒最终品质的影响,还应结合挥发性物质阈值和酒样的感官评价做进一步分析研究。
[1]NAGASHIMA Y,HE K,SINGH J,et al.Transition of aromatic volatile and transcriptome profiles during melon fruit ripening[J].Plant Sci,2021,304:1-12.
[2]廖新福,刘曼双.新疆哈密瓜产业现状及发展对策[J].新疆农业科技,2011,2011(3):1-2.
[3]LUO D S,XU X X,BI S,et al.Study of the inhibitors of cooked off-flavor components in heat-treated XiZhou melon juice[J]. J Agr Food Chem,2019,2019(67):10401-10411.
[4]CARLOS M,LARA P,ABDELALI E,et al.Genetic dissection of aroma biosynthesis in melon and its relationship with climacteric ripening[J].Food Chem,2021,2021(353):129484.
[5]PREETI,RAJU P N.Comprehensive overview of Cucumis melo[J]. J Pharm Innov,2017,6(10):181-186.
[6] PREEDY V.Processing and impact on active components in food[M].UK:Elsevier,2015:165-171.
[7]YU W S,ZHANG Y Z,LIN Y N,et al.Differential sensitivity to thermal processing of two muskmelon cultivars with contrasting differences in aroma profile[J].LWT-Food Sci Technol,2021,138(2021):110769.
[8]ARGYRIOS T,STAMATINA K,YIANIS K,et al.Grape brandy production,composition and sensory evaluation[J].J Sci Food Agr,2013,94(3):404-414.
[9]ENRIQUE D G,REMEDIOS C,MARIA D C R D,et al.Aroma of sherry products:A review[J].Foods,2021,10(4):1-33.
[10]SASA M,JELENA P D,RENATA R,et al.Volatile aroma compounds of Brandy Lozova produced from Muscat Table Grapevine cultivars[J].Molecules,2019,24(13):1-15.
[11]FANNIE T,ANA P,LOUSE U,et al.Sensorial impact and distribution of 3-methyl-2,4-nonanedione in Cognacs and spirits[J].J Agr Food Chem,2021,69(15):4509-4517.
[12]PEI L Y,LI J,XU Z L,et al.Effect of high hydrostatic pressure on aroma components,amino acids,and fatty acids of Hami melon (Cucumis melo L.var.reticulatus naud.)juice[J].Food Sci Nutr,2019,2020(8):1394-1405.
[13] XIAO Z B,XIE Y H,NIU Y W,et al.Identification of key aromas of Chinese muskmelon and study of their formation mechanisms[J]. Eur Food Res Technol,2021,247(4):777-795.
[14] SHI J D,WU H B,XIONG M,et al.Comparative analysis of volatile compounds in thirty nine melon cultivars by headspace solid-phase microextraction and gas chromatography-mass spectrometry[J].Food Chem,2020,2020(316):126324.
[15]MOSHE S,NURIT K,YAAKOV T,et al.Acetyl-CoA:Alcohol acetyltransferase activity and aroma formation in ripening melon fruits[J]. J Agr Food Chem,2001,2001(49):794-799.
[16]LUIS F H,JUAN U,ANA B.Melon fruit distillates:comparison of different distillation methods[J]. Food Chem,2003.82(4):513-519.
[17]原苗苗,张将,孙玉霞,等.哈密瓜白兰地原酒蒸馏过程中挥发性香气成分的变化[J].食品工业,2018,39(3):122-125.
[18]原苗苗,张将,孙玉霞,等.4种商业酵母对哈密瓜白兰地挥发性香气成分的影响[J].食品工业,2017,38(5):309-314.
[19]ZHANG J,ZHANG X,QIN W S,et al.Differences between retort distillation and double distillation in cherry spirits with double-kettle equipment[J].Int J Food Eng,2021,17(7):541-549.
[20] PANG X L,CHEN D,HU X S,et al.Verification of aroma profiles of Jiashi muskmelon juice characterized by odor activity value and gas chromatography-olfactometry/detection frequency analysis:aroma reconstitution experiments and omission tests[J].J Agr Food Chem,2012,60(42):10426-10432.
[21]BAKKER J,CLARKE R J.Wine flavour chemistry[M].England:Wiley-Blackwell publishing Ltd.,2004:142-148.
[22]XIANG X F,CHEN D,GAO X T et al.Characterization of odor-active compounds in the head,heart,and tail fractions of freshly distilled spirit from Spine grape(Vitis davidii Foex)wine by gas chromatography-olfactometry and gas chromatography-mass spectrometry[J]. Food Res Int,2020,137:109388.
[23]JAN H S,ISAK S P.Yeast modulation of wine flavor[J].Adv Appl Microbio,2005,57:131-164.
[24] LIU H L,SUN B G.Effect of fermentation processing on the flavor of Baijiu[J].J Agr Food Chem,2018,66(22):5425-5432.
[25]DUNKEL A,STEINHAUS M,KOTTHOFF M,et al.Nature's chemical signatures in human olfaction:a foodborne perspective for future biotechnology[J].Angew Chem Int Ed Engl,2014,53(28):7124-43.
[26]AGNIESZKA J,DIMITRA L C,CAROLYN J P,et al.(E)-1-(2,3,6-trimethylphenyl)buta-1,3-diene:A potent grape-derived odorant in wine[J].J Agr Food Chem,2003,51(26):7759-7763.
[27]LUO D S,PANG X L,XU X X,et al.Identification of cooked off-flavor components and analysis of their formation mechanisms in melon juice during thermal processing[J].J Agr Food Chem,2018,2018(65):5612-5620.