藏东南地区位于青藏高原东南部,其特殊的地理位置和气候环境,适合果树种植,素有“西藏江南”和“水果之乡”之称[1]。苹果(Malus pumila)属蔷薇科(Rosaceae)苹果属(Malus),多年生落叶乔木植物,其性凉味甘,酸甜可口且营养丰富,具有很高的营养价值和保健功效。水果表皮含丰富的微生物资源,其表皮微生物群落结构组成对酿造果酒和果醋的品质具有一定的影响[2]。由于地理环境和水果基质的差异,分离适合酿造果酒和果醋的本土酵母菌成为人们研究的热点[3-5]。根际土壤微生物作为果园生态系统的重要组成部分,对植物生长起着至关重要的作用,其微生物组成及代谢在植物根际养分循环和能量代谢中发挥着重要作用,因此,根际土壤微生物群落结构组成是衡量土壤质量的重要指标[6-8]。综上所述,研究水果表皮及根际土壤微生物群落结构组成对开发利用本土益生微生物资源和改善果树根际微生态具有重要意义。
水果表皮及根际土壤微生物与其生长环境和土壤质地息息相关。中国作为世界上苹果生产和消费大国,苹果种植区域广泛,气候类型和土壤质地多样,致使其微生物资源丰富多样。目前,有关苹果的研究主要集中在苹果酒和苹果醋加工工艺、营养价值及苹果连作土壤微生物等方面[9-12],而有关藏东南产区苹果表皮及根际土壤微生物群落结构组成的研究尚未见报道。
目前用于微生物多样性分析的方法主要包括传统纯培养法和非培养法。由于纯培养法无法分离非可培养微生物的缺点,非培养法得到广泛的应用。高通量测序技术作为非培养的一种,由于其准确性、高通量大、能够反映其真实环境微生物群落结构组成的优点,因此被广泛用于环境微生物检测[13-15]。本实验以西藏林芝苹果表皮及其根际土壤微生物为材料,基于高通量测序技术对苹果表皮及根际土壤微生物群落结构组成进行分析,并对两个样品中的优势细菌属和优势真菌属进行了关联性分析,以期为本土苹果表皮微生物资源的开发和利用提供参考。
1 材料与方法
1.1 材料与试剂
选用藏东南产区苹果(N:29°40′07.39″,E:94°20′21.23″;海拔:2 991 m)为实验材料,采用“五点采样法”,手带无菌手套,使用经体积分数75%的酒精消毒后的剪刀采集5棵果树的新鲜无病害的苹果果实(采集时间为2019年10月),置于无菌采样袋中混合后,放入低温采样箱并带回实验室,-20 ℃保存备用。
随机选取5棵健康苹果树,利用“抖根法”采集根际土壤样品,并置于无菌采样袋中,放入低温采样箱并带回实验室,-20 ℃保存备用。
每组设3个重复,分别记为苹果表皮样品(A)和根际土壤样品(AS)。
TransStart FastPfu脱氧核糖核酸(deoxyribonucleic acid,DNA)聚合酶(2.5 U/μL):北京全式金生物技术股份有限公司;琼脂糖(分析纯):美国Invitrogen公司;其他试剂均为国产分析纯。
1.2 仪器与设备
NanoDrop2000微量分光光度计:美国Thermo公司;DYCP-32C型琼脂糖水平电泳仪:北京六一仪器厂;Eppendorf 5424R 高速冷冻离心机:德国Eppendorf公司;Bio-Rad T100聚合酶链式反应(polymerase chain reaction,PCR)仪、凝胶回收试剂盒:美国Bio-Rad公司;Illumina Misq测序平台:美国Illumina公司;植物基因组DNA提取试剂盒、TIANamp Soil DNA Kit 107试剂盒:北京天根生化科技有限公司。
1.3 方法
1.3.1 提取基因组DNA及PCR扩增
使用植物基因组DNA提取试剂盒和TIANamp Soil DNA Kit 107试剂盒提取苹果表皮样品[16]和根际土壤样品[17]总DNA,用分光光度法和琼脂糖凝胶电泳检测所提基因组DNA的浓度和质量。细菌PCR扩增16S rDNA的V3-V4区,引物为341F:5′-CCTAYGGGRBGCASCAG-3′与806R:5′-GGACTACNNGGGTATCTAAT-3′。真菌PCR扩增内转录间隔区(internal transcribed spacer,ITS)区域,引物为ITS3F:5′-GATGAAGAACGYAGYRAA-3′和ITS4R:5′-TCCTCCGCYYATTGATATGC-3′,PCR产物经琼脂糖凝胶电泳检测纯化后,送至上海美吉生物科技有限公司测序。
1.3.2 数据分析及处理
经过滤排除干扰数据后获得的高质量数据拼接成Tags序列,对齐和去除引物,按照97%的一致性聚类成为操作分类单元(operational taxonomic units,OTUs),将OTUs与美国国家生物技术信息中心(national center for biotechnology information,NCBI)数据库比对并对OTU进行物种注释[18],为了得到每个OTU对应的物种分类信息,采用RDP classifier贝叶斯算法对97%相似水平的OTU代表序列进行分类学分析,并分别在各分类学水平:Domain(域)、kingdom(界)、Phylum(门)、Class(纲)、Order(目)、Family(科)、Genus(属)统计各样本的群落结构组成。利用QIIME软件进行Alpha多样性分析,计算Simpson指数、Shannon指数、Ace指数、Chao 1指数和覆盖度等[19]。R3.0软件进行其他数据分析[20-21]。
使用群落柱状图表示样品中优势细菌门、真菌门、细菌属和真菌属的群落构成及样品中的平均相对含量,使用genescloud平台(https://www.genescloud.cn)绘制关联热图,采用热图对优势真菌属和细菌属间相关性进行可视化处理。
2 结果与分析
2.1 苹果表皮微生物及根际土壤微生物序列及多样性分析
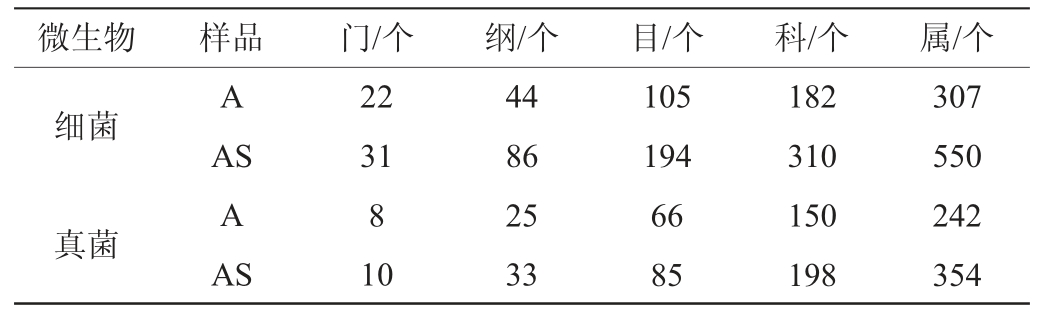
苹果表皮和根际土壤样品分别获得细菌有效序列41345条和30 487条,真菌有效序列72 751条和70 483条(见表1)。经质控过滤和去除嵌合体,有效序列在97%的相似度水平进行聚类,并进行Alpha多样性分析,结果见表1。由表1可知,苹果表皮和根际土壤样品分别获得554个、1 717个细菌OTUs和612个、1 371个真菌OTUs。各样品文库的覆盖度均在99%以上,说明高通量测序数据能基本反映各样品的真实信息。根际土壤样品Shannon、Ace和Chao 1指数均高于苹果果实表皮样品,且Simpson指数均低于苹果果实表皮样品,表明根际土壤样品中微生物多样性和丰富度均高于苹果果实表皮样品,此结果与表2一致。细菌群落的Shannon、Ace和Chao 1指数高于真菌群落,且Simpson指数低于真菌群落,表明相同样品中细菌群落多样性和丰富度均高于真菌群落,此结果与表2一致。
表1 苹果果实表皮及根际土壤样品微生物群落多样性分析
Table 1 Diversity analysis of microbial community in apple fruit epidermis and rhizoshpere soil samples
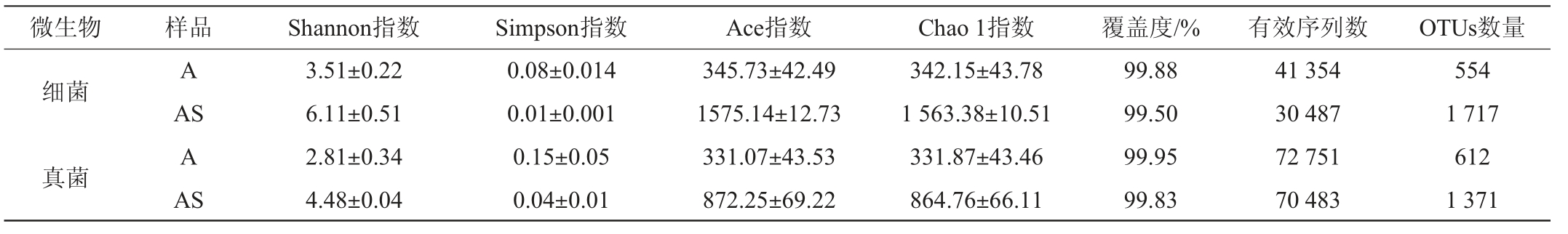
表2 样品不同分类单元数量统计
Table 2 Quantity statistics of different taxon of samples
2.2 苹果表皮微生物及根际土壤微生物群落结构组成
苹果表皮及根际土壤细菌群落组成在门分类水平结果见图1A。由图1A可知,苹果表皮样品中共鉴定出4个门(相对丰度≥1.00%),依次为放线菌门(Actinobacteriota)(34.57%)、变形菌门(Proteobacteria)(28.07%)、厚壁菌门(Firmicutes)(23.65%)、拟杆菌门(Bacteroidota)(11.63%)。根际土壤样品中共鉴定出10个门(相对丰度≥1.00%),依次为放线菌门(Actinobacteriota)(38.63%)、变形菌门(Proteobac teria)(23.64%)、酸杆菌门(Acidobacteriota)(10.16%)、绿弯菌门(Chloroflexi)(7.81%)、厚壁菌门(Firmicutes)(4.06%)、拟杆菌门(Bacteroidota)(3.94%)、蓝藻门(Cyanobacteria)(3.40%)、Gemmatimonadota(2.55%)、粘球菌门(Myxococcota)(2.31%)和Patescibacteria(1.23%)。
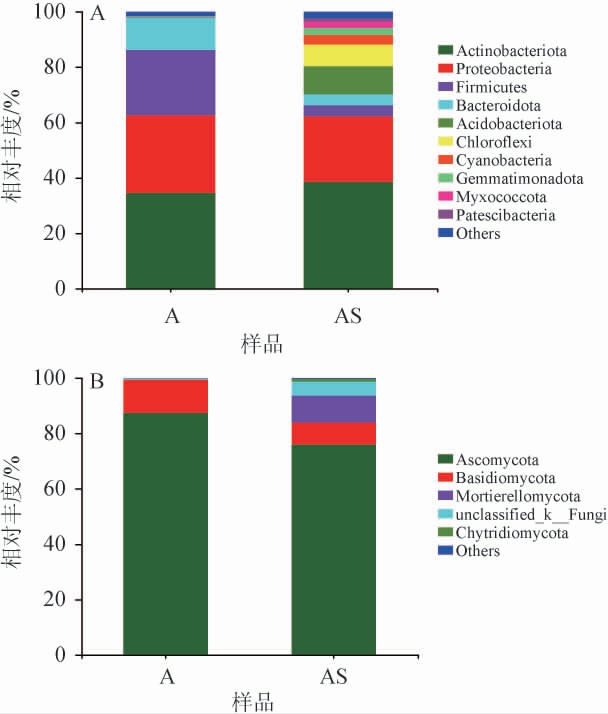
图1 苹果表皮及根际土壤微生物在门分类水平上的细菌(A)和真菌(B)群落组成
Fig. 1 Bacterial (A) and fungal (B) community composition of apple pericarp and rhizosphere soil microorganisms at phylum levels
others表示相对丰度<1%的菌门。
苹果表皮及根际土壤真菌群落组成在门分类水平结果见图1B。由图1B可知,苹果表皮样品中共鉴定出2个门(相对丰度≥1.00%),分别为子囊菌门(Ascomycota)(87.40%)、担子菌门(Basidiomycota)(12.05%)。根际土壤样品中共鉴定出5个门类(相对丰度≥1.00%),其中能够准确分类的门有4个,分别为子囊菌门(Ascomycota)(75.98%)、被孢霉门(Mortierellomycota)(9.66%)、担子菌门(Basidiomycota)(8.01%)和壶菌门(Chytridiomycota)(1.01%)。
在属分类水平上细菌群落组成见图2A。由图2A可知,在相对丰度≥2.00%条件下,苹果表皮共有14个属,其优势属为节杆菌属(Arthrobacter),其相对丰度为13.06%,其次是金黄杆菌属(Chryseobacterium)(10.39%)、芽孢杆菌属(Bacillus)(6.55%)、马赛菌属(Massilia)(6.35%)、葡萄球菌属(Staphylococcus)(5.67%)、微小杆菌属(Exiguobacterium)(5.60%)、寒冷杆菌属(Frigoribacterium)(5.42%)、甲基杆菌属(Methylobacterium-Methylorubrum)(5.29%)、假单胞菌属(Pseudomonas)(3.42%)、假节菌属(Pseudarthrobacter)(3.41%)、短小杆菌属(Curtobacterium)(2.92%)、鞘氨醇单胞菌属(Sphingomonas)(2.79%)、泛菌属(Pantoea)(2.70%)和Erwiniaceae_unclassified(2.22%)。如图2A所示,在相对丰度≥2.00%条件下,根际土壤样品共有7个属,分别为节杆菌属(Arthrobacter)(5.53%)、Vicinamibacterales_norank(2.42%)、分支杆菌属(Mycobacterium)(2.33%)、慢生根瘤菌属(Bradyrhizobium)(2.28%)、小单孢菌属(Micromonospora)(2.26%)、类诺卡氏菌属(Nocardioides)(2.19%)和Vicinamibacteraceae_norank(2.01%),其中节杆菌属为优势属。复垦土壤中节杆菌属和鞘氨醇单胞菌属是优势菌属[22],这与本研究结果一致。慢生根瘤菌属具有固氮和促进植物生长的作用[23]。假单孢菌属普遍分布于植物中,对植物生长、生物防治和养分利用等方面具有有益作用[24-27]。综上所述,苹果表皮及根际土壤富含与植物生长和病害防治相关的微生物。
在属分类水平上真菌群落组成见图2B。由图2B可知,在相对丰度≥2.00%条件下,苹果表皮真菌共有10个属,分别为外囊菌属(Taphrina)(41.07%)、枝孢霉属(Cladosporium)(8.70%)、锥梗孢属(Dissoconium)(8.57%)、附球霉属(Epicoccum)(6.33%)、线黑粉酵母属(Filobasidium)(6.11%)、维希尼克氏酵母菌属(Vishniacozyma)(3.69%)、球腔菌属(Mycosphaerella)(3.75%)、蒜孢属(Rachicladosporium)(3.03%)、Didymellaceae_unclassified(2.81%)和Ascomycota_unclassified(2.33%),其中外囊菌属是优势属。如图2B所示,在相对丰度≥2.00%条件下,根际土壤样品中真菌共有15个属,分别为被孢霉属(Mortierella)(7.62%)、附球霉属(Epicoccum)(5.76%)、Onygenales_unclassified(5.59%)、赤霉菌属(Gibberella)(5.54%)、Fungi_unclassified(5.11%)、Didymellaceae_unclassified(4.35%)、Helotiales_un-classified(3.90%)、Ascomycota_unclassified(3.88%)、外瓶柄霉属(Exophiala)(3.41%)、Pleosporales_unclassified(2.98%)、Didymosphaeriacesa_unclassified(2.87%)、Sordariomycetes_unclassified(2.60%)、光黑壳属(Preussia)(2.33%)、土赤壳属(llyonectria)(2.29%)和枝孢霉属(Cladosporium)(2.00%),其中被孢霉属是根际土壤样品的优势真菌属。枝状枝孢菌(Cladosporium cladosporioides)、链格孢菌(Alternaria spp.)、镰孢菌(Fusarium spp.)和青霉菌(Penicillium spp.)是苹果果皮和果心中分离频率较高的真菌[28],这与本研究结果一致,同时有研究表明,枝孢霉属(Cladosporium)在植物中扮演着重要角色[29-30]。结合前人研究[31-32],推测被孢霉属(Mortierella)是苹果根际土壤中重要的益生菌属。
2.3 优势菌属的关联性分析
2.3.1 苹果表皮和根际土壤样品中优势细菌属的关联分析
对苹果表皮和根际土壤样品中相对丰度≥2.00%的细菌属进行关联性分析(不包括未注释到明确分类地位的细菌属),结果见图3。由图3可知,苹果表皮中的寒冷杆菌属(Frigoribacterium)和鞘氨醇单胞菌属(Sphingomonas)与根际土壤样品中的慢生根瘤菌属(Bradyrhizobium)和小单孢菌属(Micromonospora)呈显著性正相关(P<0.05),而与节杆菌属(Arthrobacter)、分支杆菌属(Mycobacterium)和类诺卡氏菌属(Nocardioides)呈显著性负相关(P<0.05)。与此相反,苹果表皮中的假单胞菌属(Pseudomonas)与根际土壤样品中的节杆菌属(Arthrobacter)、分支杆菌属(Mycobacterium)和类诺卡氏菌属(Nocardioides)呈显著性正相关(P<0.05),而与根际土壤样品中的慢生根瘤菌属(Bradyrhizobium)和小单孢菌属(Micromonospora)呈显著性负相关(P<0.05)。由此可见,根际土壤优势细菌属与苹果表皮优势细菌属的相对丰度相互影响。

图3 苹果表皮和根际土壤样品中优势细菌属的关联分析
Fig. 3 Correlation analysis of dominant bacterial genera in apple pericarp and rhizosphere soil samples
红色代表正相关,蓝色代表负相关,如果两者相关性为正相关,则显示为红色,反之,则为蓝色;颜色深浅表示相关性强弱;*号标识具有显著关联性(P<0.05)。下同。
2.3.2 苹果表皮和根际土壤样品中优势真菌属的关联分析
在相对丰度≥2.00%条件下,对苹果表皮和根际土壤样品中的真菌属进行关联性分析(不包括未注释到明确分类地位的真菌属),结果见图4。由图4可知,苹果表皮中的线黑粉酵母属(Filobasidium)和维希尼克氏酵母菌属(Vishniacozyma)分别与根际土壤样品中的赤霉菌属(Gib-berella)和枝孢霉属(Cladosporium)呈显著性正相关(P<0.05),而上述两个酵母属与根际土壤中其他优势均属呈正向或负向相关,但无差异显著性(P>0.05)。苹果表皮样品中的锥梗孢属(Dissoconium)与根际土壤样品中的被孢霉属(Mortierella)和土赤壳属(llyonectria)呈显著性正相关(P<0.05),而与根际土壤样品中的附球霉属(Epicoccum)呈显著性负相关(P<0.05)。根际土壤样品中的枝孢霉属(Cladosporium)与苹果表皮样品中的外囊菌属(Taphrina)呈显著性正相关(P<0.05),而与苹果表皮样品中的附球霉属(Epicoccum)、枝孢霉属(Cladosporium)、球腔菌属(Mycosphaerella)、蒜孢属(Rachicladosporium)均呈显著性负相关(P<0.05)。由此可见苹果表皮真菌的分布及丰度与土壤真菌息息相关,相互影响,具体的互作机理有待进一步研究。
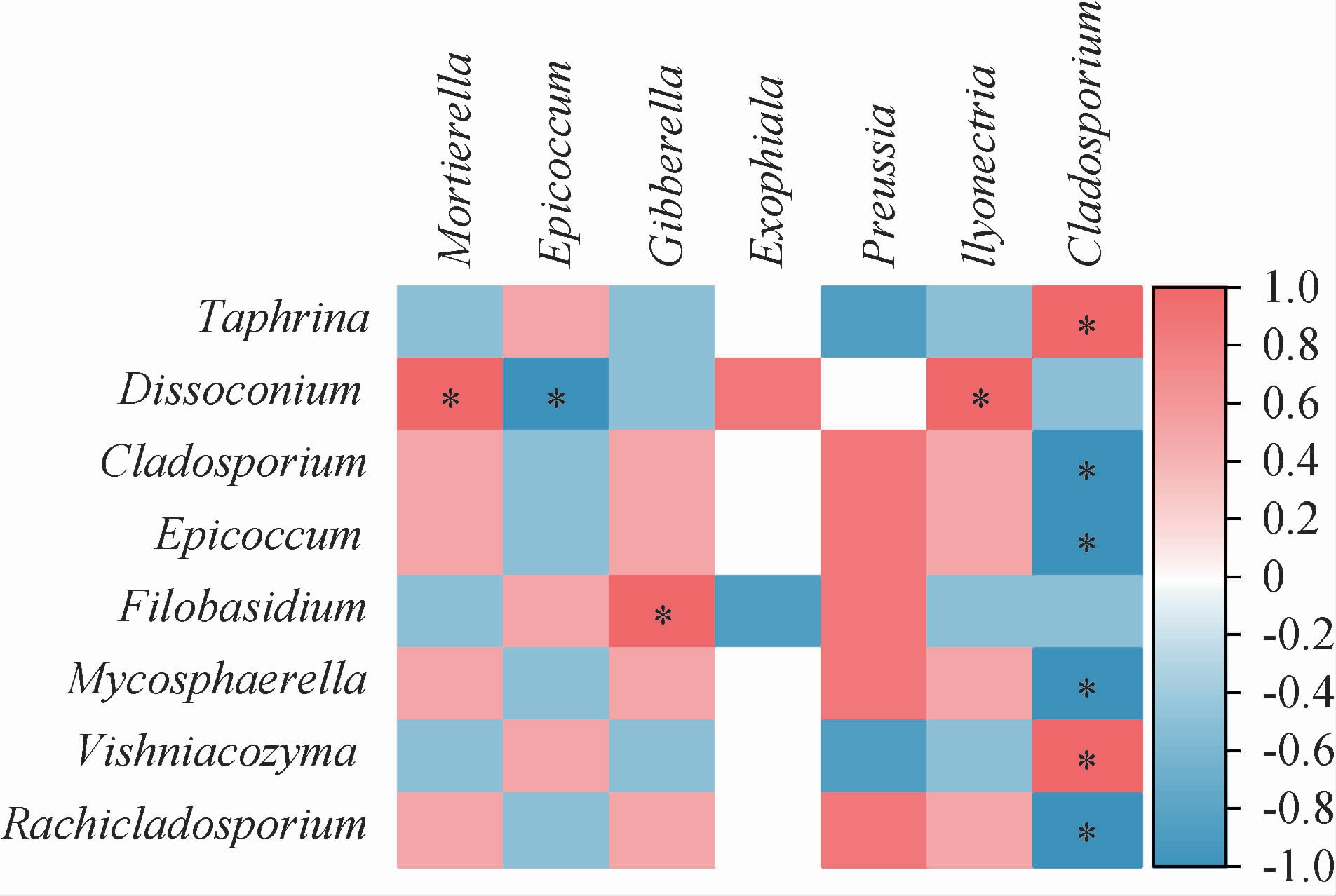
图4 苹果表皮和根际土壤样品中优势真菌属的关联分析
Fig. 4 Correlation analysis of dominant fungi genera in apple pericarp and rhizosphere soil samples
2.3.3 苹果表皮真菌与细菌间的关联性分析
在相对丰度≥2.00%条件下,对苹果表皮样品中的真菌属和细菌属进行关联性分析(不包括未注释到明确分类地位的真菌属和细菌属),结果见图5。由图5可知,苹果表皮真菌属中的枝孢霉属(Cladosporium)、附球霉属(Epicoccum)、球腔菌属(Mycosphaerella)、蒜孢属(Rachicladosporium)与苹果表皮细菌属中的节杆菌属(Arthrobacter)、芽孢杆菌属(Bacillus)和葡萄球菌属(Staphylococcus)均呈显著性正相关(P<0.05),而与苹果表皮细菌属中的金黄杆菌属(Chryseobacterium)、马赛菌属(Massilia)、假单胞菌属(Pseudomonas)、短小杆菌属(Curtobacterium)和泛菌属(Pantoea)均呈显著性负相关(P<0.05)。与此相反,苹果表皮真菌属中的维希尼克氏酵母菌属(Vishniacozyma)和外囊菌属(Taphrina)与苹果表皮细菌属中的节杆菌属(Arthrobacter)、芽孢杆菌属(Bacillus)和葡萄球菌属(Staphylococcus)呈显著性负相关(P<0.05),而与苹果表皮细菌属中的金黄杆菌属(Chryseobacterium)、马赛菌属(Massilia)、假单胞菌属(Pseudomonas)、短小杆菌属(Curtobac terium)和泛菌属(Pantoea)呈显著性正相关(P<0.05)。苹果表皮真菌属中的锥梗孢属(Dissoconium)与苹果表皮细菌属中的假节菌属(Pseudarthrobacter)呈显著性负相关(P<0.05),而与苹果表皮细菌属中的寒冷杆菌属(Frigoribacterium)和鞘氨醇单胞菌属(Sphingomonas)呈显著性负相关(P<0.05)。苹果表皮真菌属中的线黑粉酵母属(Filobasidium)与苹果表皮细菌属中的微小杆菌属(Exiguobacterium)呈显著性负相关(P<0.05)。苹果表皮真菌属中的线黑粉酵母属(Filobasidium)的相对丰度受苹果表皮中的微小杆菌属(Exiguobacterium)的负向调控,而苹果表皮生防细菌属假单胞菌属(Pseudomonas)对苹果表皮维希尼克氏酵母菌属Vishniacozyma的相对丰度呈正向调节,由此可见苹果表皮真菌与苹果表皮细菌之间存在共生和互作关系。
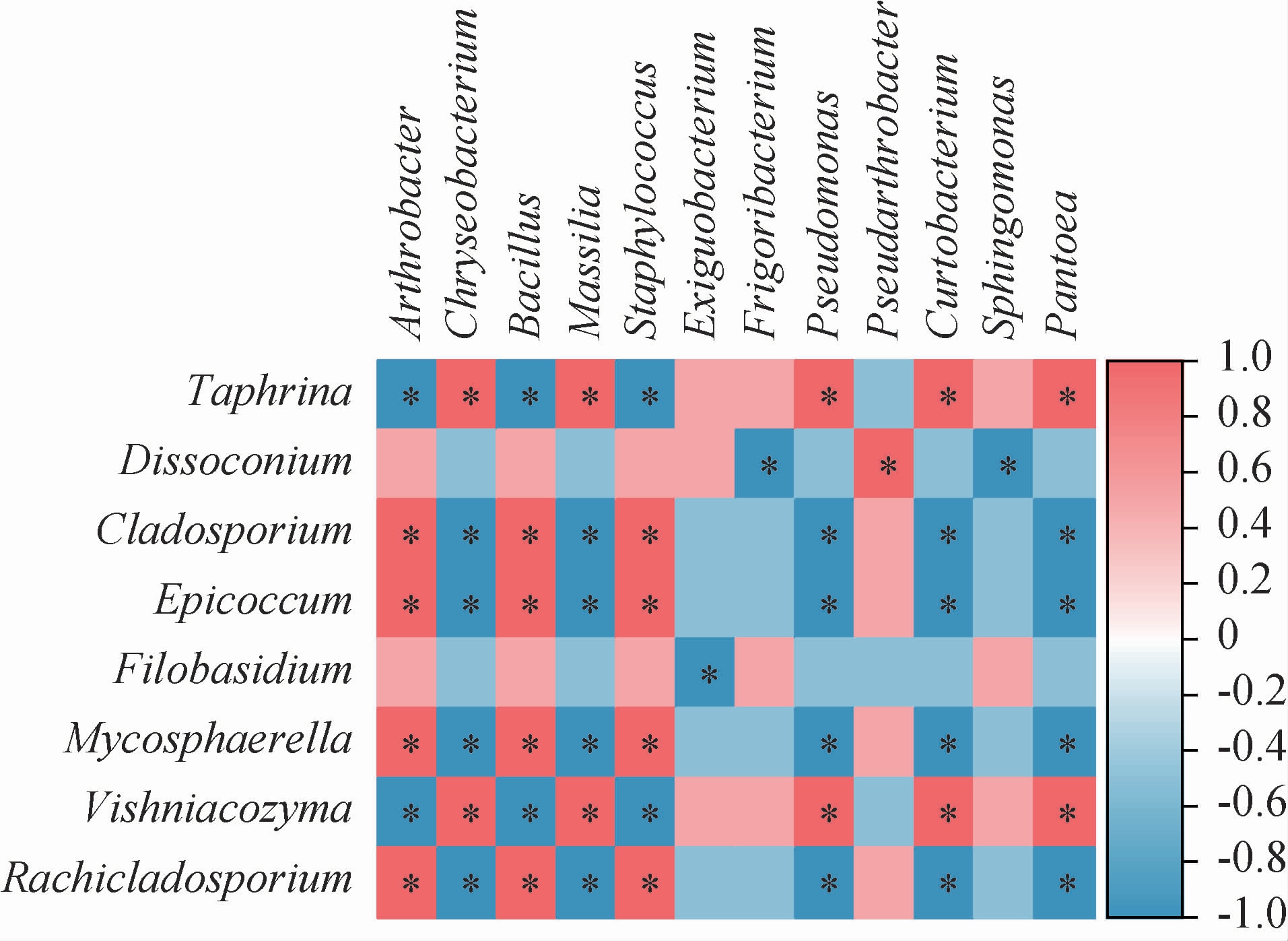
图5 苹果表皮样品中优势真菌属与细菌属的关联分析
Fig. 5 Correlation analysis of dominant fungi and bacteria in apple pericarp samples
3 结论
本实验利用高通量测序技术对藏东南产区苹果果实表皮及其根际土壤微生物群落结构组成进行研究。果实表皮和根际土壤样品分别获得554个、1 717个细菌OTUs和612个、1 371个真菌OTUs,且根际土壤样品中微生物物种多样性和丰富度均高于苹果果实表皮样品,更具有优势。细菌群落结构分析表明,苹果果实表皮样品中优势属为节杆菌属(Arthrobacter),其次为金黄杆菌属(Chryseobacterium)、芽孢杆菌属(Bacillus)、寒冷杆菌属(Frigoribacterium)、假单胞菌属(Pseudomonas)和鞘氨醇单胞菌属(Sphingomonas)等。根际土壤样品中细菌群落组成主要以节杆菌属(Arthrobacter)、分支杆菌属(Mycobacterium)、慢生根瘤菌属(Bradyrhizobium)、小单孢菌属(Micromonospora)等菌属为优势属。真菌群落结构分析表明,苹果表皮中的主要优势属为外囊菌属(Taphrina),根际土壤样品中的主要优势属为被孢霉属(Mortierella)通过细菌和真菌关联性分析,发现苹果表皮真菌线黑粉酵母属(Filobasidium)与苹果表皮细菌微小杆菌属(Exiguobacterium)呈负相关,而苹果表皮生防细菌属假单胞菌属(Pseudomonas)与苹果表酵母属维希尼克氏酵母菌属(Vishniacozyma)呈正相关。苹果表皮的部分优势菌属的相对丰度受根际土壤中的部分优势属正向或负向的影响且影响显著,同时苹果表皮真菌与苹果表皮细菌之间存在共生和互作关系,具体的共生和互作机理有待进一步研究。
[1]张二豪,赵润东,禄亚洲,等.藏东南产区葡萄和根际土壤细菌群落多样性[J].食品与发酵工业,2021,47(14):100-106.
[2] RENOUF V,CLAISSE O,LONVAUD-FUNEL A.Inventory and monitoring of wine microbial consortia[J].Appl Microbiol Biotechnol,2007,75(1):149-164.
[3]王贵双.嗜杀酵母的筛选及其在苹果酒发酵中的应用[D].北京:北京林业大学,2006.
[4]宋安东,吴云汉,李艳梅,等.产苹果酒优良酵母菌株的选育研究[J].河南农业大学学报,2002(2):183-186.
[5]祝战斌,马兆瑞,张坐省.苹果酒发酵菌种的筛选研究[J].酿酒,2003,30(1):66-67.
[6]CARVALHAIS L C,DENNIS P G D,FAN B,et al.Linking plant nutritional status to plant-microbe interactions[J].PLoS One,2013,8(7):e68555.
[7] MORGAN J A W,BENDING G D,WHITE P J.Biological costs and benefits to plant-microbe interactions in the rhizosphere[J]. J Exp Bot,2005,56(417):1729-1739.
[8]周丽霞,丁明懋.土壤微生物学特性对土壤健康的指示作用[J].生物多样性,2007(2):162-171.
[9]李建芳,张阳阳,汪清美,等.玫瑰型苹果酒的酿造工艺优化[J].食品工业,2021,42(6):169-174.
[10]隋韶奕,张素敏,王雪松,等.冰苹果酒酿造工艺探究[J].食品研究与开发,2020,41(13):157-161.
[11]吴萌萌,张瑞萍,史亚娟,等.4个苹果品种贮藏期间果实质地和营养成分的变化[J].果树学报,2020,37(9):1404-1412.
[12]吕伟静.生物炭减轻苹果连作障碍的微生物机制及改性生物炭的应用[D].泰安:山东农业大学,2021.
[13] KILMARTIN P A.Understanding and controlling non-enzymatic wine oxidation[J].Manag Wine Qual,2010,144(5):432-458.
[14]FADIJI A E,BABALOLA O O.Metagenomics methods for the study of plant-associated microbial communities:A review[J].J Microbiol Meth,2020,170:105860.
[15] YOU J,WU G,REN F P,et al.Microbial community dynamics in Baolige oilfield during MEOR treatment,revealed by Illumina MiSeq sequencing[J].Appl Microbiol Biotechnol,2016,100(3):1469-1478.
[16]张世伟,陈曦,钟其顶,等.不同品种酿酒葡萄表皮微生物群落多样性分析[J].生物技术通报,2017,33(3):128-137.
[17]史芳芳,李向泉.葡萄根际土壤真菌群落多样性分析[J].中国农业科技导报,2019,21(7):47-58.
[18]SCHLOSS P D,WESTCOTT S L,RYABIN T,et al.Introducing mothur:open-source,platform-independent,community-supported software for describing and comparing microbial communities[J]. Appl EnvironMicrobiol,2009,75(23):7537-7541.
[19]CAPORASO J G,KUCZYNSKI J,STOMBAUGH J,et al.QIIME allows analysis of high-throughput community sequencing data[J].Nat Methods,2010,7(5):335-336.
[20] JAMI E,ISRAEL A,KOTSER A,et al.Exploring the bovine rumen bacterial community from birth to adulthood[J]. ISME J,2013,7(6):1069-1079.
[21]WANG Y,SHENG H F,HE Y,et al.Comparison of the levels of bacterial diversity in freshwater,intertidal wetland,and marine sediments by using millions of illumina tags[J]. Appl Environ Microbiol,2012,78(23):8264-8271.
[22]张变华,靳东升,张强,等.不同植物种植对矿区复垦土壤微生物多样性的影响[J].农业资源与环境学报,2019,36(3):355-360.
[23]黄小娜,谭芳,姜福纯.慢生根瘤菌接种花生的结瘤能力[J].贵州农业科学,2019,47(4):74-78.
[24]赵疆,梁世军,杨涛,等.促生细菌的分离及复配菌剂对甘肃贝母产量的影响[J].中国实验方剂学杂志,2021,27(24):163-170.
[25]LEE S A,KIM Y,KIM J M,et al.A preliminary examination of bacterial,archaeal,and fungal communities inhabiting different rhizocompartments of tomato plants under real-world environments[J].Sci Rep,2019,9(1):9300.
[26]SOUSA J A J,OLIVARES F L.Plant growth promotion by Streptomycetes:ecophysiology,mechanisms and applications[J].Chem Biol Technol Agr,2016,3(1):1-12.
[27] LU Y Z,ZHANG E H,HONG M S,et al.Analysis of endophytic and rhizosphere bacterial diversity and function in the endangered plant Paeonia ludlowii[J].Arch Microbiol,2020,202(7):1717-1728.
[28]李雪,金静,李保华,等.套袋与未套袋苹果果实表皮及心部真菌种群结构与变化动态[J].菌物学报,2016,35(8):927-938.
[29]白猛,王海洋,练余兴,等.红树植物角果木内生真菌Cladosporium sp.JS1-2的次级代谢产物研究[J].中国抗生素杂志,2020,45(7):655-659.
[30]周丽思,唐坤,郭顺星.内生真菌枝孢属Cladosporium sp.对丹参生长和丹酚酸含量的影响[J].菌物学报,2018,37(1):95-101.
[31]王晓宝,王功帅,刘宇松,等.西北黄土高原地区苹果连作障碍与土壤真菌群落结构的相关性分析[J].园艺学报,2018,45(5):855-864.
[32]吴照祥,郝志鹏,陈永亮,等.三七根腐病株根际土壤真菌群落组成与碳源利用特征研究[J].菌物学报,2015,34(1):65-74.