酒酒球菌(Oenococcus oeni)主导的苹果酸-乳酸发酵(malolactic fermentation,MLF)是大多数红葡萄酒和少数白葡萄酒在酒精发酵(alcoholic fermentation,AF)后的重要工艺环节,该过程可降低葡萄酒酸度、增加香气复杂度、改善葡萄酒酸涩口感、增强葡萄酒微生物稳定性,进而提高葡萄酒的质量[1-2]。依靠酿酒环境中存在的乳酸菌进行的自发MLF通常较难控制,一些情况下甚至无法正常启动发酵,并且一旦其他的细菌(如片球菌属等)成为发酵过程的主导菌,还会给葡萄酒带来不愉悦的香气、过高的挥发酸和生物胺等[3-4]。因此,接种高活性、高活菌数的商业发酵剂是保障MLF顺利启动完成的关键[5-7]。
随着我国葡萄酒产业的不断发展,对本土优质葡萄酒的需求不断提升,我国葡萄酒企业对优质O.oeni发酵剂的需求也越来越大[8],然而目前我国葡萄酒企业使用的O.oeni发酵剂严重依赖进口,对本土发酵剂的开发缓慢,缺乏本土优良O.oeni发酵剂,导致我国葡萄酒同质化严重、本土风格不突出,开发本土优良菌株的优质发酵剂迫在眉睫。
目前,制作乳酸菌发酵剂的方法主要有真空干燥法、喷雾干燥法、真空冷冻干燥法,其中使用较为广泛且有效的方法是采用真空冷冻干燥法制备乳酸菌发酵剂[9]。真空冷冻干燥发酵剂制备的关键前提和基础就是实现菌体的高密度培养[10]。现有的乳酸菌高密度培养方法主要有缓冲盐法、化学中和法、补料培养法和渗析法[11]。有文献报道,吕兵等[12]曾综合运用缓冲盐法和化学中和法使培养液中嗜酸乳杆菌的活菌数达到2.4×109 CFU/mL;贺稚非等[13]运用缓冲盐法及补料培养法相结合的方案,使培养液中植物乳杆菌混菌发酵的活菌数达到7.24×109 CFU/mL。影响高密度培养的因素有很多,如培养基中的营养物质、pH值、接种量、补料方式、生长抑制物的积累等[14]。对于酒酒球菌,目前有关其高密度培养的研究较少,纪赟等[15]采用连续流加补料的方法,使自动诱导超级肉汤(autoinductive terrific broth,ATB)培养基中酒酒球菌的活菌数达到7.5×108CFU/mL。但是,少有研究对酒酒球菌不同的高密度培养方法进行比较。本研究选取了实验室保藏的4株优良O.oeni菌株(O.oeni ES-1、O.oeni 144-46、O.oeni 28A-1和O.oeni SD-2a),通过研究L-苹果酸对酒酒球菌的促进生长作用,选取最终菌密度(OD600nm值)较高且性状较为优良的O.oeni ES-1为出发菌株进行培养基条件优化,结合不同的高密度培养方法,对本土优良O.oeni ES-1的高密度培养条件进行优化,以期提高最终O.oeni的菌体密度,为本土优良酒酒球菌商业化应用奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
酒酒球菌(O.oeni)ES-1、144-46、28A-1、SD-2a:西北农林科技大学葡萄酒学院葡萄酒微生物实验室分离保藏。
1.1.2 试剂
葡萄糖:天津市科密欧化学试剂有限公司;酵母浸粉、蛋白胨:北京奥博星生物技术有限责任公司;硫酸镁:西陇化工股份有限公司;硫酸锰:淮南市科迪化工科技有限公司;L-盐酸半胱氨酸、琼脂粉:北京索莱宝科技有限公司;无水碳酸钠、丙三醇:四川西陇科学有限公司;3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS):北京博奥拓达科技有限公司。实验所用试剂均为分析纯或生化试剂。
1.1.3 培养基
ATB培养基:参照参考文献[16]制备。
1.2 仪器与设备
SS325型高压蒸汽灭菌锅:日本TOMY公司;DGG-9203A型电热恒温鼓风干燥箱、SHP-250型生化培养箱:上海森信实验仪器有限公司;Eppendorf Centrifuge 5417R1型台式高速冷冻离心机:德国Eppendorf公司;PHS-3C型pH计:上海仪电科学仪器股份有限公司;Cary 60 UV-Vis型分光光度计:美国安捷伦公司;SW-CJ-1FD型超净工作台:苏净集团苏州安泰空气技术有限公司。
1.3 方法
1.3.1 酒酒球菌的活化
取-80 ℃保藏的菌株接入ATB培养基,26 ℃培养48 h,转接2次。
1.3.2 菌密度的考察方法
本研究通过细菌活菌数和OD600nm值为两个考察指标衡量菌密度。采用稀释涂布平板法计算活菌数,采用分光光度计测定培养液在波长600 nm处的吸光度值,以空白培养基调零,以测得的OD600nm值衡量菌株的生长情况。
1.3.3 L-苹果酸对酒酒球菌生长的影响
在ATB培养基中分别添加0.5 g/L、1 g/L、1.5 g/L、2 g/L的L-苹果酸,以不添加L-苹果酸的ATB培养基为对照组,将ATB培养基的pH调至4.8,并以4%的接种量,分别接种O.oeni 28A-1、O.oeni 144-46、O.oeni ES-1和O.oeni SD-2a,每隔4 h测其OD600nm值并绘制生长曲线,探究L-苹果酸对酒酒球菌生长的影响。
1.3.4 酒酒球菌培养条件优化
以O.oeni ES-1为出发菌株,ATB培养基pH调至5.1,按3%接种量将同一试管中培养至对数中期的母液接种至L-苹果酸添加量为1 g/L的培养基中,每隔4 h测其OD600nm值。分别考察L-苹果酸添加量(0.5g/L、1.0g/L、1.5g/L、2.0g/L、2.5 g/L)、初始pH值(4.4、4.8、5.1、5.4、5.8)和接种量(1%、3%、5%、7%)对菌株生长的影响。
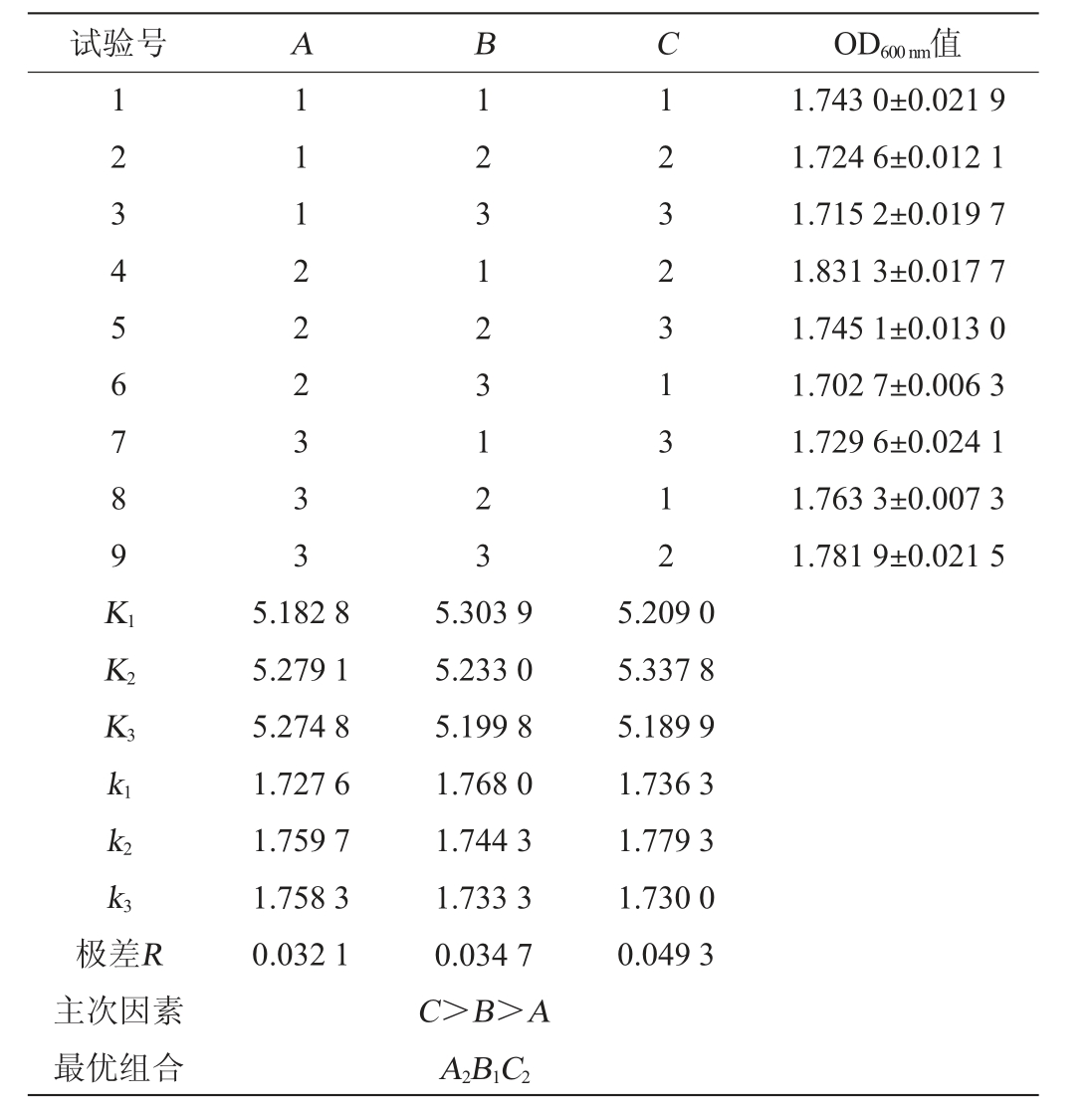
根据单因素试验结果,以初始pH(A)、接种量(B)和L-苹果酸添加量(C)为3个因素设计L9(33)正交试验,分别以到达稳定期时的OD600nm值和活菌数为考察指标,确定3个因素的最优组合。正交试验因素与水平见表1。
表1 酒酒球菌培养条件优化正交试验因素与水平
Table 1 Factors and levels of orthogonal tests for culture conditions optimization of Oenococcus oeni

1.3.5 不同高密度培养方法的比较
首先进行连续补料法条件的优化,即培养基的初始pH调至5.1,添加L-苹果酸1 g/L,接种量为3%。分别在稳定期前期向发酵液中补充不同量(10 g/L、13.3 g/L、16.7 g/L、20 g/L)的葡萄糖溶液,并且在培养过程中间断添加20%Na2CO3溶液以中和细菌代谢所产生的酸,控制pH在5.1,减少培养过程中pH值降低对菌体生长的抑制作用。测定其达到稳定期时的OD600nm值。
然后进行半连续培养条件的优化,即把培养基的初始pH调至5.1,添加L-苹果酸1 g/L,接种量为3%。将细菌培养至稳定期前期在不同离心力(429×g、966×g、1 718×g、2 685×g、3 866×g)和离心时间(10 min、20 min)条件下进行离心收集菌体,以探究最适离心条件,之后向离心收获菌体中添加等量新鲜培养基,并且在培养过程中间断添加20%Na2CO3溶液以中和细菌代谢所产生的酸,使其pH控制在5.1,然后测细菌达到稳定期时的OD600nm值。
分别考察化学中和法与连续补料法、半连续培养法相结合的方案。在上述优化培养条件的基础上,方案一为间歇式添加碱液[18]与连续补料法[19]相结合,即培养基的初始pH调至5.1,添加L-苹果酸1 g/L,接种量为3%,碳源(葡萄糖)固定在10 g/L,通过改变氮源(蛋白胨)的添加量来改变补料液的碳氮比,比较不同碳氮比(1∶0、1∶1、3∶1、5∶1、7∶1)的补料液对最终菌密度影响,并在培养过程中间断添加20% Na2CO3溶液控制pH在5.1,测定其达到稳定期时的OD600nm值和活菌数。方案二为间歇式添加碱液与半连续培养法[20]相结合,即培养基的初始pH调至5.1,添加L-苹果酸1 g/L,接种量为3%,在所得最适离心条件(离心力1 718×g,离心时间10 min)下收集菌体,之后向离心收获的菌体中添加等量新鲜培养基,并在培养过程中间断添加20%Na2CO3溶液控制pH在5.1,测定其达到稳定期时的OD600nm值和活菌数。
1.3.6 测定方法
培养液中残糖含量的测定:为了探究培养液营养匮乏的具体时期,获得开始补料的时间点,采用DNS法[17],对培养液中的残糖每隔4 h进行测定。
本研究对半连续培养法的离心条件进行优化,以离心收得率为衡量指标,离心收得率计算公式[18-21]如下:
1.3.7 数据处理
试验重复3次,采用Excel 2010进行初步分析,GraphPad Prism进行差异显著性分析与作图。
2 结果与分析
2.1 L-苹果酸对酒酒球菌生长的影响
由图1可知,添加一定量的L-苹果酸可以显著促进酒酒球菌的生长。添加0.5 g/L、1.0 g/L、1.5 g/L的L-苹果酸可使O.oeni 28A-1在稳定期达到较高的OD值;与不添加苹果酸的对照组相比,添加L-苹果酸的试验组O.oeni迟滞期较短,且均在16 h左右到达对数期,而对照组在24 h左右到达对数期。试验组与对照组均在生长72 h左右到达稳定期。添加0.5 g/L的L-苹果酸对O.oeni 28A-1生长促进作用最好,O.oeni 28A-1在稳定期获得最高的OD值。L-苹果酸对于其他供试菌株生长同样具有显著促进作用,添加0.5g/L、1.0 g/L、1.5 g/L的L-苹果酸可以促进O.oeni 144-46的生长(图1B);添加0.5g/L、1.0 g/L的L-苹果酸可以促进O.oeniES-1和O.oeni SD-2a的生长(图1C、图1D)。O.oeni可将L-苹果酸转化成L-乳酸,同时也产生丙酮酸或其代谢产物如乙酰磷酸,这些物质可以作为烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NADH2)的氢受体,乙酰磷酸在转化为乙酸的过程中,可以借助底物水平磷酸化产生额外的ATP,为细胞的生命活动提供能量[22]。因此,L-苹果酸对O.oeni生长的促进作用可能是由于O.oeni对L-苹果酸的代谢为其提供了更多的能量。当L-苹果酸添加量为2.0 g/L时,对O.oeni 28A-1、144-46均无显著促进生长作用,而对O.oeni ES-1、SD-2a有显著抑制作用,推测是因为加入过量的L-苹果酸导致培养后期培养基的pH下降至较低水平,但是过低的pH值会严重抑制O.oeni的生长[18],所以加入L-苹果酸为2.0 g/L时,对这4株菌的生长无促进效果。基于此结果,向ATB培养基中引入L-苹果酸,并对培养条件进行优化,以期提高菌体密度。在这4株菌中,最终菌密度(OD600nm值)最高的菌株为O.oeni ES-1(1.774 4±0.005 2),故选择该株菌为出发菌株进行后续试验。
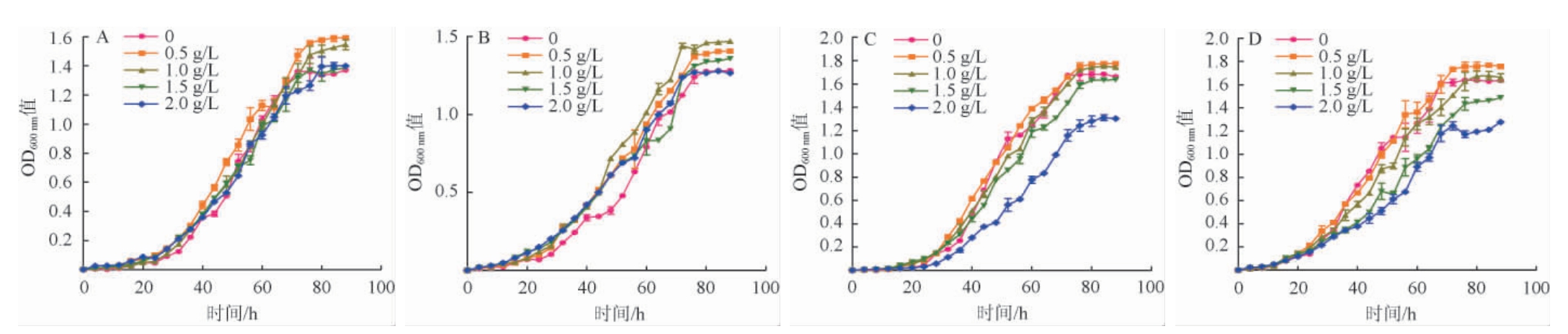
图1 L-苹果酸添加量对酒酒球菌28A-1(A)、144-46(B)、ES-1(C)、SD-2a(D)生长的影响
Fig. 1 Effect of L-malic acid addition on the growth of Oenococcus oeni 28A-1 (A),144-46 (B),ES-1 (C) and SD-2a (D)
2.2 酒酒球菌ES-1培养条件优化
2.2.1 酒酒球菌ES-1培养条件优化单因素试验
由图2A可知,向ATB培养基中添加1.0 g/L或0.5 g/L L-苹果酸可以显著促进菌株生长(P<0.05),最终可获得较高的菌体密度。添加1.5 g/L的L-苹果酸对菌株生长的抑制作用不显著(P>0.05),添加2.0 g/L或2.5 g/L的L-苹果酸对菌株生长具有明显的抑制作用,最终菌体密度明显低于不添加L-苹果酸的对照组(P<0.01)。推测是由于高浓度的有机酸会对菌株细胞膜产生毒性作用,一定程度抑制菌体生长[23]。故选择1.0 g/L为L-苹果酸的最适添加量,此条件下达到稳定期时的OD600nm值为1.726 9±0.006 8。
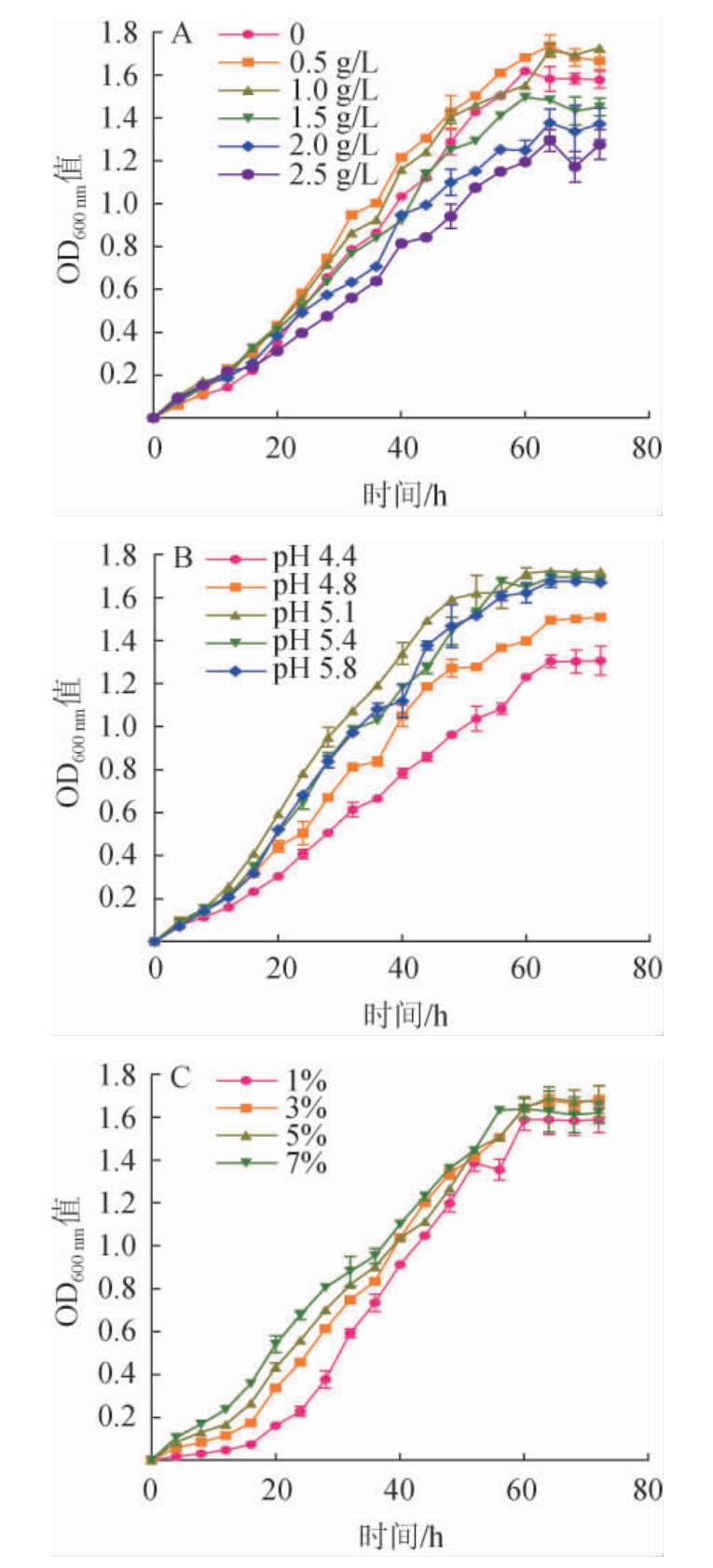
图2 L-苹果酸添加量(A)、初始pH(B)和接种量(C)对酒酒球菌ES-1生长影响
Fig. 2 Effects of L-malic acid addition (A),initial pH (B) and inoculum(C) on the growth of Oenococcus oeni ES-1
O.oeni可以一定程度地耐受高酸低pH环境,能够在葡萄酒酒精发酵后的高酸低pH环境中进行MLF[24]。但是过低的pH值会严重抑制O.oeni的生长代谢,甚至造成其无法生存[18]。由图2B可知,当初始pH低于4.8时,O.oeni ES-1的生长受到极显著的抑制(P<0.01),随着pH的降低,对O.oeni生长的抑制作用越明显。当培养基的初始pH提高至4.8时,O.oeni菌体生长速度明显加快,最终菌体密度也显著升高(P<0.01),但其生长并不是随着pH值的上升而呈上升趋势,当pH值升高至5.8时,菌体的长势略有下降。因此,O.oeni ES-1在此条件下的最适生长pH值范围为4.8~5.8。当pH为4.8时,细菌到达稳定期的菌密度最高,OD600nm值为1.721 7±0.011 9。所以在此培养基条件下,该菌的最适pH为4.8。
接种量是影响菌株生长及代谢的一个重要因素。由图2C可知,接种量为1%的菌液生长延滞期最长;接种量为3%、5%的菌液生长延滞期较短,对数期较长;接种量为7%时,菌体前期生长过快,产生的有机酸类代谢物质快速积累,使pH迅速下降,影响了菌体自身生长。除此之外,过快的生长速率使营养物质快速消耗且菌种易老化[19]。因此,3%~7%的接种量较为适宜,当接种量为3%时稳定期的菌密度最高,OD600nm值为1.682 6±0.065 5。
2.2.2 酒酒球菌ES-1培养条件优化正交试验
由表2可知,影响O.oeni ES-1最终菌体密度因素的主次顺序为C>B>A,即L-苹果酸添加量>接种量>初始pH。由K值可以确定最优组合为A2B1C2,即初始pH值5.1、接种量3%、L-苹果酸添加量为1.0 g/L,在此优化条件下可获得最高的菌体密度,OD600nm值为1.831 3±0.017 7,活菌数为(7.33±0.40)×109 CFU/mL。
表2 酒酒球菌培养条件优化正交试验结果与分析
Table 2 Results and analysis of orthogonal tests for culture conditions optimization of Oenococcus oeni
2.3 高密度培养方法的比较
2.3.1 酒酒球菌培养过程中残糖浓度和OD值变化曲线
细菌高密度培养是生产冻干发酵剂的基础。实现细菌高密度培养的核心是为菌体生长提供合理的营养、及时除去毒性代谢产物和保持稳定的比生长速率[25]。乳酸菌发酵时会产生有机酸(如乳酸、乙酸等),会使发酵过程中pH值逐渐降低。如本研究中酒酒球菌发酵初始培养基pH为5.1,生长到稳定期时pH会降至3.4左右。虽然乳酸菌具有一定的低pH耐受性,但当pH值过低时,酒酒球菌等乳酸菌的生长代谢会受到明显抑制[26]。因此,有必要采用化学中和法来控制培养过程pH值,减少由于pH降低对菌体生长的抑制作用。
由图3可知,酒酒球菌在发酵20 h后进入对数生长期,菌体密度(OD600nm)迅速上升,培养基中残糖含量迅速下降;培养至80 h后到达稳定期,菌密度无明显变化,残糖含量下降速度缓慢。在培养76 h后,培养基中的残糖含量限制细菌的生长。因此,在酒酒球菌培养至76 h(稳定期前期)左右补加一定量的糖,或者补加新鲜的培养基等营养物质,有利于提高最终稳定期时的菌体密度。故采用化学中和法分别与连续补料法、半连续培养法相结合的方案,探究不同高密度培养方案对O.oeni菌密度的影响,以期进一步提高菌体密度。
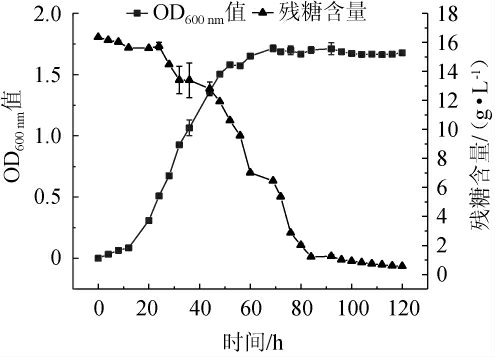
图3 酒酒球菌ES-1培养过程中残糖含量和OD600nm值变化曲线
Fig. 3 Change curve of residual sugar concentration and OD600nm value of Oenococcus oeni ES-1 during culture
2.3.2 连续补料法的葡萄糖补加量对O.oeni ES-1菌体密度的影响
由图4可知,补加10 g/L、13.3 g/L、16.7 g/L的葡萄糖均可以显著提高O.oeni ES-1最终的菌体密度(P<0.05)。其中补加10 g/L葡萄糖的O.oeni ES-1最终菌体密度最高,故10 g/L为其最适葡萄糖补加量。
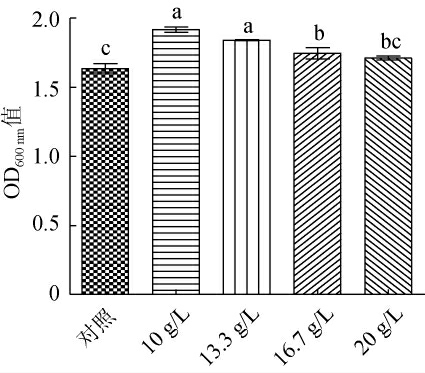
图4 葡萄糖补加量对酒酒球菌ES-1的OD600nm值影响
Fig. 4 Effect of glucose supplement on OD600nm value of Oenococcus oeni ES-1
2.3.3 半连续培养法的离心条件对O.oeni菌体密度的影响
对于化学中和法和半连续培养法相结合的方案,本研究主要探究了离心时间和离心力对细胞离心收得率的影响。研究发现离心时间过短,离心力过低无法充分的收集到菌体,离心时间过长,离心力过高则会对细菌细胞造成损伤[27-29]。由图5可知,得出的最适离心条件为离心力1 718×g,离心时间10 min,最终菌体收得率为97.65%。
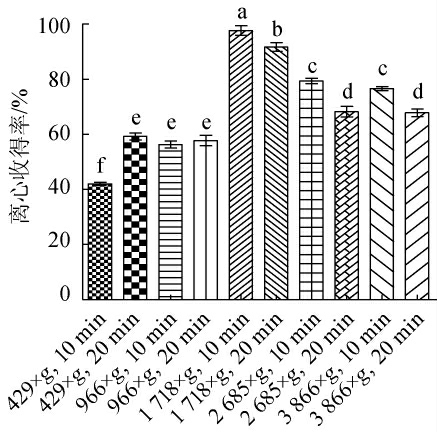
图5 半连续培养离心条件对细菌得率的影响
Fig. 5 Effect of semi-continuous culture centrifugation conditions on bacterial yield
2.3.4 两种高密度培养方案的比较优化
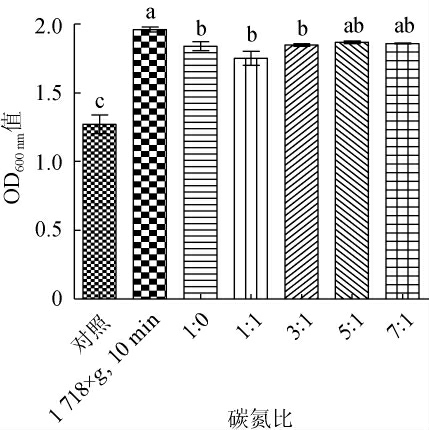
图6 不同高密度培养方法对细菌稳定期OD600nm值的影响
Fig. 6 Effects of different high-density culture methods on OD600nm value in bacteria stationary phase
两种高密度培养方案为化学中和法分别与连续补料法、半连续培养法相结合。采用化学中和法的前提下,对比在离心力1 718×g,离心时间10 min条件下收集菌体的半连续培养法和补充不同碳氮比的连续培养法对菌体密度的影响。结果表明,化学中和结合连续培养方案中,当碳氮比为5∶1时的菌体密度OD600nm值为1.867 6±0.010 7,活菌数为(1.08±0.17)×1010 CFU/mL,显著高于对照组(P<0.05)。化学中和结合半连续培养方案中,在离心力1 718×g,离心时间10 min条件下最终菌密度OD600nm值为1.960 7±0.018 5,活菌数为(1.67±0.11)×1010 CFU/mL,显著高于连续培养组和对照组(P<0.05),且是对照组活菌数((1.50±0.53)×109 CFU/mL)的11倍,达到了高密度培养的目的。
3 结论
本试验研究发现,在ATB培养基中添加一定量L-苹果酸能促进O.oeni生长。并将添加L-苹果酸应用于高密度培养的条件优化,以O.oeni ES-1为出发菌株进行菌体高密度培养条件优化,通过正交试验获得的适宜培养条件为初始pH 值5.1、接种量3%、L-苹果酸添加量1 g/L,此时O.oeni ES-1活菌数可达(7.33±0.40)×109 CFU/mL。采用化学中和法与半连续培养法相结合的方法进一步提高菌体密度,即:间断补加20% Na2CO3溶液调节pH,于培养76 h(稳定期前期)、在离心力1 718×g,离心时间10 min条件下离心收集菌体,并补加新鲜ATB培养基,最终活菌数可达到(1.67±0.11)×1010 CFU/mL,是对照组活菌数的11倍,达到了高密度培养的目的。
[1]王玲,卜潇,陈其玲,等.酒酒球菌β-葡萄糖苷酶产酶条件优化及酶学性质研究[J].西北农林科技大学学报(自然科学版),2017,45(5):130-138.
[2]任晓宁,张宇,陈其玲,等.不同发酵条件对模拟葡萄酒中酒酒球菌柠檬酸代谢的影响[J].食品工业科技,2017,38(4):180-185,190.
[3] SURIANO S,SAVINO M,BASILE T,et al.Management of malolactic fermentation and influence on chemical composition of Aglianico red wines[J].Italian J Food Sci,2015,27(3):310-319.
[4] HENS D V L,BRAVO-FERRADA B M,DELFEDERICO L,et al.Prevalence of Lactobacillus plantarum and Oenococcus oeni during spontaneous malolactic fermentation in Patagonian red wines revealed by polymerase chain reaction-denaturing gradient gel electrophoresis with two targeted genes[J].Aust J Grape Wine R,2015,21(1):49-56.
[5]ZHAOG Q,ZHANG G.Influence of freeze-drying conditions on survival of Oenococcus oeni for malolactic fermentation[J]. Int J Food Microbiol,2009,135(1):64-67.
[6] BERBEGAL C,BENAVENT-GIL Y,NAVASCUÉS E,et al.Lowering histamine formation in a red Ribera del Duero wine (Spain) by using an indigenous O.oeni strain as a malolactic starter[J].Int J Food Microbiol,2017,244:11-18.
[7]李莹莹,苏静,杨世玲,等.直投式酒酒球菌SD-2a发酵剂对葡萄酒品质的影响[J].西北农林科技大学学报(自然科学版),2016,44(12):192-200.
[8]王继锋,石侃,安玮,等.酒酒球菌(Oenococcus oeni)产胞外聚合物培养基的优化及其抗冷冻干燥性能评价[J].食品与发酵工业,2019,45(15):157-163.
[9]张雅硕,侯一超,张紫薇,等.高活性副干酪乳杆菌冻干菌粉的制备及工艺优化[J].食品工业科技,2019,40(16):90-96.
[10] HANSEN E B.Commercial bacterial starter cultures for fermented foods of the future[J].Int J Food Microbiol,2002,78(1-2):119-131.
[11]山丽杰,田洪涛,贾英民,等.浓缩型乳酸菌发酵剂制备中几个技术关键问题的探讨[J].中国乳品工业,2002,30(5):66-69.
[12]吕兵,张国农,肖光辉.新型酸奶发酵剂的研究[J].中国乳品工业,1999(5):9-11,16.
[13]贺稚非,向瑞玺,李洪军,等.泡菜活性直投式乳酸菌发酵剂的研究[J].食品科学,2006,27(8):191-197.
[14]史媛英,肖冬光.酸奶发酵剂高浓度培养的研究[J].天津轻工业学院学报,1999(1):20-25.
[15]纪赟,高丽莉,赵洪,等.酒类酒球菌的批式与流加培养特性[J].农产品加工·学刊,2008(12):29-32,35.
[16]杨世玲,陈其玲,李莹莹,等.酒酒球菌磷酸-β-葡萄糖苷酶基因的克隆及生物信息学分析[J].中国食品学报,2017,17(2):197-205.
[17]张学英,黄忠意,章发盛,等.两种检测还原糖方法的比较[J].食品与机械,2017,33(2):66-69.
[18]王华,罗华,黄科.酒类酒球菌SD-2a高密度培养的研究[J].酿酒科技,2007(4):69-72.
[19]陈百莹,郑苗,邓泽元,等.植物乳杆菌ZJ316培养基优化和高密度培养的研究[J].中国食品学报,2020,20(7):65-74.
[20]李玉娥,马玲.乳酸菌高密度培养条件优化研究[J].中国酿造,2021,40(9):150-154.
[21]康娇,张亚蓉,杨从绪,等.FYa1泡菜用直投式发酵剂的制作工艺优化[J].食品科学,2020,41(24):216-222.
[22]纪赟.酒类酒球菌培养特性研究[D].青岛:中国海洋大学,2009.
[23]杨瑞冬,李伯海,王元弛,等.Lactobacillus buchneri IMAU80233高密度发酵工艺优化[J].食品科学,2019,40(22):147-154.
[24]JIANG J,SUMBY K M,SUNDSTROM J F,et al.Directed evolution of Oenococcus oeni strains for more efficient malolactic fermentation in a multi-stressor wine environment[J].Food Microbiol,2018,73:150-159.
[25]雷张腾.保拉迪酵母菌粉的制备及稳定性研究[D].西安:陕西科技大学,2017.
[26]WANG T,LU Y Y,YAN H,et al.Fermentation optimization and kinetic model for high cell density culture of a probiotic microorganism: Lactobacillus rhamnosus LS-8[J].Bioprocess Biosyst Eng,2020,43(3):515-528.
[27]田洪涛,张柏林,贾英民,等.提高双歧杆菌在离心过程中活菌收得率的研究[J].食品科学,2000,21(6):27-30.
[28]杨玉琢,杜鹏,焦月华.乳酸菌离心工艺条件优化的研究[J].中国乳品工业,2009,37(5):9-11.
[29] BRUNO F A,SHAH N P.Viability of two freeze-dried strains of Bifidobacterium and of commercial preparations at various temperatures during prolonged storage[J].J Food Sci,2003,68(7):2336-2339.