拟除虫菊酯是一类高效广谱、低毒、低残留新型杀虫剂,其杀虫效率是有机氯、有机磷、氨基甲酸酯类的10~100倍,因此广泛运用于农业、林业等生产中,但随着在农业、林业生产上的施用,其残留物会在农田排水、地表径流、降水等进入水体后,并通过食物链最终进入人体,会给人类健康带来严重隐患。有研究表明,当拟除虫菊酯类农药在人体内长期积蓄时,会对人体的听力系统[1]、神经系统[2-3]、生育系统[4-5]等产生较大的危害。随着对拟除虫菊酯类残留危害的关注,很多国家和地区,逐渐加强了对一些水产品中拟除虫菊酯类的限量,如国际食品法典委员会(Codex Alimentarius Commission,CAC)规定了鮭肌肉中溴氰菊酯最高残留限量为30 μg/kg;欧盟(European Union,EU)规定了水产品中氯氰菊酯和溴氰菊酯最高残留量分别为50 μg/kg和10 μg/kg;美国食品药品管理局(Food and Drug Administration,FDA)规定了鱼类中溴氰菊酯最高残留量为10 μg/kg[6];而我国在食品安全国家标准GB 31650—2019《食品中兽药最大残留限量》中也规定了鱼肌肉中氯氰菊酯和溴氰菊酯最大残留限量,为分别为50 μg/kg和30 μg/kg。随着对一些水产品中拟除虫菊酯类残留危害的关注以及对氯氰菊酯和溴氰菊酯的限量,因此需要加强对拟除虫菊酯类在鱼类产品中的检测研究。
目前,对拟除虫菊酯类农药的残留检测技术很多,主要有酶联免疫分析方法(enzyme linked immunosorbent assay,ELISA)[7-8]、高效液相色谱法(high performance liquid chromatography,HPLC)[9]、气相色谱法(gas chromatography,GC)[10-14]、气相色谱-质谱法(gas chromatography-mass spectrometry,GC-MS)[15-17]、液相色谱-质谱/质谱(liquidchromatography tandem mass spectrometry,LC-MS/MS)[18-19]和气相色谱-质谱/质谱法(gas chromatography-tandem mass spectrometry,GC-MS/MS)[20-21]。而前处理方法技术主要有固相萃取法(solid phase extraction,SPE),分散固相萃取法(dSPE)等。QuEChERS(quick,easy,cheap,effective,rugged,safe)技术是2003年ANASTASSIADES M等[22]首次提出,是在固相萃取基础上发展起来的一种新型前处理净化方法,其原理是通过吸附剂填料与基质中的杂质相互作用,吸附杂质而达到除杂的目的,因其前处理简单、快速,耗费有机试剂少,对环境友好等特点,经多年发展,现已成动植物性食品中农兽药残留的主要前处理技术之一。
鱼肉基质复杂,其含有丰富的蛋白质、脂肪、氨基酸、维生素以及矿物质等,并且鱼肉中有机基质在前处理过程中较难去除干净,所以会对菊酯类农药检测带来很大困难。本研究以贵州市售淡水鱼(鲤鱼、鲟鱼、鲢鱼)为研究对象,通过应用QuEChERS前处理技术,结合高灵敏度,高抗基质干扰能力的气相色谱-串联质谱仪,对淡水鱼中6种拟除虫菊酯的定量进行研究,筛选出适宜的定性离子和定量离子,优化方法条件,实现对6种拟除虫菊酯类残留的快速检测,以期为鱼肉中6种拟除虫菊酯检测提供技术支持。
1 材料与方法
1.1 材料与试剂
淡水鱼:市售。
氯氰菊酯、溴氰菊酯、氰戊菊酯、氯氟氰菊酯、甲氰菊酯、联苯菊酯标准溶液(100 mg/L)、环氧七氯(内标)标准溶液(100 mg/L):农业部环境保护科研监测所;N-丙基乙二胺(N-propyl ethylenediamine,PSA)(粒径为40~63 μm)和十八烷基键合硅胶(C18,粒径为40 μm):美国Agilent公司;乙酸乙酯(色谱纯):默克公司;无水硫酸镁(分析纯):永大试剂有限公司;乙腈和氯化钠(分析纯):国药集团化学试剂有限公司。
1.2 仪器与设备
TRACE 1300-TSQ 9000气相色谱三重四极杆串联质谱、ThermoScientific TR-Pesticide Ⅱ色谱柱(30 m×0.25 mm×0.25 μm):美国Thermo Scientific公司;ME1002/02分析天平:梅特勒-托利多国际贸易有限公司。
1.3 方法
1.3.1 样品的制备
淡水鱼去鳞、去骨后,取肌肉组织匀浆处理,放入聚乙烯瓶中,于-20 ℃保存备用。
1.3.2 样品的前处理
称取匀浆处理的样品5 g(精确至0.01 g)于50 mL离心管中,先加2 mL超纯水混匀,加入乙腈10 mL匀浆提取5 min,再加入2~3 g NaCl振荡提取2 min,然后以5 000 r/min离心5 min,待取上清液,净化;取4 mL上述上清液于15 mL聚丙烯QuEChERS净化管(500 mg MgSO4+150 mg PSA+150 mg C18)中,涡旋振荡1 min,6 000 r/min离心5 min,然后取2 mL离心上清液于玻璃试管中,45 ℃水浴中,氮吹吹至近干,用1 mL乙酸乙酯定容后,再加入20 μL 2.5 μg/mL的环氧七氯(内标),涡旋混合复溶,过0.22 μm滤膜到进样小瓶中,待GC-MS/MS检测。
1.3.3 分析方法
(1)气相色谱检测条件
石英毛细管色谱柱(30 m×0.25 mm×0.25 μm):Thermo Scientific TR-Pesticide Ⅱ;载气:氦气(He),纯度≥99.999%,流速1.00 mL/min;不分流进样;进样体积1 μL;进样口温度为250 ℃。程序升温:初始温度为40 ℃,保持1 min,以40 ℃/min 升至120 ℃,再以5 ℃/min升至240 ℃,最后以12 ℃/min 升至300 ℃,保持6 min。
(2)质谱检测条件
电子轰击离子源(electron bombardment ion source,EI),温度:280 ℃;传输线温度:280 ℃;碰撞气:氩气(99.999%);选择反应检测扫描(selection response monitor,SRM)模式。
上述条件下,各化合物的保留时间、定性及定量离子、碰撞能量等信息见表1。
表1 6种拟除虫菊酯的CAS号、保留时间、定性和定量离子以及碰撞能量
Table 1 CAS No.,retention time,qualitative and quantitative ions,and collision energy of 6 pyrethroids
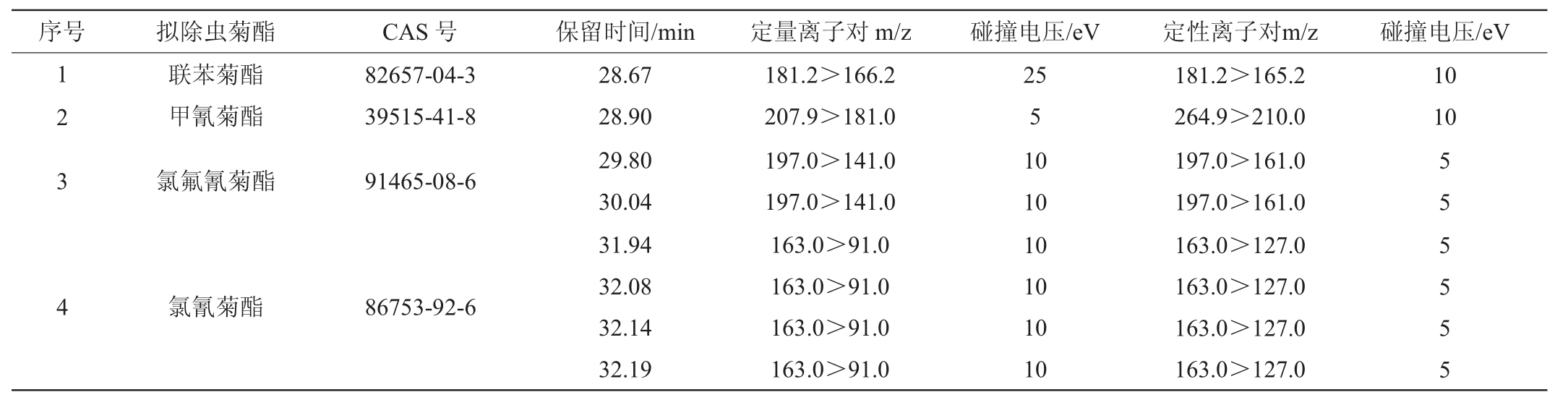
续表
1.3.4 基质效应评价及标准曲线绘制
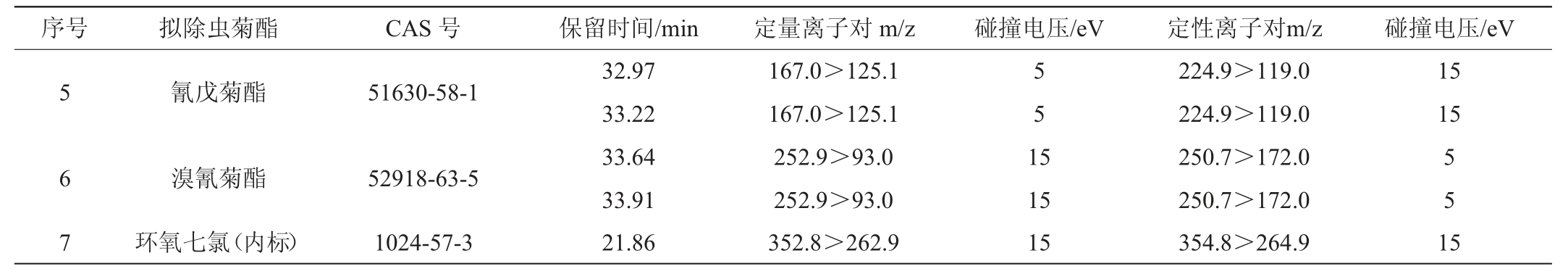
本研究采用空白基质提取液与纯溶剂配制成相同浓度,用以比较待测目标物的峰面积,通过二者峰面积的相对比值评价基质效应(matrix effect,ME),如果ME>100%,说明存在基质增强效应,ME值越大,基质增强效应越大;如果ME<100%,说明存在基质抑制效应,ME值越小,基质抑制效应越强[23]。ME计算公式如下:
式中:A表示纯溶剂中目标物峰面积;B表示相同浓度下样品基质中目标物峰面积。
分别移取上述一定量标准溶液至10 mL容量瓶中,然后用乙酸乙酯稀释定容,配制成各农药质量浓度为2 mg/L的标准混标储备液,于-20 ℃保存,备用。试验时,用对应基质空白溶液逐级稀释,配成质量浓度为5 μg/L、10 μg/L、30 μg/L、60 μg/L、150 μg/L、300 μg/L的一系列基质匹配标准工作溶液,并加入内标,在1.3.3节分析条件下进行测定。以目标物定量离子的峰面积(y)为纵坐标,进样质量浓度(x)为横坐标,进行线性回归分析。
1.3.5 加标回收率试验
向空白样品中(鲤鱼、草鱼、鳙鱼)添加水平分别为3 μg/kg、30 μg/kg和300 μg/kg的拟除虫菊酯,进行回收率和精密度实验,每个添加水平5个重复,计算回收率和精密度。
2 结果与分析
2.1 色谱条件选择
为了获得最佳的SRM质谱条件,在选定的气相条件下,对各化合物先进行单级质谱全扫描(50~500 m/z),分别获得了其保留时间和具有代表性的母离子碎片,然后再采用产物离子扫描方式通过优化碰撞能量及选择的母离子碎片击碎获得产物离子,得到了1.3.3节中较为理想的质谱检测条件和SRM色谱图,6种菊酯的GC-MS/MS色谱图见图1,其优化后的峰型对称较好,虽然联苯菊酯和甲氰菊酯出峰时间较相近,但两者对应的母离子碎片及产物离子碎片都不同,检测器会逐个离子分开扫描,所以对后期的定量定性均不会产生任何影响。
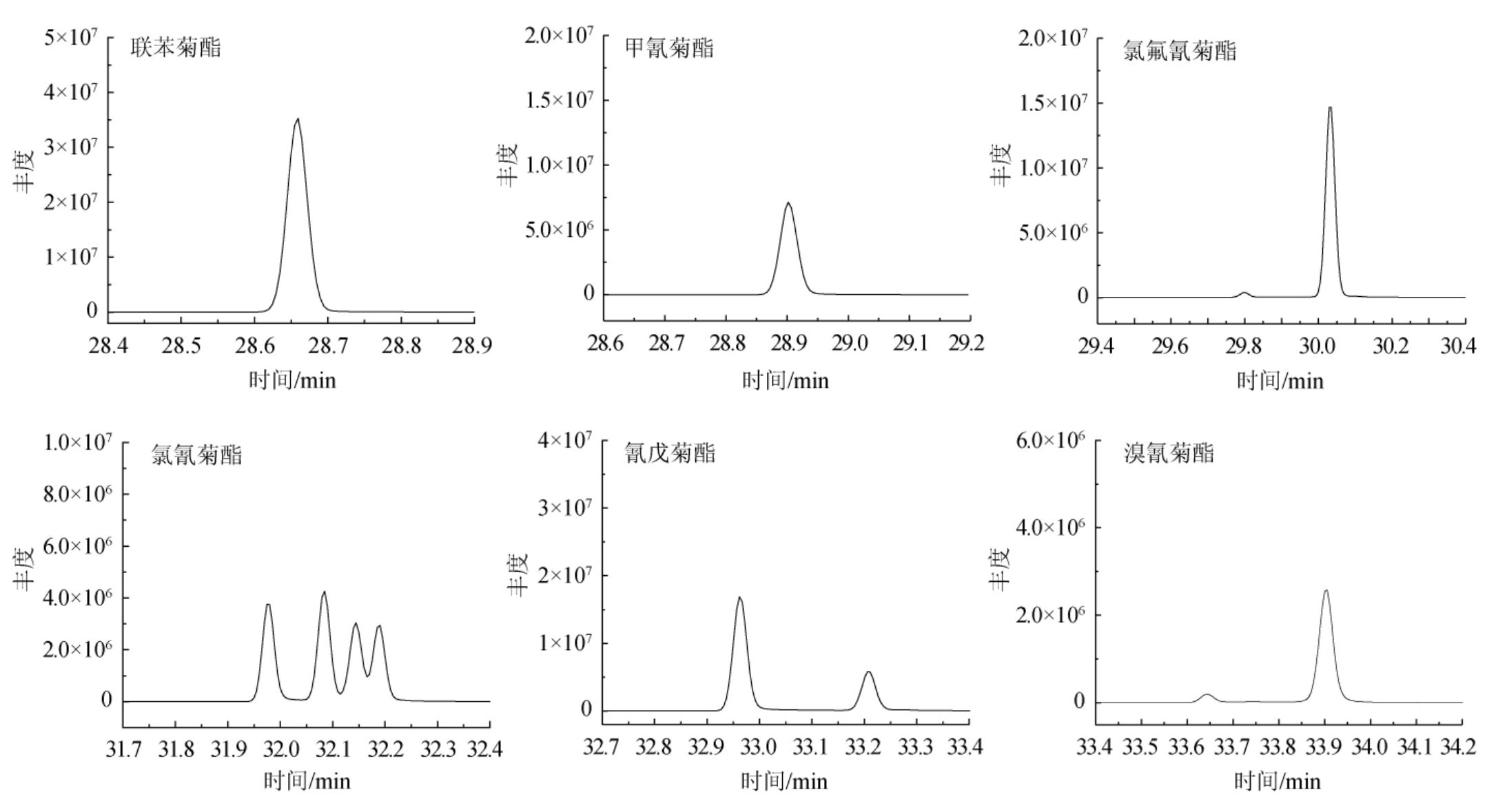
图1 6种拟除虫菊酯的GC-MS/MS选择离子流色谱图
Fig.1 Selective reaction monitoring of 6 pyrethroids by GC-MS/MS
2.2 提取、净化条件选择
2.2.1 提取试剂的优化
本研究先后考察了丙酮、乙酸乙酯和乙腈3种常用的农残提取试剂对提取效果的影响,结果表明,丙酮提取的杂质较多,不利于后续进行分离净化处理;乙酸乙酯作为提取试剂由于无法浸入鱼肉组织内部,导致回收率不高;乙腈作为提取试剂,因其良好的共萃和分层特性,为后续的分离净化提供方便,并且拥有良好的回收率。因此本研究选用乙腈作为提取试剂。
2.2.2 净化条件的选择
QuEChERS中常用到的吸附剂填料主要有石墨化炭黑(graphitized carbon black,GCB)、PSA、C18和MgSO4[24-25],由于鱼肉中含有丰富的蛋白质、脂肪及氨基酸等,所以混合使用PSA、C18和MgSO4,可以达到更好的净化效果,但吸附剂用量会对回收率有一定的影响。所以本研究以在添加量为30 μg/kg鲤鱼肉样品为例,按1.3.2方法前处理提取,净化时分别用考察的6种净化组合净化,再按1.3.3分析方法检测,考察6种不同的净化组和对各拟除虫菊酯的回收率的影响,结果见图2。
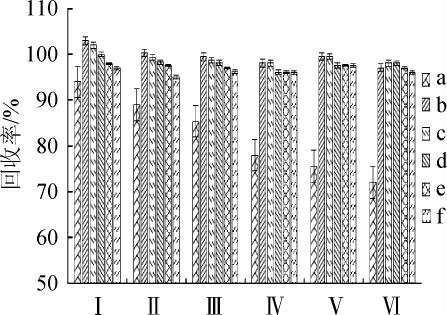
图2 鲤鱼中6种拟除虫菊酯在6种净化剂中的回收率
Fig.2 Recovery of 6 pyrethroids spiked in carp in six purifying agents
Ⅰ.PSA 50 mg+C18 50 mg+MgSO4 500 mg;Ⅱ.PSA 100 mg+C18 100 mg+MgSO4 500 mg;Ⅲ.PSA 150 mg+C18 150 mg+MgSO4 500 mg;Ⅳ.PSA 200 mg+C18 200 mg+MgSO4 500 mg;Ⅴ.PSA 250 mg+C18 250 mg+MgSO4 500 mg;Ⅵ.PSA 300 mg+C18 300 mg+MgSO4 500 mg a.联苯菊酯;b.甲氰菊酯;c.氯氟氰菊酯;d.氰戊菊酯;e.氰戊菊酯;f.溴氰菊酯
由图2可知,当组合为Ⅰ和Ⅱ时,于PSA和C18吸附剂用量较少,虽然各拟虫菊酯的回收率较高,但并通过总离子流图(total ion chromatogram,TIC)对比发现,杂质去除效果较差;当组合为Ⅲ~Ⅵ时,通过TIC图对比发现,均能达到很好的净化效果,但当随着吸附剂用量的增加,联苯菊酯的回收率降低明显。最终,在综合净化效果、满足各菊酯的回收率的同时降低实验成本,最终选择组合Ⅲ(PSA 150 mg+C18 150 mg+MgSO4 500 mg)作为净化吸附剂。
2.3 基质效应、标准曲线、检出限及定量限
以各质量浓度为30 μg/L的标液为例,分别配制基质匹配标准溶液和纯溶剂标液,并采用1.3.4中基质效应的评价公式进行基质效应评价,按1.3.4节配制基质匹配标准溶液,用GC-MS/MS检测并绘制标准曲线,其线性范围、决定系数、基质效应、检出限和定量限结果见表3。
表3 6种拟除虫菊酯的线性范围、决定系数、基质效应、检出限及定量限
Table 3 Linear ranges,determination coefficients,matrix effect,LODs and LOQs of 6 pyrethroids
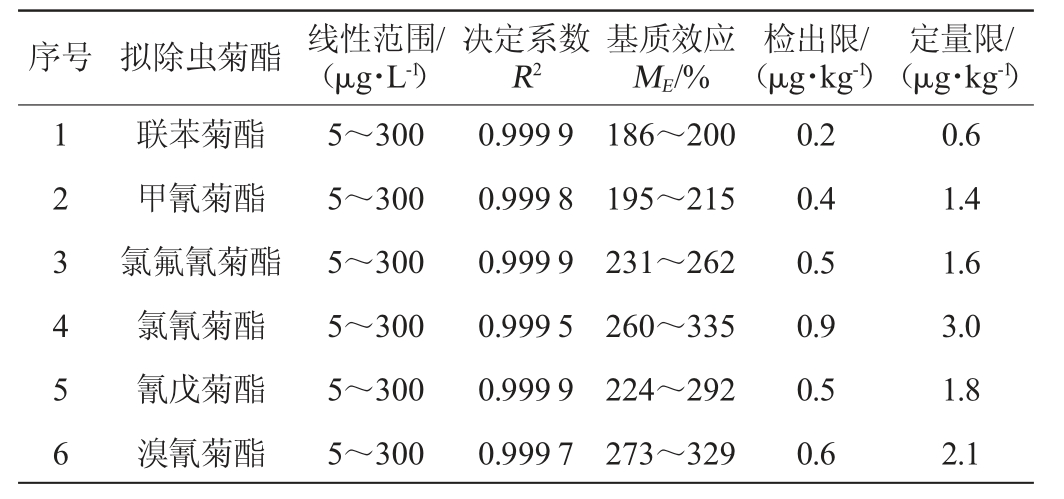
由表3可知,6种拟除虫菊酯在3种鱼肉基质中的ME在186%~335%之间,均存在较强的基质增强。为了减小基质效应的影响[28],本研究采用基质匹配标准曲线(内标法)进行定量。在线性范围内,6种菊酯的峰面积与对应的进样质量浓度间均呈良好的线性关系,决定系数R2均大于0.999 5。以被测化合物定量离子对3倍信噪比(S/N)确定的方法检出限(limit of detection,LOD),10倍信噪比(S/N)确定的方法定量限(limit of quantitation,LOQ)分别在0.2~1 μg/kg和0.6~3 μg/kg之间。
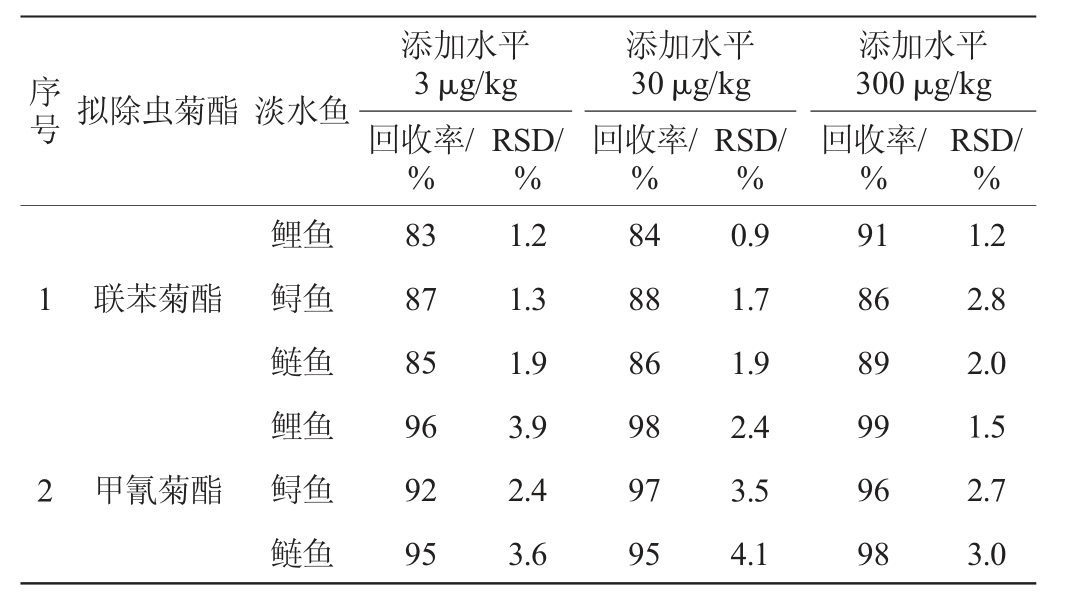
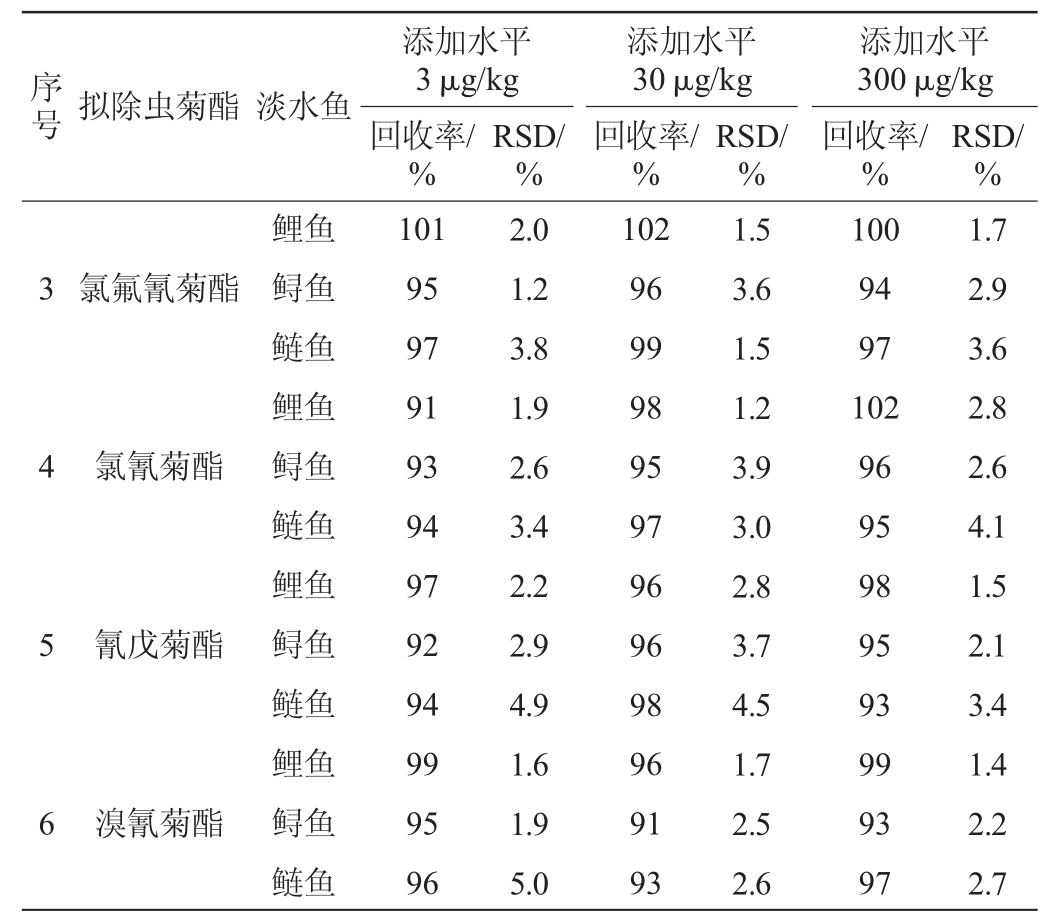
2.4 方法的精密度与加标回收率
当空白样品中添加水平分别为3 μg/kg、30 μg/kg和300 μg/kg,且每个添加水平5个平行时,测定加标回收率和相对标准偏差(relative standard deviations,RSD),结果见表4。结果表明,6种拟除虫菊酯在鱼肉中的平均回收率在83%~102%之间,相对标准偏差在0.9%~4.9%之间。表明所建立方法具有良好的准确度、精密度和重复性。
表4 6种拟除虫菊酯在淡水鱼中3个水平下的加标回收率及相对标准偏差(n=5)
Table 4 Recovery and RSD of 6 pyrethroids at three spiked levels in freshwater fish (n=5)
续表
2.5 实际淡水鱼样品中6种拟除虫菊酯的测定
从贵阳市各超市和农贸市场随机购买鲟鱼、鲢鱼、鲤鱼等30份样品,按照优化的前处理方法和色谱条件进行检测,结果均未检出6种拟除虫菊酯的残留。
3 结论
本研究通过提取溶剂和吸附剂的筛选得以优化QuEChERS前处理条件,并采取较优的GC-MS/MS条件,建立了一种快速测定淡水鱼(鲤鱼、鲟鱼、鲢鱼)中6种拟除虫菊酯残留的分析方法。本研究对基质效应进行了考察,并通过配制基质匹配标准曲线可以减少基质效应影响,从而实现了复杂基质的提取、净化浓缩与多种菊酯类残留的快速筛查及确证,能满足淡水鱼(鲤鱼、鲟鱼、鲢鱼)中6种菊酯的快速定性和定量检测,也可为其他淡水鱼肉中6种拟除虫菊酯检测提供技术支持。
[1]XU H D,MAO Y,XU B C.Association between pyrethroid pesticide exposure and hearing loss in adolescents[J].Environ Res,2020,187:109640.
[2]LAURA B,CINZIA N,DONATELLA F,et al.Early impairment of epigenetic pattern in neurodegeneration:Additional mechanisms behind pyrethroid toxicity[J].Experim Gerontol,2019,124:110629.
[3]TAPIA C M,FOLORUNSO O,SINGH A K,et al.Effects of deltamethrin acute exposure on nav 1.6 channels and medium spiny neurons of the nucleus accumbens[J].Toxicology,2020,440:152488.
[4]孙琳,肖霞,李燕,等.云南农村妇女孕早期拟除虫菊酯类农药暴露及影响因素[J].昆明医科大学学报,2018,39(6):39-43.
[5]马瑞.拟除虫菊酯类农药暴露对人群生殖系统及甲状腺和婴幼儿体格发育影响的研究进展[J].昆明医科大学学报,2019,40(3):126-130.
[6]刘永涛,何雅静,房金岑,等.动物源性水产品中兽药残留限量标准现状及对比分析[J].中国渔业质量与标准,2019,9(6):1-17.
[7]文孟棠,刘摇媛,寇莉萍,等.大白菜中拟除虫菊酯类农药残留半定量ELISA免疫检测方法的建立[J].江苏农业学报,2014,30(2):411-416.
[8]吴元元,金朵,付骋宇,等.拟除虫菊酯类农药多残留酶联免疫分析方法的条件优化[J].农药,2017,56(7):510-514.
[9]沈登辉,单晓梅,陆蓓蓓,等.固相萃取-高效液相色谱法检测水中多种拟除虫菊酯类农药[J].环境与职业医学,2013,30(1):49-52.
[10]孙晓杰,丁海燕,李兆新,等.气相色谱-电子捕获检测法测定食品中有机氯类和拟除虫菊酯类农药残留量[J].食品安全质量检测学报,2019,10(21):7283-7289.
[11]廖和菁,胡礼渊,刘瑞芳,等.气相色谱法测定坚果中8种拟除虫菊酯农药残留[J].分析测试学报,2017,36(5):669-673.
[12]李海畅,张钰萍,胡德禹,等.气相色谱法检测辣椒中7种拟除虫菊酯类农药残留[J].农药学学报,2013,15(1):117-120.
[13]田丽梅,孙志勇,向明,等.固相萃取-气相色谱法检测金银花中9种拟除虫菊酯农药残留[J].食品科学,2015,36(20):239-241.
[14]万译文,肖维,黄华伟.气相色谱法测定水产品中拟除虫菊酯类农药残留量[J].食品与机械,2010,26(5):68-70.
[15]刘会双,冯刚,刘萍,等.气相色谱-质谱法检测干辣椒中常用有机磷和拟除虫菊酯类农药的残留[J].食品安全质量检测学报,2015,6(4):1498-1503.
[16]李妍,董伟峰,王璇,等.气相色谱-质谱联用法测定糙米中9种拟除虫菊酯的残留[J].食品安全质量检测学报,2015,6(1):65-71.
[17]徐超,邹德靓,周依铂,等.气质联用-内标法检测鱼体内的醚菊酯[J].浙江工业大学学报,2020,48(5):500-503.
[18]冯永巍,许文艳,郇宇,等.超高效液相色谱-串联飞行时间质谱法测定绿茶中9种拟除虫菊酯类农药[J].食品安全质量检测学报,2020,11(11):3516-3520.
[19]张聪,周常义,江锋,等.超高效液相色谱-串联质谱法测定动物性食品中10种拟除虫菊酯类农药残留[J].分析测试学报,2018,37(8):887-893.
[20]刘丽,张琦,王海雁,等.串联双柱固相萃取-气相色谱-串联质谱法检测茶叶中拟除虫菊酯[J].色谱,2017,35(8):860-866.
[21]张艳,陈子雷,郭长英,等.气相色谱-串联质谱法测定韭菜中拟除虫菊酯类农药残留[J].食品安全质量检测学报,2021,12(4):1463-1467.
[22]ANASTASSIADES M,LEHOTAY S,STAJNBAHER D,et al.Fast and easy multiresidue method employing acetonitrile extraction/partitioning and dispersive solid-phase extraction for the determination of pesticide residues in produce[J].J AOAC Int,2003,86(2):412-431.
[23]李丽春,刘书贵,尹怡,等.气相色谱法检测水产品中拟除虫菊酯类农药的基质效应研究[J].现代食品科技,2018,34(4):270-280,220.
[24]王玉林,林婉玲,李来好,等.4目13种淡水鱼肌肉基本营养成分分析[J].食品工业科技,2019,40(11):277-283.
[25]胡芬,李小定,熊善柏,等.5种淡水鱼肉的质构特性及与营养成分的相关性分析[J].食品科学,2011,32(11):69-73.
[26]刘亚伟,董一威,孙宝利,等.QuEChERS在食品中农药多残留检测的应用研究进展[J].食品科学,2009,30(9):285-289.
[27]王慎苓,于丽,李安荣,等.QuEChERS方法在果蔬农药多残留检测中的应用[J].食品与药品,2019,21(3):231-234.
[28]张妮,王敏.气相色谱法检测农药残留过程中基质效应的研究[J].安徽农业科学,2014,42(21):7073-7075.