黄酒是中国历史经典产业之一,有着数千年的文化传承与积淀,与啤酒、葡萄酒并称为世界三大古酒。黄酒是以谷物(南方主要是糯米,北方则是黍米和玉米)为原料,经过多种混杂培养的霉菌、酵母和细菌等微生物共同作用发酵酿造而成的一种低度原酒,因其具有酒精度低、酒体丰满醇厚、营养物质丰富、风味别具一格、区域性品种繁多等特点,深受大众喜爱[1]。黄酒中含有丰富的蛋白质、氨基酸、活性肽、酚类、低聚糖、维生素、矿物质等基本营养成分以及γ-氨基丁酸、Monacolin K等具有特殊生物活性的功能性物质,并具有多种生理功效,具有极大的研究价值[2]。
近年来,代谢组学越来越广泛应用于各个领域当中,它是以生物样品中的低分子质量代谢产物如有机酸、脂肪酸、氨基酸、糖等为研究对象,通过高通量检测和数据处理,进行信息整合及生物标记物鉴定的科学[3]。代谢组学分析又分为靶向分析和非靶向分析,其中非靶向组学分析是对生物体整体的待修物进行检测,尽可能多的寻找代谢物组分,以找出造成组间明显差异的差异代谢物的研究方法[4]。目前用于代谢组学的研究分析方法主要是气相色谱(gas chromatography,GC)法、顶空固相微萃取-气质联用(headspace solid-phase microextraction-gas chromatographymass spectrometry,HS-SPME-GC-MS)法、同时蒸馏萃取气质联用(simultaneous distillation extraction-gas chromatogra phy-mass spectrometry,SDE-GC-MS)法、气相色谱-飞行时间质谱(gas chromatography-time of flight-mass spectrometry,GC-TOF-MS)法、红外光谱(infrared spectrometry,IR)法、离子迁移光谱(ion migration spectrometry,IMS)法、核磁共振(nuclear magnetic resonance,NMR)法等。其中因操作简便而广泛应用的就是顶空固相微萃取与气质联用法,但时间飞行质谱以其检测速度快、质量范围宽、离子传输率高、分辨率高、灵敏率高等优点在与色谱联用时发挥了重要的作用[5]。
目前,飞行时间质谱与气相色谱的联用分析在白酒风味中已有相关研究,而黄酒风味复杂,区域性差异明显且由于部分工艺差别其含糖量差异较大,黄酒风味代谢体系尚未明确。目前对广东客家黄酒代谢组学的研究甚少,应用飞行时间质谱分析还在探索当中,且对于不同甜黄酒代谢风味差异研究较少。因此,本研究运用非靶向代谢组学结合气相色谱-飞行时间-质谱(GC-TOF-MS)分析半干黄酒、半甜黄酒、甜黄酒三种广东客家黄酒中微量成分,对探索不同甜型黄酒风味代谢组分的异同,鉴别不同甜型黄酒,提高不同甜型广东客家黄酒品质具有重大意义,并对黄酒未来的传承与发展提供理论参考,为推动黄酒产业复兴提供动力。
1 材料与方法
1.1 材料与试剂
三种不同甜型(半干黄酒(糖度27.0 g/L,酒精度8%vol,2015年)、半甜黄酒(糖度46.4 g/L,酒精度15%vol,2018年)、甜黄酒(糖度186.2 g/L,酒精度10%vol,2018年))广东客家黄酒:市售。
L-2-氯苯丙氨酸(10 mg/mL):上海恒柏生物科技有限公司;无水甲醇、吡啶(均为色谱纯):上海Adamas有限公司;甲氧铵盐(分析纯):东京仁成工业株式会社;双(三甲基硅基)三氟乙酰胺(bis(trimethylsilyl)trifluoroacetamide,BSTFA)(含有1%(V/V)三甲基氯硅烷(trimethylchlorosilane TMCS):美国REGIS Technologies有限公司。
1.2 仪器与设备
7890B气相色谱仪、DB-5MS色谱柱(30 m×250 μm×0.25 μm):美国安捷伦公司;PEGASUS HT质谱仪:美国Leco公司;Heraeus Fresco17离心机、Forma 900 series超低温冰箱:美国Thermo Fisher Scientific公司;明澈D24 UV纯水仪:美国Merck Millipore公司;PS-60AL超声仪:深圳市雷德邦电子有限公司;DHG-9023A鼓风干燥箱:上海一恒科学仪器有限公司;LNG-T98冷冻快速浓缩离心干燥器:太仓市华美生化仪器厂。
1.3 方法
1.3.1 非靶向代谢组学-GC-TOF-MS分析黄酒代谢组分
(1)样品前处理及衍生化[6]
代谢组分提取:取黄酒样品100 μL于1.5 mL EP管中,加入300 μL无水甲醇,再加入5 μL L-2-氯苯丙氨酸,涡旋30 s,然后冰水浴超声10 min;将样品4 ℃、12 000 r/min离心15 min,小心移取50 μL上清液于1.5 mL EP管中。
(2)衍生化
在真空浓缩器中干燥提取物,向干燥后的提取物加入80 μL甲氧胺盐试剂(甲氧胺盐酸盐,溶于吡啶20 mg/mL),轻轻混匀后,放入烘箱中80 ℃孵育30 min;向每个样品中加入100 μL BSTFA(含有1%(V/V)TMCS),将混合物70 ℃孵育1.5 h,待上机检测。
1.3.2 仪器条件设置参数
色谱柱DB-5MS毛细管柱(30 m×250 μm×0.25 μm),载气为高纯度氦气(He),隔垫吹扫流速为3 mL/min,柱流速为1 mL/min,不分流模式,进样量1 μL,前进样口温度和传输线温度皆为280 ℃,柱箱升温程序:起始温度50 ℃保持1 min,以10 ℃/min升至310 ℃保持8 min,离子源温度为250 ℃,电子能量为70 eV,质量扫描范围:50~500 m/z,扫描速率12.5 spectra/s,溶剂延迟6.03 min。
1.3.3 定性定量方法
在物质定性工作中,使用了LECO-Fiehn Rtx5数据库,包括质谱匹配及保留时间指数匹配。利用内标法计算代谢组分含量(半定量),代谢组分含量的计算公式如下:
1.3.4 数据分析处理
使用ChromaTOF软件(V 4.3x,LECO)对质谱数据进行了峰提取、基线矫正、解卷积、峰积分、峰对齐等分析[7]。
2 结果与分析
2.1 不同甜型黄酒代谢组分种类和含量分析
本研究基于以上的分析条件及GC-TOF-MS的基本原则解析3种不同甜黄酒香气成分,半干黄酒、半甜黄酒、甜黄酒风味物质成分的总离子流色谱图见图1,各种风味物质成分检测结果见表1。由图1可知,3种不同甜黄酒的总离子流色谱图总体趋势大致相同,但部分物质相对含量差异较大导致其峰高差异明显。
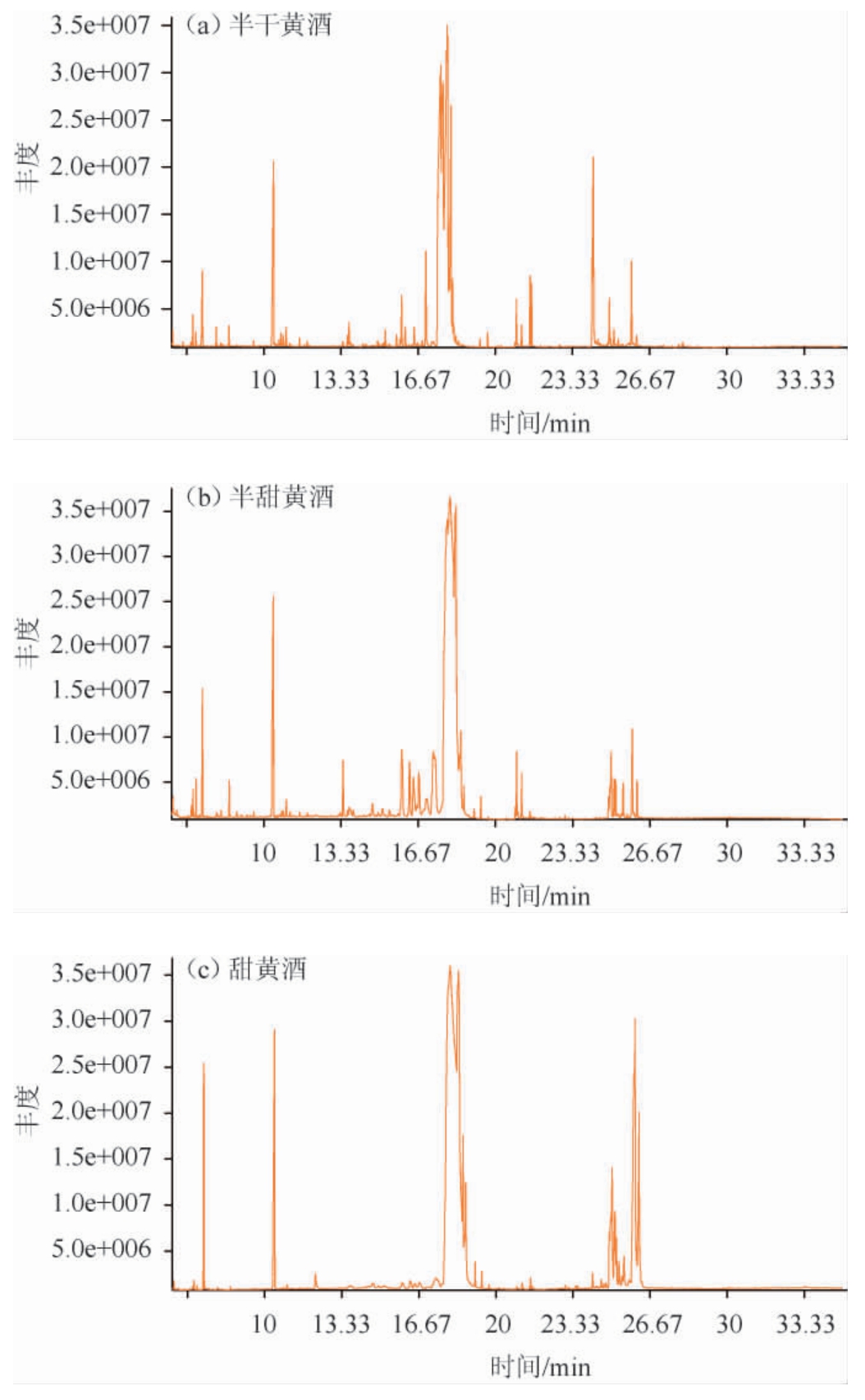
图1 不同甜型黄酒代谢组分气相色谱-飞行时间-质谱(GC-TOF-MS)分析总离子流色谱图
Fig.1 Total ion chromatogram of metabolic components in different sweet types of Huangjiu analyzed by GC-TOF-MS
表1 不同甜型黄酒的代谢组分含量测定结果
Table 1 Determination results of metabolic components contents in different sweet types of Huangjiu
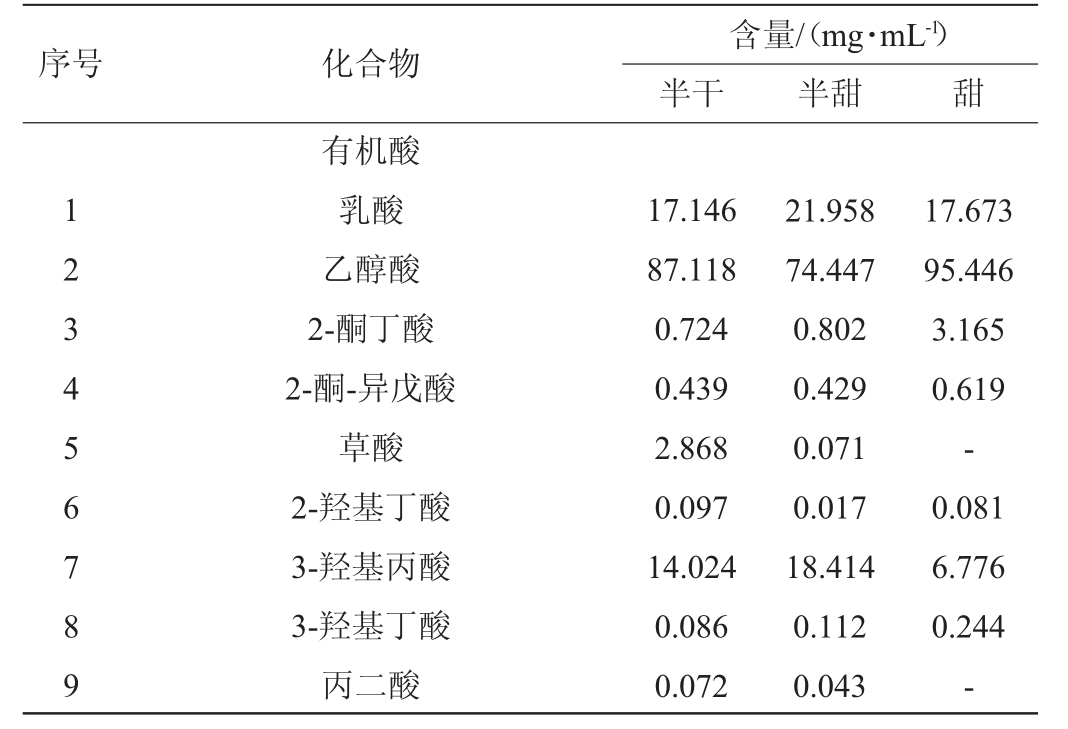
续表
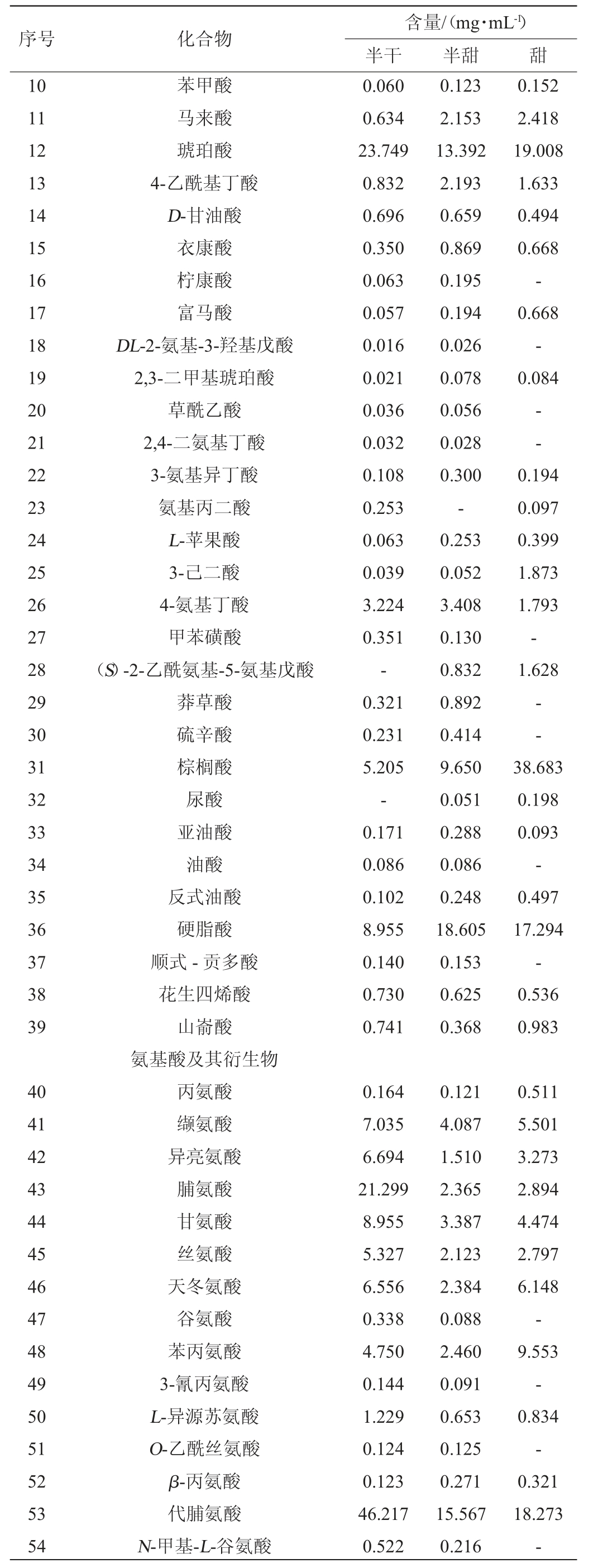
续表
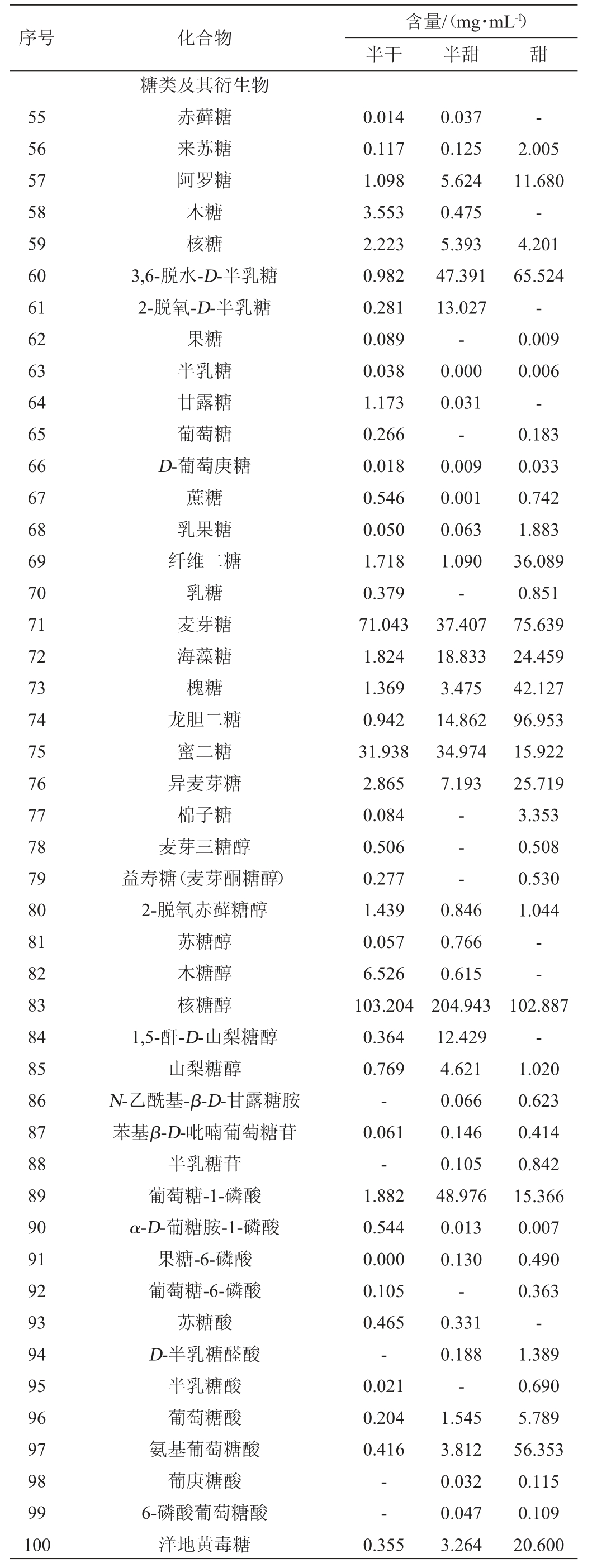
续表
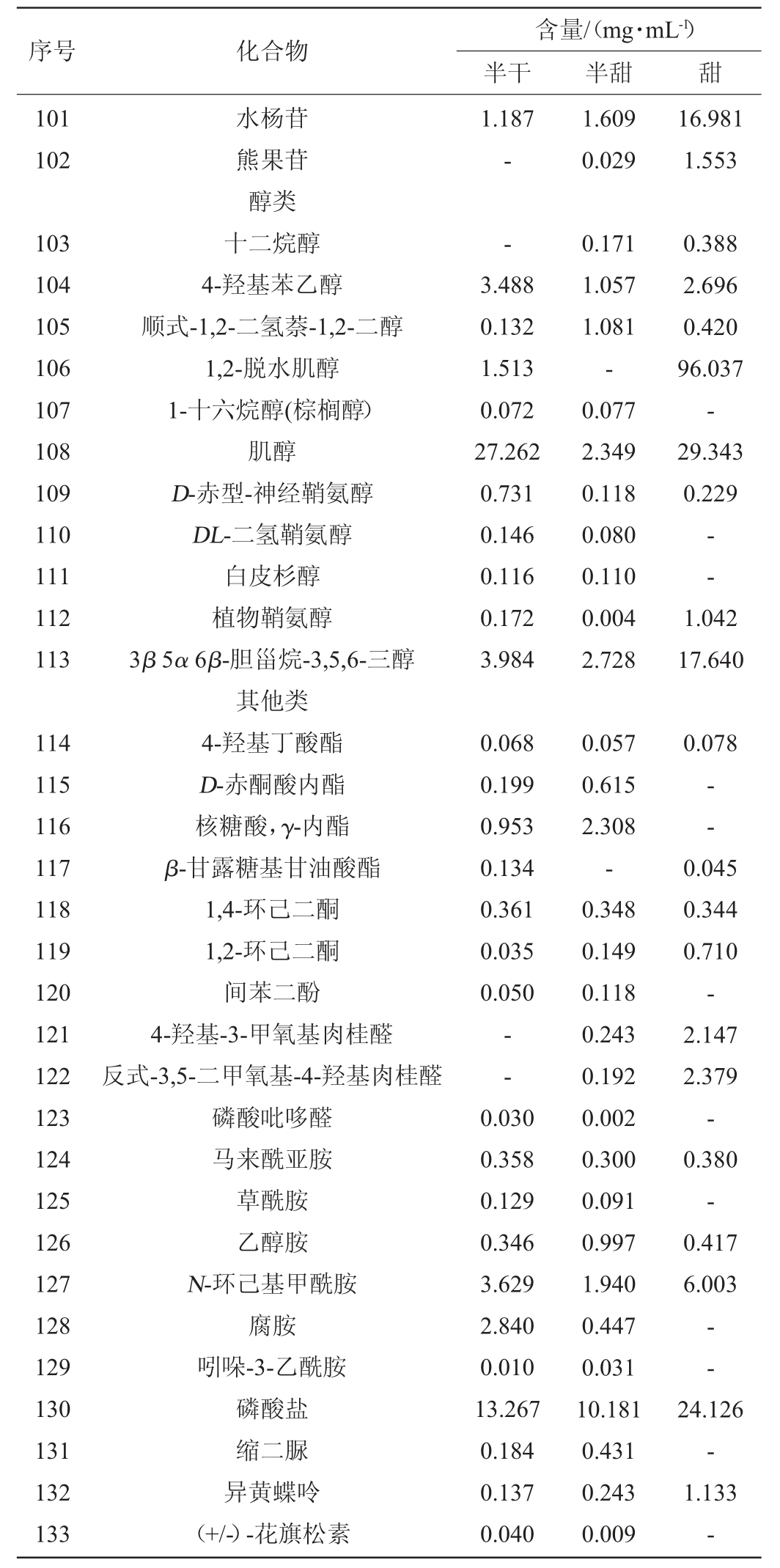
注:“-”表示未检出。
半干黄酒、半甜黄酒、甜黄酒的各代谢组分含量测定结果见表1。由表1可知,在3种不同甜黄酒中共鉴定出133种代谢组分,包括39种有机酸、15种氨基酸及其衍生物、48种糖类及衍生物、11种醇类及20种其他类。半干黄酒、半甜黄酒、甜黄酒分别共检出122种、122种、98种代谢组分。经对比分析,有76种代谢组分为3种黄酒共有,111种为半干黄酒和半甜黄酒共有,87种组分为半甜黄酒或半干黄酒和甜黄酒共有,87种组分为半干黄酒和甜黄酒共有。
3种不同甜黄酒代谢组分种类见图2。由图2可知,其中糖类及衍生物的总含量分别可达240.991mg/mL、474.522mg/mL、635.049 mg/mL,分别占总含量的41.50%、66.91%、58.34%;有机酸含量为169.834mg/mL、172.616mg/mL、213.396 mg/mL,分别占总含量的29.25%、24.34%、19.60%;氨基酸及衍生物含量分别为109.480 mg/mL、35.488 mg/mL、54.579 mg/mL,分别占总含量的18.85%、5.00%、5.01%。总的来说,半干黄酒、半甜黄酒、甜黄酒中各种类代谢组分含量区别较大。其中有机酸和糖类及其衍生物这两种代谢组分在甜黄酒中的含量多于其在半干黄酒和半甜黄酒的含量,甜黄酒以其糖量超过100 g/L而鲜甜醇厚,而大量有机酸具有抑制杂菌和呈香呈味的重要功能,两者相互作用造就甜黄酒独特鲜明的酒体风味,从含量上可看出有机酸伴随含糖量的增加也有增加的趋势。半干黄酒中氨基酸及其衍生物含量较多,其酒质厚浓丰满,且其含有的必需氨基酸含量占比居高。由于代谢组学研究以有机酸、氨基酸、糖等为主要对象,其他代谢组分对比不明显。
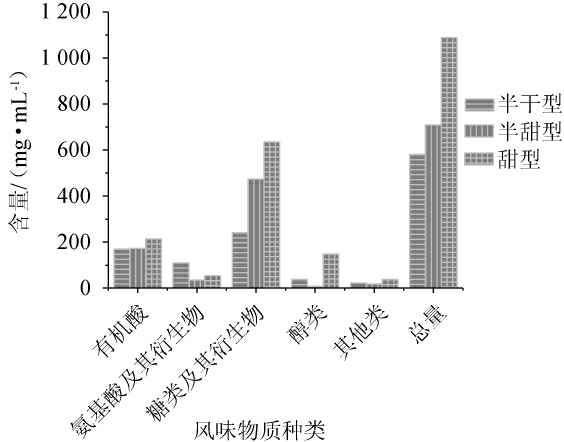
图2 不同甜型黄酒中代谢组分种类
Fig.2 Types of metabolic components in different sweet types of Huangjiu
2.2 三种不同甜黄酒中有机酸代谢组分分析
黄酒的酸度主要取决于有机酸的含量与类型,具有多种重要作用如影响酒体酸碱稳定性、抑制细菌污染生长及在储存过程中促进酯的形成等[8]。黄酒有机酸的一部分源于微生物本身,一部分源于发酵时微生物代谢过程,这些有机酸各具风味,其比例协调才能保证产品品质。半干黄酒中有机酸总量较高(29.25%>24.34%>19.60%),符合其口味酸味较强的特性。
由表1可知,3种不同甜黄酒中共鉴定出39种有机酸代谢组分,其中3种黄酒共有组分25种,包括乙醇酸、乳酸、琥珀酸、硬脂酸、棕榈酸、3-羟基丙酸、4-氨基丁酸、2-酮丁酸、苯甲酸、马来酸、衣康酸、富马酸、L-苹果酸、亚油酸、反式油酸、花生四烯酸、山嵛酸等,其中乙醇酸含量最高,乳酸、琥珀酸、硬脂酸、棕榈酸等含量较高。
在共有的有机酸组分中,乙醇酸在大自然中广泛存在如甘蔗、甜菜及未成熟的葡萄[9]等,在酱油[10]和醋[11]等发酵产品中也有发现。乳酸是由丙酮酸通过乳酸脱氢酶产生,其酸味柔和可以赋予米酒良好的风味,达到醇厚感增加、产品层次提升的目的[12]。马来酸可增强特殊果香味并改善口感,已成为食品饮料工业中的新型酸味剂。琥珀酸是三羧酸循环代谢和糖酵解的重要中间产物[13],它具有贝类特有的鲜味,其味道阈值较低且已被确定为发酵食品中的味道活性成分[14]。富马酸又名延胡索酸,味道像水果,可在肉制品等领域中作食品添加剂有调酸、抗氧化、调香和抑菌防霉等重要作用。棕榈酸、硬脂酸、亚油酸、油酸、花生四烯酸等为脂肪酸,有研究证明脂肪酸对米酒的风味形成有很大的作用[15]。而甜黄酒中棕榈酸含量达38.683 g/L,分别约为半干黄酒(5.205 g/L)、半甜黄酒(9.650 g/L)的7.43倍及4.01倍,猜测其来源于后酵过程加入的白酒,且许多研究发现棕榈酸具有众多生理功能[16],如抑制宫颈癌细胞增殖[17]及促进卵巢颗粒细胞脂质蓄积[18]等,为客家甜黄酒誉名为客家娘酒、月子酒等提供理论支持。
甜黄酒含有的有机酸代谢组分的种类最少(只有28种)但总含量最高,未检测出草酸、丙二酸、柠康酸、草酰乙酸、2,4-二氨基丁酸、甲苯磺酸、莽草酸、硫辛酸、油酸和顺式-贡多酸等有机酸,其可能原因是甜黄酒后期发酵速度缓慢导致糖代谢等反应缓慢从而造就其鲜甜的体系。在此款甜黄酒未检出的物质当中,有许多微量但具有重要保健功能的代谢组分。草酰乙酸是参与三羧酸循环的一个重要物质,它与乙酰辅酶A缩合生成柠檬酸,开始新的循环。莽草酸是莽草酸代谢途径的重要中间产物,它连接着糖代谢和多酚代谢,是合成手型药物的关键原料,也是芳香族物质生物合成过程中关键组分之一[19],其具有抗炎、镇痛作用,还可作为抗病毒和抗癌药物中间体。硫辛酸是一种天然的二硫化合物,也是存在于线粒体的辅酶,具有抗氧化、消除加速老化及致病自由基的作用,并参与关键性氧化脱羧反应,有研究[20]通过动物实验表明其对改善卵巢组织玻璃化有一定效果。
2.3 三种不同甜黄酒中氨基酸及其衍生物组分分析
氨基酸对于微生物的生长及代谢具有至关重要的作用,可作为微生物之间交叉喂养的代谢物来调控微生物之间的相互作用,进而影响体系中的微生物群落组成[21]。所以黄酒中一部分氨基酸来源于原料,一部分可能由微生物自溶产生。多种氨基酸是造就黄酒“液体蛋糕”之美誉及体现其甜、鲜、苦、涩等味感的重要原因。半干黄酒中氨基酸及其衍生物在总量上的占比明显多于其他两种黄酒,推测其他两种黄酒氨基酸含量较少的原因是发酵过程中蛋白质分解不彻底[22]。
由表1可知,三组样品中共检测出15种氨基酸及其衍生物,包括丙氨酸、脯氨酸、甘氨酸、丝氨酸、天冬氨酸、谷氨酸、缬氨酸、异亮氨酸、苯丙氨酸及其余6种衍生物等,其中4种甜味氨基酸、2种鲜味氨基酸和3种苦味氨基酸。共有组分有丙氨酸、缬氨酸、异亮氨酸、脯氨酸、甘氨酸、丝氨酸、天冬氨酸、苯丙氨酸、L-异源苏氨酸、β-丙氨酸和代脯氨酸,只有甜黄酒中未检出谷氨酸、3-氰-丙氨酸、O-乙酰丝氨酸和N-甲基-L-谷氨酸等。其中半干黄酒中脯氨酸含量(21.299 mg/mL)及代脯氨酸含量(46.217 mg/mL)皆明显高于其他两种黄酒,且半干黄酒多数氨基酸高于其他两种黄酒。猜测氨基酸含量较多的原因可能是发酵过程不被酵母等微生物利用[23];或发酵后期部分氨基酸可由糖类合成[24];有研究[25]发现黄酒中氨基酸的含量会随贮藏时间延长而增加,可能是该款半干黄酒储存时间较其他两种黄酒长,还有研究[26]表明脯氨酸、谷氨酸等是酒液沉淀蛋白的主要氨基酸。但脯氨酸同时具有较为重要的生理功能,是身体生产胶原蛋白和软骨所需的氨基酸[27],为产后妇女恢复元气提供一定帮助。
2.4 三种不同甜黄酒中糖类及其衍生物组分分析
糖类是碳源代谢的主要物质,通过糖酵解、磷酸戊糖途径和三羧酸循环(tricarboxylic acid cycle,TCA)等代谢途径为发酵微生物增殖和增长提供能量[28]。此外,糖类对酒体品质还具有一定的作用,有报道称糖的浓度会增加酒体香气物质的挥发性,且葡萄酒中糖的甜味会因为乙醇和甘油的存在而增强,不挥发性多糖和甘油可赋予干红葡萄酒致密、粘稠的感觉[29]。甜黄酒糖类组分含量最高(240.991 mg/mL),其主要原因可能是其后酵过程加入白酒而其他黄酒加入清水(一定比例[30])的原因[31],白酒极大地控制了糖化和发酵平衡使其糖类累积[32]。
由表1可知,三组样品中共检测出48种糖类及其衍生物,包括23种糖、8种糖醇、11种糖酸、4种糖苷及其他类,其中麦芽糖、海藻糖、异麦芽糖、核糖醇等含量较大。三种黄酒共有的组分包括来苏糖、阿罗糖、核糖、3,6-脱水-D-半乳糖、半乳糖、D-葡萄庚糖、蔗糖、乳果糖、纤维二糖、麦芽糖、海藻糖、槐糖、龙胆二糖、蜜二糖、异麦芽糖醇、2-脱氧赤藓糖醇、核糖醇、山梨糖醇、苯基β-D-吡喃葡萄糖苷、葡萄糖-1-磷酸、α-D-葡糖胺-1-磷酸、果糖-6-磷酸、葡萄糖酸、氨基葡萄糖酸、洋地黄毒糖、水杨苷等26种糖类及其衍生物。
甜黄酒代谢组分中核糖醇含量最高,在三种黄酒(103.204 mg/mL、204.943 mg/mL、102.887 mg/mL)分布比例约为1∶2∶1,根据有关文献得出提高酿酒酵母中的D-葡萄糖可以生产核糖醇推测其主要是酵母生长代谢过程的产物[33],而半甜黄酒葡萄糖未见检出且其他两种黄酒葡萄糖含量较少,推测可能转化为核糖醇。三种黄酒样品中以双糖含量居多,麦芽糖是鉴定出最丰富的二糖之一,还有海藻糖、槐糖、蔗糖、纤维二糖、蜜二糖、龙胆糖等。海藻糖是酵母面临高温、酒精等胁迫时会不同程度地增加的产物[34],推测客家甜黄酒后酵过程白酒的加入和炙烤是其含量达24.459 mg/mL的主要原因;且半甜黄酒酒精度较高可能是其发酵过程中产的酒精导致酵母受其胁迫海藻糖含量达18.833 mg/mL;龙胆糖是葡萄糖通过β-1,6-糖苷键组成的功能性低聚糖,推测甜黄酒中其含量达96.953 mg/mL也是葡萄糖含量较少的原因之一,海藻糖与龙胆糖等低聚糖有促进益生菌增殖等多种生理功能;纤维二糖、蜜二糖等是酒糟中常见的含量较高且未被酵母分解的糖[35]。糖的衍生物也有诸多优点,其中糖醇组分因具有较高稳定性及代谢异于普通糖类等优点广泛应用于食品加工领域[36]。糖苷类等也具有重要的药理作用,如水杨苷具有治疗发热感染、减轻关节疼痛、去除皮肤角质等药用价值[37],熊果苷具有抑制淀粉酶等降血糖活性、减轻肺纤维化症状、抑制癌细胞生长[38]。还有部分糖酸是糖类代谢中较为重要的部分中间产物,如葡萄糖-1-磷酸、葡萄糖-6-磷酸、果糖-6-磷酸、6-磷酸葡萄糖酸等[39],而葡萄糖-1-磷酸在半甜黄酒中达48.976 mg/mL,明显高于其他两种黄酒,同时从占比上看半甜黄酒糖类及其衍生物占比稍高,结果表明半甜黄酒中糖类代谢反应较为激烈。
2.5 三种不同甜黄酒中醇类及其他组分分析
由于代谢组学研究以有机酸、氨基酸、糖等为主要对象,其他代谢组分如醇类、酯类、酚类、醛类、胺类检测结果不全面,对比不明显。
醇类在维持酒类特征香气及口味方面发挥着不同的作用[40]。由表1可知,三组样品共检测出11种醇类,共有的种类有6种,分别是4-羟基苯乙醇、顺式-1,2-二氢萘-1,2-二醇、肌醇、D-赤型-神经鞘氨醇、植物鞘氨醇和3β,5α,6β-胆甾烷-3,5,6-三醇。其中肌醇是B族维生素,是细胞生长必需的营养物质,几乎存在于所有细胞中,可由D-葡萄糖-6-磷酸合成,半甜黄酒中葡萄糖-6-磷酸未被检出且肌醇含量明显低于其他两种黄酒;肌醇水溶液在35 ℃以下结晶为二水化合物,后在70 ℃可脱水为无水肌醇[41],而客家甜黄酒一般在冬季酿造且酿造后期会经过炙烤高温,其1,2-脱水肌醇含量达96.037 mg/mL。
由表1可知,其他类总有20种物质,共有8种分别是4-羟基丁酸酯、1,4-环己二酮、1,2-环己二酮、马来酰亚胺、乙醇胺、N-环己基甲酰胺、磷酸盐和异黄蝶呤。其中磷酸盐含量较大,它是几乎所有食物的天然成分之一,在干燥酵母中检测出的磷含量达1.83%,且通过添加酵母和白蛋白的效果比直接添加磷酸盐作食品添加剂的效果更好,推测磷酸盐主要来自酵母和原料米。其他组分含量较小但部分微量物质也有其突出的生理功能如4-羟基-3-甲氧基肉桂醛、(+/-)-花旗松素等。
3 结论
综上所述,三种不同甜黄酒中共检测出39种有机酸、15种氨基酸及其衍生物、48种糖类及衍生物、11种醇类及20种其他类,共同组分包括乙醇酸、乳酸、琥珀酸、硬脂酸、棕榈酸、3-羟基丙酸、4-氨基丁酸、2-酮丁酸、苯甲酸、马来酸、衣康酸、富马酸、L-苹果酸、亚油酸、反式油酸、丙氨酸、缬氨酸、异亮氨酸、脯氨酸、甘氨酸、丝氨酸、天冬氨酸、苯丙氨酸、来苏糖、阿罗糖、核糖、半乳糖、D-葡萄庚糖、蔗糖、乳果糖、纤维二糖、麦芽糖、海藻糖、槐糖、龙胆二糖、蜜二糖、异麦芽糖醇、2-脱氧赤藓糖醇、核糖醇、山梨糖醇、果糖-6-磷酸、葡萄糖酸、氨基葡萄糖酸、洋地黄毒糖、水杨苷、4-羟基苯乙醇等76种物质。
结果表明,不同广东客家黄酒代谢组分存在一定差异。半干黄酒有机酸及氨基酸含量占比较高符合其口味特性且柔和鲜爽,其中棕榈酸、脯氨酸在甜黄酒含量较大主要原因在于后酵过程加入的白酒而非一定比例的水;甜黄酒中糖含量较高但半甜黄酒中糖类及其衍生物占比较高,其中海藻糖、龙胆糖、葡萄糖-1-磷酸、核糖醇等组分差异较大,而葡萄糖含量较少,推测原因是葡萄糖参与合成海藻糖、龙胆糖等低聚糖及甜黄酒后期发酵加入的白酒抑制其糖类代谢,而半甜黄酒酿造后期糖类代谢较旺盛,其酒精度也较高。综上,导致三种黄酒代谢组分差异主要原因在于后期发酵加入的辅料的不同,酒精度及存储时间也对其有一定影响。基于试验误差和数据处理的主观性,此研究结果还需进一步验证。
[1]周家琪.黄酒生产工艺[M].北京:中国轻工业出版社,1996:1-2.
[2]刘月,祁国栋,张炳文.黄酒功能成分的研究进展[J].中国酿造,2015,34(11):27-30.
[3]王鹏飞,王倩倩,李先恩,等.GC-MS技术在延胡索块茎代谢产物研究中的应用[J].植物学报,2012,47(2):149-154.
[4]杨晓璇.基于GC-IMS和UPLC-MS/MS代谢组学技术分析不同酱油和食醋中的差异[D].济南:山东师范大学,2020.
[5]肖卫战,麦泽彬,吴曼曼,等.快速气相色谱/电子轰击离子源-飞行时间质谱联用仪的研制[J].大气与环境光学学报,2017,12(1):58-65.
[6]黄丹彤,刘晓艳,钱敏,等.基于气相色谱-飞行时间质谱分析花生油成分[J].农产品加工,2020(2):57-60,63.
[7]KIND T,WOHLGEMUTH G,LEE D Y,et al.FiehnLib:mass spectral and retention index libraries for metabolomics based on quadrupole and time-of-flight gas chromatography/mass spectrometry[J].Anal Chem,2009,81(24):10038-10048.
[8]MATO I,SUÁREZ-LUQUE S,HUIDOBRO J F.A Review of the analytical methods to determine organic acids in grape juices and wines[J].Food Res Int,2005,38(10):1175-1188.
[9]高雪莉.乙醇酸的合成工艺研究[D].天津:河北工业大学,2014.
[10]陈东,童毓敏.气相色谱法测定酱油中的有机酸[J].上海调味品,1983(1):6-8,28.
[11]李俊雯.中国四大名醋中呈味有机酸和多羟基化合物研究[D].无锡:江南大学,2019.
[12]YANG C Y,HAO R J,DU X D,et al.GC-TOF/MS-based Metabolomics studies on the effect of protein sources in formulated diet for pearl oyster,Pinctada fucata martensii[J].Aquaculture,2018,486(2):139-147.
[13]SON E Y,LEE S M,KIM M,et al.Comparison of volatile and nonvolatile metabolites in rice wine fermented by,koji,inoculated with,Saccharomycopsis fibuligera,and Aspezgillus ozyzae[J].Food Res Int,2018,109(7):596-605.
[14]ZHANG J,YI Y,PAN D D,et al.1H NMR-based metabolomics profiling and taste of boneless dry-cured hams during processing[J].Food Res Int,2019,122(8):114-122.
[15]冯德明,朱长俊,王玉洁,等.黄酒发酵过程中乳酸含量分析及变化规律的研究[J].中国酿造,2009,28(7):158-160.
[16]李其书,范怀焰,石必凤,等.董酒中健康价值生物活性物质的探讨(四)[J].酿酒科技,2020(9):119-123.
[17]周瑶瑶,陈凤云,屠文骆.棕榈酸在体外通过促进凋亡作用抑制宫颈癌Hela细胞增殖的研究[J].实用肿瘤学杂志,2019,33(5):402-406.
[18]刘琪.棕榈酸经PPARα调控SR-BI影响卵巢颗粒细胞脂质蓄积[D].衡阳:南华大学,2019.
[19]傅豪,魏旭,梁国鲁,等.茶树莽草酸代谢途径相关基因研究进展[J].分子植物育种,2021,19(2):485-493.
[20]SULCA Ñ L V,CALADO B D C,SILVA de S S,et al.Alpha lipoic acid supplementation improves ovarian tissue vitrification outcome:an alternative to preserve the ovarian function of Morada Nova ewe[J].Reprod Sci,2021,28:3109-3122.
[21]王宇乔,黄和强,王石垒,等.氨基酸对青稞酒酿造微生物群落演替及风味代谢的驱动[J].微生物学通报,2021,48(2):414-425.
[22]冯爱军.广东客家娘酒中风味物质研究[D].福州:福建农林大学,2011.
[23]JONES M,PIERCE J S.Absorption of amino acids from wort by yeasts[J].J I Brewing,1964,70(4):307-315.
[24]张巧玲,吕锡斌,秦兴,等.酱香型白酒高温大曲游离氨基酸比较分析[J].中国酿造,2019,38(4):53-57.
[25]苗雨田,杨悠悠,王浩,等.全自动氨基酸分析仪法测定不同年份黄酒中游离氨基酸的含量[J].食品安全质量检测学报,2015,6(4):1154-1161.
[26]黄雪松,陈磊.不同黄酒部位的沉淀蛋白质氨基酸组成分析[J].食品与发酵工业,2011,37(10):25-27.
[27]赵丽.蜂王浆中氨基酸含量的测定[J].食品研究与开发,2014,35(5):94-96.
[28]LEE D E,LEE S,JANG E S,et al.Metabolomic profiles of Aspeigillus ooyzae and Bacillus amyloliquefaciens during rice koji fermentation[J].Molecules,2016,21(6):773.
[29]NAVAJAS M P S,ZURBANO P F,FERREIRA V.Contribution of nonvolatile composition to wine flavor[J].Food Rev Int,2012,28(4):389-411.
[30]吕秀菊.客家黄酒文化研究[D].赣州:赣南师范大学,2016.
[31]徐艳,钟建坤,严汉彬,等.河源客家黄酒酿造工艺比较分析[J].酿酒科技,2016(7):65-66,69.
[32]洪泽淳.红曲对广东客家黄酒品质及抗氧化活性的影响[D].广州:仲恺农业工程学院,2014.
[33]TOIVARI M H,MAAHEIMO H,PENTTILA M,et al.Enhancing the flux of D-glucose to the pentose phosphate pathway in Saccharomyces cerevisiae for the production of D-ribose and ribitol[J].Appl Microbiol Biotechnol,2010,85(3):731-739.
[34]王成,战吉宬,刘兴艳,等.外源褪黑素对酿酒酵母发酵及抗氧化体系的影响[J].现代食品科技,2015,31(4):102-108,227.
[35]张梁,石贵阳,王正祥,等.利用蜜二糖的重组酿酒酵母的构建[J].食品研究与开发,2005,26(4):48-51.
[36]于广利,赵峡.糖药物学[M].青岛:中国海洋大学出版社,2012:109.
[37]李啸宇.杨树化感效应及水杨苷代谢相关基因研究[D].北京:北京林业大学,2019.
[38]孙跃.熊果苷治疗肝纤维化作用及机制研究[D].广州:广东药科大学,2019.
[39]MU Y,SU W,YU X T,et al.Untargeted metabolomics based on GCTOF-MS reveals the optimal pre-fermentation time for black glutinous rice wine[J].Int J Food Prop,2019,22(1):2033-2046.
[40]蒋洋,张翠英,李于,等.酒类风味物质对人体乙醇代谢影响的研究进展[J].食品科学,2021,42(15):242-250.
[41]林肯.肌醇对草鱼生长性能、糖脂代谢、消化和抗氧化机能的影响[D].重庆:西南大学,2018.