辣椒富含辣椒碱、辣椒红素、维生素C、矿物质、核黄素、硫胺素等成分,具有较高的营养价值[1]。发酵能够提高辣椒的营养价值和贮藏性能。我国传统的辣椒酱采用高盐发酵,再用水洗法去除多余盐分,水洗会造成辣椒维生素C等营养成分的流失。而采用接种乳酸菌发酵的方法可以弥补这些不足[2],并且乳酸菌具有促进营养吸收和调节胃肠道菌群等多种功能[3]。乳酸菌发酵果蔬能够提高其抗氧化活性、具有降血糖作用,还能提高果蔬制品的贮藏性能[4]。
目前,用于发酵果蔬的乳酸菌菌株多为来自乳制品的商用乳酸菌[5]。然而许多消费者认为商用乳酸菌发酵的蔬菜制品,会失去其传统的、特有的味道和气味[6]。开发辣椒发酵专用乳酸菌菌株对辣椒发酵工业具有重要的意义。前人对辣椒发酵微生物的研究主要集中在菌种分离纯化、辣椒发酵工艺优化、风味调配以及风味物质分析等方面。沙漠等[7-9]均从自然发酵的辣椒酱中分离出产酸量高、生长良好、耐盐性高、适用于辣椒酱发酵的乳酸菌菌株;徐清萍等[10-11]通过改变接种量、调节甜味剂用量、加盐量、发酵时间等工艺改善发酵辣椒酱品质,并采用不同乳酸菌组合发酵辣椒酱,结果表明复合乳酸菌发酵有利于降低发酵产品亚硝酸盐含量;杨玉新等[12-13]研究发现,乳酸菌和其他发酵微生物按一定比例组合形成复合菌来发酵辣椒效果更好。然而,以三樱椒(Capsicum annuum)作为原材料进行乳酸菌分离的研究尚未见报道。
本研究利用本地特色辣椒三樱椒(Capsicum annuum)进行自然发酵,采用钙溶圈法从中分离乳酸菌菌株,通过形态观察及分子生物学技术对其进行菌种鉴定,并对分离菌株的生长曲线、产酸能力和耐酸性能进行分析,以期筛选出适合三樱椒发酵的乳酸菌菌株,为三樱椒发酵工业提供后备菌株。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
辣椒:选取本校试验田中产量好、辣度高的三樱椒品系19CL75作为发酵材料。
1.1.2 培养基
MRS液体培养基[9]:蛋白胨10.0 g/L,牛肉浸膏10.0 g/L,酵母膏5.0 g/L,柠檬酸氢二铵2.0 g/L,葡萄糖20.0 g/L,吐温80 1.0 mL/L,乙酸钠5.0 g/L,磷酸氢二钾2.0 g/L,硫酸镁0.58 g/L,硫酸锰0.25 g/L,121 ℃高压蒸汽灭菌20 min。MRS固体培养基中添加琼脂粉20 g/L。
1.1.3 试剂
2×Taq Master Mix聚合酶链式反应(polymerase chain reaction,PCR)预混液、细菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒、琼脂糖(分析纯):北京索莱宝科技有限公司;蛋白胨、牛肉浸膏、酵母膏、葡萄糖、乙酸钠、磷酸氢二钾(均为生化试剂):生工生物工程(上海)股份有限公司;DL2 000 DNA Marker、6×Loading Buffer:宝生物工程(大连)有限公司。
1.2 仪器与设备
DHZ-2112恒温培养箱、HZP-150恒温振荡培养箱:上海精宏实验设备有限公司;H1650-W高速离心机:湘仪离心机仪器有限公司;UV-7502PCS紫外可见分光光度计:上海欣茂仪器有限公司;Eppendorf Mastercycler nexus PCR仪:德国Eppendorf公司;JS6800凝胶成像分析系统一体机:上海培清科技有限公司;PHSJ-3F型pH计:上海仪电科学仪器股份有限公司。
1.3 方法
1.3.1 辣椒酱发酵工艺流程
新鲜三樱椒→选择→预处理→清洗→晾干→打浆→配料→混匀→装坛→室温发酵→成品
操作要点:选择无病害无损伤的新鲜红辣椒5 kg,去除辣椒果梗,清洗干净,晾干备用。将辣椒用搅拌机打碎,同时添加5%食盐、5%白糖、4%大蒜末、6%生姜末搅拌均匀,装瓶,室温发酵20 d。
1.3.2 乳酸菌的分离纯化
取发酵完成的辣椒酱1 g加入10 mL无菌水中,混匀,用无菌水按10倍梯度稀释至10-7;取稀释好的辣椒酱液体0.2 mL,均匀涂布于含2%CaCO3的MRS固体培养基,30 ℃条件下倒置培养3 d。挑取生长较好、有溶钙圈的单菌落在MRS固体培养基上划线培养进行菌落纯化,重复纯化3次,得到单菌落,观察培养基上菌落的形态特征,并将单菌落进行革兰氏染色,于100倍的油镜下观察。
1.3.3 乳酸菌的分子生物学鉴定
挑取分离纯化后的菌株,加入5 mL MRS液体培养基,30 ℃、200 r/min条件下振荡培养24 h。采用细菌基因组DNA提取试剂盒提取基因组DNA,以其为模板,采用细菌16S rDNA引物Bak4(5'-AGGAGGTGATCCARCCGCA-3')和Bak11(5'-AGTATTGATCMTGGCTCAG-3')[14]对菌株的16S rDNA基因序列进行PCR扩增。PCR扩增体系:基因组DNA(150 μmol/L)1 μL,上下游引物(10 μmol/L)各0.3 μL,2×Taq PCR Master Mix 12.5 μL,加双蒸水(ddH2O)补充至25 μL。PCR扩增程序:94 ℃预变性3 min;94 ℃变性30 s,55 ℃退火30s,72 ℃延伸1min,35个循环;72 ℃再延伸10min。PCR扩增结束后取5 μL PCR扩增产物,采用1%琼脂糖凝胶电泳进行检测,将检测合格的PCR扩增产物送上海生工生物有限公司进行DNA测序。
将测序结果提交至美国国立生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库中,采用基本局部比对搜索工具(basic local alignment search tool,BLAST)进行序列同源性比对搜索,选取同源性较高的模式菌株的16S rDNA基因序列,采用MEGA 7.0软件中的邻接法(neighbor-joining,NJ)构建系统发育树[15]。
1.3.4 乳酸菌生长曲线的测定
将待测菌株以3%(V/V)的接种量接种于100 mL MRS液体培养基中,30 ℃、250 r/min条件下振荡培养48 h,每3 h取一次样,采用分光光度计测定发酵液在波长600 nm处的吸光度值(OD600nm值)。以培养时间(x)为横坐标,OD600nm值(y)为纵坐标绘制菌株生长曲线[16]。
1.3.5 乳酸菌产酸能力的测定
将待测菌株以3%(V/V)的接种量接种装液量为100 mL/250 mL MRS液体培养基中,30 ℃、250 r/min条件下振荡培养48 h,每3 h测定一次发酵液的pH值。
1.3.6 乳酸菌耐酸性能的测定
将待测菌株以3%(V/V)的接种量分别接种于pH值为2.0、3.0、4.0的MRS液体培养基中,30 ℃、250 r/min条件下振荡培养48 h,每5 h取一次样,采用分光光度计测OD600nm值。
2 结果与分析
2.1 辣椒酱中乳酸菌的分离和纯化
利用含有2%的CaCO3的MRS固体培养基从自然发酵辣椒酱中共分离纯化得到19株形态、颜色和大小不同、具有溶钙圈的菌株,其菌落及细胞形态见表1。
表1 分离菌株的菌落及细胞形态
Table 1 Colony and cell morphology of isolated strain

由表1可知,根据菌落及细胞形态,将19株分离菌株归为4类,菌落呈圆形,边缘整齐,呈乳白色、白色或者浅黄色;均为革兰氏阳性菌。细胞呈短杆状,单个或短链形状排列,弯曲。初步断定为乳酸菌。
2.2 分子生物学鉴定
采用1%琼脂糖凝胶对PCR扩增产物进行检测,结果见图1。
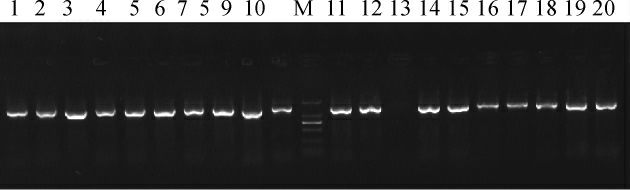
图1 19株分离菌株的16S rDNA PCR扩增产物琼脂糖凝胶电泳检测结果
Fig.1 Results of agarose gel electrophoresis of 16S rDNA PCR products of 19 isolated strains
M为DL 2 000 DNA Marker;1~12、14~20为乳酸菌16S rDNA PCR扩增产物;13为阴性对照(H2O)。
由图1可知,PCR扩增产物的碱基长度均在1 000~2 000 bp之间,与预期结果相符。基于16S rDNA基因序列构建19株菌株的系统发育树,结果见图2。
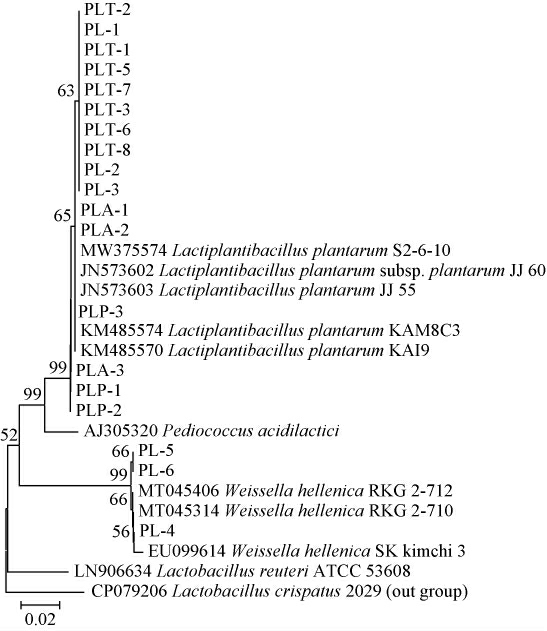
图2 基于16S rDNA基因序列19株分离菌株的系统发育树
Fig.2 Phylogenetic tree of 19 isolated strains based on the 16S rDNA gene sequences
由图2可知,菌株PLT-1、PL-1、PLP-1等16个菌株与植物乳杆菌(Lactobacillus plantarum)聚于一个分支,亲缘关系最近,菌株PL-4、PL-5、PL-6与赫轮魏斯氏菌(Weissella hellenica)聚于一个分支,亲缘关系最近,因此,鉴定菌株PL-4、PL-5、PL-6为赫轮魏斯氏菌(Weissella hellenica),其余菌株均为植物乳杆菌(Lactobacillus plantarum)。
2.3 乳酸菌菌株的生长曲线
19株菌株在MRS液体培养中的生长曲线见图3。由图3可知,16个植物乳杆菌生长情况相似,3个希腊魏斯氏菌生长情况相似。所有菌株在培养3 h时进入对数生长期,培养18 h后进入平台期。比较两个不同菌种的生长曲线发现,在培养初期3个赫轮魏斯氏菌菌株生长较快,但是培养12 h后生长速度减慢,培养18 h后这3个菌株的OD600nm值均低于植物乳杆菌菌株。说明赫轮魏斯氏菌和植物乳杆菌的生长模式不同,赫轮魏斯氏菌在培养后期生长较慢。
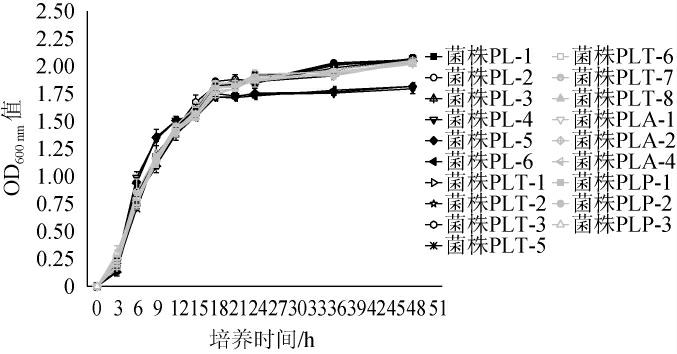
图3 19株分离菌株的生长曲线
Fig.3 Growth curves of 19 isolated strains
2.4 乳酸菌菌株产酸能力的分析
19株乳酸菌发酵过程中pH值的变化见图4。由图4可知,菌株PLP-1发酵液的pH值下降最快,其他菌株在发酵6 h前pH值下降速率相似,而发酵6 h后,菌株PL-4、PL-5、PL-6发酵液的pH值下降速度变慢,培养21 h后pH值不再下降,最终这3个菌株发酵液的pH值稳定在4.3左右,而其他植物乳杆菌菌株发酵液的pH值稳定在3.7左右。综上,植物乳杆菌的产酸能力比赫轮魏斯氏菌好,且在所有菌株中植物乳杆菌PLP-1产酸性能最好可用于辣椒酱发酵。
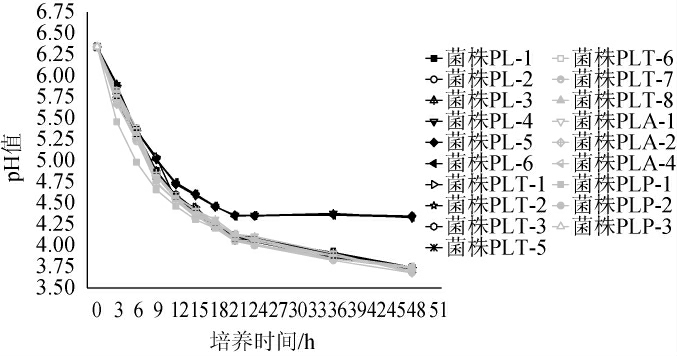
图4 19株分离菌株发酵过程中pH值的变化
Fig.4 Change of pH of 19 isolated strains during fermentation
2.5 乳酸菌菌株耐酸能力的分析
本研究分别从植物乳杆菌中挑取3株菌株(PLP-1、PLT-1和PLA-4),从赫轮魏斯氏菌中挑取2株菌株(PL-4和PL-6)进行耐酸能力分析,结果见图5。由图5可知,当pH为2.0时,5个菌株的生长均受到严重抑制;当pH值为3.0时,菌株PL-4和PL-6的生长仍然受到严重抑制,3株植物乳杆菌有所生长,OD600nm值最高达到0.6,其中植物乳杆菌PLP-1生长最好;当pH值为4.0时,两种菌的生长差异非常显著,菌株PL-4和PL-6生长仍然受到严重抑制,但3株植物乳杆菌菌株的生长较好,OD600nm值最高能达到1.2,其中植物乳杆菌PLT-1生长最好。综上所述,植物乳杆菌的耐酸性比赫轮魏斯氏菌好,且植物乳杆菌PLP-1的耐酸性最好。
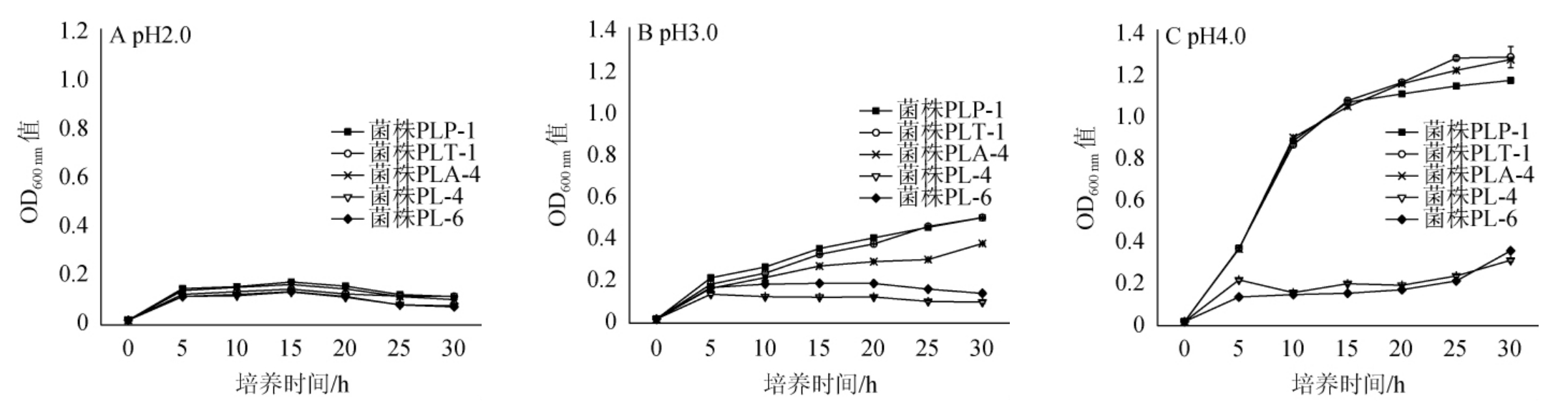
图5 5株乳酸菌菌株耐酸性的测定结果
Fig.5 Determination results of acid tolerance of 5 strains of lactic acid bacteria
3 讨论
随着生活水平的提高,人们对食品提出了更高的需求,在营养美味的前提下还要求健康。辣椒酱工业的发展也应该向更健康、更美味的方向发展。辣椒酱的研究应该集中在以下2个方面:第一,从高盐发酵向低盐发酵发展,盐分的过量不仅破坏食品的营养价值,而且影响人们的健康,因此,应该研究更健康的低盐发酵技术。第二,从自然发酵辣椒酱向人工接种发酵菌方向发展,开发出适合辣椒酱发酵的工程菌株,并且开发复合菌种发酵技术,利用乳酸菌、酵母菌等多种发酵菌来改善发酵辣椒酱的品质和风味。
本研究从自然发酵辣椒酱中分离出19株乳酸菌菌株,经分子生物学鉴定,其中,16株为植物乳杆菌(Lactobacillus plantarum),3株为赫轮魏斯氏菌(Weissella hellenica)。植物乳杆菌是革兰氏阳性菌株,菌体形态有圆端短杆状、弯杆状和链状3种,常见于泡菜、酵素和酸奶等发酵食品中,可以有效改善肠胃环境[17-18]。赫轮魏斯氏菌属于魏斯氏菌属,在食品发酵过程中的作用主要体现在两方面:一方面对食品中风味物质如有机酸、酯类及短链脂肪酸等的合成具有重要作用,另一方面魏斯氏菌属的有些菌株具有合成细菌素、低聚糖、胞外多糖和纤维素等特性,具有潜在的益生菌特性[19-21],目前,关于其在果蔬发酵中的研究报道较少。有研究表明,乳杆菌属和魏斯氏菌属均为发酵辣椒中的优势菌属[22]。目前,从辣椒发酵产品中分离得到的乳酸菌主要为植物乳杆菌[7,16,23],尚未见到从辣椒发酵产品中分离出赫轮魏斯氏菌的报道。
本研究测定了19株乳酸菌菌株的生长特性和产酸性能,结果表明,植物乳杆菌和赫轮魏斯氏菌的生长特性不同,植物乳杆菌前期生长较慢,但培养12 h后植物乳杆菌生长速度超过了赫轮魏斯氏菌,且最终OD600nm值比赫轮斯氏菌高。植物乳杆菌和魏斯氏菌的产酸性能也不同,在培养6 h前,植物乳杆菌和赫轮魏斯氏菌发酵液的pH值下降速率相似,而发酵6 h后,植物乳杆菌发酵液pH下降速率比赫轮魏斯氏菌快,最终植物乳杆菌发酵液的pH值稳定在3.5,而赫轮魏斯氏菌发酵液的pH值稳定在4.3,说明植物乳杆菌产酸能力比希腊魏斯氏菌好。耐酸性研究表明,在pH<4.0的培养基中赫轮魏斯氏菌的生长受到严重抑制,而植物乳杆菌在pH为4.0和3.0的MRS液体培养基中生长受到的抑制较小。有报道称食窦魏斯氏菌在发酵泡菜时pH下降比植物乳杆菌快,而且可以和植物乳杆菌协同作用促进泡菜的发酵,发酵产物风味更好,新增了7种挥发性物质[24],本研究结果表明发酵前期赫轮魏斯氏菌发酵液pH下降较快,但发酵后期植物乳杆菌发酵液pH下降较快。有研究表明,在果蔬发酵食品中,魏斯氏菌是发酵初期的优势菌群,并具有较高的营养价值,在发酵的后期被乳杆菌所替代[25],这与本研究结果相符。由此推测在果蔬发酵前期pH值较高,赫轮魏斯氏菌生长较快为优势菌群,随着发酵的进行,发酵液pH值逐渐降低,赫轮魏斯氏菌的耐酸能力较弱,生长变慢,植物乳杆菌的耐酸性好因此取代魏斯氏菌成为优势菌群[26]。
4 结论
采用溶钙圈法从自然发酵三樱椒中共分离出19株乳酸菌菌株,经分子生物技术鉴定,其中16株为植物乳杆菌(Lactobacillus plantarum),3株为赫轮魏斯氏菌(Weissella hellenica)。生长曲线测定结果表明,植物乳杆菌前期生长较慢,但培养12 h后生长速度优于赫轮魏斯氏菌,且最终OD600nm值比赫轮魏斯氏菌高。产酸能力分析结果表明,16株植物乳杆菌产酸能力比3株赫轮魏斯氏菌好,且植物乳杆菌PLP-1最好。耐酸性分析结果表明,16株植物乳杆菌的耐酸性比3株赫轮魏斯氏菌好,且植物乳杆菌PLP-1最好。
[1]XU X,WU B,ZHAO W,et al.Correlation between autochthonous microbial communities and key odorants during the fermentation of red pepper(Capsicum annuum L.)[J].Food Microbiol,2020,91:103510.
[2]韦宗卉.乳酸菌发酵对辣椒酱品质影响的研究[D].扬州:扬州大学,2017.
[3]THOMPSON H O,ÖNNING G,HOLMGREN K,et al.Fermentation of cauliflower and white beans with Lactobacillus plantarum impact on levels of riboflavin,folate,vitamin B 12,and amino acid composition[J].Plant Food Hum Nutr,2020,75(12):236-242.
[4]王思轩,付雪,朱雪梅,等.乳酸菌发酵果蔬研究进展[J].乳业科学与技术,2020,43(2):56-59.
[5]KLEWICKA E,MOTYL I,LIBUDZISZ Z.Fermentation of beet juice by bacteria of genus Lactobacillus sp.[J].Eur Food Res Technol,2004,218(2):178-183.
[6]PIASECKA-JOZWIAK K,ROZMIERSKA J,CHABLOWSKA B,et al.Starter cultures for lactic acid fermentation of sweet pepper,pattypan squash and tomatoes[J].Pol J Food Nutr Sci,2013,63(2):95-102.
[7]沙漠,逄焕明,古丽娜孜,等.自然发酵辣椒酱中乳酸菌的分离与鉴定[J].食品与机械,2012,28(1):35-37,143.
[8]武亚婷,杜木英,丁承焱,等.新疆地区自然发酵辣椒酱中耐盐乳酸菌的筛选鉴定[J].中国酿造,2019,38(12):43-47.
[9]钟燕青,夏延斌.自然发酵辣椒中一株乳酸菌的分离筛选及鉴定[J].农产品加工(学刊),2011(11):52-54.
[10]徐清萍,张如霞,张锋,等.影响发酵辣椒酱品质因素探讨[J].中国调味品,2019,44(6):70-72,76.
[11]徐清萍,张如霞,纵伟,等.不同组合菌发酵辣椒酱的对比研究[J].中国调味品,2019,44(5):71-74,79.
[12]杨玉新,任花,李丹.辣椒酱复合菌种发酵工艺的研究[J].中国酿造,2011,30(8):162-164.
[13]方俊,陈怡,蒋立文,等.不同菌株接入盐渍辣椒汁和干辣椒混合体系发酵风味物质的比较[J].中国酿造,2021,40(1):111-117.
[14]BARTKIENE E,LELE V,RUZAUSKAS M,et al.Lactic acid bacteria isolation from spontaneous sourdough and their characterization including antimicrobial and antifungal properties evaluation[J].Microorganisms,2019,8(1):64.
[15]TOLIENG V,PRASIRTSAK B,MIYASHITA M,et al. Sporolactobacillus shoreicorticis sp.nov.,a lactic acid-producing bacterium isolated from tree bark[J].Int J Syst Evol Micr,2017,67(7):2363-2369.
[16]叶陵,李勇,王蓉蓉,等.剁辣椒中优良乳酸菌的分离鉴定及其生物学特性分析[J].食品科学,2018,39(10):112-117.
[17]洪青,刘振民,吴正钧,等.植物乳杆菌的研究进展[J].乳业科学与技术,2017,40(6):33-37.
[18]樊龙星,张朝正,赵华.响应面法优化植物乳杆菌发酵混合蔬菜汁[J].中国调味品,2020,45(4):93-97.
[19]李文,陈银元,陈立明,等.两株魏斯氏菌的益生特性比较[J].食品与发酵工业,2019,45(15):37-43.
[20]WEERAPONG W,LAPHASLADA P,TOSUKHOWONG S,et al.Two putatively novel bacteriocins active against Gram-negative food borne pathogens produced by Weissella hellenica BCC 7293[J].Food Control,2015,55:176-184.
[21]CHEN C,CHEN X,JIANG M,et al.A newly discovered bacteriocin from Weissella hellenica D1501 associated with Chinese dong fermented meat(Nanx Wudl)[J].Food Control,2014,42:116-124.
[22]韩俊燕,赵国忠,赵建新,等.发酵辣椒细菌多样性的16S rDNA测序分析[J].中国食品学报,2018,18(5):246-251.
[23]杨剑,卿煜维,邓放明,等.传统发酵辣椒中产香乳酸菌的分离鉴定[J].食品与发酵工业,2019,45(24):58-63.
[24]张楠笛,祝林,许琴,等.食窦魏斯氏菌协同植物乳杆菌改善四川泡菜风味[J].食品科学,2020,41(14):102-108.
[25]李巧玉,方芳,堵国成,等.魏斯氏菌在发酵食品中的应用[J].食品与发酵工业,2017,43(10):241-247.
[26]刘洋,丁悦,孙劲松,等.基于高通量测序分析四川辣椒酱自然发酵过程中细菌群落结构演替规律[J].食品工业科技,2020,41(24):81-86.