随着中华人民共和国农业农村部194号公告的颁布,我国全面进入禁抗时代。益生菌因具有改善消化道内环境、促生长、提高免疫力及分泌产生多种消化酶等功能,被认为是饲用抗生素的最佳替代品[1-2]。产酸菌代谢产生的乳酸等有机酸可以在动物机体内起到酸化肠道、抑制病原菌进而治疗肠道疾病,促进动物生长和提高饲料转化率等功效,该类菌株的典型代表即乳酸菌。但乳酸菌对温度、胆盐及胃液不良环境的抵抗力较差,使其在颗粒料中的存活及畜禽益生素的应用受到了很大的限制,而芽孢菌可以代谢产生芽孢,具有耐高温、耐胆盐、耐酸等抗逆特性,芽孢菌制成的菌剂是较为理想的微生物制剂。因此筛选具有产酸能力的芽孢菌就很有必要。
凝结芽孢杆菌(Bacillus coagulans)是一类代谢可以产乳酸又可以形成芽孢的细菌[3],被美国食品药品监督管理局和美国饲料控制官员协会列入可用于饲料的安全微生物菌种名单[4],我国农业部2004年在第372号公告中批准其作为饲料添加剂使用现已广泛地应用于医药[5]、畜禽[6-8]和水产[9-10]等行业[11]。朱明明等[12]报道1日龄肉仔鸡饮水中添加108 CFU/mL的产酸芽孢杆菌BC66可提高肉仔鸡生长性能,减少死亡率,改善空肠绒毛高度和隐窝深度;柳成东等[13]报道无论是否肠毒性大肠埃希杆菌(enterotoxigenic Escherichia coli enteritis,ETEC)K88感染处理,饲用凝结芽孢杆菌均可通过平衡肠道菌群、维持肠道正常形态和缓解肠道炎症反应改善断奶仔猪生长性能。CHANG X L等[14]研究报道,饲喂产酸芽孢杆菌SCC-19可以增强鲤鱼的非特异性免疫和抗氧化能力,提高鲤鱼的生长性能。
本研究采用梯度稀释平板涂布法从散养蛋鸡肠道分离产酸性能较好的芽孢菌,并对其耐受性进行测定,筛选在消化道内可以产酸进而发挥类乳酸菌优势的菌株,从而为产酸芽孢杆菌在畜禽养殖中的具体应用提供科学依据,为替抗微生态制剂类产品的研制提供新的微生物资源。
1 材料与方法
1.1 材料与试剂
1.1.1 分离源
山东省泰安市东平县旧县乡村民散养鸡肠道内容物,取新鲜样品于无菌取样袋中,封好放入冰盒内,带回实验室于4 ℃冰箱中保存,尽快进行菌株的分离。
1.1.2 培养基
LB培养基:蛋白胨1%、酵母膏0.5%、NaCl 0.5%、葡萄糖0.2%,pH 6.8。
分离培养基:LB培养基配方添加0.5%碳酸钙。
富集培养基、种子培养基及发酵培养基配方同LB培养基。均于121 ℃灭菌20 min。
1.1.3 试剂
人工胃液:体积分数9.5%~10.5%的盐酸4.1 mL,加250 mL水稀释,使pH值达到2.0,加2.5 g胃蛋白酶,0.2 μm滤膜过滤除菌,4 ℃冰箱保存待用。
人工肠液:磷酸二氢钾3.4 g,加250 mL水溶解,用0.4%的氢氧化钠溶液调pH值至6.8,每100 mL液体中加入1 g胰蛋白酶,混匀后,0.2 μm滤膜过滤除菌,4 ℃冰箱保存待用。
2×Taq聚合酶链式反应(polymerase chain reaction,PCR)MasterMix:含Taq脱氧核糖核酸(deoxyribonucleicacid,DNA)聚合酶及脱氧核糖核苷三磷酸(deoxynucleotide triphosphate,dNTP)等,天根生化科技(北京)有限公司。
细菌基因组DNA提取试剂盒:天根生化科技(北京)有限公司。
1.2 仪器与设备
SW-CJ-2F型超净工作台:江苏通净净化设备有限公司;HPX-9082 MBE型数显电热培养箱:上海博迅实业有限公司医疗设备厂;DHZ-CA型大容量振荡器:太仓市实验设备厂;FA-1004型电子分析天平:上海太平仪器厂;LDZX-75KBS立式压力蒸汽灭菌器:上海申安医疗器械厂;LC-20A 高效液相色谱仪(high performance liquid chromatography,HPLC):日本岛津仪器有限公司。
1.3 实验方法
1.3.1 分离纯化
取适量散养鸡内容物至80 mL LB培养基中37 ℃富集培养20 h,取培养液稀释至10-6 CFU/mL,准确吸取100 μL涂布于分离培养基,37 ℃恒温静置培养48 h后,挑取培养基上具有明显透明圈的单菌落斜面保存。
1.3.2 菌株发酵液的制备
选取单菌落纯培养物接种至发酵培养基,37℃、180r/min振荡培养24 h,分别于接种后0、2 h、4 h、6 h、8 h、10 h、12 h、24 h取样测定测定发酵液的pH值,选取发酵液pH值较低的时间点进行后续试验。
1.3.3 产酸性能的测定
将发酵液5 000 r/min离心10 min,所得上清液进行液相色谱分析发酵液中乳酸、乙酸等有机酸含量检测,检测方法参照文献[15]。
1.3.4 菌株的鉴定
生理生化实验:根据分离菌的菌落和菌体形态,革兰氏染色以及生理生化反应,按《伯杰氏细菌鉴定手册》进行初步归属。
分子生物学鉴定:目的菌株接种于新鲜的LB培养基中培养20 h,试剂盒提取菌体DNA,并对其进行16S rDNA序列扩增。所用引物为通用引物:1492r/27f,1492r(5'-ggttaccttgttacgactt-3'),27f(5'-agagttgatcctggctcag-3')。体系(50 μL)为:Mixture 25 μL,上下游引物各1 μL,模板DNA 2 μL,超纯水21 μL。PCR扩增程序为:94 ℃预变性5 min,94 ℃变性1 min,52 ℃退火1 min,72 ℃延伸2 min,25个循环,72 ℃延伸10 min。PCR产物送至北京博尚生物技术有限公司进行序列测定。
登录GeneBank对菌株16S rDNA测序结果利用基本局部比对工具(basic local alignment search tool,BLAST)进行检索,并下载相关属种的16S rDNA序列,采用DNAMAN、DNAclub、MEGA3.1等软件进行同源性分析,并构建系统进化树。
1.3.5 耐酸性试验
取发酵20 h的菌液10 mL,3 000 r/min离心15 min,弃上清,将菌体用生理盐水洗涤3次,先加入生理盐水5 mL,用10 mol/L的盐酸调节乳酸菌菌悬液的pH值分别为2.0、3.0、4.0,然后用生理盐水定容至10 mL,于37 ℃处理4 h。取菌悬液,梯度稀释法计数,从而计算存活率,以pH6.0的菌液为对照。
1.3.6 耐胆盐试验
菌液按5%(V/V)的接种量分别接种于胆盐质量浓度为0.1 g/100 mL、0.3 g/100 mL、0.5 g/100 mL的LB培养基中,以不加胆盐的LB培养基为对照,37 ℃培养4 h,取样进行平板菌落计数,计算存活率。
1.3.7 人工胃肠液耐受性测定
10%(V/V)接种量接至人工胃肠液中,37 ℃、180 r/min培养4 h,取样活菌计数。
1.3.8 耐热性能测定
LB培养基接种目的菌株,37 ℃、180 r/min培养24 h,镜检芽孢率达80%取样,发酵液85 ℃处理15 min,梯度稀释活菌计数,计算热处理存活率。
2 结果与分析
2.1 散养鸡肠道内容物产酸性能较好菌株的分离
将散养鸡肠道内容物在37 ℃条件下培养后得到数个溶钙圈效果明显的单菌落,挑选透明圈较大的5个单菌落进行后续实验。
2.2 菌株发酵液的制备
将溶钙圈较大的5个单菌落接种至发酵培养基,37 ℃培养,发酵液pH变化如图1所示。
由图1可知,培养至10 h时5株菌的发酵液pH均达到最低,其中菌株DPLY-7的发酵液pH最低为5.04,取此时发酵液进行有机酸测定。分析代谢过程中有机酸的种类及含量是评价产酸菌株产酸性能最有力的依据[15]。在整个发酵过程中每隔2 h取发酵液,通过检测发酵过程中pH的变化,37 ℃培养5 h之后pH迅速降低,10 h发酵液pH到达最低点,而后发酵液pH逐渐回升,pH的升高为发酵后期芽孢的形成创造了有利条件。
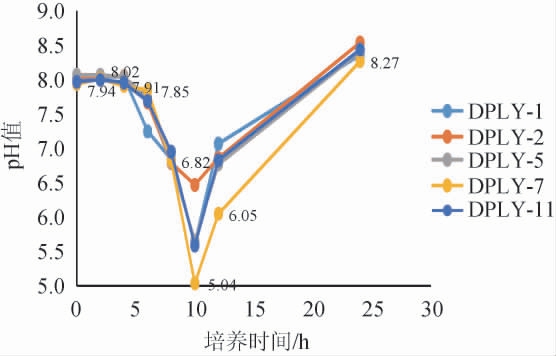
图1 5株菌发酵液pH变化
Fig.1 pH change of fermentation broth of 5 strains
2.3 5株分离菌株产酸性能测定
5株分离菌株的产酸结果见表1。
表1 5株菌产有机酸测定结果
Table 1 Determination results of organic acid production of 5 strains
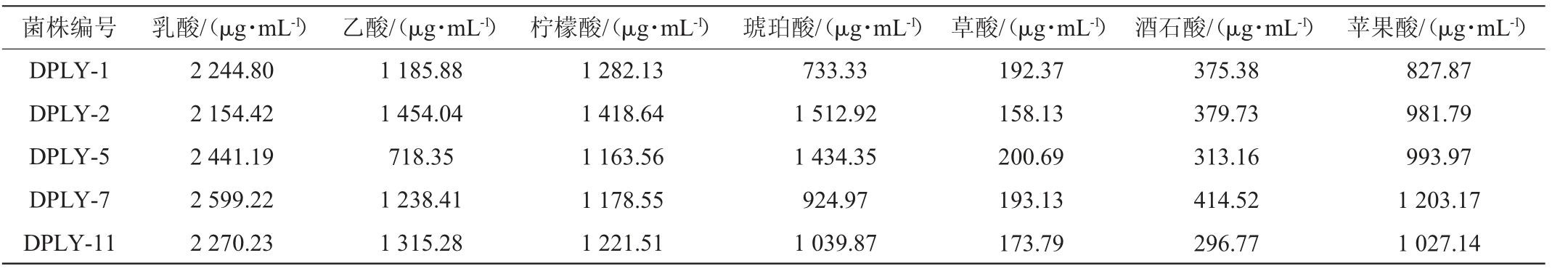
由表1可知,5株分离菌株代谢产生的有机酸主要为乳酸和乙酸,其中菌株DPLY-7产乳酸含量最高,为2 599.22 μg/mL。乳酸和乙酸对于提高饲料消化率、维持肠道有益微生物的生长繁殖同时抑制肠道致病菌、改善肠道环境具有重要的作用[15],菌株DPLY-7代谢产生有机酸的能力较强,后续实验选择该菌株进行。
2.4 目的菌株鉴定
2.4.1 菌株DPLY-7生长特性研究
将DPLY-7接种在LB培养基上,37 ℃恒温培养48 h,如图2所示,形成2~3 mm大小的圆形菌落,浅黄白色而有光泽,表面湿润、平坦,紧贴培养基,边缘整齐;油镜下观察菌体呈短杆状,芽孢一端膨大端生,革兰氏染色呈阳性。
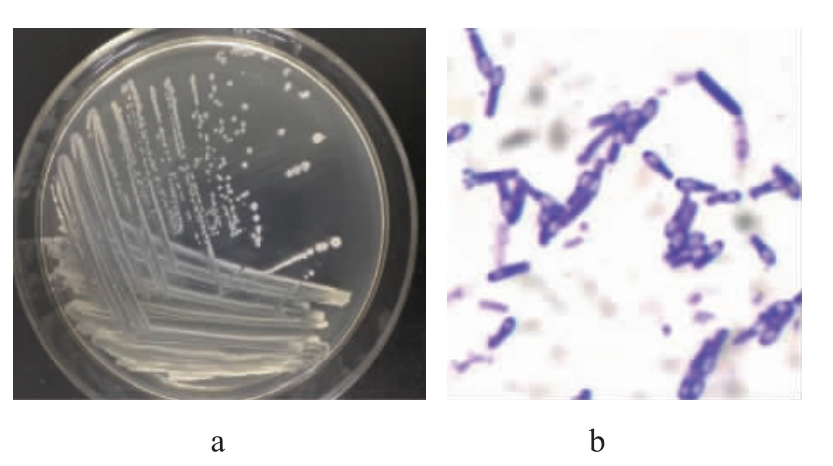
图2 菌株DPLY-7菌落(a)及菌体(b)形态
Fig.2 Morphology of colony (a) and cell (b) of strain DPLY-7
2.4.2 菌株DPLY-7生理生化实验结果
菌株DPLY-7生理生化实验结果见表2。
表2 菌株DPLY-7生理生化实验结果
Table 2 Results of physiological and biochemical experiments of strain DPLY-7

注:“+”表示阳性或能利用;“-”表示阴性或不能利用。
根据菌株DPLY-7上述生理生化实验结果(见表2)及菌落形态特征,参考《常见细菌系统鉴定手册》初步判断菌株DPLY-7为凝结芽孢杆菌(Bacillus coagulans)。
2.4.3 菌株DPLY-7的16S rDNA序列分析
菌株DPLY-7的PCR扩增产物琼脂凝胶电泳结果(图3)表明,条带在1 000~2 000 bp之间,约为1 500 bp。
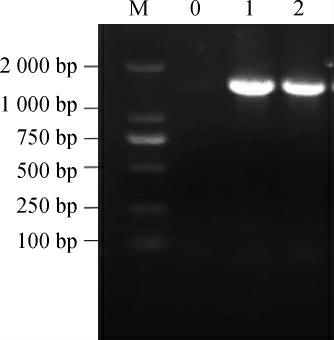
图3 菌株DPLY-7 PCR扩增产物琼脂糖凝胶电泳结果
Fig.3 Agarose gel electrophoresis results of PCR amplification products of strain DPLY-7
M为Marker DL2 000;0为阴性对照,1、2为菌株DPLY-7 PCR产物的两个重复。
菌株DPLY-7的16S rDNA序列在NCBI中进行BLAST比对分析后发现其与凝结芽孢杆菌(Bacillus coagulans)有较高的同源性(99%),从Genbank中调取并下载相似性最大和该属内其他种相关的16S rDNA,利用MEGA3.1软件的Neighboring-joining方法构建系统发育树,结果见图4。
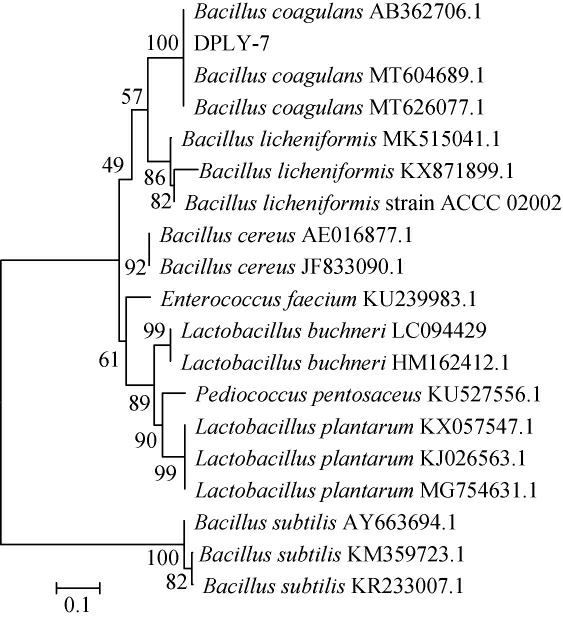
图4 基于16S rDNA基因序列菌株DPLY-7的系统发育树
Fig.4 Phylogenetic tree of strain DPLY-7 based on 16S rDNA gene sequences
由图4可知,菌株DPLY-7与凝结芽孢杆菌(Bacillus coagulans)自然聚为一支,经过同源性比对发现,菌株DPLY-7与凝结芽孢杆菌(Bacillus coagulans)。16S rDNA序列同源性超过99%。一般来讲,在种分类等级上,如果2个分类单位间的16S rDNA序列同源性>97.5%,则认为属于同一个种[17-18]。综合菌株DPLY-7的生理生化特点及16S rDNA系统进化分析,确定该菌株为凝结芽孢杆菌(Bacillus coagulans)。
2.5 菌株DPLY-7耐受性测定
2.5.1 耐胆盐性能测定
由图5可知,菌株DPLY-7在胆盐浓度为0.1%环境中存活率为97.83%,接近100%,随着胆盐浓度的增大,存活率明显下降,在胆盐浓度为0.3%时,存活率为53.57%;在胆盐浓度为0.5%时,存活率仍可达到42.86%。益生菌只有能耐受一定的胆盐浓度,才能在肠道内定殖[19],由此可以看出,菌株DPLY-7具一定的耐胆盐效果。
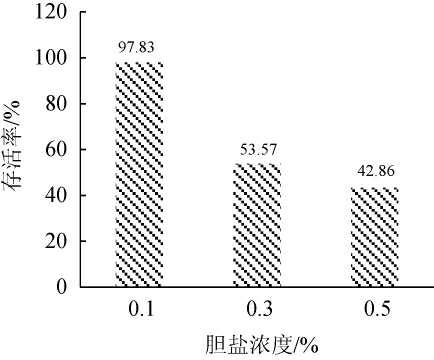
图5 菌株DPLY-7胆盐耐受性测定结果
Fig.5 Determination results of bile salt tolerance of strain DPLY-7
2.5.2 耐酸性能测定
由图6可知,菌株DPLY-7在pH2.5、pH3.5、pH4.5的条件下作用4 h,存活率分别为79.76%、94.05%、98.81%,表明该菌株对低pH具有一定耐受性。
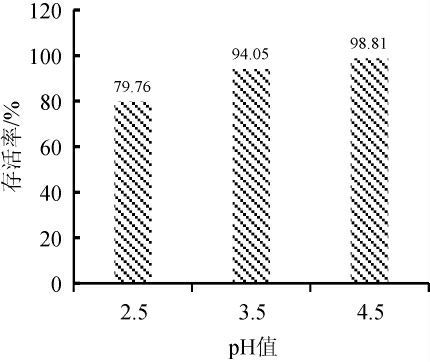
图6 菌株DPLY-7酸耐受性测定结果
Fig.6 Determination results of acid tolerance of strain DPLY-7
2.5.3 人工胃肠液耐受性测定
37 ℃、180 r/min条件下作用4 h检测目的菌株对人工胃、肠液耐受性,结果见图7。
由图7可知,菌株DPLY-7对人工胃液耐受性较好,作用4 h存活率为89.96%,这与MAJEED M等[20]报道的凝结芽孢杆菌MTCC 5856可耐受pH2.0人工胃液结果一致;人工肠液作用4 h存活率为194.42%,这与吴振超等[21]报道的芽孢杆菌耐受性趋势一致。
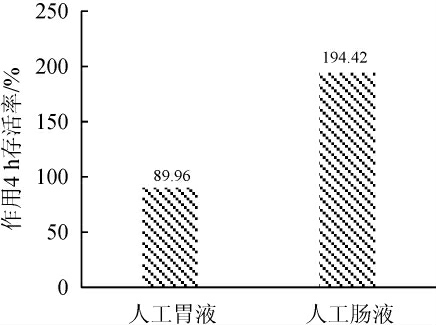
图7 菌株DPLY-7在人工胃肠液中存活率测定结果
Fig.7 Determination results of survival rate of strain DPLY-7 in artificial gastric and intestinal fluid
胃肠道作为动物消化吸收的重要器官,其微生物区系的平衡对维持动物机体的健康起着重要的作用。益生菌经口服进入动物机体,必须先经过胃然后到小肠定殖,因此,益生菌只有能够抵抗较强的酸性环境和较高浓度的胆盐才能使其在肠道中存活和正常发挥作用[22]。本研究分离筛选的凝结芽孢杆菌DPLY-7具有良好的耐酸、耐胆盐及人工胃肠液耐受性,可顺利通过胃进入小肠发挥作用,提高动物机体性能[23],具有广阔的应用前景[24]。
2.5.4 耐热性能测定
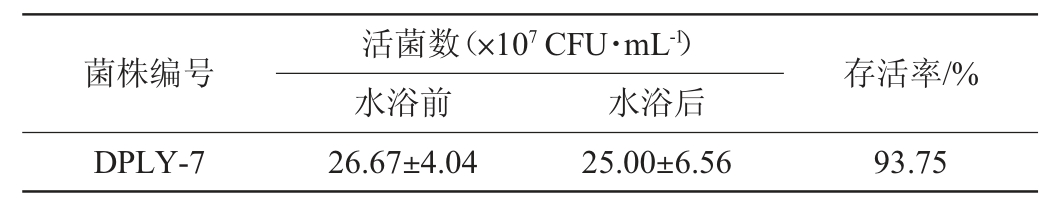
由表3可知,菌株DPLY-7发酵液85 ℃水浴处理15 min后活菌数存活率为93.75%。饲用芽孢菌大多数情况下添加到饲料中才能广泛的应用到养殖一线,颗粒料制粒温度一般为85 ℃瞬时冷却[25],本研究菌株经85 ℃作用15 min,活菌数损失较少,说明该菌株能克服市场上大多数益生菌不耐热的缺点,具有良好的市场应用前景。
表3 菌株DPLY-7热耐受性测定结果
Table 3 Determination results of heat tolerance of strain DPLY-7
3 总结
本研究从散养鸡肠道内容物分离筛选到一株产酸性能较好的凝结芽孢杆菌(Bacillus coagulans)DPLY-7。37 ℃培养10 h发酵液pH最低为5.04,经高效液相色谱检测其代谢产物有机酸主要为乳酸、乙酸,其含量分别为2 599.22 μg/mL,1238.41μg/mL。菌株DPLY-7具有良好的低pH、胆盐、人工胃肠液及热耐受性,是一株具有快速产酸性能优越的益生菌。
[1]董秋月,陈檬燕,辛杨,等.益生菌的筛选及安全性研究进展[J].食品研究与开发,2012,33(10):228-232.
[2]李雯静,肖运才,毕丁仁,等.畜禽用益生菌的研究进展[J].中国医药科学,2013(6):37-39.
[3]MANDEL D R,EICHAS K,HOLMES J.Bacillus coagulans:a viable adjunct therapy for relieving symptoms of rheumatoid arthritis according to a randomized,controlled trial[J].BMC Complement Altern Med,2010,10:1.
[4]NYANGALE E P,FARMER S,CASH H A,et al. Bacillus coagulans GBI-30,6086 modulates Faecalibacterium prausnitzii in older men and women[J].J Nutr,2015,145(7):1446-1452.
[5]ROSA M L,BOTTARO G,GULINO N,et al.Prevention of antibioticassociated diarrhea with Lactobacillus sporogens and fructo-oligosaccharides in children.A multicentric double-blind vs placebo study[J].Minerva Pediatr,2003,55(5):447-452.
[6]ADAMI A,CAVAZZONI V.Occurrence of selected bacterial groups in the faeces of piglets fed with Bacillus coagulans as probiotic[J].J Basic Microbiol,1999,39(1):3-9.
[7]周映华,吴胜莲,胡新旭,等.不同芽孢杆菌对断奶仔猪生产性能的影响[J].饲料工业,2012,33(3):21-23.
[8]黄世猛,黄楚然,赵丽红,等.凝结芽孢杆菌对感染沙门氏菌蛋鸡生产性能、蛋品质和血浆生化指标的影响[J].动物营养学报,2017,29(12):4534-4541.
[9]袁丰华,林黑着,李卓佳,等.凝结芽孢杆菌对尖吻鲈的生长,消化酶及非特异性免疫酶的影响[J].上海海洋大学学报,2010,19(6):792-797.
[10]江永明,付天玺,张丽,等.微生物制剂对奥尼罗非鱼生长及消化酶活性的影响[J].水生生物学报,2011,35(6):998-1004.
[11]孙彦婷,康宇,李向辉,等.凝结芽孢杆菌在动物生产中的研究进展及应用[J].饲料研究,2021(17):145-148.
[12]朱明明,潘晶晶,柯轲.凝结芽孢杆菌BC66对沙门氏菌攻毒肉仔鸡生长性能、空肠绒毛结构及肠黏膜免疫的影响[J].中国饲料,2021(15):146-150.
[13]柳成东,肖明霞,赵平,等.饲用凝结芽孢杆菌对感染产肠毒素大肠杆菌K88断奶仔猪生长性能和肠道健康的影响[J].动物营养学报,2021,33(8):4373-4383.
[14]CHANG X L,CHEN Y Y,FENG J C,et al.Amelioration of Cd-induced bioaccumulation,oxidative stress and immune damage by probiotic Bacillus coagulans in common carp (Cyprinus carpio L.)[J].Aquacult Rep,2021,20:100678.
[15]张建梅,胡顺珍,穆熙军,等.一株具有产酸能力的芽孢杆菌的筛选及性能检测[J].家畜生态学报,2012,33(1):66-72.
[16]刘敏,张丽香,牛天贵.产酸芽孢杆菌的筛选及鉴定[J].山西农业大学学报(自然科学版),2008(1):26-29.
[17]CLAYTON R A,SUTTON G,JR P S H,et al.Intraspecific variation in small-subun it 16S rRNA sequences in GenBank:why single sequences may not adequately represent prokaryotic taxa[J].Int J Syst Bcateriol,1995,45(3):595-599.
[18]KOLBERT C P,P ERSNG D H.Ribosomal DNA sequencing as a tool for identification of bacterial pathogens[J].Curr Opin Microbiol,1999,2(3):229-305.
[19]CHOU L S,WEIMER B.Isolation and characterization of acid and biletolerant isolate from strains of Lactobacillus acidophilus[J].J Dairy Sci,1999,82(1):23-31.
[20]MAJEED M,MAJEED S,ARUMUGAM S,et al.Comparative evaluation for thermostability and gastrointestinal survival of probiotic Bacillus coagulans MTCC 5856[J].Biosci Biotechnol Biochem,2021,85(4):962-971.
[21]吴振超,陈玉珂,高永生,等.一株黄金鲫鱼源蜡状芽孢杆菌的筛选、鉴定及耐性研究[J].大连海洋大学学报,2020(4):1-14.
[22]辛国芹,辛国民,徐海燕,等.一株植物乳杆菌的分离鉴定及特性研究[J].江西农业学报,2012,24(8):77-80.
[23]向阳,胡鲲,方曙光,等.凝结芽孢杆菌BC66对团头鲂脏器组织形态及血清生化指标的影响[J].中国饲料,2021(19):145-149.
[24]孙彦婷,康宇,李向辉,等.凝结芽孢杆菌在动物生产中的研究进展及应用[J].饲料究,2021(17):145-148.
[25]乔欣君.凝结芽孢杆菌的生物学功能特性及其在动物生产中的应用[J].饲料研究,2021(16):151-153.