大曲是以小麦(或配有大麦、豌豆)为主要原料,自然接种网罗环境微生物,在人工控制的温度和湿度下培育而成[1]。大曲作为富含多酶多菌的微生物发酵制剂,在白酒的酿造过程中起着糖化、生香、发酵、提供菌源的作用,故酿酒行业素有“曲为酒之骨”之说[2-3]。
大曲中含有大量的微生物,主要包括细菌、霉菌和酵母菌,是白酒发酵生产过程中的关键基础微生物[4]。霉菌的主要功能是分泌糖化酶、液化酶及蛋白酶,能够分解酿酒原料中的淀粉、蛋白质等大分子物质,经过一系列复杂的生化反应产生种类众多的芳香类物质[5],为后续酒体风味的形成奠定基础[6];酵母菌主要包括产酒酵母和产酯酵母,产酒酵母多属于酿酒酵母属,主要影响产酒率,为白酒发酵提供动力[7],产酯酵母具有产酯能力,能够增加酒体的酯含量,赋予酒舒适的香气[8-9]。细菌种类繁多,补充并丰富了霉菌的酶系,是产生有机酸、酯类、酮类等风味物质和酚、黄酮等功能活性物质的主要贡献者[5]。不同的微生物各司其职,对白酒的酿造也起着不同的作用。
近年来,关于微生物群落多样性的研究很多,大多采用传统可培养方法、聚合酶链式反应-变性梯度凝胶电泳(polymerase chain reaction-denaturing gradient gel electrophoresis,PCR-DGGE)、脱氧核糖核酸(deoxyribonucleic acid,DNA)克隆文库,其中利用传统方法分离到的微生物在种类和数量上有限[10];PCR-DGGE、DNA克隆文库等方法存在测序量有限、工作量大、灵敏度不高,且仅对群落中主要成分比较敏感等缺陷[11],而高通量测序技术具有测序时间短、测序通量高的优势,为准确揭示微生物菌群的多样性提供了强有力的手段,能够充分展示微生物菌群的多样性[12],因此,已被广泛用于分析酿酒微生物的群落组成[13-14]。
培养成熟的新鲜大曲需经一段时间的储存才能投入使用[15],储存期间发生多种生化反应,使得微生物区系结构、酶系结构、物系结构都会发生重大变化,是重要的后熟过程[16]。适当的储存对于大曲的质量提升有着极其重要的作用[17];但储存期过长,容易导致曲虫危害,增加损耗和库存成本[18-19]。在实际生产中,大曲储存时间都是凭借经验进行操作的,具有一定风险。目前,对于大曲不同储藏期的微生物多样性研究较少,因此,本研究利用Illumina Miseq高通量测序技术对不同储藏期赊店老酒大曲的微生物群落多样性进行分析,解析储藏过程中不同微生物的群落组成及差异,完善浓香型白酒大曲微生物数据库,为改善大曲储藏时间以提高后续白酒酿造工艺提供理论依据。
1 材料与方法
1.1 材料与试剂
大曲:河南赊店老酒股份有限公司;Fast DNA SPIN Kit for Soil:美国MP Biomedicals公司;产物回收试剂盒:天根生化科技有限公司;Trans DNA 15Kmarker、DNA聚合酶AP221-02:北京全式金生物技术公司;聚合酶链式反应(polymerase chain reaction,PCR)缓冲液、脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphates,dNTPs)混合液、真菌扩增引物SSU0817F和1196R、细菌扩增引物338F和806R:美吉生物医药科技(上海)有限公司。
1.2 仪器与设备
Julabo TW12恒温水浴锅:优莱博技术(北京)有限公司;Nano Drop 2000紫外可见分光光度计、ST16R高速冷冻离心机、PICO17小型台式离心机:赛默飞世尔科技(中国)有限公司;GeneAmp 9700型PCR仪:美国ABI公司;Quanti Fluor-ST DNA定量仪:美国Promega公司;Illumina Miseq高通量测序仪:美国Illumina公司。
1.3 试验方法
1.3.1 样品采集
3月龄(A)、6月龄(B)、9月龄(C)三个储藏时期的大曲分别按堆垛层的上中下取3个平行样本进行五点取样,粉碎混匀后,做好标记,用无菌袋密封-20 ℃保存备用。
1.3.2 大曲微生物总DNA提取及PCR扩增
根据Fast DNA SPIN Kit for Soil说明书进行总DNA抽提,DNA浓度和纯度利用NanoDrop2000进行检测,利用1%琼脂糖凝胶电泳检测DNA质量。
以提取的总DNA为模板,采用SSU0817F(5'-TTAGCATGGAATAATRRAATAGGA-3')、1196R(5'-TCTGGACCTGGTGAGTTTCC-3')为引物对真菌的18S rDNA基因序列进行PCR扩增,采用338F(5'-ACTCCTACGGGAGGCAGCAG-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3')为引物对细菌的V3~V4可变区基因序列进行PCR扩增。PCR扩增体系均为:5×FastPfu缓冲液4 μL,2.5 mmol/L dNTPs2μL,正向引物(5μmol/L)0.8μL,反向引物(5μmol/L)0.8 μL,FastPfu聚合酶0.4 μL,DNA模板10 ng,补加双蒸水(ddH2O)至20 μL。PCR扩增程序:95 ℃预变性3 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s,共30个循环;最后72 ℃延伸10 min。PCR扩增结束后,采用2%琼脂糖凝胶电泳检测PCR扩增产物,检测合格后,使用2%琼脂糖凝胶回收PCR扩增产物,利用AxyPrep DNA Gel Extraction Kit进行纯化,Tris-HCl洗脱,再用2%琼脂糖凝胶电泳检测。利用QuantiFluorTM-ST进行检测定量。
1.3.3 高通量测序与数据分析
文库的建立和高通量测序由上海美吉生物医药科技有限公司完成。
原始测序序列使用Trimmomatic软件质控,使用Flash软件进行拼接;使用的Uparse软件,根据序列相似度>97%进行操作分类单元(operational taxonomic unit,OTU)[20]聚类;使用Uchime软件剔除嵌合体。利用核糖体数据库项目(ribosomal database project,RDP)classifier对每条序列进行物种分类注释,比对Silva数据库(SSU123),设置比对阈值为70%。基于OTU聚类分析,通过Mothur(v1.30.2)软件计算每个样品的α多样性指数,包括Shannon指数、Simpson指数、Chao 1指数等反映酒曲样品中的微生物菌群的丰富度和多样性[20]。
2 结果与分析
2.1 不同储藏期浓香型白酒大曲高通量测序及α多样性分析结果
Illumina Miseq高通量测序结果通过质控和过滤后得到优质序列,根据序列相似度>97%聚类得到OTU数,并对测序结果进行α多样性分析,结果见表1。
表1 浓香型白酒大曲高通量测序及α多样性分析结果
Table 1 Results of high-throughput sequencing and α diversity analysis of strong-flavor Baijiu Daqu
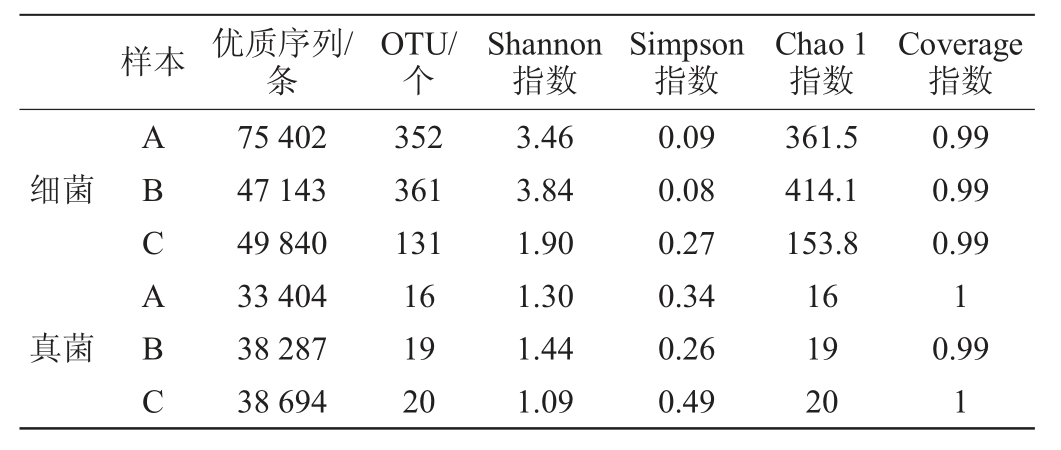
由表1可知,从3个大曲样品共获得细菌优质序列172385条,平均碱基长度为443 bp;共获得真菌优质序列110 385条,平均碱基长度为401 bp。将所有序列按照97%的相似性进行OTU聚类分析,在聚类过程中去除嵌合体,共得到了605个细菌OTU和26个真菌OTU。储藏期不同,OTU数目也有所不同。α多样性分析是用来表征某个特殊区域或者生态环境中的物种多样性,常包括香农(Shannon)指数、辛普森(Simpson)指数和超1(Chao 1)指数等[20]。其中Shannon值越大,说明群落多样性越高,Chao 1指数常用来估计物种总数,其值越大,物种丰富度越高,而Simpson指数值越大,其物种多样性越低[21]。由表1亦可知,6月龄大曲样品的Shannon指数、Chao 1指数均达到最大值,而Simpson指数处于最小值,说明6月龄大曲样品的群落多样性和物种丰富度最高。为考察本次试验取样及测序深度合理,绘制浓香型白酒大曲样品细菌及真菌微生物的Shannon指数曲线,结果见图1。
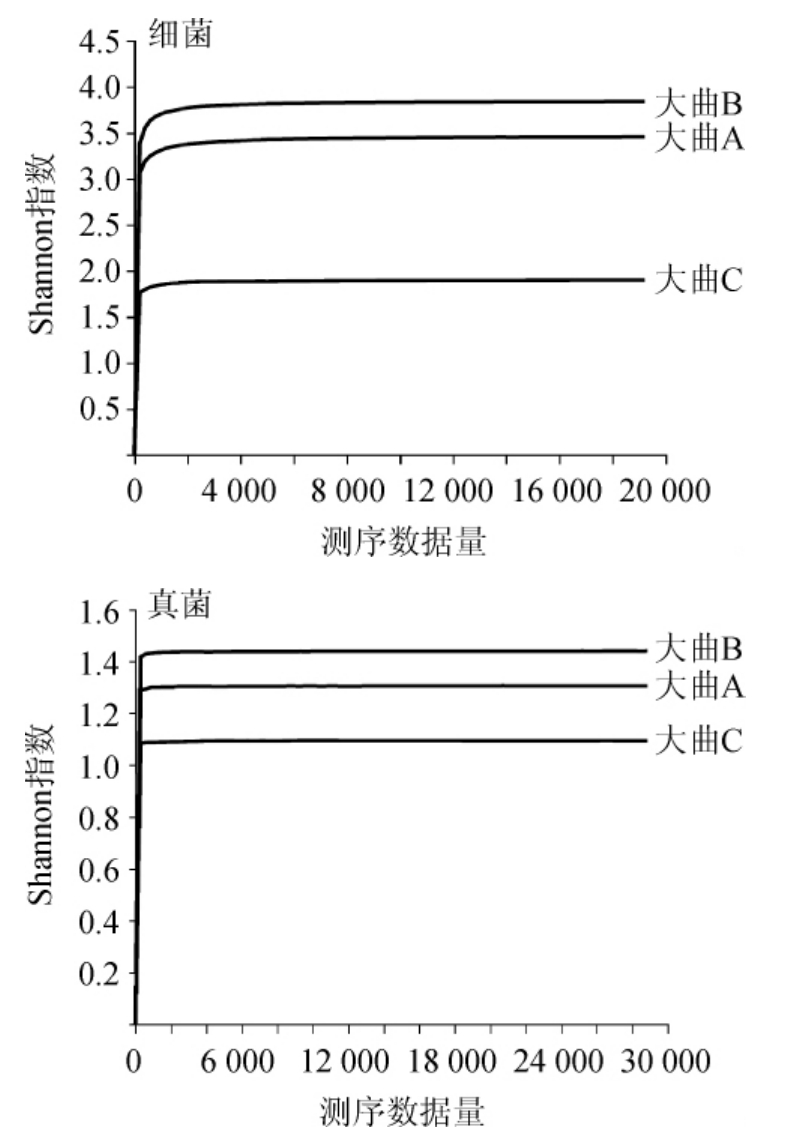
图1 浓香型白酒大曲样品的Shannon指数曲线
Fig.1 Shannon index curve of strong-flavor Baijiu Daqu samples
由图1可知,各个样品随着测序数量的增加,其Shannon指数稀释曲线趋于平坦,且表1中的Coverage指数均>0.99,由此可知本次试验取样及测序深度合理,结果能够代表所有样本微生物的真实菌群情况。
2.2 OTU分布的Venn图
Venn图可以用来统计多个样本中所共有和独有的物种数目,可以比较直观的表现样本在OTU水平上的组成相似性及重叠性,不同储藏期浓香型白酒大曲样品OTU的Venn图见图2。
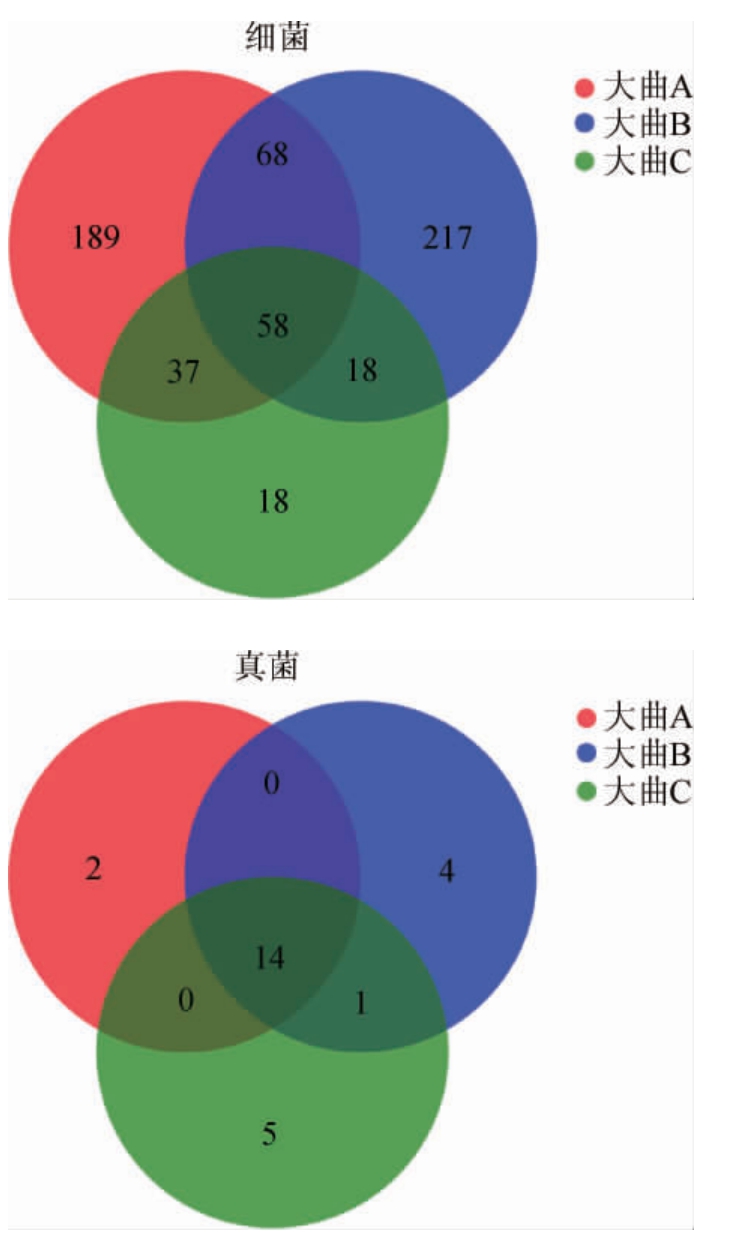
图2 不同储藏期浓香型白酒大曲样品OTU的Venn图
Fig.2 Venn diagram of OTU of strong-flavor Baijiu Daqu samples in different storage periods
由图2可知,从3个大曲样品中共获得605个细菌,其中共有的OTU数目为58个,占OTU总数的9.5%,3月龄与6月龄独有的OTU数目均接近其总OTU半数,而9月龄独有的OTU数目较少;共获得26个真菌OTU,其中共有的OTU数目为14个,占OTU总数的54%,即所代表的真菌物种长期存在于不同储藏期的大曲中。通过Venn图可以看出,不同储藏期的大曲所含有的微生物种类存在差异性。
2.3 不同储藏期浓香型白酒大曲微生物菌群结构分析
2.3.1 基于门水平不同储藏期浓香型白酒大曲微生物菌群结构分析
基于门水平不同储藏期浓香型白酒大曲微生物菌群结构分析结果见图3。
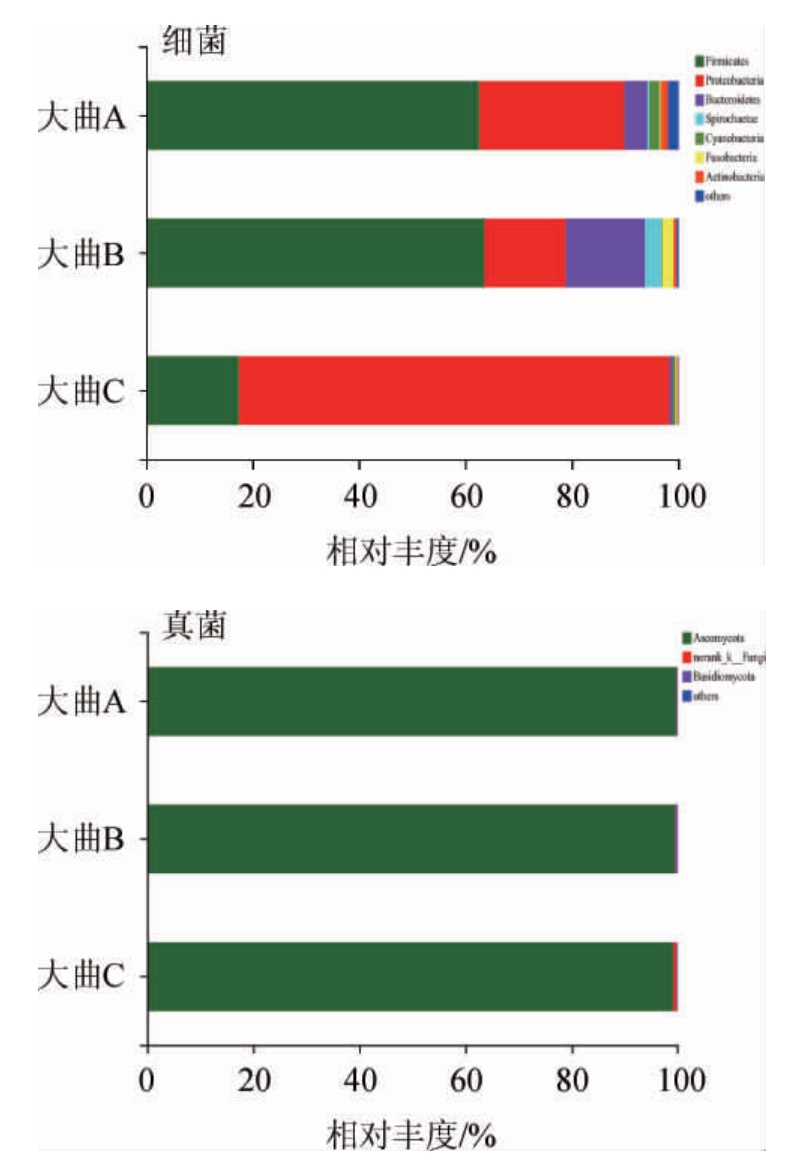
图3 基于门水平不同储藏期浓香型白酒大曲样品细菌及真菌菌群结构分析结果
Fig.3 Analysis result of bacteria and fungi community structure in strong-flavor Baijiu Daqu samples at different storage periods based on phylum level
others表示相对丰度<1%的菌门,norank表示该分类水平上没有明确的分类信息或分类名称。
由图3可知,在门水平上细菌门主要有厚壁菌门(Fimicutes)、变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、蓝藻菌门(Cyanobacteria)、放线菌门(Actinobacteria),其中3月龄大曲样品的优势细菌门(相对丰度>1%)有厚壁菌门(62.66%)、变形菌门(27.15%);6月龄大曲样品的优势细菌门有厚壁菌门(63.53%)、变形菌门(15.26%)、拟杆菌门(14.87%);9月龄大曲样品的优势细菌门有变形菌门(80.86%)和厚壁菌门(17.39%);变形菌门在大曲储存过程中相对丰度先下降后上升,在后期达到绝对优势。在门水平上,3月龄、6月龄、9月龄大曲样品的优势真菌门(相对丰度>1%)均为子囊菌门(Ascomycota),且3个样品中子囊菌门比例均达到99%。
2.3.2 基于属水平不同储藏期浓香型白酒大曲微生物菌群结构分析
基于属水平不同储藏期浓香型白酒大曲微生物菌群结构分析结果见图4。
由图4可知,在属水平上3月龄大曲样品所含优势细菌属(相对丰度>1%)有10个,分别为乳球菌属(Lactococcus)(27.90%)、肠杆菌属(Enterobacter)(23.14%)、乳杆菌属(Lactobacillus)(14.81%)、魏斯氏菌属(Weissella)(7.12%)、芽孢杆菌属(Bacillus)(2.32%)、片球菌属(Pediococcus)(1.97%)、葡萄球菌属(Staphylococcus)(1.61%)、norank_c_Cyanobacteria(1.48%)、肠球菌属(Enterococcus)(1.48%)、norank_f_Bacteroidales_S24-7_group(1.00%)。6月龄大曲样品所含优势细菌属有8个,分别为unclassified_f_Peptostreptococcaceae(24.64%)、Escherichia-Shigella(11.80%)、土孢杆菌属(Terrisporobacter)(6.47%)、Clostridium_sensu_stricto_1(5.68%)、乳杆菌属(Lactobacillus)(4.61%)、norank_f_Bac teroidales_S24-7_group(3.65%)、Ruminococcaceae_UCG-005(2.88%)、Rikenellaceae_RC9_gut_group(2.63%)。9月龄大曲样品所含优势细菌属有4个,分别为肠杆菌属(Enterobacter)(79.80%)、乳杆菌属(Lactobacillus)(6.32%)、魏斯氏菌属(Weissella)(4.59%)、片球菌属(Pediococcus)(1.59%)。土孢杆菌属、Clostridium sensu stricto 1、Ruminococcaceae UCG-005只在6月龄大曲中为优势细菌属,在3月龄和9月龄大曲中为非优势细菌属。
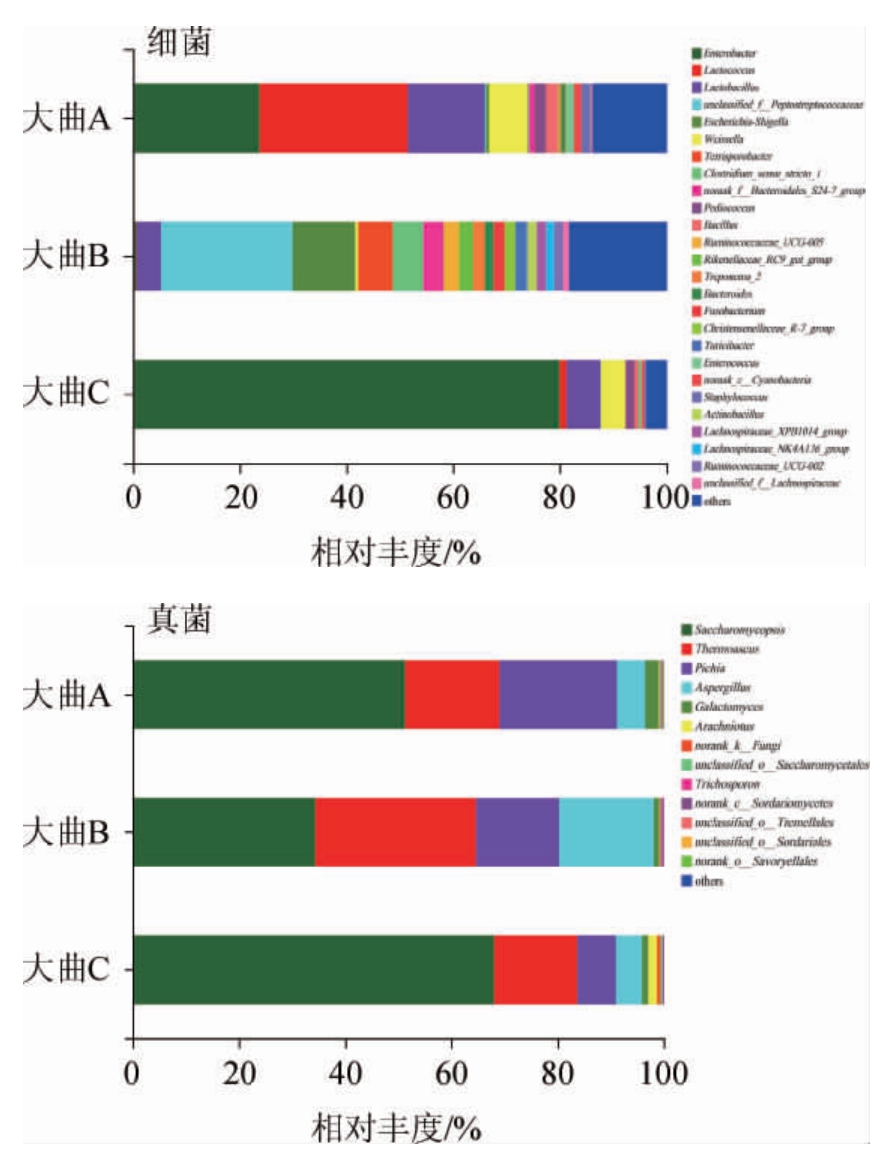
图4 基于属水平不同储藏期浓香型白酒大曲样品细菌及真菌菌群结构分析结果
Fig.4 Analysis results of bacteria and fungi community structure in strong-flavor Baijiu Daqu samples at different storage periods based on genus level
others表示相对丰度<0.01%的菌属,norank表示该分类水平上没有明确的分类信息或分类名称,unclassified指在置信度70%下未与数据库比对。
从不同储藏期浓香型白酒大曲样品的细菌群落结构分析,3月龄和9月龄大曲样品在属水平上绝大多数为产乳酸的菌属,如乳酸杆菌、乳酸球菌、魏斯氏菌属和肠杆菌属,此类菌属在发酵过程中产生的乳酸与乙醇被酯化形成乳酸乙酯,但乳酸乙酯含量过多会造成酒体香味不协调[15-16],6月龄大曲独有的菌属Terrisporobacter、Clostridium_sensu_stricto_1、Ruminococcaceae_UCG-005为己酸菌,己酸菌的代谢产物己酸乙酯是构成浓香型白酒的主体香味物质。3月龄大曲中的乳酸杆菌、乳酸球菌、魏斯氏菌属均属于乳酸菌[17]。在白酒酿造过程中,乳酸菌可发酵碳水化合物产生大量乳酸,过量乳酸会造成白酒口感酸涩,影响酒质,且在酸性环境易形成生物胺[18],人体摄入过量的生物胺会对机体造成不良反应[19]。6月龄大曲样品中的Clostridium_sensu_stricto_1属于梭菌纲,梭菌纲微生物是浓香型白酒酿造中主要的己酸菌[20];Terrisporobacter、Ruminococcaceae_UCG-005也是能产己酸的己酸菌[15]。9月龄大曲样品中的肠杆菌属可发酵糖类产生乳酸[21],且也是大曲中可产生物胺的细菌[22]。
由图4亦可知,在属水平上3个大曲样品中共检测出6个优势真菌属(平均相对丰度>1%),分别为复膜孢酵母属(Saccharomycopsis)、嗜热子囊菌属(Thermoascus)、毕赤酵母属(Pichia)、曲霉菌属(Aspergillus)、耐碱酵母属(Galactomyces)、Arachniotus。3月龄大曲样品含有5个优势真菌属,分别为复膜孢酵母属(Saccharomycopsis)(51.18%)、毕赤酵母属(Pichia)(22.14%)、嗜热子囊菌属(Thermoascus)(17.79%)、曲霉菌属(Aspergillus)(5.33%)、耐碱酵母属(Galactomyces)(2.54%);6月龄大曲样品所含优势菌属类型与3月龄大曲样品相同,但占比不同,即复膜孢酵母属(Saccharomycopsis)(34.27%)、嗜热子囊菌属(Thermoascus)(30.27%)、曲霉菌属(Aspergillus)(17.80%)、毕赤酵母属(Pichia)(15.70%)、耐碱酵母属(Galactomyces)(1.06%);9月龄大曲样品含有6个优势真菌属,分别为复膜孢酵母属(Saccharomycopsis)(67.94%)、嗜热子囊菌属(Thermoas cus)(15.69%)、毕赤酵母属(Pichia)(7.30%)、曲霉菌属(As pergillus)(4.91%)、Arachniotus(1.67%)、耐碱酵母属(Galactomyces)(1.16%)。
从不同储藏期浓香型白酒大曲样品的真菌群落结构分析,3、6、9月龄大曲样品的真菌群落组成相差不大,但组成比例差异明显,6月龄大曲的嗜热子囊菌属和曲霉菌属占比均高于其他月龄的大曲。曲霉菌属能够产生淀粉酶、蛋白酶、糖化酶、酯化酶、果胶酶、纤维素酶和单宁酶,在白酒的酿造过程中主要作用于发酵的前期,是白酒发酵原料中淀粉等大分子物质的主要动力之一,为发酵持续进行和风味物质形成发挥着重要作用[23]。嗜热子囊菌属具有良好的酶分泌特性,产纤维素酶、蛋白酶、淀粉酶、脂肪酶等酶类,并具有良好的热稳定性,能够在白酒发酵过程中温度较高的条件下保持稳定的催化效率[24],在后续的堆积糖化发酵以及对风味的形成起着重要的作用[5],有利于大曲产酒生香。毕赤酵母属具有较强产酯功能,能够利用发酵环境中的糖类、氨基酸、蛋白质等物质[25],生成大量酯类风味物质,是白酒酿造中一类重要的功能微生物[26]。复膜孢酵母属能够分泌淀粉酶在内的多种水解酶[27],是成品曲中酶类的重要产生菌,同时具有较好的产酒和产酯能力[28]。
随着大曲储藏时间的延长,不仅会影响多种微生物的相对丰度及产酶特性,还会增加库存成本,故从微生物的富集、平衡角度及菌属特性分析,建议储存期为6个月的浓香型大曲更适合投入后续白酒酿造生产。梁丽文等[18]选取白云边酒不同储存期的高温大曲为研究对象,从微生物数量、细菌种类、发酵力和糖化力等方面的变化规律进行分析,结果表明大曲储存6月为宜;梁晨等[29]利用高通量测序剖析0~6月份大曲成熟过程中原核微生物群落结构及风味成分的变化规律,得到大曲贮存4~6个月更有利于白酒的酿造;刘雪等[17]通过研究浓香型中高温大曲的理化指标和微生物种类及数量随储存期延长的变化规律,得出大曲要储存3~5个月方能投入生产。本研究结果与以上研究基本一致。
此外,本研究首次从浓香型白酒大曲中检测出的菌属有耐碱酵母属、Arachniotus、norank_c_Cyanobacteria、Escherichia-Shigella、土孢杆菌属、norank_f_Bacteroidales_S24-7_group、Ruminococcaceae_UCG-005、Rikenellaceae_RC9_gut_group。HU Z等[30]采用高通量测序技术分析青贮玉米秸秆,在属水平上检测出norank_c_Cyanobacteria;戴奕杰等[31]在酱香型白酒大曲检测到Escherichia-Shigella等为优势菌属;栗连会等[32]在泸型酒酒醅中发现土孢杆菌属;LI T等[33]利用高通量测序技术在小鼠肠道中检测到norank_f_Bacteroidales_S24-7_group;BAY V等[34]利用高通量测序技术在奶牛爪角中检测到Ruminococcaceae_UCG-005和Rikenellaceae_RC9_gut_group这两种微生物。部分菌属已证实存在于酿酒过程中,但其生长机制与代谢机制的研究仍然滞后,在浓香型白酒酿造中,上述菌属的功能仍有待进一步研究。
3 结论
本研究采用高通量测序技术对不同储藏期赊店老酒浓香型白酒大曲的微生物群落结构进行分析,结果表明,从3个储藏时期大曲样品中共发现26个细菌属和13个真菌属,其中共有的优势细菌属为乳球菌属(Lactococcus)、肠杆菌属(Enterobacter)、乳杆菌属(Lactobacillus)、魏斯氏菌属(Weissella);共有的优势真菌属为复膜孢酵母属(Saccharomycopsis)、嗜热子囊菌属(Thermoascus)、毕赤酵母属(Pichia)、曲霉菌属(Aspergillus)、耐碱酵母属(Galactomyces);不同储存期大曲样品群落组成相似,但其优势菌群的相对丰度差异明显。从微生物的菌属特性、平衡角度分析,储存期为6月的大曲更适合投入白酒生产。
此外,首次从浓香型白酒大曲中发现耐碱酵母属、Arachniotus、norankcCyanobacteria、Escherichia-Shigella、土孢杆菌属、norank f Bacteroidales S24-7 group、Ruminococcaceae UCG-005和Rikenellaceae RC9 gut group。进一步揭示了大曲储存过程中微生物的多样性及群落结构变化,在此基础上建议了大曲的最佳储存时间,对后续大曲出库投入白酒酿造的合理储存时间具有一定的科学指导意义,有利于大曲质量的提高。
[1]XIAO C,YANG Y,LU Z M,et al.Daqu microbiota exhibits species-specific and periodic succession features in Chinese Baijiu fermentation process[J].Food Microbiol,2021,98(1):103766.
[2]LI J X,LIU G Y,HE H K,et al.Analysed the fungal community structure of high-temperature Daqu and medium-temperature Daqu based on highthroughput sequencing technology[J].Food Ferment Ind,2018,44(12):52-59.
[3]沈毅,陈波,张亚东,等.影响高温大曲质量的关键控制点[J].酿酒科技,2019(8):17-21.
[4]WU X Y,JING R X,CHEN W H,et al.High-throughput sequencing of the microbial diversity of roasted-sesame-like flavored Daqu with different characteristics[J].3 Biotech,2020,10(11):502.
[5]YAN S B,CHEN X S,GUANG J Q.Bacterial and fungal diversity in the traditional Chinese strong flavour liquor Daqu[J].J I Brewing,2019,125(4):443-452.
[6]陈蒙恩,韩素娜,侯建光,等.陶融大曲培养贮存过程生化指标变化规律及相关性研究[J].食品与发酵工业,2020,46(13):146-151.
[7]郭燕,钟迟迪,董晓山,等.中高温大曲中酵母菌的分离及其在小曲酒中发酵性能初探[J].食品与发酵工业,2020,46(8):78-84.
[8]郭敏,黄永光,邱树毅,等.高通量测序在酱香白酒微生态多样性研究中的应用[J].中国酿造,2017,36(5):146-151.
[9]罗方雯,黄永光,涂华彬,等.基于高通量测序技术对茅台镇酱香白酒主酿区域酵母菌群结构多样性的解析[J].食品科学,2020,41(20):127-133.
[10]张双燕,廖永红,纪南,等.基于高通量测序技术分析北京清香型大曲微生物多样性[J].中国酿造,2016,35(11):49-53.
[11]王春艳,宋建阳,吕慧鑫,等.基于高通量测序的宋河浓香型白酒不同窖龄窖泥细菌群落结构分析[J].中国酿造,2019,38(9):163-166.
[12]ZHOU J H,XIA F,CHE S C,et al.Microbial diversity in rhizosphere soil of Cotinus coggygria based on high throughput sequencing[J].Plant Dis Pests,2019,10(11):15-23.
[13]XIE M W,LV F X,MA G X,et al.High throughput sequencing of the bacterial composition and dynamic succession in Daqu for Chinese sesame flavour liquor[J].J I Brewing,2020,126(1):98-104.
[14]杨旭,马歌丽,王光路,等.高通量测序解析白酒中高温大曲细菌和真菌群落结构[J].中国酿造,2020,39(6):119-123.
[15]GUAN T W,YANG H,OU M Y,et al.Storage period affecting dynamic succession of microbiota and quality changes of strong-flavor Baijiu Daqu[J].LWT-Food Sci Technol,2021,139:110544.
[16]SHI S,PENG Z F,QIAO Z W,et al.Analysis of the change of sacchari-fying power and fermenting power for Luzhou-flavor Daqu and their fungal diversity during storage[J].Food Ferment Ind,2017,43(5):76-79.
[17]刘雪,曹建全,李霞,等.景芝浓香大曲随储存期延长的变化规律[J].酿酒科技,2018(3):65-71.
[18]梁丽文,缪礼鸿,杨团元,等.浓酱兼香型白酒不同储存期的高温大曲微生物群落结构与发酵特征分析[J].酿酒科技,2016(7):37-41.
[19]LIU P H,ZHANG L H,DU X W,et al.Dynamic analysis of physicochemical and biochemical indices and microbial communities of lightflavor Daqu during storage[J].J Am Soc Brew Chem,2019,77(4):1-8.
[20]陈申习,宿智新,张磊,等.基于高通量测序的清香型和酱香型酒曲真菌群落特征研究[J].中国酿造,2021,40(7):49-53.
[21]陈慧颖,李慧星,许彬,等.河南浓香型酒醅的真菌微生物菌群多样性及共变性[J].工业微生物,2021,51(2):36-45.
[22]吴树坤,谢军,卫春会,等.四川不同地区浓香型大曲微生物群落结构比较[J].食品科学,2019,40(14):21.
[23]HU X L,WANG K L,NIU J G J,et al.Analysis of microbial community diversity in medium temperature Daqu based on high-throughput sequencing technology[J].J Light Ind,2019,34(4):21-29.
[24]LIU C C,FENG S B,WU Q,et al.Raw material regulates flavor formation via driving microbiota in Chinese liquor fermentation[J].Front Microbiol,2019,10:1520.
[25]刘婷,陈可丹,黄冰静,等.不同生产环境对特香型大曲的影响[J].中国酿造,2019,38(7):18.
[26]SONG J K,TANG H L,LIANG H B,et al.Effect of bioaugmentation on biochemical characterisation and microbial communities in Daqu using Bacillus,Saccharomycopsis and Absidia[J].Int J Food Sci Technol,2019,54(8):2639-2651.
[27]SU C,ZHANG K Z,CAO X Z,et al.Effects of Saccharomycopsis fibuligera and Saccharomyces cerevisiae inoculation on small fermentation starters in Sichuan-style Xiaoqu liquor[J].Food Res Int,2020,137:109425-109425.
[28]王晓丹,陈美竹,班世栋,等.茅台大曲中酵母的分离,鉴定及其功能初探[J].食品科学,2017,38(4):51-57.
[29]梁晨,杜海,徐岩.大曲贮存过程中原核微生物群落结构及风味成分演替规律[J].微生物学通报,2017,44(2):384-393.
[30]HU Z,CHANG J,YU J,et al.Diversity of bacterial community during ensiling and subsequent exposure to air in whole-plant maize silage[J].Asian Austral J Anim,2018,31(9):1464-1473.
[31]戴奕杰,李宗军,田志强.酱香型白酒大曲和糟醅的细菌多样性分析[J].食品科学,2019,40(4):152-159.
[32]栗连会,肖辰,陆震鸣,等.泸型酒发酵酒醅中乳酸菌群落的来源、演替规律及功能预测[J].食品与生物技术学报,2018,37(12):1242-1247.
[33]LI T,GAO J,DU M,et al.Milk fat globule membrane supplementation modulates the gut microbiota and attenuates metabolic endotoxemia in high-fat diet-fed mice[J].J Funct Foods,2018,47:56-65.
[34]BAY V,GRIFFITHS B,CARTER S D,et al.16S rRNA amplicon sequencing reveals a polymicrobial nature of complicated claw horn disruption lesions and interdigital phlegmon in dairy cattle[J].Sci Rep,2018,8(1):1-12.