β-甘露聚糖酶(β-mannanase)是一类专一性作用于β-1,4-D-甘露糖苷键的半纤维素水解酶[1-2],能够以内切的方式将甘露聚糖水解为甘露低聚糖,而甘露低聚糖作为一种新型的功能性食品添加剂,可以有效改善动物和人的肠道菌群结构、提高机体机能[3-5]。目前甘露低聚糖已逐渐应用于食品工业,前景十分广阔。β-甘露聚糖酶除了在食品方面有着广阔的应用前景,其在造纸、洗涤、饲料、医药和石油开采等方面也具有较大的应用价值[6-8]。
β-甘露聚糖酶来源非常广泛,存在于植物、动物和微生物中[9]。植物来源的β-甘露聚糖酶多来自豆类等发芽的种子、槐豆胶及魔芋块茎中,动物来源的β-甘露聚糖酶多发现于一些海洋软体动物及蜗牛等[10]。而微生物来源的β-甘露聚糖酶是目前报道最多的,也是最丰富的[11-12]。常见产β-甘露聚糖酶的细菌有芽孢杆菌(Bacillus sp.)、假单胞菌(Pseudomonas sp.)、产酸细菌等[13-14];常见的产β-甘露聚糖酶的真菌主要有青霉属(Penicillium sp.)、曲霉属(Aspergillus sp.)等[15-16]。微生物来源的β-甘露聚糖酶相比于动植物,有着资源更加广泛、活性高、pH和温度作用范围广、培养条件简单、酶分子改造便利的优点[17-18]。此外,微生物来源的β-甘露聚糖酶可以在极端环境条件下(低pH、高温等)筛选得到耐受度更好的酶。LV J N等[19]报道的枯草芽孢杆菌(Bacillus subtilis)MAFIC-S11来源的β-甘露聚糖酶室温下在pH 2.2的缓冲液中处理60 min后,仍保持60%以上的活性。
本研究拟以常年种植魔芋的土样为实验材料,以魔芋粉为唯一碳源,筛选出高产β-甘露聚糖酶的菌株,并通过形态学观察、生理生化特征和分子生物学鉴定,同时对其产酶条件进行初步优化,为后续的魔芋开发和工业化应用奠定理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
土壤样品:取自西峡县西坪镇后塘沟村多年种植魔芋地;梅里埃VITEK芽孢杆菌鉴定卡:上海净信实业发展有限公司。
1.1.2 化学试剂
3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)、酵母粉、蛋白胨、氯化钠、硫酸镁、磷酸氢二钾、磷酸氢二铵、氯化钙、甘露聚糖、乳糖、蔗糖(均为分析纯或生化试剂):国药集团化学试剂有限公司;魔芋粉、大豆粉(均为食品级):北京索莱宝科技有限公司。
1.1.3 培养基
富集培养基:魔芋粉10.0 g/L,酵母粉2.0 g/L,蛋白胨10.0 g/L,NaCl 5.0 g/L,K2HPO4 1.0 g/L,调pH至7.0。121 ℃灭菌15 min。
选择培养基:魔芋粉10.0 g/L,NaCl 5.0 g/L,K2HPO4 1.0 g/L,琼脂粉20 g/L,调pH至7.0。121 ℃灭菌15 min。
发酵培养基:魔芋粉10g/L,蛋白胨5.0g/L,酵母粉5.0g/L,NaCl 10.0 g/L,硫酸镁0.2 g/L,磷酸氢二钾1 g/L,调pH至7.0。121 ℃灭菌15 min。
种子培养基采用LB培养基:胰蛋白胨10.0 g/L,酵母膏5.0 g/L,NaCl 5.0 g/L,蒸馏水1 000 mL。121 ℃灭菌15 min。
1.2 仪器与设备
DRP-9025型恒温培养箱:上海森信仪器有限责任公司;DK-S11数显恒温水浴锅:上海精宏实验设备有限公司;LDZX-50KBS型立式压力蒸汽灭菌器:上海申安医疗器械有限责任公司;TCYQ全温摇瓶柜:太仓市豪成实验仪器制造有限公司;MiniAmp型基因扩增仪:美国ABI公司;Axio Imager.M2型全电动正置荧光显微镜:德国蔡司公司;DYY-6C电泳仪:北京六一生物科技有限公司;DChemiDoc XRS+化学发光成像分析系统:美国Bio-Bad公司。
1.3 实验方法
1.3.1 菌株的筛选
(1)富集培养
称取土样2.0 g加入富集培养基中,在200 r/min、30 ℃条件下培养24 h。按照2%(V/V)的接种量吸取富集到的菌液接种至新的富集培养基中,相同的条件培养16 h。
(2)初筛
将富集培养得到的菌液用无菌水稀释成10-1、10-2、10-3、10-4、10-5后,取100 μL在以魔芋粉为唯一碳源的选择培养基上涂布,于30 ℃恒温培养培养16 h。培养得到的单菌落经2次平板划线纯化后用于后续透明圈测定和产酶测定。
将选择培养基的配方中加入0.05%的刚果红,灭菌后倒置固体培养基。挑取选择培养基上的单菌落进行分区点布后,于30 ℃恒温培养。观察透明圈出现的时间以及大小,记录透明圈直径(D)与菌落直径(d)比值(D/d)。
(3)复筛
选择D/d值较大即产β-甘露聚糖酶能力较强的菌株,接入种子培养基,30 ℃、180 r/min振荡培养18 h,按3%(V/V)接种量转接至发酵培养基中,相同条件下振荡培养24 h,在4 ℃、10 000 r/min条件离心10 min,上清液即粗酶液,测定β-甘露聚糖酶酶活,复筛菌株。
1.3.2 β-甘露聚糖酶活性测定[20]
采用DNS法测定β-甘露聚糖酶的活性。以灭活的酶液作为空白对照,分别取0.1 mL适当稀释的两种粗酶液与0.5%的甘露聚糖溶液0.9 mL(由pH7.0,0.1 mol/L的磷酸缓冲液配制)混合均匀,每个样品三个重复,置于50 ℃水浴中反应10 min,加入200 μL DNS,煮沸5 min终止反应,吸取200 μL显色液在波长540 nm处测吸光度值。β-甘露聚糖酶活力的计算公式如下:
式中:U为β-甘露聚糖酶活力,U/mL;C为甘露聚糖质量浓度,μg/mL;V1为加入的底物体积,mL;V为所用粗酶液体积,mL;T为反应时间,min;n为稀释倍数。
β-甘露聚糖酶酶活定义[21]:在37 ℃、pH值为5.5反应条件下,以每分钟从质量浓度为3 mg/mL甘露聚糖溶液中释放生成1 μmol甘露聚糖所需要的酶量为1个酶活力单位(U/mL)。
1.3.3 产β-甘露聚糖酶菌株的鉴定
(1)形态学观察
选择培养基筛选得到的单菌落重新在选择培养基上进行划线,30 ℃培养16 h,观察菌落形态特征,同时进行革兰氏染色,显微镜下观察并记录菌株形态。
(2)生理生化试验
依照《伯杰细菌鉴定手册》和《微生物学实验》对菌株进行生化鉴定[22]。实验采用VITEK 芽孢菌鉴定卡进行。按照试剂盒说明书操作,记录、分析实验结果。
(3)分子生物学鉴定[23]
将菌株接种于LB液体培养基上,在30 ℃、180 r/min条件下振荡培养24 h,采用Ezup柱式细菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)抽提试剂盒提取筛选菌株的基因组DNA,以其为模板,采用16S rDNA通用引物27F和1492R、gyrB基因通用引物UP-1和UP-2r扩增目标菌株的16S rDNA序列和gyrB基因序列。PCR扩增体系(50 μL):Taq PCR mix 25 μL,上、下游引物各1 μL,双蒸水(ddH2O)23 μL。PCR扩增程序:94 ℃预变性10 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸90 s,30个循环,72 ℃延伸5 min。PCR产物经0.8%琼脂糖凝胶电泳检测后,送至华大基因公司进行测序。将所得序列结果提交至美国国家生物技术信息中心(national center of biotechnology information,NCBI)的GenBank数据库中进行基本局部比对工具(basic local alignment search tool,BLAST)检索,选取同源性最高的已知菌种的16S rDNA序列和gyrB基因,采用MEGA 6.0软件中的邻接(neighbor-joining,NJ)法构建系统发育树。
1.3.4 种子液的制备
挑取纯化后的单菌落至LB液体培养基中,在200 r/min、30 ℃条件下培养16 h,用于菌株HKS018的产酶条件优化。
1.3.5 菌株的产酶条件优化
发酵时间的确定:在30 ℃、转速180 r/min、发酵培养基初始pH 7.0、接种量1%,装液量50 mL/250 mL的条件下,对菌株进行培养,期间每4 h取样测定发酵液β-甘露聚糖酶活性,考察发酵时间对菌株产酶的影响。
发酵温度的确定:在转速180 r/min、发酵时间48 h、发酵培养基初始pH 7.0、接种量1%,装液量50 mL/250 mL的条件下,考察发酵温度25 ℃、28 ℃、30 ℃、33 ℃、36 ℃、39 ℃、42 ℃、45 ℃、48 ℃、51 ℃、54 ℃、57 ℃、60 ℃对菌株产酶的影响。
接种量的确定:在30 ℃、转速180 r/min、发酵时间48 h、发酵培养基初始pH 7.0、接种量1%,装液量50 mL/250 mL的条件下,考察接种量0.5%、1.0%、1.5%、2.0%、2.5%、3.0%(V/V)对菌株产酶的影响。
初始pH的确定:在30 ℃、转速180 r/min、发酵时间48 h、接种量1%,装液量50 mL/250 mL的条件下,考察初始pH值为4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5对菌株产酶的影响。
装液量的确定:在30 ℃、转速180 r/min、发酵培养基初始pH7.0、发酵时间48 h、接种量1%的条件下,考察装液量为25mL/250mL、50mL/250mL、75mL/250mL、100mL/250mL、125 mL/250 mL对菌株产酶的影响。
发酵转速的确定:在30 ℃、发酵培养基初始pH 7.0、发酵时间48 h、接种量1%,装液量50 mL/250 mL的条件下,考察转速分别设置为100 r/min、120 r/min、140 r/min、160 r/min、180 r/min、200 r/min、220 r/min对菌株产酶的影响。
2 结果与分析
2.1 菌株的筛选
通过富集培养和透明圈筛选从西峡县西坪镇后塘沟村多年种植魔芋地土壤样品中得到6株不同形态的单菌落,分别标记为2号、3号、6号、8号、9号、10号。挑取代表菌株单菌落接种至含有刚果红的选择培养基上,30 ℃过夜培养24 h透明圈见图1,β-甘露聚糖酶酶活测定结果见表1。由图1可知,6号菌株具有明显的水解透明圈,D/d值最大。由表1可知,6号菌株的发酵液β-甘露聚糖酶的活性最高,将其命名为HKS018,进一步对其进行鉴定。

图1 筛选菌株的水解透明圈
Fig.1 Hydrolytic transparent circles of screened strains
表1 筛选菌株的β-甘露聚糖酶酶活测定结果
Table 1 Determination results of β-mannanase activities of screened strains
2.2 菌株HKS018的菌落形态和细胞形态
对菌株HKS018进行划线培养和革兰氏染色,其菌落及细胞形态分别见图2。由图2A可知,其菌落呈浅黄色,近圆形,表面干燥,不透明,边缘不整齐。由图2B可知,革兰氏染色为紫色,为革兰氏阳性,菌体呈杆状,(0.7~0.9)μm×(1.5~2.7)μm,单个或成对排列。
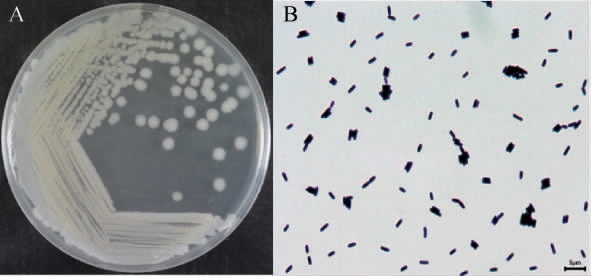
图2 菌株HKS018的菌落(A)及细胞(B)形态
Fig.2 Morphology of colony (A) and cell (B) of strain HKS018
2.3 菌株HKS018的生理生化试验
使用VITEK 芽孢菌鉴定卡对菌株HKS018的生理生化特性进行鉴定,结果见表2。由表2可知,菌株HKS018可以D-甘露糖、D-甘露醇、古老糖作为碳源生长,但不能利用环糊精、D-半乳糖、糖原、肌醇、甲基-D-木糖苷、麦芽三糖、D-松三糖、N-乙酰-D-氨基葡萄糖、D-塔格糖、D-海藻糖、D-葡萄糖、D-核糖等。菌株HKS018可在β-木糖苷酶、苯丙氨酸芳胺酶、α-半乳糖苷酶、丙氨酸-苯丙氨酸-脯氨酸芳胺酶、β-半乳糖苷酶、L-吡咯烷酮芳胺酶等酶中生长。菌株HKS018还可水解七叶苷,耐受6.5%的NaCl、多粘菌素B,但对卡那霉素和竹桃霉素不耐受。将以上生理生化鉴定结果输入梅里埃API 50 CHB鉴定系统中,初步鉴定菌株HKS018为枯草芽孢杆菌(Bacillus subtilis)。
表2 菌株HKS018的生理生化特性测定结果
Table 2 Determination results of physiological and biochemical characteristics of strain HKS018

注:“+”表示结果阳性,“-”表示结果阴性,“+w”表示结果弱阳性。
2.4 菌株HKS018的分子生物学鉴定
将测序得到的16S rDNA序列在NCBI数据库进行BLAST分析,结果表明与菌株HKS018的同源性达99.57%以上的菌株有10株,其中同源性最高的菌株有Bacillus cabrialesii TE3T(MK462260)、Bacillus inaquosorum KCTC 13429T(AMXN01000021)、Bacillus tequilensis KCTC 13622T(AYTO01000043),为99.93%。对此比对结果,使用MEGA 6.0软件构建系统发育树,结果见图3。由图3可知,菌株HKS018的16S rDNA序列与多个菌株的同源性都非常接近,因此仅依靠16S rDNA序列的同源性比对无法确定菌株HKS018的种属。

图3 基于16S rDNA基因序列菌株HKS018的系统发育树
Fig.3 Phylogenetic tree of strain HKS018 based on 16S rDNA gene sequences
gyrB基因编码DNA促旋酶的B亚单位,序列相对保守,广泛存在于细菌中,目前已应用于细菌鉴定中[23]。对菌株HKS018的gyrB基因序列在NCBI数据库进行BLAST分析,其与Bacillus subtilis BCRC 10255T(DQ309293)的同源性最高,为100%。而MEGA软件构建的系统发育树见图4。由图4可知,与HKS018菌株亲缘关系最近的菌株为Bacillus subtilis BCRC 10255T(DQ309293)。结合菌株菌落和细胞形态、生理生化特征及16S rDNA、gyrB基因序列的比对分析结果,鉴定菌株HKS018为枯草芽孢杆菌(Bacillus subtilis)。
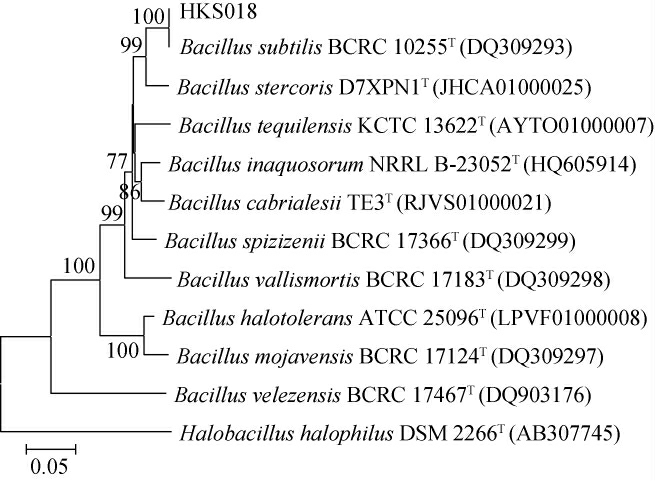
图4 基于gyrB基因序列菌株HKS018的系统发育树
Fig.4 Phylogenetic tree of strain HKS018 based on gyrB gene sequences
2.5 产酶条件优化
2.5.1 发酵时间的确定
发酵时间是决定微生物产酶活性高低的一个重要因素。由图5可知,随着发酵时间在0~48 h内的延长,β-甘露聚糖酶活性随之逐渐升高;发酵时间为48 h,β-甘露聚糖酶活性达到最高,为9.18 U/mL;发酵时间>48 h之后,酶活随着时间的延长呈迅速下降趋势。推测可能由于摇瓶发酵后期营养物质耗尽,菌株进入衰亡期导致。因此,菌株HKS018的最优发酵时间为48 h。

图5 发酵时间对β-甘露聚糖酶活性的影响
Fig.5 Effect of fermentation time on β-mannanase activity
2.5.2 发酵温度的确定
由图6可知,发酵温度为25~30 ℃时,发酵液中β-甘露聚糖酶活性随着温度的升高而升高;发酵温度在30 ℃时,发酵液中β-甘露聚糖酶活性最高;当发酵温度超过30 ℃之后,发酵液中β-甘露聚糖酶活性随着温度的升高而逐渐降低,并且发酵温度在超过45 ℃后,活性迅速下降。因此,菌株HKS018的最优发酵温度为30 ℃。
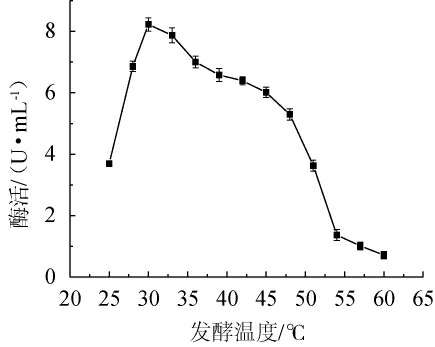
图6 发酵温度对β-甘露聚糖酶活性的影响
Fig.6 Effect of fermentation temperature on β-mannanase activity
2.5.3 接种量的确定
由图7可知,接种量在0.25%~1.00%时,β-甘露聚糖酶活随着接种量的增加而升高;接种量为1.0%时,发酵液中β-甘露聚糖酶活性最高;接种量>1.0%之后,β-甘露聚糖酶活随着接种量的增加而下降。说明低接种量造成了发酵液中生物量过低,酶活水平偏低,但过高的接种量也导致了菌株生长过快,营养物质耗尽,造成菌株过早进入衰亡期,不利于产酶及酶蛋白保持稳定。因此,菌株HKS018的最优接种量为1.0%。
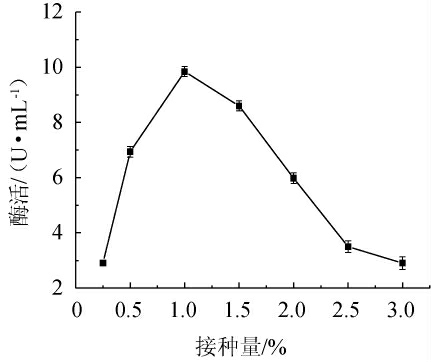
图7 接种量对β-甘露聚糖酶活性的影响
Fig.7 Effect of inoculum on β-mannanase activity
2.5.4 初始pH的确定
由图8可知,当初始pH在4.0~7.0时,酶活随着pH的升高而升高;当初始pH在7.0时,酶活达到最高;当初始pH>7.0之后,酶活随着pH的升高而迅速下降。说明过酸、过碱的环境对菌株产酶有一定的影响[24]。因此,菌株最优初始pH为7.0。
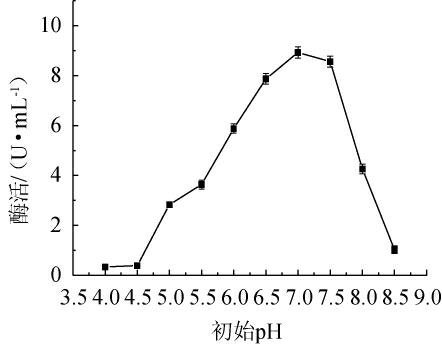
图8 初始pH对β-甘露聚糖酶活性的影响
Fig.8 Effect of initial pH on β-mannanase activity
2.5.5 装液量的确定
由图9可知,当装液量为20~50 mL/250 mL时,发酵液β-甘露聚糖酶活性随之增高;当装液量为50 mL/250 mL时,发酵液β-甘露聚糖酶活性最高;当装液量>50 mL/250 mL之后,酶活随装液量的增加而迅速降低。因此,菌株发酵培养基最优装液量为50 mL/250 mL。
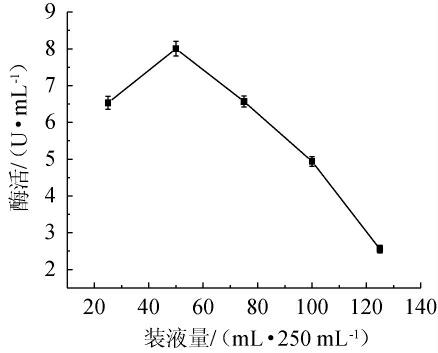
图9 装液量对β-甘露聚糖酶活性的影响
Fig.9 Effect of liquid volume on β-mannanase activity
2.5.6 转速的确定
由图10可知,当转速在100~180 r/min时,发酵液β-甘露聚糖酶活性随着转速的增加而升高;当转速在180 r/min时,发酵液β-甘露聚糖酶活性最高;当转速>180 r/min之后,酶活随着转速的增加而下降。推测可能由于过高的转速增加了三角瓶对菌体的剪切力,进而导致菌体产酶能力下降。因此,最优发酵转速为180 r/min。
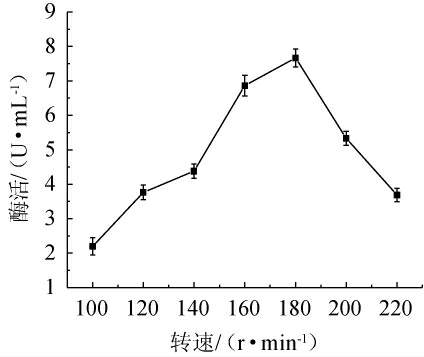
图10 转速对β-甘露聚糖酶活性的影响
Fig.10 Effect of rotating speed on β-mannanase activity
2.5.7 验证试验
为了验证单因素优化试验结果,在单因素试验的最优条件下对菌株HKS018进行产β-甘露聚糖酶发酵试验。结果表明,在发酵温度30 ℃、发酵时间48 h、初始pH值为7.0、接种量1.0%、装液量50 mL/250 mL、转速180 r/min条件下,菌株HKS018发酵液中β-甘露聚糖酶活力为68.28 U/mL,比优化前酶活力提高了5.29倍。虽然通过发酵条件优化,酶活力有明显提高,但与已报道的菌株HDYM-04[25]来源的β-甘露聚糖酶酶活力(4 890 U/mL)差距很大。后续可考虑将菌株HKS018发酵培养基的优化与发酵条件的优化结合起来进一步提高酶活。
3 结论
本研究从常年种植魔芋的土壤中,通过透明圈法分离到一株可以以魔芋粉为唯一碳源生长的菌株HKS018。经过形态学观察、生理生化试验及分子生物学分析,鉴定菌株HKS018为枯草芽孢杆菌(Bacillus subtilis)。其最优产酶条件为:发酵温度30 ℃、发酵时间48 h、初始pH值为7.0、接种量1.0%、装液量50 mL/250 mL、转速180 r/min。在此最佳条件下,β-甘露聚糖酶酶活为68.28 U/mL,比优化前酶活力提高了5.29倍。本研究为后续β-甘露聚糖酶在食品和饲料工业上的应用奠定了基础。
[1]张蕊,朱虹,周峻沛,等.β-甘露聚糖酶分子生物学研究进展[J].中国农业科技导报,2018,20(5):34-46.
[2]SRIVASTA P K,KAPOOR M.Properties,and application of endo-βmannanases[J].Biotechnol Adv,2017,35(1):1-19.
[3]田庚,高伟强,陈晓波,等.热稳定性高β-甘露聚糖酶产生菌的筛选、鉴定及酶学性质研究[J].食品工业科技,2020,41(19):127-131.
[4]LIU H X,GONG J S,LI H,et al.Biochemical characterization and cloning of an endo-1,4-β-mannanase from Bacillus subtilis YH12 with unusually broad substrate profile[J].Process Biochem,2015,50(5):712-721.
[5]YAMABHAI M,SAK-UBOL S,SRILA W,et al.Mannan biotechnology:from biofuels to health[J].Crit Rev Biotechnol,2016,36(1):32-42.
[6]SEESOM W,THONGKET P,YAMAMOTO T,et al.Purification,characterization,and overexpression of an endo-1,4-β-mannanase from thermotolerant Bacillus sp.SWU60[J].World J Microbiol Biotechnol,2017,33(3):53-64.
[7]宋妍,崔堂兵.产气肠杆菌B19中β-甘露聚糖酶基因的克隆表达及酶学性质研究[J].食品工业科技,2018,39(13):142-149.
[8]LI Y X,YI P,LIU J,et al.High-level expression of an engineered β-mannanase (mRmMan5A) in Pichia pastoris for manno-oligosaccharide production using steam explosion pretreated palm kernel cake[J].Bioresour Technol,2018,256:30-37.
[9]张建新,宋宜乐,冯军厂,等.微生物β-甘露聚糖酶的研究进展[J].中国酿造,2019,38(4):7-10.
[10]高伟强,陈赟,梁琪,等.两株产耐高温β-甘露聚糖酶的枯草芽孢杆菌分离鉴定及其酶学性质研究[J].饲料研究,2021,44(8):73-77.
[11]郭尚旭,王瑶,那金,等.细菌β-甘露聚糖酶研究进展[J].中国农学通报,2017,33(27):61-65.
[12]张婕,赵敏,卢磊,等.产β-甘露聚糖酶细菌的筛选及产酶条件的优化[J].北京林业大学学报,2011,33(4):96-101.
[13]MEENAKSHI,SINGH G,BHALLA A,et al.Solid state fermentation and characterization of partially purified thermostable mannanase from Bacillus sp.MG-33[J].Bioresources,2010,5(3):1689-1701.
[14]李晓艳,张庆芳,于爽,等.β-甘露聚糖酶生产菌株的筛选鉴定及发酵条件的研究[J].大连大学学报,2016,37(3):51-55.
[15]KOTE N V,PATIL A G G,MULIMANI V H.Optimization of the production fo thermostable endo-β-1,4 mannanases from a newly isolated Aspergillus niger gr and Aspergillus flavus gr[J].Appl Biochem Biotechnol,2019,152(2):213-223.
[16]BLIBECH M,GHORBEL R E,FAKHFAKH I,et al.Purification and characterization of a low molecular weight of beta-mannanase from Penicillium occitanis Po16[J].Appl Biochem Biotechnol,2010,160(4):1227-1240.
[17]杨苗.β-甘露聚糖酶产生菌的筛选鉴定、产酶条件优化及酶学特性研究[D].武汉:湖北工业大学,2016.
[18]王彩虹.真菌甘露聚糖酶的基因克隆表达及热稳定性机制初步研究[D].北京:中国农业科学院,2015.
[19]LV J N,CHEN Y Q,PEI H L,et al.Cloning,expression,and characterization of β-mannanase from Bacillus subtilis MAFIC-S11 in Pichia pastoris[J].Appl Biochem Biotechnol,2013,169(8):2326-2340.
[20]KATROLIA P,ZHOU P,ZHANG P,et al.High level expression of a novel β-mannanase from Chaetomium sp.exhibiting efficient mannan hydrolysis[J].Carbohydr Polym,2012,87(1):480-490.
[21]甄红敏,华晓晗,马俊文,等.产黄青霉β-甘露聚糖酶的高效表达、性质及应用[J].食品科学,2021,42(8):98-105.
[22]沈萍,范秀荣,李广武.微生物学实验[M].北京:高等教育出版社,1999:210-227.
[23]傅奇,林俊杰,冯亚栋,等.16S与gyrB基因联合建树快速鉴定一株解淀粉芽孢杆菌[J].食品与发酵工业,2020,46(12):116-120.
[24]汤文晶,李松,马忠宝,等.碱性β-甘露聚糖酶产生菌的筛选、鉴定及发酵条件优化[J].食品与发酵工业,2019,45(23):50-54.
[25]葛菁萍,赵丹,宋刚,等.β-甘露聚糖酶产生菌HDYM-04的分离鉴定及产酶条件优化[J].食品科学,2009,30(21):262-266.