酵母是决定葡萄酒最终质量的重要因素之一,不同酿酒酵母(Saccharomyces cerevisiae)菌株的代谢产物存在差异,因而影响葡萄酒的风味和独特性[1]。随着葡萄酒市场的发展,单一酿酒酵母发酵使葡萄酒同质化问题逐渐突出,与此同时因地理位置环境特征等因素新疆产区的葡萄酒普遍存在糖高酸低褪色快等问题,混菌发酵有助于改善葡萄酒的颜色、香气和口感,一定程度上解决新疆产区的问题,近年非酿酒酵母(non-Saccharomyces cerevisiae)受到越来越多的关注[2],研究发现耐热克鲁维酵母(Kluyveromyces thermotolerans)能够增加葡萄酒酸度,降低pH值[3-4],Lachancea thermotolerans与Saccharomyces cerevisiae共同发酵发现其可提高葡萄酒的乳酸含量[5],而酸度对葡萄酒的颜色、口感、稳定性、风味指数、总酚、单宁都有直接的影响[6],但非酿酒酵母大多发酵力弱,耐酒精能力有限,无法单独完成发酵[7],因此通常将其与酿酒酵母混合发酵。混合发酵更有利于葡萄酒香气物质的产生[8-10],因为它们可以在与酿酒酵母混合发酵中生成特定的香气化合物,并产生高活性的聚半乳糖醛酸酶和β-D-木糖苷酶,可提高果酒质量、增加葡萄酒的复杂性[11-12],金宇宁[13]研究发现,酵母PL09发酵冰葡萄酒能产生较多香气物质。此外,有研究表明,用粟酒裂殖酵母(Schizosaccharomyces pombe)发酵可增加红葡萄酒整体吡喃花青素的含量[14],非酿酒酵母在连续发酵过程中具有较高的羟基肉桂酸脱羧酶活性[15],均可以增加葡萄酒色素的稳定性。关于非酿酒酵母与酿酒酵母混菌发酵对葡萄酒品质影响的研究多集中在香气物质的分析,而对葡萄酒颜色以及酚类物质影响的研究相对较少。
因此,本研究以新疆天山北麓产区赤霞珠葡萄为原料,主要采用2种非酿酒酵母(CT10、PL09)分别与3种酿酒酵母(MST、CEC01、F33)顺序发酵酿造干红葡萄酒,通过监测酒精发酵过程及苹果酸-乳酸发酵结束后的颜色、酚类物质的变化及感官品评,分析不同非酿酒酵母与酿酒酵母混合发酵对葡萄酒品质产生的影响与差异,以期为提高葡萄酒品质以及非酿酒酵母的利用和选择提供理论依据。
1 材料与方法
1.1 材料与试剂
赤霞珠葡萄(含糖量(以还原糖计)为251.00 g/L,可滴定酸(以酒石酸计)为5.25 g/L):2020年9月采自新疆天山北麓产区冰湖酒庄。
酿酒酵母(Saccharomyces cerevisiae)MST、CEC01、耐热克鲁维酵母(Kluyveromyces thermotolerans)CT10、布鲁塞尔德克酵母(Dekkera bruxellensis)PL09:上海鼎唐国际贸易有限公司;酿酒酵母(Saccharomyces cerevisiae)F33、酒酒球菌(Oenococcus oeni):法国Laffort公司。
无水葡萄糖、无水乙醇、氢氧化钠、硫酸铜(均为分析纯)、没食子酸、芦丁(纯度>98%):天津市致远化学试剂有限公司;盐酸、碳酸钠、磷酸(均为分析纯):天津市北联精细化学品开发有限公司;福林-酚试剂(分析纯):北京索莱宝科技有限公司。
1.2 仪器与设备
PL303电子天平:梅特勒-托利多仪器(上海)有限公司;PHS-3C精密pH计:上海仪电科学仪器股份有限公司;DZKW-S-6数显恒温水浴锅:北京市永光明医疗仪器有限公司;TU-1810APC紫外可见分光光度计:北京普析通用仪器有限责任公司;DW-40L 92海尔医用低温保存箱:青岛海尔特种电器有限公司。
1.3 试验方法
1.3.1 酵母的活化
非酿酒酵母的活化:分别称取适量非酿酒酵母CT10、PL09,用10倍酵母质量的20~25 ℃蒸馏水进行活化,然后添加约3倍于复水液的无硫葡萄汁中,制备成酵母悬浮液,静置20 min,完成非酿酒酵母活化。
酿酒酵母的活化:将纯水加热至35~40 ℃,分别称取适量酿酒酵母MST、CEC01、F33加入其中,轻柔搅拌后静置15~20 min,完成酿酒酵母活化。
1.3.2 赤霞珠干红葡萄酒的制备及不同酵母的添加方式
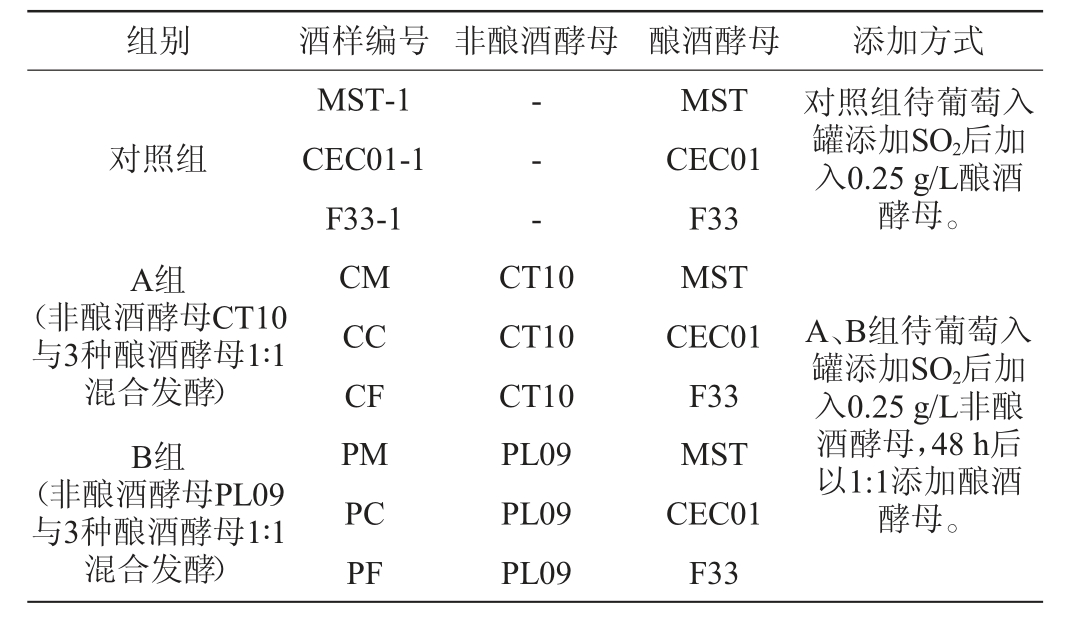
赤霞珠酿酒葡萄去除杂质,除梗破碎后入60 L不锈钢桶(装罐量约80%),将亚硫酸盐溶解于去离子水中并按照30 mg/L添加,分别接入活化好的非酿酒酵母0.25 g/L,每隔5 h进行一次开放式循环操作,48 h后以1∶1分别接入活化好的酿酒酵母0.25 g/L,顺序接种进行常温(室温22~24 ℃)发酵,每天进行温度比重监测,分别在发酵前期(添加酵母前,起始比重为1 105),发酵中期(比重下降至1 050),发酵末期(比重不再下降时)取样,酒精发酵结束后接入乳酸菌启动苹果酸-乳酸发酵(室温18~20 ℃),通过纸层析法检测发酵进程,发酵结束后添加SO2(60 mg/L亚硫酸盐)终止发酵,得到赤霞珠干红葡萄酒。不同酵母的添加方式见表1。
表1 不同酵母的添加方式
Table 1 Adding ways of different yeasts
1.3.3 分析检测
(1)基本理化指标
总酸(以酒石酸计)、挥发酸(以乙酸计)、pH、总糖、酒精度、干浸出物、SO2等均参照国标GB/T 15038—2006《葡萄酒、果酒通用分析方法》测定。
(2)颜色指标
色度、色调参照郝笑云[16]的方法,其中色度为波长420nm、520nm、620nm处吸光度值之和,色调为波长420nm、520nm吸光度值之比值;总色素(totalcolorofpigments,WCP):在1 mL酒样中加入9 mL 0.1 mol/L HCl,pH<1,4~5 h后测波长520 nm处吸光度值;葡萄酒颜色(wine color,WC):在2 mL酒样中加入20 μL乙醛,45 min后测波长520 nm处吸光度值;聚合色素(polymeric pigment color,PPC)[17]:5 mL酒样中添加15 mg NaHSO3,1 min后测波长520 nm处的吸光度值。
(3)酚类物质
总酚(以没食子酸计):参照鲁榕榕[18]福林-酚(Folin-Ciocalten)比色法;单宁:参照RAJKOVICˊM B等[19]的方法;总花色苷:参照翦祎等[20]的pH示差法;总类黄酮(以芦丁计):参照杨雪峰等[21]氯化铝比色法。
(4)感官分析
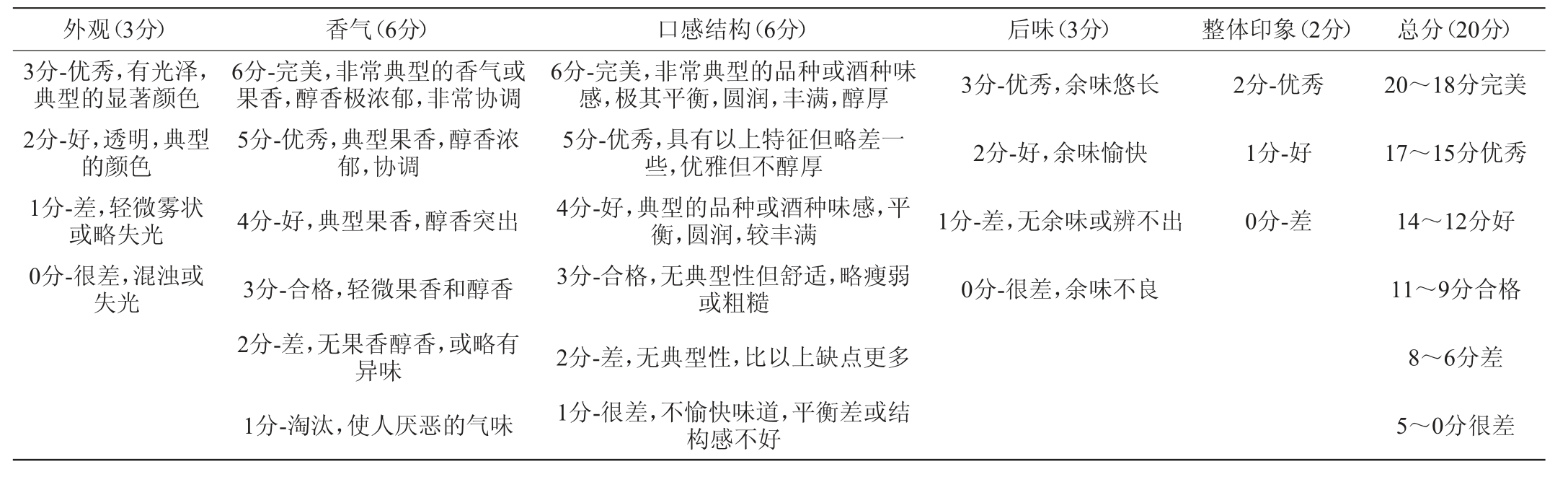
感官品评方法以美国葡萄酒协会(American Wine Society,AWS)的葡萄酒品尝表[22]为评价标准见表2。评酒人员由10名本校葡萄酒专业的学生和老师组成(6名男性,4名女性,年龄范围为20~40岁之间),在相同条件下对混菌顺序发酵的葡萄酒进行5个方面的感官品评,每方面的得分由高到低表示该项感官由强至弱,总分为20分。
表2 赤霞珠干红葡萄酒感官评分标准
Table 2 Sensory evaluation standards of Cabernet Sauvignon dry red wine
1.3.4 数据处理
通过Excel 2010 进行数据统计,利用SPSS 20.0对数据进行显著性分析、相关性分析,应用Origin 9.0软件绘图。
2 结果与分析
2.1 发酵过程中比重、温度及酒精度的变化
各酒样发酵过程中比重、温度、酒精度变化结果见图1。由图1a可知,起始发酵时3种酿酒酵母启动发酵快于先接种非酿酒酵母的处理,其中酿酒酵母CEC01启动发酵最快,发酵2d后比重下降幅度增加,发酵5d后酒样MST-1与CEC01-1趋于同步,酒样F33-1比重下降较缓慢,发酵第9天比重不变,表明3种酿酒酵母酒精发酵结束,而混菌发酵的酒样比重下降幅度较缓慢。由图1b可知,发酵第2天时接种酿酒酵母进行混菌发酵后温度变化幅度增大,发酵至第4天温度达到最高值,但低于酿酒酵母发酵温度,且下降幅度较慢,发酵至12 d时比重与温度基本保持稳定,结束酒精发酵。通过观察发酵进程可知,非酿酒酵母完成酒精发酵所需时间较长,这与张曼等[23]研究结果一致,体现非酿酒酵母发酵能力弱的特点。由图1c可知,发酵初期酒样CEC01-1酒精度上升最快,酒样MST-1、F33-1次之,发酵至第9天逐渐趋于平稳,混菌发酵酒样则在发酵第3天时酒精度开始大幅上升,发酵至第11天时逐渐趋于平稳,除酒样PF外,其他混菌发酵酒样酒精度高于均对照组。
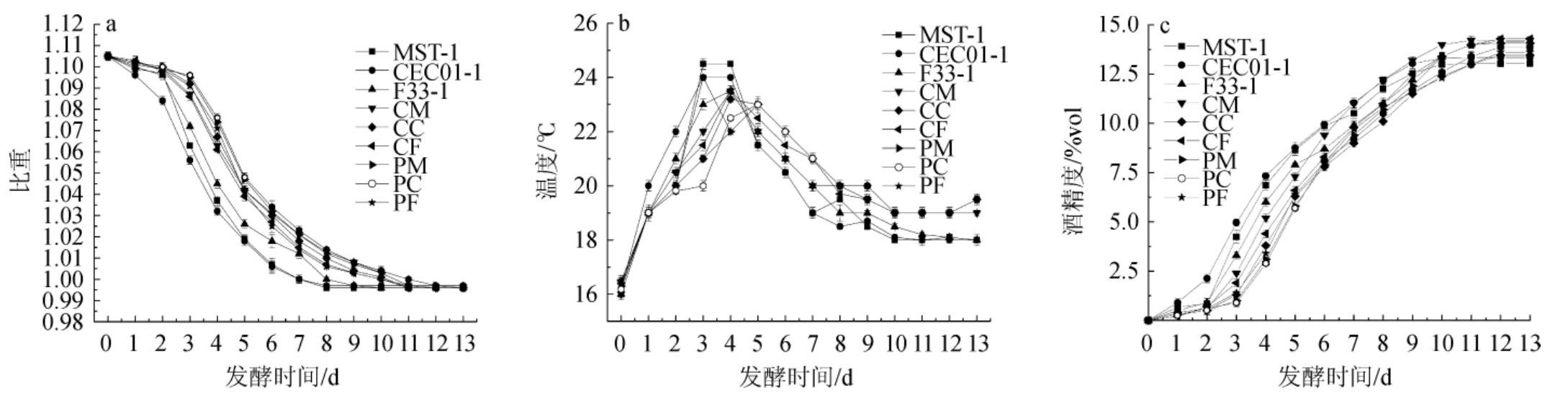
图1 发酵过程中比重(a)、温度(b)及酒精度(c)的变化
Fig.1 Changes of specific gravity (a),temperature (b) and alcohol content (c) during fermentation process
2.2 混菌顺序发酵对葡萄酒理化指标的影响
由表3可知,各酒样理化指标均符合GB/T 15038—2006《葡萄酒、果酒通用分析方法》的标准。混菌发酵与单菌发酵的葡萄酒相比总酸含量升高,其中A组总酸含量整体较高均在4.13 g/L以上,其中酒样CC比对照组提高了6.25%,B组中酒样PM比对照组提升5.97%,酒样PC最高达到4.31g/L,比对照组提升7.75%,差异性显著(P<0.05),A和B两组的pH随总酸的变化呈现出相应的规律性,且低于对照组(酒样CM除外);酒样CM、PM、PC酒精度显著高于对照(P<0.05),酒样CM、CF、PF干浸出物含量显著高于对照组(P<0.05),其中酒样CF酒精度及干浸出物含量达到最高,酒样F33-1及CF、PF干浸出物显著高于其他处理组(酒样CM除外)(P<0.05);表明混菌发酵有利于提升葡萄酒总酸及干浸出物的含量,这与何晓丽等[24]的研究结果相似。
表3 混菌顺序发酵的赤霞珠干红葡萄酒理化指标
Table 3 Physicochemical indexes of Cabernet Sauvignon dry red wines by sequential fermentation with mixed yeasts
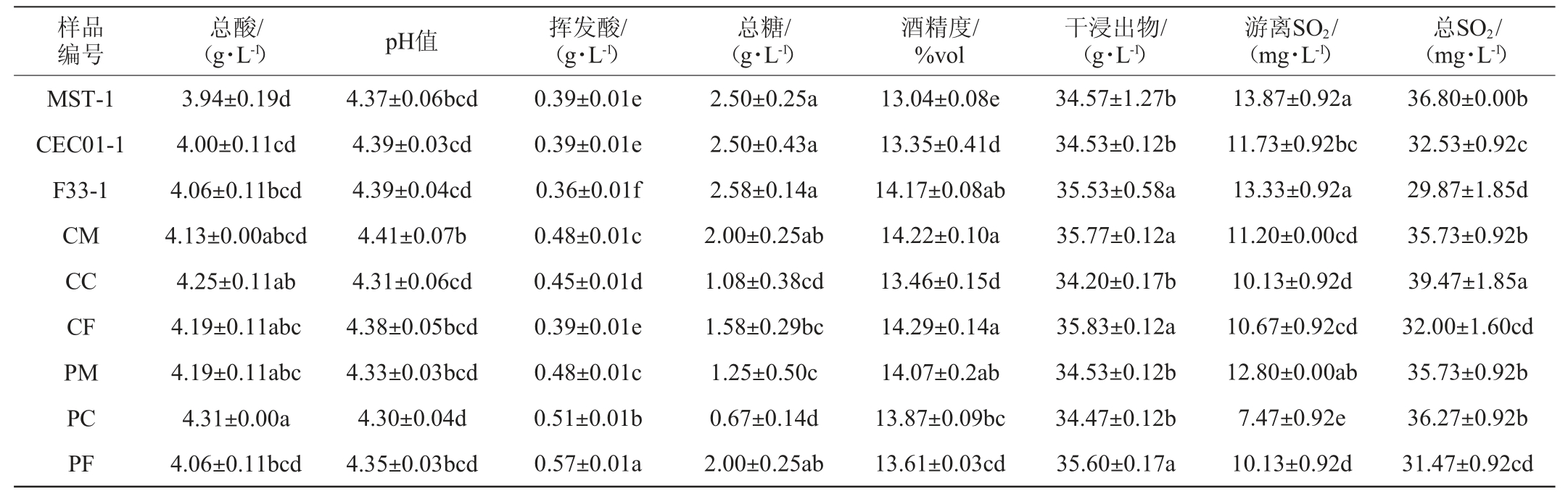
注:不同小写字母表示差异性显著(P<0.05)。下同。
2.3 混菌顺序发酵对葡萄酒颜色的影响
2.3.1 混菌顺序发酵对葡萄酒色度、色调的影响
各葡萄酒酒样色度、色调的测定结果见图2。
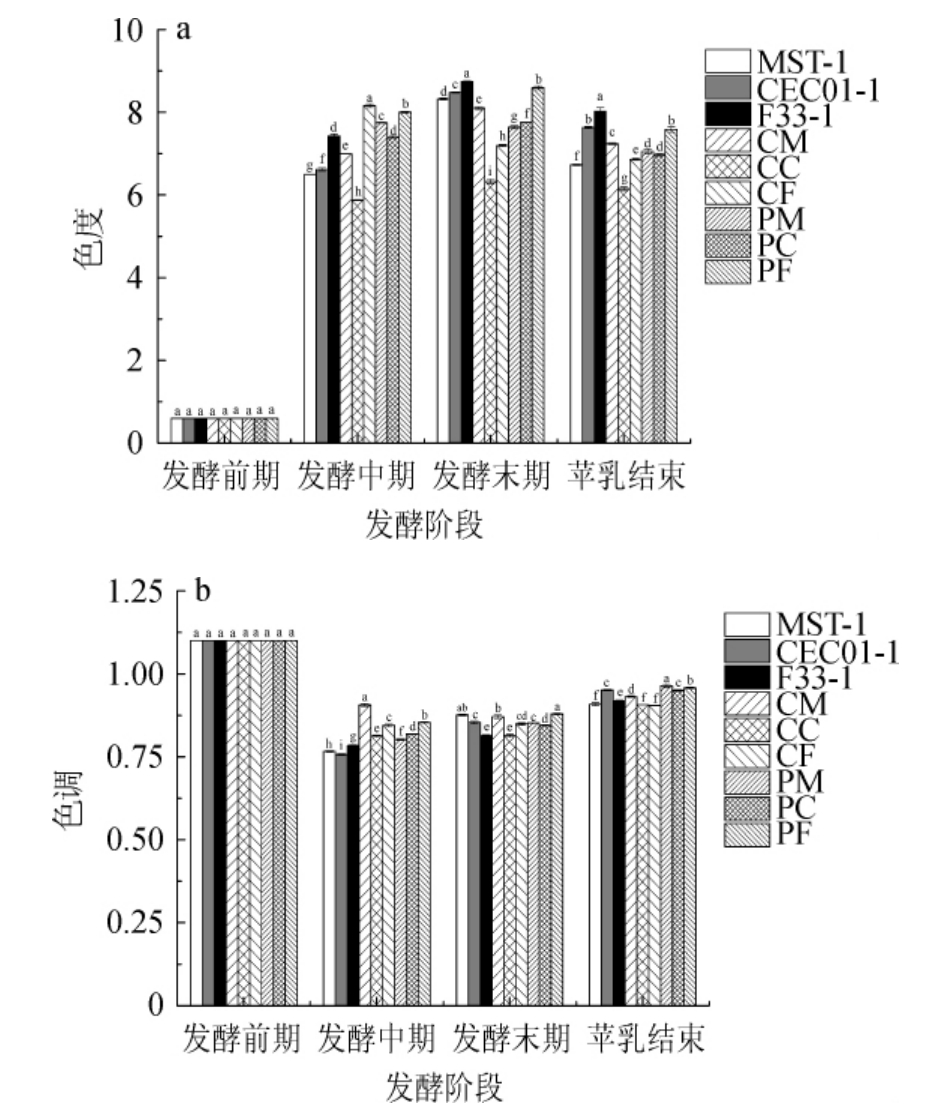
图2 混菌顺序发酵赤霞珠葡萄酒的色度(a)及色调(b)
Fig.2 Chroma (a) and hue (b) of Cabernet Sauvignon wines by sequential fermentation with mixed yeasts
由图2a可知,随着酒精发酵的进行色度呈上升趋势,说明各酒样颜色在向红色调转移,苹乳发酵结束后色度略有下降,酒样CM、PM的色度显著高于对照组(P<0.05),其他酵母组合色度值均显著低于对照组(P<0.05),这可能是酵母对酒样颜色得吸附作用引起的[25];色调值越高表明酒的色调越偏向黄色,越低越偏向于红色[26]。由图2b可知,酒精发酵过程中色调的变化先下降而后略有上升,苹乳发酵结束后色调值发生小幅上升,表明酒样黄色调略有增加,其中酒样CC、CF显著低于对照组和B组酒样(P<0.05),王玉华等[27]研究发现,L.thermotolerans与S.pombe顺序接种发酵能够提升美乐干红葡萄酒色度降低色调,与本研究结果相似,这可能与酵母细胞壁对葡萄酒颜色的吸附作用有关[28],且添加增酸非酿酒酵母吸附效果较为突出,表明与增酸非酿酒酵母混菌发酵有固色作用。
2.3.2 混菌顺序发酵对葡萄酒WCP、WC、PPC值的影响
各葡萄酒酒样WCP、WC、PPC值的测定结果见图3。WCP与游离态的花色苷密切相关,WC包含了易被氧化的花色苷,PPC则是单体花色苷与酚类物质间相互作用聚合而成的多酚[29]。由图3a可知,混菌顺序发酵葡萄酒总色素在酒精发酵期间呈不断上升趋势,苹乳发酵结束后各酒样总色素略有下降,其中酒样MST-1、CEC01-1、PF下降幅度相对较少。由图3b可知,葡萄酒颜色在酒精发酵阶段不断升高,苹乳发酵结束后则再次上升,对照组及酒样CM升高较多,而除酒样CM、PF外,其他组显著低于对照组(P<0.05)。由图3c可知,聚合色素在酒精发酵期间总体表现为上升趋势,苹乳发酵结束后,酒样MST-1、PM略有下降,其他组均有不同程度上升,其中酒样F33-1最高,其次为酒样PF,酒样CM与PM则显著高于酒样MST-1(P<0.05),说明适当的混菌发酵有利于稳定葡萄酒的颜色,这一结果与BENITO Á等[5]研究结果有相似之处。这可能是因为混菌发酵能够促进葡萄糖苷特定前体物产量的增加,提高了稳定色素葡萄糖苷的合成[30]。
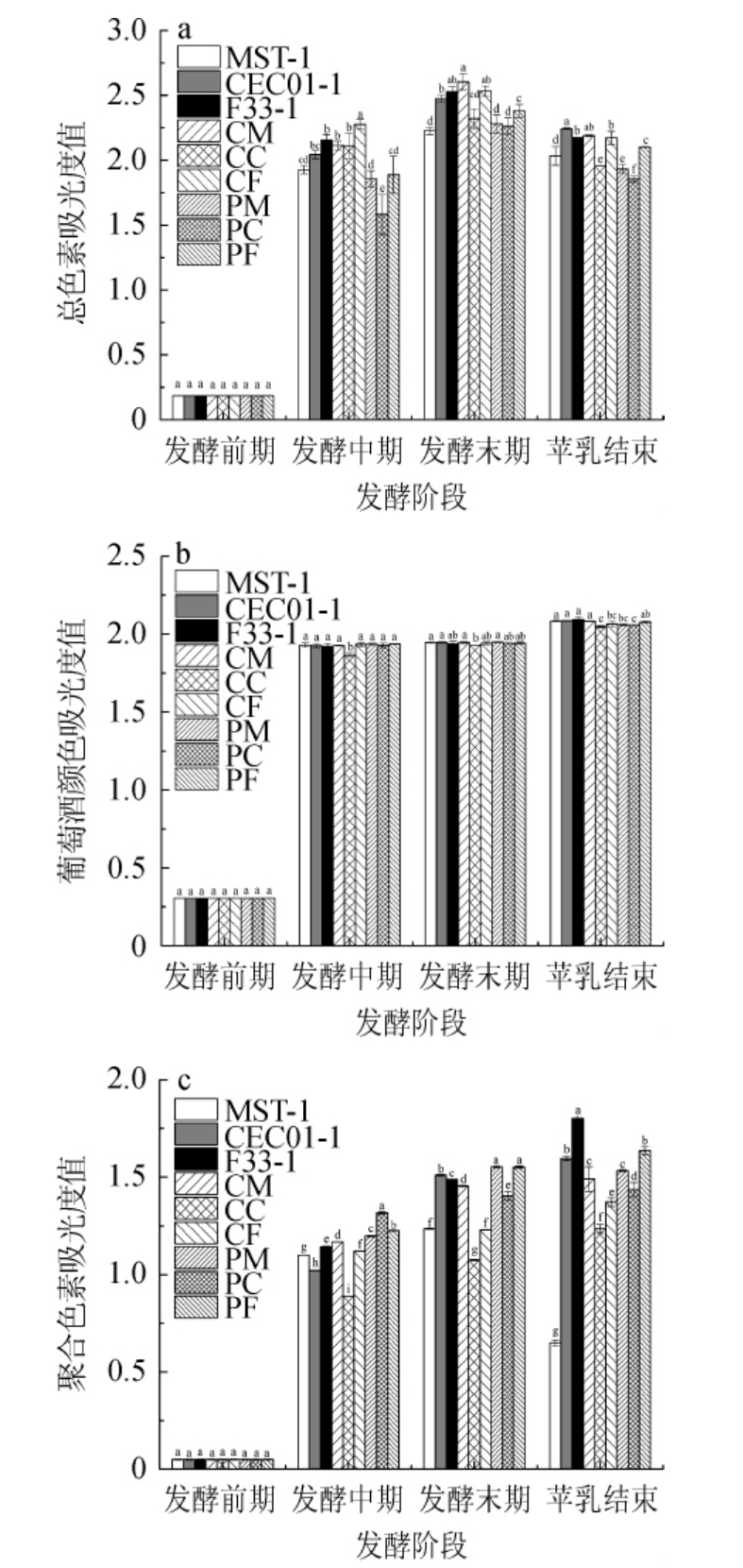
图3 混菌顺序发酵赤霞珠干红葡萄酒的总色素(a)、葡萄酒颜色(b)及聚合色素(c)
Fig.3 Total pigments (a),wine color (b),polymeric pigment (c) of Cabernet Sauvignon dry red wine by sequential fermentation with mixed yeasts
2.4 混菌顺序发酵对葡萄酒酚类物质含量的影响
各葡萄酒酒样酚类物质含量的测定结果见图4。由图4a可知,单宁含量随酒精发酵的进行不断上升,发酵末期混菌发酵酒样单宁含量(酒样PF除外)显著高于对照(P<0.05),苹乳发酵结束后酒样CEC01-1单宁含量大于其他两种酿酒酵母,混菌发酵酒样PF达到最高值3 550.28 mg/L,比酒样F33-1上升17.74%,差异性显著(P<0.05),其次为酒样CM,比酒样MST-1上升12.30%。此外,不难发现A组单宁含量略高于B(酒样PF除外)组,宋淑燕[31]研究发现,加酸对葡萄酒单宁含量略有提升作用,本研究中的现象则可能是因为生物增酸所导致的。
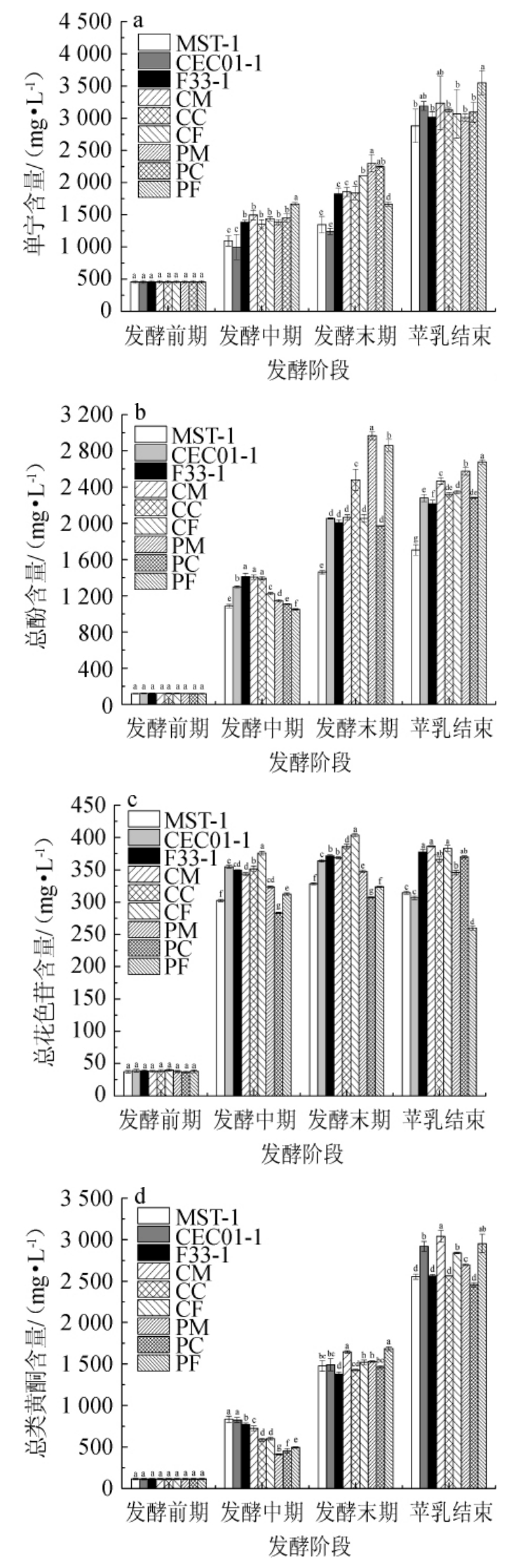
图4 混菌顺序发酵赤霞珠干红葡萄酒中单宁(a)、总酚(b)、总花色苷(c)及总类黄酮(d)含量
Fig.4 Tannin (a),total phenols (b),total anthocyanins (c) and total flavonoids (d) contents in Cabernet Sauvignon dry red wine by mixed order fermentation
由图4b可知,总酚含量随酒精发酵的进行呈上升趋势,发酵末期混菌发酵酒样(PM、PF、CC)总酚含量显著高于对照(P<0.05),苹乳发酵结束后酒样PF总酚含量最高,其次为酒样PC、CM,混菌发酵酒样总酚含量高于对照(P<0.05),酒样CEC01-1除外,其中酒样CM、PM比酒样MST-1分别提升44.68%、50.96%,酒样PF比F33-1提升20.96%,说明混菌顺序发酵有提升葡萄酒中总酚含量的作用,而酒样CC、PM、PF出现小幅下降,可能因为菌株的不同酵母细胞壁对酚类物质的吸附作用有差异,因而出现降低的现象[32],CARIDI A等[33]的研究也发现,不同菌株对葡萄酒酚类物质保护作用不同。
由图4c可知,总花色苷含量随酒精发酵的进行基本呈不断上升趋势,发酵中期与末期变化趋势基本相似,发酵末期A组酒样与酒样PM总花色苷含量显著高于对照组(P<0.05),苹乳发酵结束后酒样CM、PC、F33-1总花色苷含量持续上升,而酒样PF下降19.81%,比酒样F33-1低31.25%。其他混菌发酵酒样总花色苷含量显著高于对照组(P<0.05),其中酒样CM、PM分别比酒样MST-1提升22.90%、9.90%,酒样CC、PC分别比酒样CEC01-1提升19.40%、20.60%,说明非酿酒酵母与酿酒酵母顺序接种发酵有利于总花色苷的浸出,可能是因为总花色苷在这些酵母细胞壁上的吸收较低,或推迟了聚合过程[33]。
由图4d可知,随酒精发酵的进行总类黄酮不断地被浸出,到达发酵末期混菌发酵效果更为明显,苹乳发酵结束后,酒样CM、PF、CEC01-1含量较高,酒样CM、PM比MST-1分别升高19.02%、5.59%,酒样CF、PF比F33-1分别升高10.88%、15.34%,差异性显著(P<0.05),说明混菌顺序发酵对葡萄酒中总类黄酮含量略有提升作用,这可能同样是因为总类黄酮在这些酵母壁上的吸收较低,因而呈现出较高的含量[33]。
2.5 感官评价
各葡萄酒酒样感官评价结果见表4。由表4可知,混菌顺序发酵对赤霞珠干红葡萄酒感官质量有较大的影响,混菌发酵的葡萄酒总分显著高于纯酿酒酵母发酵酒(P<0.05),对照组总分在12.65~14.04分,混菌发酵酒样总分则在15.67~17.18分,根据AWS法评价分别为“好”和“优秀”,这与FRESNO J M D等[30]研究结果相似,从外观得分可以看出混菌发酵可评价为“好”,说明混菌发酵比单一酵母发酵酒的外观品质好,而外观品质与颜色品质息息相关;香气得分中混菌发酵酒样总分在5.34~5.73分,可评价为“优秀”,而单一酿酒酵母发酵总分在4.06~4.38分,则评价为“好”,说明混菌发酵有利于葡萄酒香气的提升;口感结构得分中酒样CM、PF得分分别为5.10~5.03分,可被评价为“优秀”,其他混菌发酵酒样得分在4.74~4.94分,对照组得分在4.00~4.29分,均可评价为“好”;后味(酒样MST-1除外)和整体印象得分在2.00~2.34分与1.12~1.63分,均可评为“好”,但相对而言混菌发酵得分较单一酵母发酵酒高。综上,说明混菌发酵比单一酵母发酵更有利于葡萄酒感官品质的提升,且不同酵母效果差异明显,其中酒样CM、PF相比于其他酒样的香气更复杂,口感更圆润饱满。
表4 混菌顺序发酵赤霞珠干红葡萄酒感官评价结果
Table 4 Results of sensory evaluation of Cabernet Sauvignon dry red wines by sequential fermentation with mix yeasts

2.6 相关性分析
如表5所示,总酸与总花色苷、感官得分显著正相关(P<0.05),表明总酸越高,葡萄酒中花色苷含量越高,而与酸对应的pH则与WC显著正相关(P<0.05),表明高pH会使葡萄酒中不稳定的花色苷增多,因此增酸有利于葡萄酒颜色的稳定;酒精度与PPC、总花色苷、感官得分极显著正相关(P<0.01),说明较高的酒精度可以提升葡萄酒颜色的稳定性以及感官得分;色度与WCP、WC、PPC极显著正相关(P<0.01);色调与PPC、总酚极显著正相关(P<0.01),与总花色苷显著负相关(P<0.05);PPC与总酚极显著正相关(P<0.01),表明总酚含量越高,聚合色素含量越高;总类黄酮与干浸出物、WCP、单宁、总酚极显著正相关(P<0.01);感官得分与PPC、总类黄酮显著正相关(P<0.05),与总酚极显著正相关(P<0.01),说明较高的酚类物质含量可以使葡萄酒颜色更稳定,得到更高的感官得分,从而得到品质较好的葡萄酒。
表5 混菌顺序发酵赤霞珠干红葡萄酒指标相关性分析
Table 5 Indexes correlation analysis of Cabernet Sauvignon dry red wines by sequential fermentation with mixed yeasts

注:“*”和“**”分别表示相关性达到0.05和0.01的显著水平。
3 结论
本研究采用2种非酿酒酵母与3种酿酒酵母混菌顺序发酵赤霞珠干红葡萄酒,通过分析不同发酵阶段颜色与酚类物质的变化及感官品评。结果表明,混菌发酵能够稳定葡萄酒色泽品质,提升酚类物质含量,提高感官得分。其中以酒样CM、PF效果最佳,CM能增加3.47%酸度而更好的平衡葡萄酒的口感,PF能更好的提升葡萄酒单宁17.74%、总酚20.96%以增强葡萄酒的结构,从而增强葡萄酒的骨架,根据AWS感官评价两者得分均为“优秀”,高出对照20%以上,因而为非酿酒酵母的选择和利用提供了理论依据。
[1]孙悦,杨慧敏,何荣荣,等.商业酵母在葡萄酒工业化生产中的定殖情况分析[J].中国农业科学,2021,54(9):2006-2016.
[2]LIU P T,LU L,DUAN C Q,et al.The contribution of indigenous non-Saccharomyceswine yeast to improved aromatic quality of Cabernet Sauvignon wines by spontaneous fermentation[J].LWT-Food Sci Technol,2016,71:356-363.
[3]董琦楠,叶冬青,梁艳英,等.高产酸本土非酿酒酵母菌株的筛选及发酵性能研究[J].中国酿造,2021,40(8):70-75.
[4]BENITO S.The impacts of Lachancea thermotolerans yeast strains on winemaking[J].Appl Microbiol Biot,2018,102(16):6775-6790.
[5]BENITO Á,CALDERÓN F,PALOMERO F,et al.Quality and composition of airén wines fermented by sequential inoculation of Lachancea thermotolerans and Saccharomyces cerevisiae[J].Food Technol Biotechnol,2016,54(2):135-144.
[6]VILELA A.Use of nonconventional yeasts for modulating wine acidity[J].Fermentation,2019,5(1):27.
[7]CLAVIJO A,CALDERÓN I L,PANEQUE P.Diversity of Saccharomyces and non-Saccharomyces yeasts in three red grape varieties cultured in the Serranía de Ronda(Spain)vine-growing region[J].Int J Food Microbiol,2010,143(3):241-245.
[8]LI H M,JIANG D Q,LIU W L,et al.Comparison of fermentation behaviors and properties of raspberry wines by spontaneous and controlled alcoholic fermentations[J].Food Res Int,2020,128:108801.
[9]尤雅,段长青,燕国梁.扁平云假丝酵母与酿酒酵母混合发酵对葡萄酒乙醇含量及香气的影响[J].食品科学,2018,39(20):146-154.
[10]ZHANG B Q,IVANOVA-PETROPULOS V,DUAN C Q,et al.Distinctive chemical and aromatic composition of red wines produced by Saccharomyces cerevisiae co-fermentation with indigenous and commercial non-Saccharomyces strains[J].Food Biosci,2021,41:100925.
[11]RENAULT P,COULON J,REVEL G D,et al.Increase of fruity aroma during mixed T.delbrueckii/S.cerevisiae wine fermentation is linked to specific esters enhancement[J].Int J Food Microbiol,2015,207:40-48.
[12]HU K,QIN Y,TAO Y S,et al.Potential of glycosidase from non-Saccharomyces isolates for enhancement of wine aroma[J].J Food Sci,2016,81(4):M935-M943.
[13]金宇宁.东北葡萄产区不同产地及树龄对‘北冰红’酒质影响的研究[D].北京:中国农业科学院,2021.
[14]MORATA A,BENITO S,LOIRA I,et al.Formation of pyranoanthocyanins by Schizosaccharomyces pombe during the fermentation of red must[J].Int J Food Microbiol,2012,159(1):47-53.
[15]BENITO Á,MORATA A,PALOMERO F,et al.Formation of vinylphenolic pyranoanthocyanins by Saccharomyces cerevisiae and and Pichia guillermondii in red wines produced following different fermentation strategies[J].Food Chem,2011,124(1):15-23.
[16]郝笑云.贺兰山东麓新红葡萄酒酚类物质对颜色影响的研究[D].银川:宁夏大学,2013.
[17]FANZONE M,PEÑA-NEIRA A,GIL M,et al.Impact of phenolic and polysaccharidic composition on commercial value of Argentinean Malbec and Cabernet sauvignon wines[J].Food Res Int,2012,45(1):402-414.
[18]鲁榕榕.瓶内二次发酵及带酒泥陈酿对‘贵人香’起泡葡萄酒品质影响的研究[D].兰州:甘肃农业大学,2018.
[19]BRAJKOVICˊM B,SREDOVICˊI D.The determination of titratable acidity and total tannins in red wine[J].J Agr Sci,2009,54(3):223-246.
[20]翦祎,韩舜愈,张波,等.单一pH 法、pH 示差法和差减法快速测定干红葡萄酒中总花色苷含量的比较[J].食品工业科技,2012,33(23):323-325,423.
[21]杨雪峰,翟婉丽,原雨欣,等.“放血”(saignée)发酵工艺中媚丽不同酒种质量变化[J].食品与发酵工业,2019,45(2):129-135.
[22]陈彤国,袁缓缓,雷小青,等.不同皮籽比例对葡萄酒酚类物质和感官特性的影响[J].食品与发酵工业,2019,45(4):117-122,128.
[23]张曼,钟涛,魏雪,等.不同非酿酒酵母与酿酒酵母混合发酵对脆红李酒品质的影响[J].食品与发酵工业,2021,47(12):110-116.
[24]何晓丽,马成武,许引虎,等.非酿酒酵母对河西走廊黑比诺葡萄酒发酵品质的影响[J].酿酒科技,2021(5):112-116.
[25]ECHEVERRIGARAY S,SCARIOT F J,MENEGOTTO M,et al.Anthocyanin adsorption by Saccharomyces cerevisiae during wine fermentation is associated to the loss of yeast cell wall/membrane integrity[J],Int J Food Microbiol,2020,314(1):108383.
[26]金洪伟,梁恒宇,郭坤,等.酿酒酵母F15和CC17共接种发酵对赤霞珠葡萄酒品质及感官特性的影响[J].食品工业科技,2021,42(8):109-116.
[27]王玉华,盛文军,李敏,等.耐热克鲁维酵母和粟酒裂殖酵母顺序接种发酵对美乐干红葡萄酒品质的影响[J].食品科学,2019,40(8):102-111.
[28]王琨,张军翔,张毅,等.不同商用酵母对葡萄酒外观品质影响机理研究[J].中外葡萄与葡萄酒,2008(6):32-34.
[29]李斌斌,赵晓敏,周鹤,等.不同冷浸渍时间对干红葡萄酒酚类物质和色泽品质的影响[J].食品与发酵工业,2019,45(18):183-188,194.
[30]FRESNO J M D,MORATA A,LOIRA I,et al.Use of non-Saccharomyces in single-culture mixed and sequential fermentation to improve red wine quality[J].Eur Food Res Technol,2017,243(12):2175-2185.
[31]宋淑燕.葡萄醪总酸调整对红葡萄酒品质的影响研究[J].宁夏农林科技,2009(1):40-41.
[32]谭玉岩,郝宁.酿酒酵母与非酿酒酵母混合发酵对果酒品质的影响[J].食品工业科技,2020,41(8):353-359.
[33]CARIDI A,CUFARI A,LOVINO R,et al.Influence of yeast on polyphenol composition of wine[J].Food Technol Biotech,2004,42(1):37-40.