蓝莓富含酚类物质,如花色苷、单宁、酚酸等,具有显著的营养价值和抗氧化能力[1-2]。蓝莓单宁(tannins,TA)主要存在于果皮和籽中[3],在酿造过程中释放到蓝莓酒中,赋予其复杂的口感和抗氧化功效。然而,从皮或籽中释放出的单宁会被酒醪或酒体中的细胞壁多糖吸附形成沉淀,导致蓝莓酒中单宁的含量降低[4-6]。单宁作为蓝莓酒的“骨架”,对于酒体的口感、颜色和抗氧化性具有积极的作用,尤其是被细胞壁率先吸附的高聚合度单宁贡献着酒体的收敛性和色泽[7-8],影响着其品质。一些研究表明,在发酵前通过提高浸渍温度和延长浸渍时间能够增加葡萄醪中单宁的含量[9-10],但会带来生产成本增加和时间变长的问题。
葡萄酒酿造过程中,单宁的含量会下降,主要原因是这些成分与悬浮的葡萄细胞壁之间发生了相互作用[11]。OSETE-ALCARAZ A等[12]研究发现,酿造初期清除悬浮的细胞壁,酿造结束后葡萄酒中的单宁含量可提高43%。有研究结果表明,添加果胶酶和纤维素酶能够改变细胞壁多糖的网络结构,从而减少细胞壁对单宁的吸附量[13-14]。
蓝莓细胞壁主要由果胶、纤维素和半纤维素等多糖构成[15],在酿酒过程中可被水解酶解构,降低其对单宁的吸附能力。BAUTISTA-ORTIN A B等[16]研究表明,单宁的分子质量越大,与细胞壁多糖的亲和力越强。WANG Y F等[17]研究发现,蓝莓中的单宁多为B型缩合单宁和高分子质量单宁,易与细胞壁多糖结合形成复合物而降低其在蓝莓酒中的含量。
因此,水解酶的添加有可能减少蓝莓酒酿造过程中细胞壁对单宁的吸附,进而提高蓝莓酒中单宁的含量,目前这方面的研究还有待深入。本研究的主要目的是探究果胶酶和纤维素酶的添加方式(单独、顺序及同时)对蓝莓细胞壁结构及其吸附单宁能力的影响,旨在为蓝莓酒酿造过程中酶或酶组合的选择提供参考。
1 材料与方法
1.1 材料与试剂
兔眼蓝莓(品种:灿烂):由云南省玉溪市安琼蓝莓种植基地提供。
三氟乙酸(分析纯):上海麦克林生物科技有限公司;(+)-儿茶素、(-)-表儿茶素、(-)-表没食子儿茶素、(-)-表儿茶素没食子酸酯、D-(+)-半乳糖醛酸标准品:上海源叶生物科技公司;果胶酶(pectinase,PEC)EC 3.2.1.15(30 000 U/g)、纤维素酶(cellulase,CEL)EC 3.2.1.4(25 000 U/g)、蓝莓单宁标准品(纯度>98%)、甲基纤维素(黏度1 500 CP)、抗坏血酸、3,5-二硝基水杨酸、间苯三酚(均为分析纯)、乙腈、甲酸(均为色谱级):上海阿拉丁生物科技股份有限公司。
1.2 仪器与设备
e2695高效液相色谱仪(high performance liquid chromatography,HPLC):美国Waters公司;3-18K高速冷冻离心机:德国Sigma公司;UV-1700紫外-可见光分光光度计:日本岛津公司;LC-10N-50A真空冷冻干燥机:上海力辰仪器科技有限公司;NicoLET IS50 FT-IR光谱仪:美国Thermo Nicolet公司;TM3030 Plus扫描电镜:日本Hitachi公司。
1.3 方法
1.3.1 蓝莓细胞壁的纯化
以新鲜蓝莓果皮为原料,参考APOLINAR-VALIENTE R等[18]的方法制备纯化细胞壁(cell walls,CW)。首先,清洗蓝莓以除去灰尘,然后用刀片将皮与果肉剥离。随后将果皮放置液氮中速冻并研磨成粉末,将果皮粉末悬浮在沸水中5 min以灭活内源酶,待悬浮果皮粉末的沸水冷却至室温后,使用均质机(10 000 r/min)均质2 min。将均质后的混合物离心(10 000×g,15 min),丢弃上清液。将固体残留物用体积分数70%乙醇(30 ℃)洗涤数次以去除醇溶性固体和酚类物质,用乙醇(体积分数96%)和丙酮分别洗涤3次。最后,将不溶性残留物冻干后研磨成粉末,即为CW,在室温下储存于干燥皿中备用。
1.3.2 酶处理方式对蓝莓细胞壁吸附单宁的影响
反应体系的设置参考BAUTISTA-ORTÍN A B等[19]的方法,配制模拟溶液(含12%的乙醇并用三氟乙酸将pH调至3.6,使用三氟乙酸调pH有助于稳定单宁的结构和提高高效液相色谱检测的灵敏度、准确度[20]),然后称取520 mg的CW到40 mL模拟溶液中,混合均匀后添加不同的细胞壁水解酶和80 mg单宁进行反应。反应体系中,单宁和CW的最终质量浓度分别为2 mg/mL和13 mg/mL。酶的添加方式参考NOGALES-BUENO J等[21]的方法,如表1所示。然后用磁力搅拌器将反应溶液搅拌90 min(200 r/min,25 ℃),反应期间避光,并用氮气吹扫。反应结束后,将样品离心(10 000×g,10 min),分别收集上清液和沉淀,并在4 ℃下储存备用。每个处理设置6次重复。其中3个重复的上清液经过浓缩(-0.1 MPa,50 ℃)后溶解在甲醇中(上清液∶甲醇=10∶1,V/V)用于分析单宁的含量,另外3个重复的上清液直接用于分析多糖的组成。收集的沉淀(即反应后的CW)用于分析细胞壁结构的变化。
表1 模拟溶液中酶的添加方式
Table 1 Enzyme addition ways in the model solution
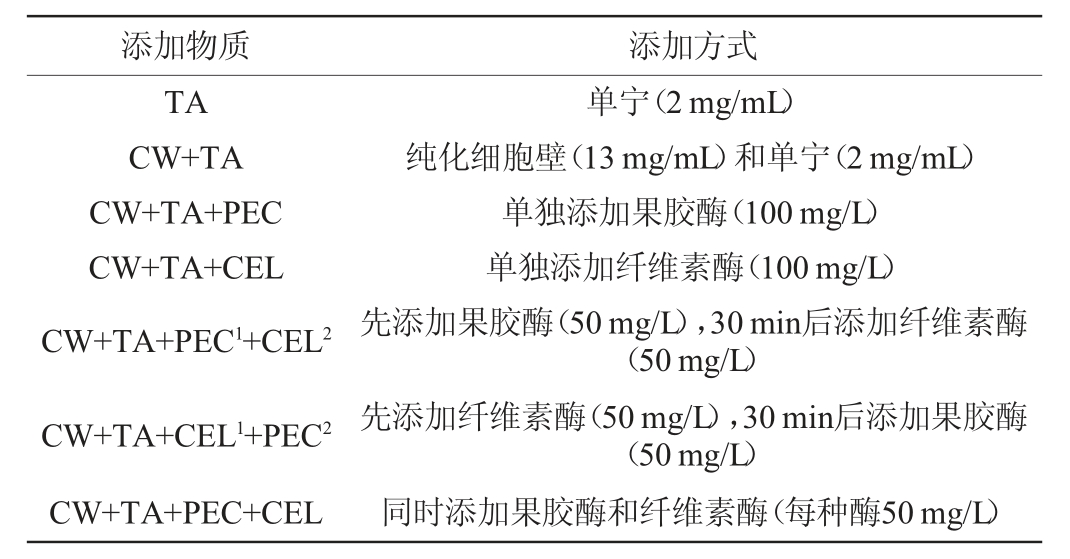
注:表中上标数字“1”和“2”分别代表“先添加”和“后添加”。
1.3.3 单宁含量的测定及吸附率计算
单宁含量的测定参考SARNECKI S C J等[22]的方法,使用4 g/100 mL的甲基纤维素溶液沉淀“1.3.2”上清液中的单宁。在波长280 nm处,分别测定上清液中未添加甲基纤维素溶液的吸光度值和添加甲基纤维素溶液的吸光度值,两者吸光度值相减,得到溶液中所含单宁的吸光度值,然后根据(+)-儿茶素标准曲线计算溶液中单宁的含量,结果表示为每毫升模拟溶液的(+)-儿茶素当量(mg/mL)。以吸光度值(y)为纵坐标,(+)-儿茶素质量浓度(x)为横坐标,绘制标准曲线,得到回归方程为y=0.365 9x+0.053 2。通过标准曲线计算单宁含量。
单宁吸附率的计算公式如下:
式中:C为实验组中单宁的含量,mg/mL;C0为空白组(TA)反应后单宁的含量,mg/mL。
1.3.4 单宁组成的分析
参照KENNEDY J A等[23]的方法并略微修改,分析“1.3.2”上清液中单宁的组成。首先配制含100 g/L间苯三酚和20 g/L抗坏血酸的0.2 mol/L HCl的甲醇溶液(称为间苯三酚分解试剂)。然后将间苯三酚分解试剂与“1.3.2”中上清液的甲醇提取物(1∶1)在65 ℃的水浴中反应30 min,并用2倍体积的0.2 mol/L醋酸钠溶液终止反应。
分析条件:检测器为光电二极管阵列检测器(photodiode array detector,PAD),波长为280 nm。洗脱条件参考BUSSE-VALVERDE N等[24]的方法。流动相A:体积分数为2%的甲酸溶液;流动相B:乙腈-水-甲酸体积比为80∶18∶2;TC-C18色谱柱(250 mm×4.6 mm,5 μm);流速为0.8 mL/min,进样体积10 μL,温度30 ℃。梯度洗脱程序为:0~5 min,0%B;5~35 min,0%~10%B;35~65 min,10%~20%B。单宁裂解产物的组成根据它们在波长280 nm处的响应值进行鉴定,以(+)-儿茶素为标准品进行定量。单宁的构成单元参照文献[23]进行定性。平均聚合度(mean degree of polymerization,mDP)的计算方法为所有亚基(即黄烷-3-醇单体和间苯三酚加合物,以摩尔为单位)的总和除以所有黄烷-3-醇单体的总和(以摩尔为单位)。
单宁没食子酰化百分比(percentage of galloylation,Gal)的计算:

1.3.5 半乳糖醛酸和总糖含量的测定
溶液中半乳糖醛酸含量的测定参考文献[25]中的方法。在波长540 nm处测量吸光度值,以D-(+)-半乳糖醛酸为定量标准计算样品中半乳糖糖醛酸的含量。重复分析3次,结果取平均值。
总糖含量的测定参考杨宁等[26]的方法并略作修改。取2 mL待测液并添加7 mL稀盐酸,80 ℃水浴20 min。反应结束后,用2.5 mol/L NaOH将溶液的pH调至7.0。取3 mL 3,5-二硝基水杨酸添加到溶液中,沸水浴9 min,冷却至室温并在波长540 nm处测量吸光度值。总糖的含量以D-(+)-葡萄糖为标准品进行定量。重复分析3次,结果取平均值。
1.3.6 纯化细胞壁多糖化学结构的分析
参考BUREAU S等[27]的方法,将CW和“1.3.2”中反应后的纯化细胞壁样品冻干,并储存在P2O5环境中以去除残留的水分。红外光谱在波数4 000~500 cm-1范围内测定,并用空气背景光谱进行校正,信号累计扫描次数32次,每个样本重复扫描3次。
1.3.7 纯化细胞壁微观结构的分析
将CW和“1.3.2”中反应后的纯化细胞壁样品用双面胶带固定在样品台上,并用溅射镀膜机溅射金粉。在高真空条件下观察图像,加速电压为10 kV,图像放大倍数为1 000。
1.3.8 数据统计与分析
每个数据平行测量3次。数据表示为“平均值±标准偏差”,采用SPSS 22.0软件对结果进行方差分析(analysis of variance,ANOVA),然后用Duncan检验进行组间多重比较来分析数据之间的显著性差异(P<0.05),使用Origin 2018软件作图。
2 结果与分析
2.1 酶处理方式对模拟溶液中单宁含量的影响
由图1可知,与空白组(TA)相比,添加纯化后的蓝莓细胞壁(CW+TA)显著降低模拟体系上清液中单宁的含量(P<0.05),单宁的吸附率达51.9%。与对照组(CW+TA)相比,添加水解酶提高了模拟体系中单宁的含量,除单独使用果胶酶组(CW+TA+PEC)外,其他各组差异均显著(P<0.05)。在添加酶试验组中,同时使用果胶酶和纤维素酶组(CW+TA+PEC+CEL)单宁含量最高,为1.26 mg/mL,显著高于其他各组(P<0.05)。在顺序添加酶试验组中,优先使用果胶酶组(CW+TA+PEC1+CEL2)的单宁含量显著高于优先使用纤维素酶组(CW+TA+CEL1+PEC2)(P<0.05)。
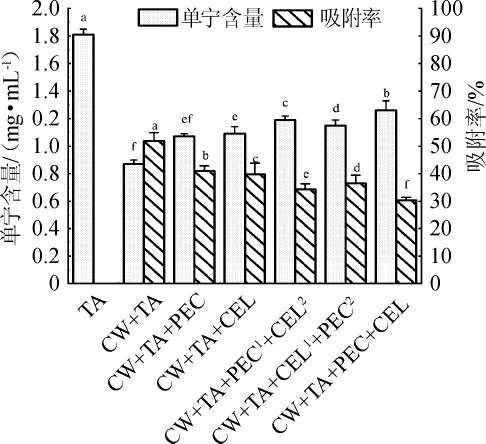
图1 酶处理方式下模拟溶液中单宁的含量和吸附率
Fig.1 Content and adsorption rate of tannins in model solution with enzyme treatment
不同组别小写字母表示差异显著(P<0.05)。
酶处理组单宁的含量均高于对照组(CW+TA),这是由于在酶的作用下蓝莓细胞壁多糖网络被分解,细胞壁吸附单宁的能力减弱。CW+TA+PEC+CEL组单宁的吸附率最低为30.4%,这可能是由于同时添加果胶酶和纤维素酶能够有效分解蓝莓细胞壁中的果胶和纤维素,减少细胞壁对单宁的吸附。OSETE-ALCARAZ A等[28]的研究表明在模拟葡萄酒溶液中同时添加果胶裂解酶和多聚半乳糖醛酸酶使细胞壁多糖分解的最显著,并释放低分子质量的可溶性多糖到溶液中,降低了单宁与细胞壁多糖之间的相互作用。CW+TA+PEC1+CEL2组和CW+TA+CEL1+PEC2组单宁的吸附率分别为34.3%和36.5%,表明优先加入果胶酶能够更大程度地保留溶液中单宁的含量,这可能是由于细胞壁中果胶的解构有利于纤维素酶分解纤维素,进而减少细胞壁对单宁的吸附量[29]。CW+TA+PEC1+CEL2组单宁的吸附率(34.3%)高于CW+TA+PEC+CEL组(30.4%),这可能是由于细胞壁孔隙率的增加会促进高分子质量单宁在细胞壁网络框架中的包裹[14],因此增加了细胞壁对单宁的吸附率。
单宁含量的提高可能会增加蓝莓酒的涩感,然而酒体涩感的强度不仅取决于单宁的含量,还取决于单宁的组成和平均聚合度[30]。此外,酒体的pH、酒精度、多糖含量等成分,都会对酒体的涩感产生一定程度的影响[31]。因此,酒体中单宁的含量并不完全是判定涩感强弱的唯一指标。适度的涩感使得酒体口感醇厚、后味绵长。在酿造过程中,酿酒师有时会添加单宁以增强酒体的口感和提高成品酒的营养价值。
2.2 酶处理方式对模拟溶液中细胞壁与单宁相互作用的影响
模拟体系上清液中单宁组成的分析参照文献[23]的方法。间苯三酚与单宁反应的机理如图2所示,在酸性条件下单宁发生解聚,释放出末端单元黄烷-3-醇单体(儿茶素、表儿茶素等)和延伸端单元黄烷-3-醇中间体(碳正离子形式),黄烷-3-醇中间体可以与间苯三酚结合生成可分析的加合物,仅末端的单元以黄烷-3-醇单体的形式稳定存在。
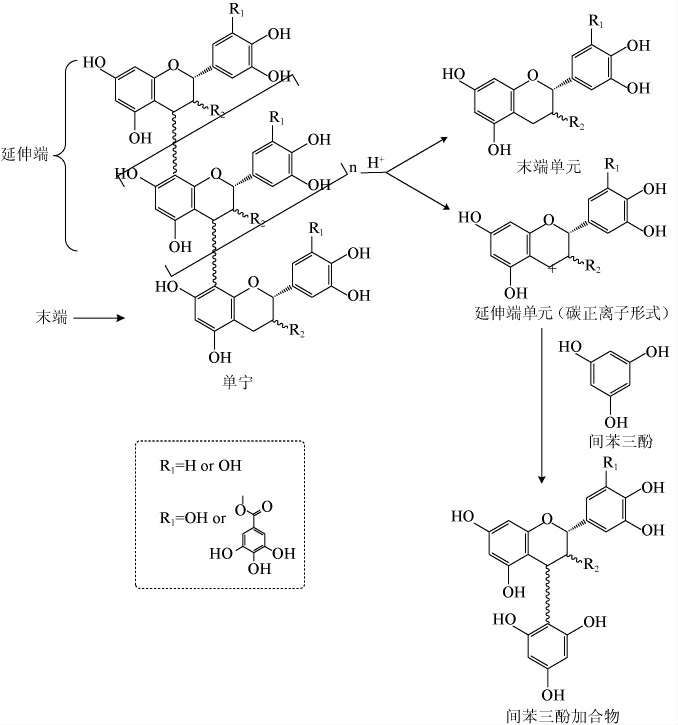
图2 间苯三酚与单宁反应的机理
Fig.2 Reaction mechanism of phloroglucinol and tannins
模拟溶液中单宁的亚基组成见图3。由图3可知,共检测出7种单宁亚基单体,其中包括3种末端单元和4种延伸端单元,参照文献[23-24]对间苯三酚加合物进行定性。
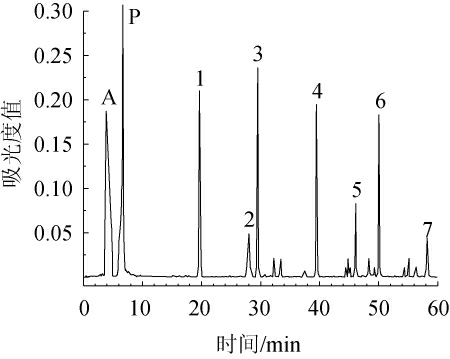
图3 间苯三酚存在下酸催化蓝莓单宁裂解产物的HPLC色谱图
Fig.3 HPLC chromatogram of blueberry tannin cleavage product catalyzed by acid catalysis in the presence of phloroglucinol
A:抗坏血酸;P:间苯三酚;1,2,3和5分别是(-)-表没食子儿茶素、(+)-儿茶素、(-)-表儿茶素和(-)-表儿茶素没食子酸酯的间苯三酚加合物;4、6和7分别是(+)-儿茶素、(-)-表儿茶素和(-)-表儿茶素没食子酸酯。
如表2所示,在单宁的构成单元中,(+)-儿茶素和(-)-表儿茶素是主要的亚基,这与蓝莓中多为B型缩合单宁的组成特征一致。与空白组(TA)相比,蓝莓细胞壁的存在(CW+TA)显著降低模拟体系上清液中单宁的平均聚合度(mDP)(P<0.05),为3.94。与对照组(CW+TA)相比,添加水解酶增加了模拟体系上清液中单宁的mDP,尤其同时添加果胶酶和纤维素酶最为显著,这表明酶的添加能够增加高聚合度单宁分子在溶液中的含量。研究表明,细胞壁吸附单宁的能力随单宁分子质量的增加而增强,高聚合度的单宁可能因具有更多结合细胞壁多糖的位点而优先被细胞壁吸附,而低聚合度的单宁因自缔合作用减少了其与细胞壁的结合[16,19,32]。本研究模拟溶液中高聚合度单宁分子含量的增加表明酶的添加降低了细胞壁结合单宁的能力,其中同时添加果胶酶和纤维素酶效果最为显著。CW+TA+PEC组溶液中剩余单宁的mDP(3.95)与CW+TA组(3.94)差异不显著(P>0.05),表明仅在果胶酶的作用下,细胞壁仍然保持着较强的吸附单宁的能力,这与“2.1”在所有添加酶试验组中,单独添加果胶酶处理组溶液中单宁的含量最低一致。
表2 酶处理方式下模拟溶液中单宁的组成
Table 2 Composition of tannins in model solution with enzyme treatment
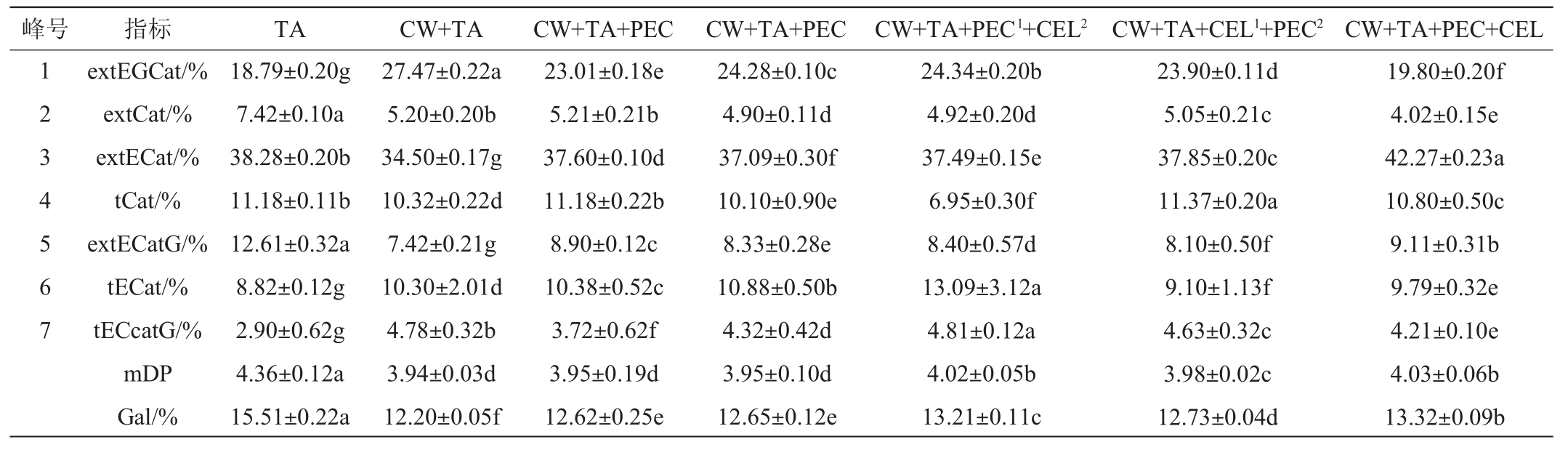
注:extEGCat:延伸端单元(-)-表没食子儿茶素与间苯三酚加合物的百分比;extCat:延伸端单元(+)-儿茶素与间苯三酚加合物的百分比;extECat:延伸端单元(-)-表儿茶素与间苯三酚加合物的百分比;tCat:末端单元(+)-儿茶素的百分比;extECatG:延伸端单元(-)-表儿茶素没食子酸酯与间苯三酚加合物的百分比;tECat:末端单元(-)-表儿茶素的百分比;tECcatG:末端单元(-)-表儿茶素没食子酸酯的百分比;mDP:平均聚合度;Gal:没食子酰化百分比。同行不同小写字母表示差异显著(P<0.05)。
与空白组(TA)相比,添加纯化后的蓝莓细胞壁使模拟体系上清液中单宁的没食子酰化百分比均显著降低(P<0.05)。这可能是因为单宁分子中没食子酸的取代增加了细胞壁多糖与单宁形成氢键的位点数量,所以没食子酰化百分比(Gal%)较高的单宁优先被细胞壁吸附[16]。结果表明,酶的添加能够提高模拟溶液中剩余单宁的Gal%,这表明酶处理后的细胞壁对单宁的吸附量减少,尤其是在同时添加果胶酶和纤维素酶时细胞壁对单宁的吸附能力最弱。
2.3 酶处理方式对模拟溶液中半乳糖醛酸和总糖含量的影响
为分析酶处理方式对分解果胶和细胞壁多糖能力的差异,模拟体系中半乳糖醛酸和总糖的含量见表3。
表3 模拟溶液中半乳糖醛酸和总糖含量
Table 3 Contents of galacturonic acid and total sugar in the model solution
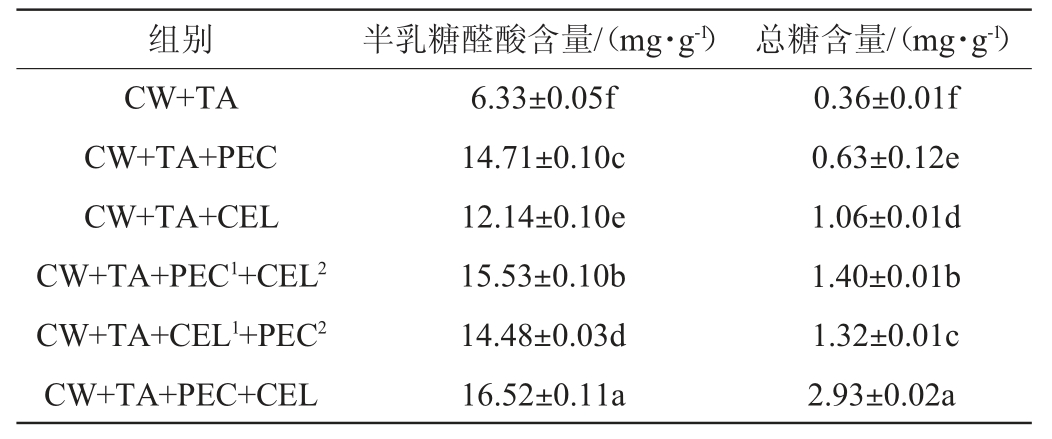
注:同列不同小写字母表示差异显著(P<0.05)。
由表3可知,在顺序添加酶试验组中,优先使用果胶酶组(CW+TA+PEC1+CEL2)的半乳糖醛酸含量显著高于优先使用纤维素酶组(CW+TA+CEL1+PEC2)(P<0.05)。在单独添加酶试验组中,单独添加纤维素酶组(CW+TA+CEL)的总糖含量显著高于单独添加果胶酶试验组(CW+TA+PEC)(P<0.05)。
CW+TA组溶液中含有少量的半乳糖醛酸和总糖,这表明模拟溶液能够促进CW中多糖的释放,这与BEAVER J W等[33]的研究结果一致。CW+TA+PEC1+CEL2组的半乳糖醛酸含量高于CW+TA+CEL1+PEC2组,可能是由于先添加果胶酶水解果胶,有利于纤维素酶破坏蓝莓细胞壁多糖的网络结构,这提高了果胶酶分解果胶的效率,增加溶液中半乳糖醛酸的含量。CW+TA+CEL组溶液中总糖含量显著高于CW+TA+PEC组(P<0.05),这可能是由于纤维素的分解使蓝莓细胞壁的多糖网络结构变疏松,有利于细胞壁内多糖的释放。有研究发现纤维素酶分解纤维素打开了细胞壁的结构,促进细胞壁内果胶多糖的释放,增加了溶液中总糖的含量[19,34],这在本实验单独添加纤维素酶处理方式下得到进一步的验证。酶处理后,溶液中半乳糖醛酸和总糖含量增加,表明蓝莓细胞壁多糖分解和释放,这可能解释细胞壁对单宁吸附能力降低的原因。
2.4 酶处理方式对细胞壁多糖结构的影响
红外光谱分析蓝莓细胞壁多糖化学结构的变化见图4。
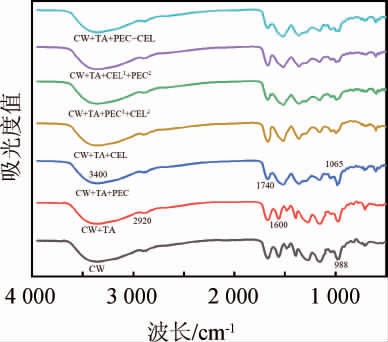
图4 酶处理方式下细胞壁多糖的傅里叶变换红外光谱
Fig.4 FT-IR of cell wall polysaccharides with enzyme treatment
由图4可知,细胞壁多糖在波数3 400 cm-1和2 920 cm-1处出现两个特征峰,分别与糖类的O-H和C-H的伸缩振动有关[35]。波数1 740 cm-1和1 600 cm-1处的两个吸收峰分别与果胶中的酯化羧基(-COOR)和非酯化羧基的伸缩振动有关。波数1 065 cm-1处的吸收峰归因于糖苷键(C-O-C)的伸缩振动,这可能与半纤维素有关[36]。波数988 cm-1处的吸收峰是由于C-O、C-C的伸缩振动引起,这可能与纤维素有关[37]。LIU X W等[37]研究发现,在1 800~800 cm-1波数范围内,1 065 cm-1和988 cm-1处的吸收峰分别与半纤维素和纤维素的存在有关。由图4可知,在波数988 cm-1附近,CW组、CW+TA组、CW+TA+PEC组的特征吸收峰强度高于添加纤维素酶的处理组,这是由于未添加纤维素酶的细胞壁中含有较多的纤维素。ABIDI N等[38]运用红外光谱研究棉纤维中细胞壁和纤维素含量的变化,结果表明可以用吸收峰振动的综合强度间接估测纤维素的含量。在添加酶的试验组中,CW+TA+PEC+CEL组在波数1 740 cm-1和988 cm-1附近吸收强度最弱,这可能是由于同时添加果胶酶和纤维素酶使细胞壁中的果胶和纤维素大量分解。本研究表明,酶的不同添加方式对蓝莓细胞壁多糖的分解效果不同,这可能解释了不同处理组中细胞壁对单宁吸附能力不同的原因,但实际结果要根据对细胞壁微观结构的观察进一步验证。
2.5 酶处理方式对细胞壁微观结构的影响
如图5所示,纯化的细胞壁(CW)表面相对平滑、结构致密,CW+TA组(图5A)的细胞壁比CW破碎程度高。CW+TA+PEC组(图5B)比CW+TA+CEL组(图5C)的细胞壁结构分解程度较小,这与总糖含量分析结果一致。CW+TA+CEL1+PEC2组的细胞壁结构呈块状(图5E),而CW+TA+PEC1+CEL2组的细胞壁结构相对较为破碎,并具有一些微小的孔洞(图5D),表明优先添加果胶酶更有利于细胞壁结构的分解。CW+TA+PEC+CEL组细胞壁形态分布不均匀且呈碎片状(图5F),说明同时添加果胶酶和纤维素酶能够有效分解蓝莓细胞壁的结构,这验证了在此酶处理方式下单宁吸附率最低的结果。研究发现,细胞壁孔洞的增加将促进高聚合度单宁分子渗透到更疏松的细胞壁网络,增加细胞壁对高分子质量单宁的吸附量[14]。先添加果胶酶再添加纤维素酶处理方式下,细胞壁微小孔洞的形成可能是细胞壁对单宁吸附率高于同时添加果胶酶和纤维素酶的原因。

图5 不同酶处理方式下细胞壁的扫描电镜
Fig.5 Scanning electron microphotographs of cell walls with different enzyme treatment methods
CW代表纯化的蓝莓细胞壁;A~F分别代表CW+TA、CW+TA+PEC、CW+TA+CEL、CW+TA+PEC1+CEL2、CW+TA+CEL1+PEC2、CW+TA+PEC+CEL组中反应后的细胞壁。
3 结论
水解酶的不同添加方式均显著降低蓝莓细胞壁对高聚合度单宁的吸附量(P<0.05),提高模拟酒中单宁的含量。蓝莓单宁的组成单元主要是(+)-儿茶素和(-)-表儿茶素,水解酶的添加因分解蓝莓细胞壁的多糖结构而减少对高聚合度单宁的吸附量。在所有添加方式中,同时添加果胶酶和纤维素酶及先添加果胶酶再添加纤维素酶分别使细胞壁对单宁的吸附率降低21.5%和17.6%,先添加果胶酶再添加纤维素酶处理方式下,细胞壁微小孔洞的形成使得蓝莓细胞壁对单宁吸附率高于同时添加果胶酶和纤维素酶处理方式。本实试探究水解酶的不同添加方式对模拟酒中单宁含量的影响,为提升蓝莓酒的营养品质提供一定的理论参考依据。在后续研究中,可探究从细胞壁中释放出的多糖与单宁之间的相互作用机制,或探究限制蓝莓酒中的多糖对单宁吸附的方法。
[1]KIM J G,KIM H L,KIM S J,et al.Fruit quality,anthocyanin and total phenolic contents,and antioxidant activities of blueberry cultivars grown in Suwon,Korea[J].J Zhejiang Univ-SCI B,2013,14(9):793-799.
[2]SUN X Y,YAN Z C,ZHU T,et al.Effects on the color,taste,and anthocyanins stability of blueberry wine by different contents of mannoprotein[J].Food Chem,2018,279(11):63-69.
[3]SANTOS R O,TRINDADE S C,MAURER L H,et al.Physicochemical,antioxidant and sensory quality of Brazilian blueberry wine[J].An Acad Bras Cienc,2016,88(3):1557-1568.
[4]黄婷.蓝莓酒的非生物稳定性的研究[D].大连:大连工业大学,2015.
[5]任佳琦,刘昕,雷琳,等.苹果多酚/果胶相互作用及其对浊汁体系理化特性和稳定性的影响[J].食品科学,2021,42(10):14-22.
[6]王丽颖,李福香,杨雅轩,等.多糖与多酚相互作用机制及其对多酚特性的影响研究进展[J].食品科学,2017,38(11):276-282.
[7]舒楠,谢苏燕,路文鹏,等.延迟采收及不同酿造工艺对北国红山葡萄干红酒单宁含量影响[J].中国酿造,2019,38(2):173-176.
[8]谭立杭.红葡萄酒中缩合单宁特性与感官收敛性的关系研究[D].杨凌:西北农林科技大学,2019.
[9]李震,张乐宏,崔旋旋,等.不同浸渍工艺对夏黑葡萄醪理化指标及颜色的影响[J].中国酿造,2020,39(10):152-156.
[10]朱艳霞,杨佳荟,王沙沙,等.低温浸渍对‘关口葡萄’干白葡萄酒风味物质的影响[J].食品科学,2020,41(4):199-206.
[11]BINDON K A,SMITH P A,HOLT H,et al.Interaction between grapederived proanthocyanidins and cell wall material.2.Implications for vinification[J].J Agr Food Chem,2010,58(19):10736-10746.
[12]OSETE-ALCARAZ A,BAUTISTA-ORTIN A B,ORTEGA-REGULES A,et al.Elimination of suspended cell wall material in musts improves the phenolic content and color of red wines[J].Am J Enol Vitic,2019,70(2):201-204.
[13]OSETE-ALCARAZ A,GÓMEZ-PLAZAE,MARTÍNEZ-PÉREZ P.The influence of hydrolytic enzymes on tannin adsorption-desorption onto grape cell walls in a wine-like matrix[J].Molecules,2021,26(3):770-785.
[14]LE B C,BOUCHET B,RENARD C M G C.Non-covalent interaction between procyanidins and apple cell wall material.Part III:Study on model polysaccharides[J].Bio Bio Act,2005,1725(1):10-18.
[15]LIN Z S,PATTATHIL S,HAHN M G,et al.Blueberry cell wall fractionation,characterization and glycome profiling[J].Food Hydrocolloid,2019,90(5):385-393.
[16]BAUTISTA-ORTIN A B,CANO-LECHUGA M,RUIZ-GARCÍA Y,et al.Interactions between grape skin cell wall material and commercial enological tannins.Practical implications[J].Food Chem,2014,152(6):558-565.
[17]WANG Y F,FONG S,JOHNSON-CICALESE J,et al.Variation of anthocyanins,proanthocyanidins,flavonols,and organic acids in cultivated and wild diploid blueberry species[J].Hortscience,2019,54(3):576-585.
[18]APOLINAR-VALIENTE R,ROMERO-CASCALES I,LÓPEZ-ROCA J M,et al.Application and comparison of four selected procedures for the isolation of cell-wall material from the skin of grapes cv.Monastrell[J].Anal Chim Acta,2010,660(1-2):206-210.
[19]BAUTISTA-ORTÍN A B,ABDALLAH R B,CASTRO-LÓPEZ L,et al.Technological implications of modifying the extent of cell wall-proanthocyanidin interactions using enzymes[J].Int J Mol Sci,2016,17(1):123-128.
[20]DHANANI T,SHAH S,KUMAR S,et al.A validated high-performance liquid chromatography method for determination of tannin-related marker constituents gallic acid,corilagin,chebulagic acid,ellagic acid and chebulinic acid in four terminalia species from India[J].J Chromatogr Sci,2014,53(4):625-632.
[21]NOGALES-BUENO J,BACA-BOCANEGRA B,HEREDIA F J,et al.Phenolic compounds extraction in enzymatic macerations of grape skins identified as low-level extractable total anthocyanin content[J].J Food Sci,2020,85(2):324-331.
[22]SARNECKI S C J,DAMBERGS R G,JONES P,et al.Quantification of condensed tannins by precipitation with methyl cellulose:development and validation of an optimized tool for grape and wine analysis[J].Aust J Grape Wine Res,2006,12(1):39-49.
[23]KENNEDY J A,JONES G P.Analysis of proanthocyanidin cleavage products following acid-catalysis in the presence of excess phloroglucinol[J].J Agr Food Chem,2001,49(4):1740-1746.
[24]BUSSE-VALVERDE N,GÓMEZ-PLAZA E,LÓPEZ-ROCA J M,et al.Effect of different enological practices on skin and seed proanthocyanidins in three varietal wines[J].J Agr Food Chem,2010,58(21):11333-11339.
[25]MANSOLDO F R P,NEVES A,CARDOSO V D,et al.Evaluation of Kluyveromyces marxianus endo-polygalacturonase activity through ATR-FTIR[J].Analyst,2019,144(13):4111-4120.
[26]杨宁,王伟明,姚琳,等.3,5-二硝基水杨酸法测定发酵型果露酒中总糖含量[J].中国酿造,2018,37(1):181-184.
[27]BUREAU S,SCIBISZ I,LE B C,et al.Effect of sample preparation on the measurement of sugars,organic acids,and polyphenols in apple fruit by mid-infrared spectroscopy[J].J Agr Food Chem,2012,60(14):3551-3563.
[28]OSETE-ALCARAZ A,GÓMEZ-PLAZA E,MARTINEZ-PÉREZ P,et al.The impact of carbohydrate-active enzymes on mediating cell wall polysaccharide-tannin interactions in a wine-like matrix[J].Food Res Int,2020,129(5):108889-108898.
[29]ZIETSMAN A J J,MOORE J P,FANGEL J U,et al.Profiling the hydrolysis of isolated grape berry skin cell walls by purified enzymes[J].J Agr Food Chem,2015,63(37):8267-8274.
[30]DUAN B,REN Y,ZHAO Y,et al.An adequate regulated deficit irrigation strategy improves wine astringency perception by altering proanthocyanidin composition in Cabernet Sauvignon grapes[J].Sci Hortic,2021,285(3):110182-110192.
[31]WANG S Y,MANTILLA S M,SMITH P A,et al.Astringency subqualities drying and pucker are driven by tannin and pH-Insights from sensory and tribology of a model wine system[J].Food Hydrocolloid,2020,109(4):106109-106116.
[32]任佳琦,李福香,雷琳,等.原花青素与果胶相互作用对果蔬加工特性的影响[J].食品与发酵工业,2019,45(12):83-88.
[33]BEAVER J W,MILLER K V,MEDINA-PLAZA C,et al.Heat-dependent desorption of proanthocyanidins from grape-derived cell wall material under variable ethanol concentrations in model wine systems[J].Molecules,2019,24(19):3561-3574.
[34]ARNOUS A,MEYER A S.Discriminated release of phenolic substances from red wine grape skins(Vitis vinifera L.)by multicomponent enzymes treatment[J].Biochem Eng J,2009,49(1):68-77.
[35]刘小辰,林海龙.提取方法对香蕉皮粗多糖的组成、性质及结构的影响[J].中国酿造,2021,40(7):204-208.
[36]KACURAKOVA M,CAPEK P,SASINKOVA V,et al.FT-IR study of plant cell wall model compounds:Pectic polysaccharides and hemicelluloses[J].Carbohydr Polym,2000,43(2):195-203.
[37]LIU X W,RENARD C M G C,BUREAU S,et al.Revisiting the contribution of ATR-FTIR spectroscopy to characterize plant cell wall polysaccharides[J].Carbohydr Polym,2021,263(1):117935-117945.
[38]ABIDI N,CABRALES L,HAIGLER C H.Changes in the cell wall and cellulose content of developing cotton fibers investigated by FTIR spectroscopy[J].Carbohydr Polym,2014,100(2):9-16.