蒎烯(C10H16)是一种重要的天然单萜化合物,在自然界中主要以α-蒎烯和β-蒎烯的两种异构体形式存在,其异构体如下:
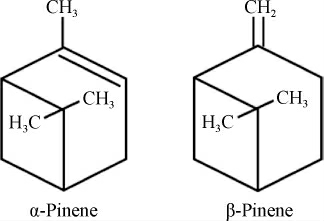
蒎烯主要存在于自然界的松柏杉植物中,松柏杉植物的分泌物可用于提取松节油,松节油的主要成分—蒎烯含量高达90%。目前,工业上提取蒎烯的主要方法是从针叶植物中提取松节油,再从松节油中通过一些蒸馏、减压精馏等方法提取蒎烯。虽然我国的松柏杉属植物资源种类繁多且分布较广,但是通过化工手段提取蒎烯成本昂贵、工艺复杂、浪费资源而且对环境有较大污染。随着微生物工程和代谢工程的发展,通过生物合成手段生产蒎烯有望在将来成为替代化工合成的策略。蒎烯可由前体物质牻牛儿基焦磷酸(geranyl pyrophosphate,GPP)通过蒎烯合酶作用生成。在蒎烯化合物的合成过程中,由于合成蒎烯所需的萜类合酶(terpene synthases,TPS)催化合成的多样性[1-2],使得最终生成的萜类化合物种类丰富、结构繁多,具有不同的理化性质和生物活性,在能源、医药、军事、食品、日化用品等多个领域拥有广泛的应用和发展前景,所以通过微生物合成蒎烯具有重要意义。
1 蒎烯的用途
蒎烯由于独特的空间结构及理化性质在能源、医药、化工、食品、和材料等领域发挥着巨大作用,具有重大的利用价值和发展空间。
1.1 能源方面
人类的一切经济活动和生存都依赖于能源的供给,而开采其他资源和利用其他资源也都要依赖能源,能源需求问题影响着人类的生存和发展,能源的消耗量已成为衡量人民生活水平的标准,随着人口的不断增长和人类现有能源的日趋减少,寻求新型、高能和可持续生产的能源迫在眉睫。蒎烯由于其独特的双键和双环结构可以在特定条件下通过环化加氢形成蒎烯二聚体。其二聚体具有与高能燃料JP-10相似的高体积能量[3-5],被认为是喷气式飞机及火箭燃料的替代品,因此具有极高的商业和军事应用价值。
1.2 医药方面
近年来人们对蒎烯的关注增加,对α-蒎烯的药理研究也不断增多,并且越来越多的被应用到医药领域,如小儿感冒颗粒[6]、桉柠蒎肠溶软胶囊[7]等。研究发现,蒎烯具有抗菌[8]、抗病毒[9]、抗肿瘤[10-11]、抗炎[12]、抗过敏及改善溃疡等作用[13-14]。虽然蒎烯具有广泛的药理性质,但药物活性较低,如何高效发挥蒎烯的药物活性还需要对其进行深入研究和改造。
1.3 化工方面
蒎烯除了在能源和医药方面的作用外,还可以用于化工方面。由于松节油的主要成分蒎烯含量达90%左右,而我国又具有丰富的松柏杉资源,故可以利用松节油提炼蒎烯来进行一系列的化工合成生产产品。如以蒎烯为原料合成热熔胶和橡胶等材料[15];蒎烯与冰片烯作用合成的樟脑醌是一种具有光敏和生理活性的单萜类双酮化合物,应用较广,但是价格昂贵[16]。而且蒎烯还可以作为很多化工产品的原材料,因此蒎烯在化工方面发挥着巨大作用。
1.4 食品方面
蒎烯在食品添加剂方面也有着广泛的用途,目前研究最多的是通过蒎烯来合成紫苏糖甜味剂[17]。虽然人们已经早已掌握了蔗糖和葡萄糖的提取工艺,但是由于大量摄入蔗糖和葡萄糖容易导致肥胖和糖尿病,从健康方面来讲紫苏糖是一种优质的高甜度、低热量的甜味添加剂,并且紫苏糖还可以作为糕点、饮料、酱油的防腐剂[18]。
1.5 材料方面
蒎烯在材料方面也有广泛应用。蒎烯树脂又称聚萜烯树脂,是以松节油为原料通过聚合得到的碳氢类树脂[19]。20世纪初期和末期主要是通过石油为原料合成树脂材料,但是由于化石能源的不可再生性以及人类对化石能源的需求量不断增加,迫使人类寻找环保型、可再生物质来替代石油。蒎烯树脂具有很好的工业加工性,并且原料永不枯竭,低毒环保,符合可持续发展的需求,因此以蒎烯作为原料合成树脂已经逐渐成为一种趋势[20]。
2 蒎烯的生物合成途径
蒎烯属于萜烯类化合物,萜烯类化合物目前已发现的种类超8 000种[21],并且所有的萜烯类化合物都是通过相应萜类合酶通过催化对应的前体物质进行合成。蒎烯的合成通常包括三个步骤:第一步为五碳模板物质异戊烯焦磷酸(isopentenyl pyrophosphate,IPP)和二甲基丙烯基二磷酸(dimethylallyl pyrophosphate,DMAPP)的形成;第二步是以IPP和DMAPP作为前体物质合成GPP、法呢基焦磷酸(farnesyl pyrophosphate,FPP)、香叶基香叶基焦磷酸(geranylgeranyl pyrophosphate,GGPP)等物质;第三步以GPP、FPP、GGPP为前体物质通过相应的酶催化合成对应的萜类物质。蒎烯是由其前体物质GPP通过蒎烯合酶(pinene synthase,PS)催化得到。蒎烯合成途径主要分为甲羟戊酸(mevalonate,MVA)途径和甲基赤藓糖醇-4-磷酸酯(methylerythritol-4-phosphate,MEP)途径。MVA途径主要存在于真核生物,部分革兰氏阴性菌和古细胞生物中,MVA途径不仅是蒎烯合成的代谢途径,而且在细胞代谢活动中起着关键作用,MVA途径中关键酶的缺失会影响细胞的生长甚至导致细胞死亡[22]。MEP途径主要存在于细菌,原生动物和藻类和高等植物中,是植物合成蒎烯化合物的关键途径。目前主要是利用原核生物大肠杆菌(Escherichia coli)和真核生物酿酒酵母(Saccharomyces cerevisiae)作为底盘生物通过一系列代谢改造进行蒎烯的生产。MEP途径如下:
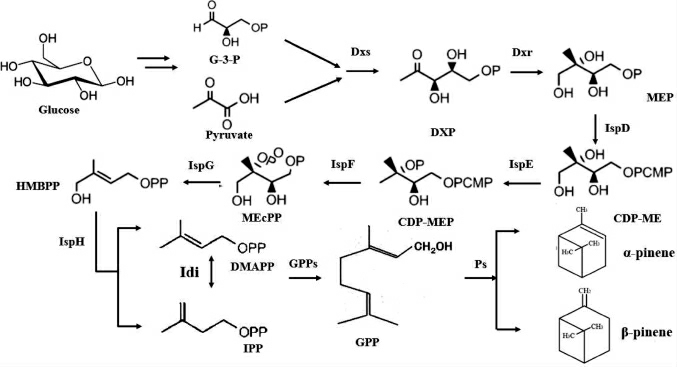
图1 蒎烯合成甲基赤藓糖醇-4-磷酸酯途径
Fig.1 Methylerythritol-4-phosphate pathway of pinene synthesis
2.1 大肠杆菌代谢工程合成蒎烯
大肠杆菌作为实验室常用的模式菌株,具有以下优点:(1)具有清晰的遗传背景;(2)作为成熟的基因克隆表达菌株便于操作;(3)繁殖迅速,培养代谢易于控制。所以大肠杆菌可以作为微生物代谢产蒎烯的首选菌株。在大肠杆菌中蒎烯的代谢合成是通过MEP途径进行,首先合成IPP和DMAPP前体,再通过各种萜烯合酶催化合成蒎烯(图3)。在MEP合成蒎烯途径中,葡萄糖通过糖酵解途径转化为甘油醛-3-磷酸(glyceraldehyde 3-phosphate,G-3-P)和丙酮酸,5-磷酸脱氧木酮糖合酶(deoxyoxylulose-5-phosphate synthase,DXS)将3-磷酸甘油醛和丙酮酸缩合为5-磷酸脱氧木酮糖(deoxyoxylulose-5-phosphate,DXP),并利用自身的烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADPH)在DXP还原异构酶(1-deoxy-D-xylulose5-phosphate reductoisomerase,DXR)作用下生成MEP。在MEP代谢通路中,MEP的生成被视为关键前体物质,所以DXP和DXS代谢反应被称为关键限速反应。MEP在2-甲基赤藓醇磷酸胞苷酰基转移酶(2-C-methyl-D-erythritol-4-phosphate cytidylyltransferase,IspD)作用下生成4-二磷酸胞苷酰-2-C-甲基-D-赤藓糖醇(4-diphosphocytidyl-2-C-methyl-D-erythritol,CDP-ME),进而经过CDPME激酶(4-diphosphocytidyl-2-C-methyl-D-erythritolkinase,IspE)、2-C-甲基赤藓糖醇2,4-环二磷酸合成酶(2-c-methylerythritol 2,4-cyclic diphosphate synthase,IspF)、4-羟基-3-甲基-2-丁烯焦磷酸(4-hydroxy-3-methyl-2-butene pyrophos phoric acid,HMBPP)合成酶(4-hydroxy-3-methyl-2-butene pyrophosphate synthase,IspG)和HMBPP还原酶(4-hydroxy-3-methyl-2-butene pyrophosphate reductase,IspH)的催化作用生成合成蒎烯的前体物质牻牛儿基焦磷酸(GPP),GPP在PS的催化作用下生成蒎烯。
蒎烯合酶基因主要来源于松柏杉属植物,YANG J M等[23]将来源于巨冷杉(Abiesgrandis)的蒎烯合酶基因导入大肠杆菌,并利用构建的外源MVA途径进行蒎烯合成,摇瓶发酵最大产量达5.44 mg/L;SARRIA S等[24]将来源于火炬松(Pinus taeda)、欧洲云杉(Piceaabies)、巨冷杉(Abiesgrandis)的不同蒎烯合酶基因和牻牛儿基焦磷酸合酶基因进行两两组合共表达和融合表达,优化培养条件后蒎烯产量达32 mg/L;TASHIRO M等[25]通过实验室进化手段蒎烯合酶,并将其与GPP合酶基因以及MVA代谢途径相关基因共同导入大肠杆菌中共表达,获得蒎烯产量可达140 mg/L。
2.2 酿酒酵母代谢工程合成蒎烯
酿酒酵母与大肠杆菌相比具有更强大的蛋白表达和翻译后修饰系统以及完整的内膜系统,所以更适合蛋白的表达[26],是蒎烯合成的优秀底盘生物。在酿酒酵母中蒎烯的合成主要是通过MVA途径进行。首先酿酒酵母通过两条代谢途径产生乙酰辅酶A(coenzyme A,CoA):(1)葡萄糖通过糖酵解途径产生的丙酮酸进入线粒体,在丙酮酸脱氢酶(pyruvate dehydrogenase,PDH)复合体作用下产生乙酰辅酶A[27];(2)存在胞质中的丙酮酸在丙酮酸脱羧酶、乙醛脱氢酶和乙酰辅酶A合酶等一系列酶的催化作用下产生乙酰辅酶A[28-29],乙酰辅酶A是酿酒酵母代谢网络中最重要的代谢中间体,也是萜类物质生成的重要前提物质。乙酰辅酶A在硫解酶(thiolase,THL)和3-羟基-3-甲基戊二酸单酰辅酶A合成酶(3-hydroxy-3-methyl glutaryl coenzyme A synthase,HMGS)的催化作用下生成HMG-CoA,HMG-CoA还原酶(3-hydroxy-3-methyl glutaryl coenzyme A reductase,HMGR)是MVA途径中的关键限速酶,且此步催化反应是一个不可逆的反应。MVA在MVA激酶(mevalonate kinase,MK)磷酸化作用下生成甲羟戊酸-5-磷酸(mevalonate 5-phosphate,MVA-5-P),进而在MVA-5-P-激酶(mevalonate 5-phosphate kinase,PMK)、甲羟戊酸焦磷酸脱羧酶(diphosphate mevalonate decarboxylase,DPMD)等酶作用下生成IPP和DMAPP。与MEP途径相同,利用牻牛儿基焦磷酸合酶(geranyl pyrophosphate synthase,GPPS)合酶和PS产生蒎烯。
以酿酒酵母作为底盘生物来生产蒎烯,目前报道的文章较少,陈天华等[30]通过在酿酒酵母中异源表达来源于火炬松(Pinus taeda L.)的蒎烯合酶基因,并通过对代谢途径进行一系列的优化使蒎烯产量从初始的0.329 mg/L提高到最终的11.7 mg/L,这也是目前报道的在酿酒酵母中的最高产量。本实验室以自主产权的产甘油假丝酵母(Candida glycerinogenes)作为底盘生物,经过密码子优化将来源于火炬松(Pinus taeda)的蒎烯合酶基因整合到基因组中,通过摇瓶发酵其蒎烯产量达0.8 mg/L。对Candida glycerinogenes进行了蒎烯的耐受性实验,该菌在1 g/L的酵母中仍然可以生长,所以可以通过对代谢途径进行改造在Candida glycerinogenes进行蒎烯生产有巨大潜力。MVA途径如下:
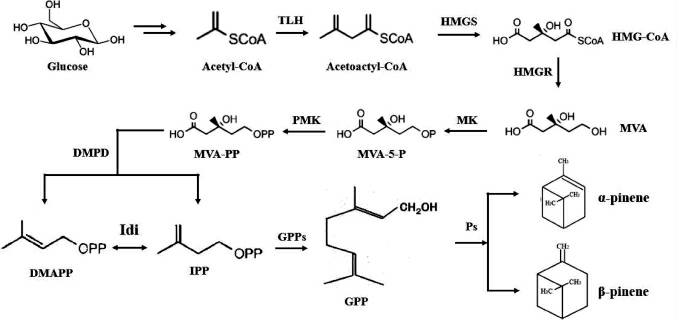
图2 蒎烯合成甲羟戊酸途径
Fig.2 Synthesis pathway of mevalonate from pinene
3 提高蒎烯合成的策略
近年来随着合成生物学和代谢工程的发展,利用微生物合成高附加值产物已经成为社会发展的趋势。但是仅仅通过微生物自身的代谢途径进行代谢产物合成还是存在很大的局限性,所以为了进一步提高代谢产物合成,一般有传统方法、关键酶蛋白工程改造、高通量筛选高酶活蒎烯合酶(图3)。
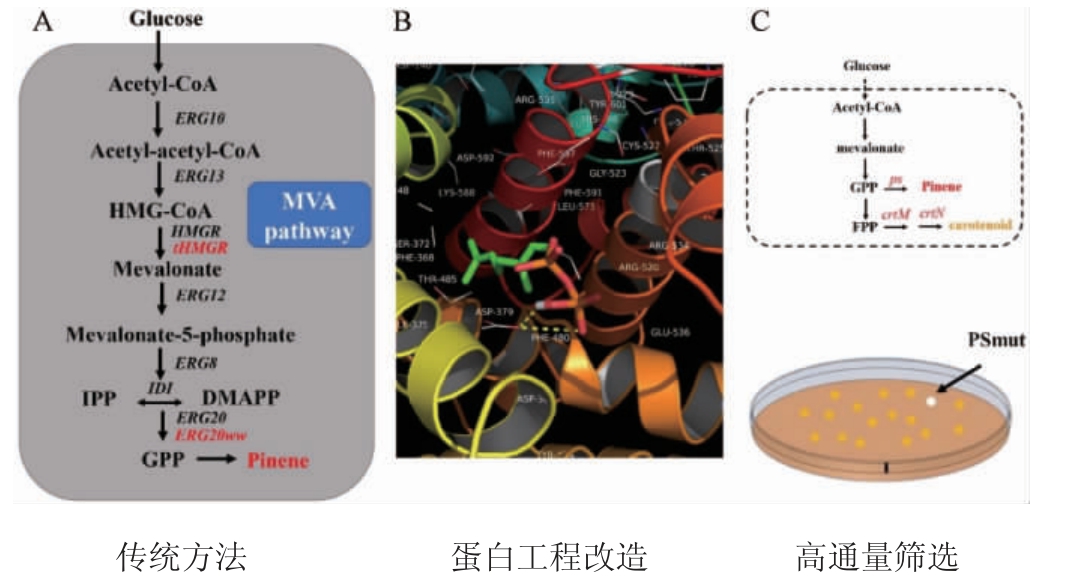
图3 提高蒎烯合成的策略
Fig.3 Strategies to enhance pinene synthesis
3.1 传统方法
因为蒎烯的合成主要由MVA途径和MEP途径[31-33],所以为了提高蒎烯的产量,通常最直接的办法是通过强化代谢通路中关键限速酶的表达来提高代谢通路碳流。研究表明HMGR是关键限速酶[34],过表达基因HMGR可以明显提高胞内甲羟戊酸含量,增强MVA途径的通量,除了HMGR是关键酶外,异戊烯基焦磷酸异构酶(isopentenyl diphosphate isomerase,IDI1)催化IPP和DMAPP之间的异构化,也是实现GPP合成的重要步骤[35],通常情况下IPP和DMAPP之间含量差异巨大,通过过表达IDI1可以改变胞内IPP和DMAPP的比例从而加速GPP合成。陈天华等[30]通过过表达截短的HMGR及IDI1等策略使蒎烯产量提高了34.5倍,所以强化代谢通路可以有效提高蒎烯产量。除了过表达关键限速酶外,通过引入外源基因,并进行正交实验也是提高蒎烯产量的重要措施。
3.2 关键酶蛋白工程改造
MVA途径或MEP途径的关键酶的增强是提高蒎烯产量的传统通用方法。虽然可以在一定程度上提高蒎烯产量,但是增加的大部分代谢碳流向了FPP和下游产物,只有很少部分GPP用于蒎烯的合成[36]。为了进一步提高蒎烯产量需要引入特异性GPP合成酶并通过蛋白质工程改造来提高酶的催化活性。由于有报道称酿酒酵母中GPP和FPP的合成是由同一种酶-法呢基焦磷酸合成酶ERG20连续催化进行的,所以对ERG20进行蛋白质工程改造,有望成为提高GPP合成的主要策略[37-39],IGNEA C等[40]通过蛋白质结构建模分析了ERG20主要是F96、A99、N127抑制FPP合酶活性,然后对其进行一系列突变,结果发现分别表达突变的ERG20(F96W)、ERG20(N127W)后,桧萜的产量分别提高了3.21和5.57倍。而F96W和N127W双点突变使桧萜产量增加至10.32倍。陈天华等[30]通过在酿酒酵母中引入ERG20突变体ERG20ww(F96W/N127W),明显提高了蒎烯产量,进一步证明了对关键酶进行改造对提高蒎烯产量的重要性。
3.3 高通量筛选高酶活蒎烯合酶
除了强化代谢通路及改造关键酶的方法,最重要的是提高蒎烯合酶的酶活,通常采用的方法是紫外诱变、常压室温等离子体(atmospheric and room temperature plasma,ARTP)诱变及易错聚合酶链式反应等来获得突变文库,但是如何获得高酶活的蒎烯合酶,是后期筛选存在的关键问题[41]。随着高通量筛选技术的发展,可以为筛选高酶活蒎烯合酶提供思路。在所有的高通量筛选方法中,最受欢迎的是基于颜色或荧光的高通量筛选技术[42-43]。基于颜色或荧光的细胞筛分是一种非常直观的高通量筛选方法,一般用于生产来自有色产品(番茄红素[44]、胡萝卜素[45]、虾青素[46]等)可以通过颜色深浅来检查。随着荧光激活细胞分选(fluorescence activated cell sorting,FACS)的发展[47-48],可以将具有荧光代谢物或可被荧光染色的物质的细胞调谐到特定波长的激发光,激活细胞内荧光信号,根据荧光对细胞进行分选单细胞水平的强度,大大提高了筛选效率[49];TASHIRO M等[50]通过实验室适应性进化,根据颜色差异成功筛选到了高酶活的突变蒎烯合酶,在摇瓶中蒎烯产量可以达到140 mg/L。
4 蒎烯毒性对蒎烯合成的影响
4.1 蒎烯毒性的胁迫机制
蒎烯作为一种单萜,对微生物细胞具有很强的毒副作用,因此常被用作抑制细胞生长的阻滞剂。它对微生物细胞的胁迫机制较为复杂细胞。目前的研究表明,单萜对细胞产生毒副作用,其调控机制可能有以下几个方面:(a)破坏细胞膜导致菌体死亡,LIU J D等[51]用致死剂量的柠檬烯胁迫酿酒酵母细胞后发现细胞膜流动性降低、通透性增高且脂肪酸的比例增加,细胞膜功能受到了严重的损伤。(b)破坏细胞壁的完整性,抑制细菌的生长。BRENNAN T C R等[52]研究表明,柠檬烯刺激引起了细胞壁的结构损伤,与细胞壁完整性通路有关的基因(ROM1,RLM1,PIR3,CTT1,YGP1,MLP1,PST1和CWP1)出现不同程度的上调,且对细胞壁降解酶的敏感性增加了4倍,但目前对于单萜破坏细胞壁与细胞膜的具体机理研究仍然不清楚。(c)刺激细胞导致胞内活性氧(reactive oxygen species,ROS)大量积累,破坏包括细胞膜在内的多种细胞器膜的功能。BAKKALI F等[53]研究发现,酿酒酵母中不同的单萜处理可诱导不同类型ROS的积累;LIU J等[54]研究发现,随着单萜处理浓度的增加,细胞内和细胞外ROS水平增加,细胞内MDA水平增加,萜处理后,胞内主要抗氧酶的编码基因如GSH2、TRR1和GPX2在转录水平分别上调了12.8、6.0及32.2倍,表明酿酒酵母激活了其酶系抗氧化系统用以抵御ROS积累造成的氧胁迫。(d)影响胞内能量代谢,URIBE S等[55]研究发现,β-蒎烯可以抑制细胞呼吸,影响酵母细胞中H+和K+的转运,并干扰线粒体膜的完整性和三磷酸腺苷(adenosine triphosphate,ATP)的产生。
4.2 提高宿主蒎烯耐受性的策略
由以上单萜对细胞毒性的机制可以看出,当单萜浓度达到一定值时,可能会造成不可逆的细胞损伤,抑制细菌生长,甚至导致细菌死亡[56-58]。目前的研究主要通过两种方法降低蒎烯对细胞的毒性作用:一是提高细胞对蒎烯的耐受性。BRENNAN T C R等[52]通过逐步提高柠檬烯的胁迫浓度对酿酒酵母进行适应性进化,经过200次传代培养筛选获得6株柠檬烯耐受性明显提高的菌株,通过基因组全测序鉴定获得了关键突变蛋白tTcb3p1-989,并发现过表达tTcb3p1-989能够使进化前的菌株对柠檬烯的耐受性提高9倍。二是减少蒎烯与细胞的接触,主要包括蒎烯的隔离和外排两种方式。蒎烯主要是通过自由扩散或者相关的转运蛋白通过主动运输实现从胞内到胞外的外排。DUNLOP M J等[59]将细菌基因组中筛选的43个外排泵在大肠杆菌中进行异源表达,发现表达来源于大肠杆菌外排泵AcrAB和来源于泊库岛食烷菌(Alcanivorax borkumensis)的未鉴定的外排泵可以使大肠杆菌对柠檬烯的耐受性增加;WANG Y等[60]在酿酒酵母中异源表达了来自花香子囊的ABC转运蛋白GcABC-G1,显着提高了重组酵母菌株的存活率。
虽然一些研究在不同程度上提高了细胞对单萜的耐受性,但总的来说,单萜的毒性仍然是限制其高产的重要因素。但是,目前酵母对单萜的研究比较单一,仅限于柠檬烯,不够全面,还没有发现酵母对蒎烯的耐受性的研究。因此,分析蒎烯致毒性的主要机制并进一步提高酵母耐受性,可以为通过代谢工程和合成生物学技术构建高效的酵母单萜合成平台奠定基础。蒎烯胁迫机制如下:
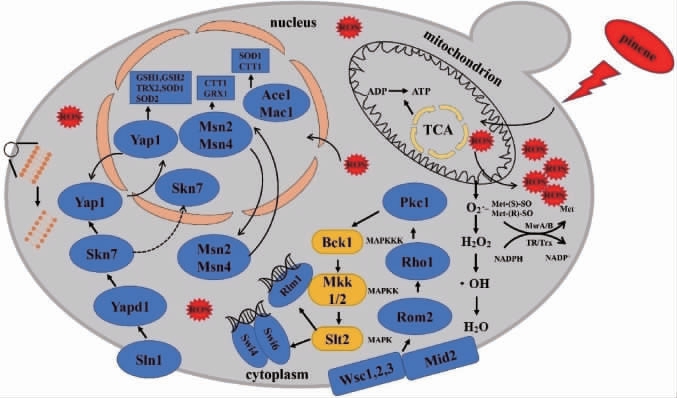
图4 蒎烯胁迫机制
Fig.4 Mechanism of pinene stress
5 蒎烯生物合成的现状及问题
利用代谢工程及合成生物学等方法在微生物中重构蒎烯合成途径,通过优化合成途径使微生物成为高效合蒎烯化合物的细胞工厂,已有不少文献报道[61-63]。然而单萜的微生物合成发展仍然相对滞后,其产量仅仅维持在毫克级别。目前蒎烯的合成主要是在大肠杆菌和酿酒酵母中通过MEP途径和MVA途径进行合成。但是无论是MEP途径还是MVA途径都存在GPP前体供给不足的问题,由于GPP是蒎烯合成的直接前体物质,所以GPP的供给量直接决定了蒎烯的产量。在酿酒酵母中缺乏GPP合成的特异性酶,GPP和FPP的合成由同一个酶ERG20连续催化[64],且FPP的合成会消耗大量的前体GPP,这就造成了GPP不能在胞内大量积累,但是又不能阻断FPP的生成,因为FPP的缺失对酵母是致死的[65-66]。所以通常的策略是对ERG20进行F96W和N127W位氨基酸进行突变ERG20WW以减弱向FPP合成的碳通量,而且不会影响GPP的合成。IGNEA C等[40]研究报道,在酵母底盘中表达ERG20ww时桧烯的产量较不引入该蛋白增加了10.5倍。除了增加前体物质GPP的含量,对关键限速酶基因进行突变或截短也是很重要的策略。在MVA途径中,HMGR是关键限速酶,HMGR又分为HMG1与HMG2[67],这两种酶N末端均有将蛋白质靶向到内质网的结构,C末端具有催化活性结构。研究发现,通过对N端结构进行截短,使C端活性中心暴露在胞质可以增大HMGR的催化活性。KEASLING J D等[68]在酿酒酵母中过表达截短的tHMGR将紫穗槐二烯的产量提高了将约5倍。所以若要提高蒎烯的产量,需要解决的关键问题就是优化其代谢途径,解除限速酶对代谢通路的限制并提高关键前体物质的积累量。
6 总结和展望
本文主要综述了蒎烯的微生物合成途径以及利用大肠杆菌和酿酒酵母作为底盘生物生产蒎烯。通过对蒎烯合成途径进行解析,旨在寻找和发现最优的蒎烯合成通路。目前蒎烯的微生物合成几乎陷入瓶颈阶段,其关键问题在于蒎烯合成前体物质GPP的缺乏,以及代谢途径中关键限速酶HMGR对通路碳流的限制作用。但是,这并不表明蒎烯微生物合成没有前景,相反只要突破目前面对的瓶颈问题,通过微生物来产蒎烯将会有巨大发展前景。为了提高微生物的蒎烯合成能力,具体策略如下:1)蒎烯合成途径中关键酶(ERG20、HMGR、IDI1)的筛选和改造;2)定向进化策略,对蒎烯合酶基因进行定向进化,提高催化活性;3)引入高效的异源代谢途径来增加前体物质的积累量。4)弱化支路途径和GPP下游途径对碳流的消耗,保证GPP碳源的供应;5)提高底盘生物对蒎烯的耐受性。值得思考的是,除了对关键基因进行过表达、敲除以及突变,还需要注意代谢途径中的非关键基因,因为关键基因的敲除和替换对菌体可能是致命的,所以需要考虑如何从全局角度设计更为合理的代谢工程方案。
[1]CHEN F,THOLL D,BOHLMANN J,et al.The family of terpene synthases in plants:a mid-size family of genes for specialized metabolism that is highly diversified throughout the kingdom[J].Plant J,2011,66(1):212-229.
[2]梁宗锁,方誉民,杨东风.植物萜类化合物生物合成与调控及其代谢工程研究进展[J].浙江理工大学学报,2017,37(2):255-264.
[3]HARVEY B G,WRIGHT M E,QUINTANA R L.High-density renewable fuels based on the selective dimerization of pinenes[J].Energ Fuel,2009,24(1):267-273.
[4]MEYLEMANS H A,QUINTANA R L,HARVEY B G.Efficient conversion of pure and mixed terpene feedstocks to high density fuels[J].Fuel,2012,97:560-568.
[5]MEYLEMANS H A,BALDWIN L C,HARVEY B G.Low-temperature properties of renewable high-density fuel blends[J].Energ Fuel,2013,27(2):883-888.
[6]张小龙,孙晓,马新飞,等.气相色谱法同时测定小儿感冒颗粒中百秋李醇、薄荷脑、α-蒎烯、β-蒎烯的含量[J].首都医药,2014,21(22):110-112.
[7]李慧,张翠欣,张少芳,等.HPLC-DAD法同时测定桉柠蒎肠溶软胶囊中桉油精、柠檬烯和α-蒎烯的含量[J].中国药房,2015,26(3):411-413.
[8]SILVA A C R D,LOPES P M,AZEVEDO M M B D,et al.Biological activities of α-pinene and β-pinene enantiomers[J].Molecules,2012,17(6):6305-6316.
[9]ASTANI A,SCHNITZLER P.Antiviral activity of monoterpenes betapinene and limonene against herpes simplex virus in vitro[J].Iran J Microbiol,2014,6(3):149-155.
[10]LOIZZO M R,MENICHINI F,TUNDIS R,et al.Comparative chemical composition and antiproliferative activity of aerial parts of Salvia leriifolia Benth.and Salvia acetabulosa L.essential oils against human tumor cell in vitro models[J].J Med Food,2010,13(1):62-69.
[11]ZHANG Z,GUO S,LIU X,et al.Synergistic antitumor effect of α-pinene andβ-pinene with paclitaxel against non-small-cell lung carcinoma(NSCLC)[J].Drug Res (Stuttg),2015,65(4):214-218.
[12]BAE G S,PARK K C,CHOI S B,et al.Protective effects of alphapinene in mice with cerulein-induced acute pancreatitis[J].Life Sci,2012,91(17-18):866-871.
[13]NAMSY,CHUNGCK,SEOJH,etal.Thetherapeuticefficacy of α-pinene in an experimental mouse model of allergic rhinitis[J].Int Immunopharmacol,2014,23(1):273-282.
[14]PINHEIRO M D A,MAGALHÃES R M,Torres D M,et al.Gastroprotective effect of α-pinene and its correlation with antiulcerogenic activity of essential oils obtained from Hyptis species[J].Pharmacogn Mag,2015,11(41):123-130.
[15]腊明,傅丽华,苏涛,等.α-蒎烯作为共聚单体用于白乳胶的制备[J].中国胶粘剂,2007(5):43-45.
[16]梁志华,李好瑾,徐徐,等. α-蒎烯合成樟脑醌的研究[J].南京林业大学学报,2013(3):123-128.
[17]王宗德,宋湛谦.松节油合成香料的研究现状(一)[J].精细与专用化学品,2003,11(12):3-5.
[18]郑延华,卢礼灿.从α-蒎烯合成紫苏糖的研究[J].湘潭大学自然科学学报,1995(1):58-61.
[19]王上田,葛刚.用α-蒎烯制甜味剂[J].林化科技通讯,1985(2):6-8.
[20]李蒙俊.α-蒎烯的聚合反应与萜烯树脂的制备[J].生物质化学工程,1993(4):2-4,9.
[21]PEMBERTON T A,CHEN M B,HARRIS G G,et al.Exploring the influence of domain architecture on the catalytic function of diterpene synthases[J].Biochemistry,2017,56(14):2010-2023.
[22]WILDING E I,KIM D Y,BRYANT A P,et al.Essentiality,expression,and characterization of the class II 3-hydroxy-3-methylglutaryl coenzyme a reductase of Staphylococcus aureus[J].J Bacteriol,2000,182(18):5147-5152.
[23]YANG J M,NIE Q J,REN M,et al.Metabolic engineering of Escherichia coli for the biosynthesis of alpha-pinene[J].Biotechnol Biofuels,2013,6(1):60.
[24]SARRIA S,WONG B,GARCÍA MARTÍN H,et al.Microbial synthesis of pinene[J].ACS Synth Biol,2014,3(7):466-475.
[25]TASHIRO M,KIYOTA H,KAWAI-NOMA S,et al.Bacterial production of pinene by a laboratory-evolved pinene-synthase[J].ACS Synth Biol,2016,5(9):1011-1020.
[26]AJIKUMAR P K,XIAO W H,TYO K E J,et al.Isoprenoid pathway optimization for Taxol precursor overproduction in Escherichia coli[J].Science,2010,330(6000):70-74.
[27]WEINERT B T,IESMANTAVICIUS V,MOUSTAFA T,et al.Acetylation dynamics and stoichiometry in Saccharomyces cerevisiae[J].Mol Syst Biol,2014,10(1):716.
[28]TAKAHASHI H,MCCAFFERY J M,IRIZARRY R A,et al.Nucleocytosolic acetyl-coenzyme a synthetase is required for histone acetylation and global transcription[J].Molecular Cell,2006,23(2):207-217.
[29]STARAI V J,ESCALANTE-SEMERENA J C.Acetyl-coenzyme a synthetase(AMP forming)[J].Cell Mol Life Sci,2004,61(16):2020-2030.
[30]陈天华,张若思,姜国珍,等.产蒎烯人工酵母细胞的构建[J].化工学报,2019,70(1):189-198.
[31]LICHTENTHALERA H K,SCHWENDERA J,DISCHB A,et al.Biosynthesis of isoprenoids in higher plant chloroplasts proceeds via a mevalonate-independent pathway[J].FEBS Lett,1997,400(3):271-274.
[32]RODRÍGUEZ-CONCEPCIÓN M,BORONAT A.Elucidation of the methylerythritol phosphate pathway for isoprenoid biosynthesis in bacteria and plastids.A metabolic milestone achieved through genomics[J].Plant Physiol,2002,130(3):1079-1089.
[33]BLOCH K.Sterol molecule:structure,biosynthesis,and function[J].Steroids,1992,57(8):378-383.
[34]CAO X,WEI L J,LIN J Y,et al.Enhancing linalool production by engineering oleaginous yeast Yarrowia lipolytica[J].Bioresour Technol,2017,245(Pt B):1641-1644.
[35]PANG Y R,ZHAO Y K,LI S L,et al.Engineering the oleaginous yeast Yarrowia lipolytica to produce limonene from waste cooking oil[J].Biotechnol Biofuels,2019,12(1):241.
[36]HERRERO O,RAMÓN D,OREJAS M.Engineering the Saccharomyces cerevisiae isoprenoid pathway for de novo production of aromatic monoterpenes in wine[J].Metab Eng,2008,10(2):78-86.
[37]ZHAO J Z,BAO X M,LI C,et al.Improving monoterpene geraniol production through geranyl diphosphate synthesis regulation in Saccharomyces cerevisiae[J].Appl Microbiol Biotechnol,2016,100(10):4561-4571.
[38]JIANG G Z,YAO M D,WANG Y,et al.Manipulation of GES and ERG20 for geraniol overproduction in Saccharomyces cerevisiae[J].Metab Eng,2017,41:57-66.
[39]DENG Y,SUN M X,XU S,et al.Enhanced(S)-linalool production by fusion expression of farnesyl diphosphate synthase and linalool synthase in Saccharomyces cerevisiae[J].J Appl Microbiol,2016,121(1):187-195.
[40]IGNEA C,PONTINI M,MAFFEI M E,et al.Engineering monoterpene production in yeast using a synthetic dominant negative geranyl diphosphate synthase[J].ACS Synth Biol,2014,3(5):298-306.
[41]DUARTE J M,BARBIER I,SCHAERLI Y.Bacterial microcolonies in gel beads for high-throughput screening of libraries in synthetic biology[J].ACS Synth Biol,2017,6(11):1988-1995.
[42]DIETRICH J A,MCKEE A E,KEASLING J D.High-throughput metabolic engineering:advances in small-molecule screening and selection[J].Annu Rev Biochem,2010,79(1):563-590.
[43]LIU W S,JIANG R R.Combinatorial and high-throughput screening approaches for strain engineering[J].Appl Microbiol Biotechnol,2015,99(5):2093-2104.
[44]ALPER H,MIYAOKU K,STEPHANOPOULOS G.Construction of lycopene-overproducing E.coli strains by combining systematic and combinatorial gene knockout targets[J].Nat Biotechnol,2005,23(5):612-616.
[45]LI J,SHEN J,SUN Z Q,et al.Discovery of several novel targets that enhance β-carotene production in Saccharomyces cerevisiae[J].Front Microbiol,2017,8:1116.
[46]ZHOU P P,XIE W P,LI A P,et al.Alleviation of metabolic bottleneck by combinatorial engineering enhanced astaxanthin synthesis in Saccharomyces cerevisiae[J].Enzyme Microb Technol,2017,100:28-36.
[47]LEE J H,LEE S H,YIM S S,et al.Quantified high-throughput screening of Escherichia coli producing poly(3-hydroxybutyrate)based on FACS[J].Appl Biochem biotechnol,2013,170(7):1767-1779.
[48]SCHALLMEY M,FRUNZKE J,EGGELING L,et al.Looking for the pick of the bunch:high-throughput screening of producing microorganisms with biosensors[J].Curr Opin Biotechnol,2014,26:148-154.
[49]BOERSMA Y L,DRÖGE M J,SLOOT A M V D,et al.A novel genetic selection system for improved enantioselectivity of Bacillus subtilis lipase A[J].Chem Bio Chem,2008,9(7):1110-1115.
[50]TASHIRO M,KIYOTA H,KAWAI-NOMA S,et al.Bacterial production of pinene by a laboratory-evolved pinene-synthase[J].ACS Synth Biol,2016,5(9):1011-1020.
[51]LIU J D,ZHU Y B,DU G C,et al.Response of Saccharomyces cerevisiae to D-limonene-induced oxidative stress[J].Appl Microbiol Biotechnol,2013,97(14):6467-6475.
[52]BRENNAN T C R,KRÖMER J O,NIELSEN L K.Physiological and transcriptional responses of Saccharomyces cerevisiae to D-limonene show changes to the cell wall but not to the plasma membrane[J].Appl Environ Microbiol,2013,79(12):3590-3600.
[53]BAKKALI F,AVERBECK S,AVERBECK D,et al.Cytotoxicity and gene induction by some essential oils in the yeast Saccharomyces cerevisiae[J].Mutat Res,2005,585(1-2):1-13.
[54]LIU J,ZHU Y,DU G,et al.Exogenous ergosterol protects Saccharomyces cerevisiae from D-limonene stress[J].J Appl Microbiol,2013,114(2):482-491.
[55]URIBE S,RAMIREZ J,PEÑA A.Effects of beta-pinene on yeast membrane functions[J].Bacteriol,1985,161(3):1195-1200.
[56]LI Y X,FENG Y Q,WANG X,et al.Adaptation of pine wood nematode Bursaphelenchus xylophilus to β-pinene stress[J].BMC Genomics,2020,21(1):478.
[57]TGJ A,MH A,RBM B,et al.Effects of α-pinene on life history traits and stress tolerance in the springtail Folsomia candida[J].Comp Biochem Physiol C Toxicol Pharmacol,2020,229:108681.
[58]SINGH H P,BATISH D R,KAUR S,et al.α-pinene inhibits growth and induces oxidative stress in roots[J].Ann Bot,2006,98(6):1261-1269.
[59]DUNLOP M J,DOSSANI Z Y,SZMIDT H L,et al.Engineering microbial biofuel tolerance and export using efflux pumps[J].Mol Syst Biol,2011,7:487.
[60]WANG Y,LIM L,DIGUISTINI S,et al.A specialized ABC efflux transporter GcABC-G1 confers monoterpene resistance to Grosmannia clavigera,a bark beetle-associated fungal pathogen of pine trees[J].New Phytol,2013,197(3):886-898.
[61]WU X M,MA G,LIU C Y,et al.Biosynthesis of pinene in purple nonsulfur photosynthetic bacteria[J].Microb Cell Fact,2021,20(1):101.
[62]BAO S H,ZHANG D Y,MENG E,et al.Improving biosynthetic production of pinene through plasmid recombination elimination and pathway optimization[J].Plasmid,2019,105:102431.
[63]NIU F X,HE X,WU Y Q,et al.Enhancing production of pinene in Escherichia coli by using a combination of tolerance,evolution and modular co-culture engineering[J].Front Microbiol,2018,9:1623.
[64]FISCHER M J C,MEYER S,CLAUDEL P,et al.Metabolic engineering of monoterpene synthesis in yeast[J].Biotechnol Bioeng,2011,108:1883-1892.
[65]SZKOPI NˊSKA A,PŁOCHOCKA D.Farnesyl diphosphate synthase;regulation of product specificity[J].Acta Biochim Pol,2005,52(1):45-55.
[66]GRABI NˊSKA K,PALAMARCZYK G.Dolichol biosynthesis in the yeast Saccharomyces cerevisiae:an insight into the regulatory role offarnesyl diphosphate synthase[J].FEMS Yeast Res,2002,2(3):259-265.
[67]BASSON M E,THORSNESS M,FINER-MOORE J,et al.Structural and functional conservation between yeast and human3-hydroxy-3-methylglutaryl coenzyme A reductases,the rate-limiting enzyme of sterol biosynthesis[J].Mol Cell Biol,1988,8(9):3797-3808.
[68]KEASLING J D.Synthetic biology and the development of tools for metabolic engineering[J].Metab Eng,2012,14(3):189-195.