2,3,5,6-四甲基吡嗪(tetramethylpyrazine,TTMP)又称川芎嗪,是一种含氮杂环化合物,天然存在于可可豆、榛子、番石榴等坚果和水果中,也存在于豆制品、乳制品、陈醋、白酒等多种发酵食品中,具有令人愉快的烘烤香味[1]。TTMP被认为是一类重要的香味化合物,作为一种安全的食品调味剂,已被广泛应用于食品中以改善风味[2]。TTMP可通过微生物代谢和美拉德反应产生,作为在曲霉酸之后第二个在天然产物中发现的吡嗪化合物,TTMP最早由KOSUGE T等[3]在枯草芽孢杆菌培养液中发现并分离出来。因TTMP具有极低的风味阈值,其对白酒、食醋等发酵食品的风味形成具有重要贡献[4],同时也赋予食品健康保健的作用。已有的科学研究表明,TTMP具有抑制血小板聚集和血栓形成、扩张外周血管、增强免疫力、防治肝纤维化等药理作用[5],此外,TTMP还可以对神经系统产生多种作用,吴斌等[6]研究发现,TTMP具有抑制心源性脑梗死患者神经功能损伤的作用。基于对上述研究成果的认识与理解,酿造行业也越来越关注产品中TTMP的含量,特别是在食醋和白酒行业,使用微生物工程和发酵工程等领域的科学技术方法来提高酿造食品中TTMP的含量已成为当前研究热点之一[7-8]。本文对发酵食品中TTMP的检测方法、微生物合成途径及发酵食品中TTMP的增产策略等几个方面进行了总结分析,为提高发酵食品中TTMP含量和更加深入的研究TTMP的生物合成机理提供可以参考的理论依据。
1 发酵食品中TTMP的检测方法
国标GB 1886.295—2016《食品添加剂2,3,5,6-四甲基吡嗪》中规定了四甲基吡嗪采用气相色谱法进行测定,现阶段针对食醋、白酒等发酵食品中TTMP的检测方法主要有气相色谱法(gas chromatography,GC)、高效液相色谱法(high performance liquid ghromatography,HPLC)、气质联用法(gas chromatography-mass spectrometry,GC-MS)等。气相色谱与液相色谱法都可以对发酵食品中的TTMP进行有效分离,且操作简单,方便快捷,联合使用质谱检测器时可获得更低的目标化合物检出限[5]。
1.1 样品前处理
发酵食品中TTMP的含量较低,且其他组分复杂[9],所以发酵食品的前处理就尤为重要,通过样品前处理在去除干扰物质同时可将TTMP有效富集。对发酵食品或发酵液的前处理主要有液液萃取法(liquid-liquid extraction,LLE)、液液微萃取(liquid-liquid microextraction,LLME)、顶空固相微萃取法(headspacesolid-phasemicroextraction,HS-SPME)等。液液萃取最常用的是利用有机溶剂进行常规萃取。温丹华等[10]使用有机溶剂与酸交替的方法萃取山西老陈醋中的TTMP,首先通过三氯甲烷将TTMP从食醋中萃取出来,再利用0.2 mol/L盐酸溶液将三氯甲烷中的TTMP萃取到水相,后续用HPLC进行检验,此方法平均回收率可以达到85.44%。FAN W L等[11]报道一种从大曲中提取香味物质的方法,同样可以用来提取TTMP,该方法将NaCl饱和的样品用重蒸溶剂(戊烷∶乙醚=1∶1,V/V)进行萃取,通过调pH的方法可以将萃取组分逐步分成酸性/水溶性、中性和碱性组分,然后将其干燥、氮吹后通过气相色谱进行检测。
为了减少有机溶剂的使用,同时增加萃取效率,液液微萃取也被成功运用到发酵食品TTMP的检测中。WU J H等[12]通过液液微萃取技术萃取了食醋中的TTMP,以400 μL的二氯乙烷作为萃取溶剂,以2.4 mL乙醇作为分散溶剂,萃取5 mL样品的回收率可以达到97.97%以上。为了缩短萃取时间,可以利用超声和涡旋处理进行辅助[13],孙啸涛等[14]建立了一种利用涡旋辅助液液微萃取方法,在对白酒中TTMP萃取时,通过涡旋60 s即可以使样品溶液和萃取溶剂达到萃取平衡。
近些年来随着固相微萃取法的发展,顶空固相微萃取技术因具有无溶剂、成本低、使用方便、检测快速的优点,在食品行业的研究和应用也越来越广泛,特别是对低分子质量、低沸点的化合物萃取效果较好[15]。黄璇等[16]利用顶空固相微萃取方法对纳豆的挥发性成分进行了提取,然后用GC-MS进行检测,共检测出包括TTMP在内的6种吡嗪类物质。顶空固相微萃取技术的萃取效果主要与萃取头材质、萃取温度、萃取时间等因素相关[17],同时还可以通过增加盐浓度来降低分析物的溶解度,从而提高目标物的萃取效率[15]。吴建峰[5]用二乙烯基苯/Carboxen/聚二甲基硅氧烷固相微萃取萃取头在萃取温度50 ℃、萃取时间40 min时,加入NaCl至0.3 g/mL的条件下对白酒中的TTMP进行萃取,实验结果表明,加标回收率可以达到108.05%。
1.2 检测方法
前处理后的发酵食品样品,一般采用气相色谱或者是高效液相色谱进行样品中各组分的分离,并使用相应的检测器进行检测。通过液液萃取的样品一般采用配有紫外检测器的液相色谱仪来检测,此检测方法快速、简单、回收率高,准确性和重复性也比较好[18]。通过顶空固相微萃取法处理的样品一般采用气相色谱进行检测,除了紫外检测器以外,还可以利用氢离子火焰检测器进行检测[19]。气相色谱与质谱联用可以对组分进行精准的分析,但是对于定量分析具有一定的局限性。黄杰等[20]建立了一种利用三重四极杆气质联用仪来检测白酒中TTMP的方法,通过二次碰撞对目标物进行定性定量的分析,其抗干扰能力较强,更适用于复杂成分的分析。
2 食品中TTMP的来源
烷基吡嗪类物质既存在于植物种子和水果中,也存在于豆制品、乳制品、咖啡、陈醋、白酒等加工食品中,对食品的风味调节起着重要作用。对于发酵食品来说,其中的烷基吡嗪主要来源于美拉德反应(Maillard reaction,MR)与微生物代谢。
2.1 美拉德反应
美拉德反应(MR)指的是氨基化合物(如氨基酸)和羰基化合物(通常指还原糖)之间发生的一系列非酶褐变反应,可以给食品带来多重变化,对食品风味、颜色的形成有十分重要的作用[21]。MR颜色的改变主要与MR产物类黑素的生成有关,类黑素也与抗氧化活性有关[22],吡嗪类物质主要影响的是食品的风味。也有研究发现,MR会产生像丙烯酰胺这样对人体健康不利的物质[21]。
MR分三个阶段进行,其初始阶段是还原糖的羰基与氨基化合物发生缩合反应生成希夫碱(schiff base),随即环化生成N-葡萄糖基胺,进一步通过阿马多利(amadori)分子重排生成amadori化合物。进入中间阶段后,amadori化合物迅速发生烯醇化,释放氨基,裂解生成二羰基化合物;二羰基化合物进一步与氨基化合物发生斯特勒克降解(Strecker degradation)反应,生成的羰氨类化合物经过缩合生成吡嗪类物质。最终阶段中MR将中间阶段生成的各种产物进一步聚合生成类黑素[21]。羰基化合物和氨基化合物的种类对MR有显著影响,且氨基化合物对吡嗪类物质的生成影响更大,如以甘氨酸、丝氨酸为原料进行MR合成生成的吡嗪类物质比脯氨酸、亮氨酸为原料时的产量更高。在食醋和白酒酿造环境中氨基化合物的来源主要是植物降解产生的天然蛋白水解产物,研究表明以分子质量低的(<1 000 Da)天然蛋白水解产物为原料时产生的吡嗪含量更高[23]。此外MR还与反应时间、温度、pH值等多种因素有重要关系,一般来说MR最适pH为5.0~8.0,在弱碱性的条件下更利于吡嗪物质的生成。在合适的条件下,温度越高、维持时间越长反应生成物种类越多、含量越高[24]。因此,白酒酿造过程中的MR主要存在于温度较高的制曲、高温堆积、蒸馏等阶段[25],食醋酿造过程中MR则更多的是在熏醅、晾晒和陈酿阶段发生[26]。
2.2 微生物发酵
研究发现,在不具有MR发生条件的食品酿造过程中,也有TTMP的生成[25,27],由此可见,食品发酵过程中除MR以外还有别的途径会产生TTMP。KOSUGE T等[28]在纳豆和用于发酵生产纳豆芽孢杆菌(Bacillus natto)的培养物中都分离出了TTMP。另有研究发现,在大豆酿造的环境中添加TTMP生物合成途径的前体物质乙偶姻会使产品的TTMP含量显著提高[29]。另外,从大曲和酒醅中筛出的地衣芽孢杆菌(Bacillus licheniformis),在以高粱为主要原料的营养环境中固态发酵,也检测到了TTMP的生成[30]。由此可以推测,酿造过程中的TTMP产生很有可能来源于微生物代谢。已有很多研究者在酿造食品的发酵生产过程中筛选出了可以生产TTMP的菌株(见表1),微生物代谢生产TTMP的研究也越来越受到科研工作者的广泛关注。
表1 食品酿造过程中的产四甲基吡嗪菌株
Table 1 Tetramethylpyrazine producing strains in food brewing process

注:a为液体培养基;b为固态发酵麸曲培养基;c为大豆固体培养基。
3 微生物发酵生产TTMP
3.1 产TTMP菌株
3.1.1 芽孢杆菌发酵生产TTMP
在微生物合成TTMP途径被提出后,许多学者开展了芽孢杆菌发酵生产TTMP的研究,XIAO Z J等[38]报道了一株从苹果园和葡萄园土壤中分离出的芽孢杆菌可以利用葡萄糖和豆粕的酶消化产物来生产高纯度的TTMP,产量可以达到4.33 g/L。此外,还有一些提高TTMP产量的方法被应用于枯草芽孢杆菌(Bacillus subtilis)发酵过程中,ZHU B F等[39]通过控制pH来提高产量,将发酵分为了两个阶段,第一个阶段是细菌的生长和前体物质的积累,第二个阶段是TTMP的形成。前者需要在弱酸性条件下进行,在pH值为5.5时,得到了细胞的最大生长速率0.833 g/(L·h)和前体物质乙偶姻的最大积累量1.118 g/(L·h);在产物形成阶段调节pH值为7.0,得到TTMP的最大生长速率0.095 g/(L·h),最终得到的产物质量浓度为7.43 g/L,相比于之前的研究,TTMP产量得到较大提高。且枯草芽孢杆菌对人无毒无害、无治病性、不污染环境,可以安全的添加到发酵环境中[40]。
3.1.2 乳酸杆菌与其他菌种发酵生产TTMP
乳酸杆菌等一些其他种属的微生物也逐渐被发现可用于TTMP的生产,SOO K等[41]通过乳酸杆菌生产TTMP,该科研工作首先通过发酵使TTMP的前体物质乙偶姻大量积累,所需的氮源通过加入精氨酸来代谢产生。发酵结束后,将发酵液升温即可产生TTMP,在121 ℃条件下,乙偶姻的转化率可以达到15%。DEMAIN A L等[42]报道了一株谷氨酸棒状杆菌(Corynebacterium glutamicum)的突变体具有生产TTMP的能力,产量可达3 g/L,但此突变株的生长需要异亮氨酸、缬氨酸、亮氨酸和泛酸盐等物质,且TTMP的大量积累需要加入硫胺素。XU Y Q等[43]利用基因工程技术改造出了高产TTMP菌株,该研究工作对大肠杆菌(Escherichia coli)的改造部分包括对比不同菌株的乙偶姻合成基因簇,找出高效基因簇;改变核糖体结合位点到起始密码子的距离,提高翻译效率;微调还原型辅酶Ⅰ(nicotinamide adenine dinucleotide,NADH)氧化酶的表达等。通过基因改造和优化发酵条件,使菌在分批补料发酵条件下有效的利用底物葡萄糖生成乙偶姻,质量浓度可以达到68.4 g/L。将发酵液上清直接用于生产TTMP,在初始pH值为7.5的条件下,加入磷酸氢二铵40 min内TTMP产量达到了16.1 g/L。
近些年来微生物发酵生产TTMP的技术取得了长足的进步,产量也得到了大幅提高。然而,食品发酵往往是一个复杂的多菌种发酵系统,将高产TTMP的菌种应用到食品发酵环境中还面临诸多挑战,如适应复杂的发酵环境、添加方式和添加量、发酵微环境和营养调节等都是需要深入研究的问题。
3.2 微生物生产TTMP的合成途径
自从发现枯草芽孢杆菌可以生产TTMP以后,对其代谢通路的研究就成为微生物生产TTMP一个关键领域。KOSUGE T等[28]研究发现,枯草芽孢杆菌(Bacillus subtilis)能产生TTMP后,依据实验结果对生物合成途径进行了合理推测,首先吡嗪中胺部分来自氨基酸,碳部分来自糖。通过Voges-Proskauer(V-P)试验发现,此枯草芽孢杆菌可以产生乙偶姻,从化学角度分析TTMP可以由乙偶姻合成(见图1a)。此方法奠定了研究TTMP生物合成途径的基本框架,越来越多的发现证明并丰富了此路线。
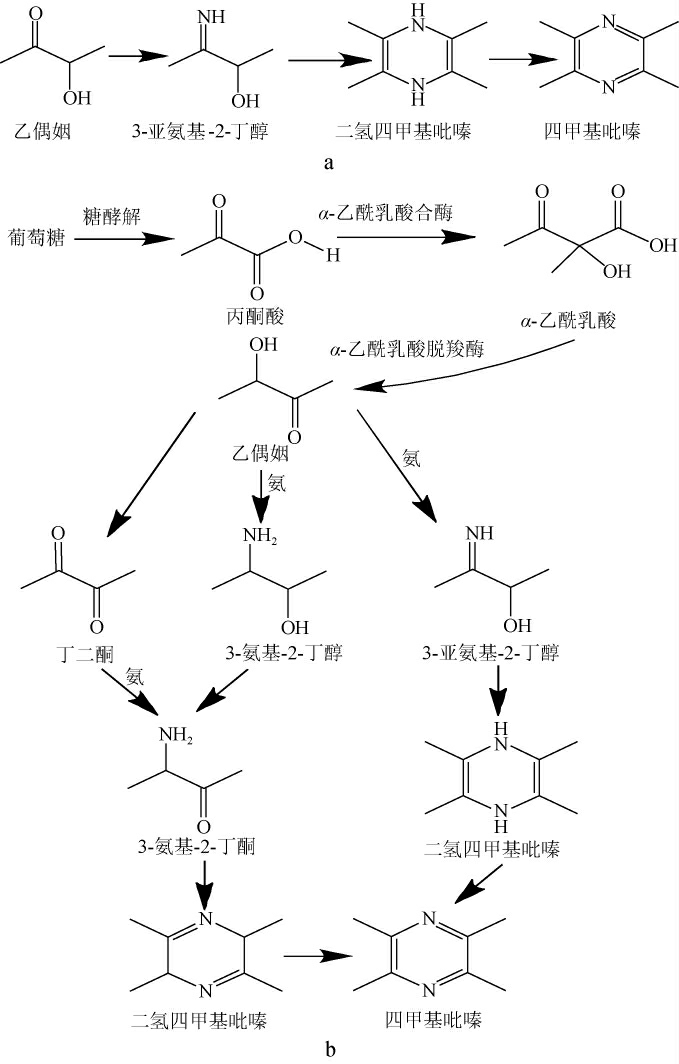
图1 四甲基吡嗪的生物合成通路
Fig.1 Biosynthetic pathways of tetramethylpyrazine
3.2.1 前体物质乙偶姻
乙偶姻即3-羟基-2-丁酮,具有令人愉快的酸奶气味和脂肪奶油味道,在化学合成中乙偶姻是多种化合物特别是杂环化合物的前体物质[44]。LARROCHE C等[29]在研究枯草芽孢杆菌(Bacillus subtilis)固态发酵大豆生产吡嗪时,加入乙偶姻可使TTMP的产量大幅度提高,在一定程度上解释了乙偶姻作为TTMP的前体物质的可能性。HUANG T C等[45]通过同位素标记法在体外建立了乙偶姻与不同铵盐反应体系模型,证明由乙偶姻首先生成3-氨基-2-丁酮,再二聚为二氢吡嗪的过程是可行的。DICKSCHAT J S等[46]通过构建乙偶姻合成基因突变体菌株与同位素标记的方法证明了在产TTMP的菌体内存在由乙偶姻到二氢吡嗪的过程,该研究进一步明确了乙偶姻为微生物合成TTMP的前体物质。
3.2.2 TTMP生物合成途径
由乙偶姻到TTMP这一合成途径在微生物体内是否有相关酶的参与,这一问题成为了该领域的一个争论热点。目前大多数研究者倾向于此过程是非酶促反应,RIZZI G P[47]在温和条件下观察到了水溶液中乙偶姻和铵盐自发形成TTMP的现象。吴建峰等[48]在体外以乙偶姻和氨为底物研究温度对TTMP生成的影响,发现高温可以加快反应速率,并通过从酿酒曲中筛选出的高产TTMP的枯草芽孢杆菌进行原位反应验证,在发酵液中提高乙偶姻与氨的反应阶段的温度后,合成产物的量明显增多,60 ℃条件下的产物是37 ℃的5倍左右,证明了乙偶姻和氨反应生成TTMP的过程可通过简单的热力学反应得以实现。但DICKSCHATJ S等[46]研究发现,在琼脂糖固体培养基中乙偶姻与氨无法自发的生成TTMP,而在微生物的参与下是可以生成的。微生物的来源和多样性极其丰富,其对环境的适应性和应激性也非常强,且体内代谢合成机制极其复杂,其体内是否存在酶促反应仍有待进一步研究。综合上述内容,目前TTMP的生物合成机制逐步清晰,首先是经糖酵解等途径生成的丙酮酸,再由酶催化生成乙偶姻,最终由乙偶姻与氨生成TTMP(见图1b)。
4 提高发酵食品中TTMP含量的策略
发酵食品中的TTMP来自于美拉德反应和微生物代谢,美拉德反应十分复杂,过程中会产生多种产物,难以控制[21]。为此人们更希望通过微生物合成途径来提高发酵食品中TTMP的含量。乙偶姻作为TTMP的前体,通过提高乙偶姻的含量来提高TTMP产量是可行的,且乙偶姻也可以增加食品的风味[44]。MENG W等[49]通过对地衣芽孢杆菌(Bacillus licheniformis)进行基因工程操作,过表达α-乙酰乳酸脱羧酶基因和α-乙酰乳酸合成酶基因,使乙偶姻的产量增加了23.06%,继而使TTMP的产量提高了15.47%。白酒酿造过程的酸性环境并不适合α-乙酰乳酸合成酶催化反应,为此ZHAO T等[50]通过定点突变提高了酶的耐酸性,使其更适合酿造环境,但以上两个研究在发酵食品的进一步应用面临基因工程菌的安全性评价问题。陈诗佳等[7]将高产乙偶姻的酿酒酵母(Saccharomyces cerevisiae)应用到白酒酿造中,酒醅中乙偶姻含量提高了320.38%,TTMP提高了74.66%,相比芽孢杆菌,酿酒酵母可能更适用于白酒酿造过程的厌氧和偏酸性环境。
现阶段向发酵环境中加入菌的方式多为在发酵曲中加入菌制成强化曲,再将强化曲按照发酵工艺加入发酵环境中。葛向阳等[8]将地衣芽孢杆菌(Bacillus licheniformis)的悬液按照0.5%的比例加入制曲原料中,结果表明大曲中的TTMP提高了4~10倍。ZHANG L Q等[51]将接种高产TTMP菌株的加强曲与未接种菌株的曲按照不同比例混合后用于发酵,发现当比例为5∶5时效果最好,可以将食醋中的乙偶姻与TTMP分别提高了191.84%和123.17%。因此,通过加强曲的方式将微生物菌株应用到发酵过程来提高酿造食品的TTMP含量较为可行和便捷。
5 总结与展望
随着生活水平的不断提高,人们更加追求生活的品质,对于食品更注重风味与健康,这促使着食品行业的健康发展。另外分子生物学、发酵工程等技术的融合和集成创新,也为进一步研发健康发酵食品提供了新的思路。针对现阶段已经筛选出的高产TTMP的菌株,可以通过合成微生物组的研究探索出最佳的菌种组合方式,提高菌株的稳定性和综合应用性能。另外,通过分子生物学技术手段进一步明确TTMP的微生物合成途径,可为减少发酵副产物和提高转化率提供理论基础。
[1]FORS S M,OLOFSSON B K.Alkylpyrazines,volatiles formed in the Maillard reaction.II.Sensory properties of five alkylpyrazines[J].Chemical Senses,1986,11(1):65-77.
[2]XIAO Z J,HOU X Y,XIN L,et al.Accelerated green process of tetramethylpyrazine production from glucose and diammonium phosphate[J].Biotechnol Biofuel,2014,7(1):106.
[3]KOSUGE T,KAMIYA H.Discovery of a pyrazine in a natural product:tetramethylpyrazine from cultures of a strain of Bacillus subtilis[J].Nature,1962,24(193):776-776.
[4]FAN W L,XU Y,ZHANG Y H.Characterization of pyrazines in some Chinese liquors and their approximate concentrations[J].J Agr Food Chem,2007,55(24):9956-9962.
[5]吴建峰.白酒中四甲基吡嗪全程代谢机理研究[D].无锡:江南大学,2013.
[6]吴斌,徐士军.川芎嗪用于心源性脑梗死患者效果观察[J].山东医药,2017,57(20):84-86.
[7]陈诗佳,李玲玲,陈叶福,等.高产乙偶姻酵母菌种的选育与提高白酒中四甲基吡嗪含量的研究[J].酿酒科技,2018(10):114-119.
[8]葛向阳,李晓欢,周庆伍,等.利用现代生物技术提高大曲中四甲基吡嗪含量的研究[J].酿酒,2018,45(5):32-34.
[9]XIA T,ZHANG B,DUAN W H,et al.Nutrients and bioactive components from vinegar:A fermented and functional food[J].J Funct Food,2020,64:103681.
[10]温丹华,李叶丽,史晓亚,等.山西老陈醋醋龄拉曼光谱快速检测方法的建立[J].食品与发酵工业,2019,45(11):242-247.
[11]FAN W L,QIAN M C.Identification of aroma compounds in Chinese'Yanghe Daqu'liquor by normal phase chromatography fractionation followed by gas chromatography [sol]olfactometry[J].Flavour Fragr J,2006,21(2):333-342.
[12]WU J H,ZHAO H B,DU M,et al.Dispersive liquid-liquid microextraction for rapid and inexpensive determination of tetramethylpyrazine in vinegar[J].Food Chem,2019,286:141-145.
[13]SERESHTI H,IZADMANESH Y,SAMADI S.Optimized ultrasonic assisted extraction-dispersive liquid-liquid microextraction coupled with gas chromatography for determination of essential oil of Oliveria decumbens vent[J].J Chromatogr A,2011,1218(29):4593-4598.
[14]孙啸涛,王宗元,刘淼,等.涡旋辅助液液微萃取结合GC-MS法检测67 种白酒中四甲基吡嗪,4-甲基愈创木酚和4-乙基愈创木酚[J].食品科学,2017,38(18):80-86.
[15]SABIK H,FORTIN J,MARTIN N.Identification of pyrazine derivatives in a typical maple syrup using headspace solid-phase microextraction with gas chromatography-mass spectrometry[J].Food Chem,2012,133(3):1006-1010.
[16]黄璇,廖卢艳,范琳,等.固相微萃取法分析纳豆挥发性成分[J].食品工业科技,2012,3(10):58-61.
[17]肖天鹏,郑晓峰,吕吉鸿,等.顶空-固相微萃取-气相色谱法检测可可麦汁中吡嗪类化合物[J].分析化学,2012,40(10):1589-1592.
[18]司冠儒,张温清,张显,等.HPLC 快速检测芝麻香型白酒中四甲基吡嗪[J].酿酒,2014,41(5):89-91.
[19]XIAO Z J,ZHAO L,TIAN L,et al.GC-FID determination of tetramethylpyrazine and acetoin in vinegars and quantifying the dependence of tetramethylpyrazine on acetoin and ammonium[J].Food Chem,2018,239:726-732.
[20]黄杰,陆玮,汤有宏,等.基于GC-QQQ 分析技术测定白酒中四甲基吡嗪的研究[J].食品与发酵科技,2015,51(6):50-53.
[21]STAROWICZ M,ZIELINˊSKI H.How Maillard reaction influences sensorial properties (color,flavor and texture) of food products?[J].Food Rev Int,2019,35(8):707-725.
[22]XU Q P,TAO W Y,AO Z H.Antioxidant activity of vinegar melanoidins[J].Food Chem,2007,102(3):841-849.
[23]YU H,ZHANG R Y,YANG F.W,et al.Control strategies of pyrazines generation from Maillard reaction[J].Trend Food Sci Technol,2021,112:795-807.
[24]SUN Y F,LIN L,ZHANG P Y.Color development kinetics of Maillard reactions[J].Ind Eng Chem Res,2021,60(9):3495-3501.
[25]ZHANG W Q,SI G R,LI J L,et al.Tetramethylpyrazine in Chinese sesame flavour liquor and changes during the production process[J].J I Brewing,2019,125(1):155-161.
[26]XU W,XU Q P,CHEN J H,et al.Ligustrazine formation in Zhenjiang aromatic vinegar:changes during fermentation and storing process[J].J Sci Food Agr,2011,91(9):1612-1617.
[27]司冠儒,张温清,梅婕,等.宣酒小窖芝麻香型白酒蒸馏过程中四甲基吡嗪的研究[J].酿酒科技,2016(6):75-77.
[28]KOSUGE T,ADACHI T,KAMIYA H.Isolation of tetramethylpyrazine from culture of Bacillus natto,and biosynthetic pathways of tetramethylpyrazine[J].Nature,1962,195(4846):1103-1103.
[29]LARROCHE C,BESSON I,GROS J B.High pyrazine production by Bacillus subtilis in solid substrate fermentation on ground soybeans[J].Process Biochem,1999,34(6-7):667-674.
[30]林群,肖之陶,付秋香,等.产香风味地衣芽孢杆菌(Bacillus licheniformis)的分离及发酵代谢产物分析[J].酿酒科技,2013(12):49-52.
[31]李晓霞.汾酒大曲中高产四甲基吡嗪菌株的筛选及其在酿酒中的应用研究[D].晋中:山西师范大学,2016.
[32]丁雪梅.酒曲中高产四甲基吡嗪菌株的选育及发酵优化[D].天津:天津科技大学,2015.
[33]徐岩,范文来,王海燕,等.风味分析定向中国白酒技术研究的进展[J].酿酒科技,2010(11):73-78.
[34]赵德义,汤丹丹,曹建全,等.产四甲基吡嗪微生物菌株的选育[J].中国酿造,2015,34(3):102-106.
[35]李晓欢,葛向阳,汤有宏,等.古井桃花曲中高产四甲基吡嗪功能微生物筛选及其发酵条件优化[J].酿酒,2016,43(3):52-56.
[36]ZHANG W Q,SI G R,RAO Z M,et al.High yield of tetramethylpyrazine in functional Fuqu using Bacillus amyloliquefaciens[J].Food Biosci,2019,31:100435.
[37]赵洪源.凉州熏醋传统酿造过程高产四甲基吡嗪微生物筛选及其代谢机理初探[D].兰州:甘肃农业大学,2015.
[38]XIAO Z J,XIE N Z,LIU P H,et al.Tetramethylpyrazine production from glucose by a newly isolated Bacillus mutant[J].Appl Microbiol Biotechnol,2006,73(3):512-518.
[39]ZHU B F,XU Y.Production of tetramethylpyrazine by batch culture of Bacillus subtilis with optimal pH control strategy[J].J Ind Microbiol Biotechn,2010,37(8):815-821.
[40]王晓阁.枯草芽孢杆菌研究进展与展望[J].中山大学研究生学刊(自然科学·医学版),2012,33(3):14-23.
[41]SOO K,LEE H J,SHON D H,et al.Optimum conditions for the production of tetramethylpyrazine flavor compound by aerobic fed-batch culture of Lactococcus lactis subsp.lactis biovar.diacetylactis FC1[J].J Microbiol Biotechn,1994,4(4):327-332.
[42]DEMAIN A L,JACKSON M,TRENNER N R.Thiamine-dependent accumulation of tetramethylpyrazine accompanying a mutation in the isoleucine-valine pathway[J].J Bacteriol,1967,94(2):323-326.
[43]XU Y Q,XU C Y,LI X T,et al.A combinational optimization method for efficient synthesis of tetramethylpyrazine by the recombinant Escherichia coli[J].Biochem Eng J,2018,129:33-43.
[44]XIAO Z J,LU J R.Strategies for enhancing fermentative production ofacetoin:a review[J].Biotechnol Adv,2014,32(2):492-503.
[45]HUANGTC,FUHY,HOC T.Mechanistic studies of tetramethylpyrazine formation under weak acidic conditions and high hydrostatic pressure[J].J Agr Food Chem,1996,44(1):240-246.
[46]DICKSCHAT J S,WICKEL S,BOLTEN C J,et al.Pyrazine biosynthesis in Corynebacterium glutamicum[J].Eur J Organ Chem,2010,2010(14):2687-2695.
[47]RIZZI G P.Formation of pyrazines from acyloin precursors under mild conditions[J].J Agr Food Chem,1988,36(2):349-352.
[48]吴建峰,徐岩.白酒细菌酒曲固态培养条件下B.subtilis S12产四甲基吡嗪的合成机制[J].食品与生物技术学报,2014,33(1):8-15.
[49]MENG W,DING F,WANG R M,et al.Enhanced production of tetramethylpyrazine in Bacillus licheniformis BL1 through aldC over-expression and acetaldehyde supplementation[J].Scientif Rep,2020,10(1):1-8.
[50]ZHAO T,LI Y,YUAN S Q,et al.Structure-based design of acetolactate synthase from Bacillus licheniformis improved protein stability under acidic conditions[J].Front Microbiol,2020,11:582909.
[51]ZHANG L Q,HUANG J,ZHOU R Q,et al.Evaluating the feasibility of fermentation starter inoculated with Bacillus amyloliquefaciens for improving acetoin and tetramethylpyrazine in Baoning bran vinegar[J].Int J Food Microbiol,2017,255:42-50.