牛心柿,是山西孝义柿子最主要品种,2008年国家农业部正式批准“孝义柿子”为农产品地理标志产品,是支持当地产业经济发展的重要特色农产品[1]。牛心柿属于完全涩柿(pollination constant astringent,PCA),营养价值高,享有“果中圣品”的美誉,含有丰富的甘露醇、葡萄糖、果糖、五环三萜类化合物等成分[2-3],不仅具有较高的食用价值,还有抗肿瘤、抗老化、预防心血管疾病等的重要生理和药理功效[4-5]。目前,天然营养的果汁饮料发展极为迅速,而柿果多以柿饼、柿醋、柿酒加工为主,柿汁饮料还较为少见。
有机酸作为果实加工制品中风味物质和营养成分重要的构成因素,具有帮助消化、促进食欲等功能,有机酸的组成和含量,是决定加工制品质量和品质的重要指标之一[6-8]。柿果中有机酸约占果实干质量的1.26%,主要包括苹果酸、柠檬酸、奎尼酸等[9],赋予了柿果特殊的口感,但加工制品柿汁中有机酸研究较少,准确测定柿汁中有机酸种类和含量对把控产品品质具有重要意义。有机酸测定方法较多,常见的方法主要包括酶法[10-11]、毛细管电泳法[12-14]、离子色谱法[15-17]、气相色谱法[18-20]、高效液相色谱法(high performance liquid chromatography,HPLC)[21-23]等,其中酶法单次测得的有机酸种类单一,大批样品检测耗时较长;毛细管电泳法可以快速、有效分离有机酸,但样品制备能力差,灵敏度较低,电渗会因样品组成而变化,对分离重现性有影响;气相色谱法对不易挥发的有机酸需要进行衍生化反应,过程繁琐,不适宜普遍应用;HPLC法是目前分离有机酸普遍采用的测定方法,具有易于操作、分离效率高、准确度高和精密度好等优点,因而广泛应用于检测领域。
果汁中有机酸成分及含量研究较多,但牛心柿汁中多种有机酸的定量分析鲜见报道。本实验以山西孝义产牛心柿为原料,制备牛心柿汁,建立高效液相色谱法同时测定牛心柿汁中5种有机酸含量,优化HPLC色谱条件,并对HPLC法进行方法学考察,以期为牛心柿汁的品质监控,及后续产品的产业化开发提供科学依据和理论参考。
1 材料与方法
1.1 材料与试剂
柿果为山西孝义产牛心柿,-18 ℃保存备用;苹果酸、奎尼酸、乳酸、乙酸、柠檬酸标准品(纯度均>98%):美国Sigma公司;甲醇(色谱纯):赛默飞世尔科技(中国)有限公司;磷酸、磷酸二氢钾(均为分析纯):国药集团化学试剂有限公司;果胶酶(30 000 U/g)、纤维素酶(10 000 U/g):上海麦克林生化科技有限公司;实验用水为超纯水。
1.2 仪器与设备
1100型高效液相色谱仪(配有四元泵、真空脱气机、自动进样器、可变波长紫外检测器和化学工作站):美国安捷伦科技有限公司;KQ-500D型超声波清洗仪:东莞市科桥超声波仪器有限公司;TG16-WS型高速离心机:长沙湘智离心机仪器有限公司;AL204型电子天平:梅特勒-托利多仪器(上海)有限公司;NW150V型超纯水系统:上海康雷分析仪器有限公司;RE-52A型旋转蒸发仪:青岛明博环保科技有限公司;SB10-98循环水式多用真空泵:上海豫康科教仪器设备有限公司;WZS-1型阿贝折射仪:山东博科再生医学有限公司。
1.3 方法
1.3.1 浓缩牛心柿汁的制备
柿果微波解冻,清水洗净,除去花萼,打浆,称取一定量柿果浆加入蒸馏水(柿果浆与蒸馏水体积比1∶3),分别加入0.09%果胶酶(30 000 U/g)和0.1%纤维素酶(10 000 U/g),在50 ℃水浴条件下酶解2.5 h,待酶解结束后,将匀浆置于85 ℃水浴中加热10 min灭酶,待匀浆冷却后用4层纱布过滤除去柿渣即得柿汁(可溶性固形物含量为5°Bx)。柿汁分别在-0.085 MPa、100 r/min、55 ℃条件下进行真空旋转蒸发浓缩,95 ℃水浴条件下常压蒸发浓缩,最终得到浓度为30°Bx的浓缩牛心柿汁,冷却至室温备用。
1.3.2 样品预处理
取适量牛心浓缩柿汁样品,以10 000 r/min离心15 min,分离沉淀蛋白质、果胶等,取上清液2 mL,超纯水定容至10 mL,用0.22 μm微孔滤膜过滤,为待测样品,上机测定。
1.3.3 标准溶液的配制
配制磷酸盐缓冲溶液0.01 mol/L KH2PO4,磷酸调pH至2.7,分别称取适量苹果酸、奎尼酸、乳酸、乙酸、柠檬酸标准品,缓冲溶液溶解定容至10 mL,充分摇匀,得到质量浓度分别为2.000 mg/mL、2.000 mg/mL、1.600 mg/mL、2.000 mg/mL、1.600 mg/mL的混合标准储备液,置于4 ℃条件下避光保存备用。取适量标准储备液,用磷酸盐缓冲溶液将其分别稀释2、5、10、20、50、100倍,得到不同质量浓度的混合标准系列工作溶液。
1.3.4 HPLC色谱条件
色谱柱:AglientTC-C18色谱柱(4.6 mm×250 mm,5 μm);流动相:A相甲醇与B相0.01 mol/L KH2PO4(磷酸调pH值至2.7)体积比为1∶99,超声后用0.45 μm的水相滤膜过滤;流速:0.6 mL/min,等度洗脱;柱温:25 ℃;进样量:10 μL;检测器:可变波长紫外检测器;检测波长:210 nm。
1.3.5 HPLC色谱条件优化
通过改变磷酸盐缓冲液浓度、流动相比例、流速、柱温四个变量,对HPLC色谱条件进行优化,其中磷酸盐缓冲液浓度分别为0.01 mol/L、0.02 mol/L、0.03 mol/L(KH2PO4);甲醇体积分数分别为1%、2%、3%、4%;流速分别为0.6 mL/min、0.8 mL/min、1.0 mL/min;柱温分别为25 ℃、30 ℃、35 ℃。
1.3.6 数据处理
使用Adobe Photoshop CS6软件对图像进行处理,Microsoft Excel 2016软件和SPSS 23.0软件对数据进行处理和分析,测定数据以“平均值±标准差”(X±S)表示。
2 结果与分析
2.1 HPLC色谱条件优化
2.1.1 检测波长的确定
分别对苹果酸、奎尼酸、乳酸、乙酸、柠檬酸5种有机酸的标准溶液进行紫外扫描,结果表明,5种有机酸在波长210 nm附近均有较大吸收,故选择210 nm为有机酸的检测波长进行实验。
2.1.2 流动相磷酸盐缓冲液浓度的选择
有机酸为弱酸,大部分以离子状态存在于水相中呈解离平衡,提高H+浓度有助于使有机酸以分子状态在色谱柱上增加保留时间[24],因此在流动相中添加磷酸盐缓冲液可延长保留时间,其中KH2PO4缓冲液作为弱酸电离抑制剂加入流动相中,有利于有机酸的分离检测。分别考察0.01mol/L、0.02 mol/L、0.03 mol/L的KH2PO4溶液对分离效果的影响,结果见图1。由图1可知,流动相中KH2PO4缓冲液浓度不同时,奎尼酸、苹果酸、乳酸、乙酸、柠檬酸各有机酸峰型较好,均能有效分离。改变KH2PO4缓冲液浓度对各有机酸分离效果影响不大,但较高浓度的盐溶液会影响泵和色谱柱的寿命。因此,选择0.01 mol/L的KH2PO4溶液作为流动相缓冲液。
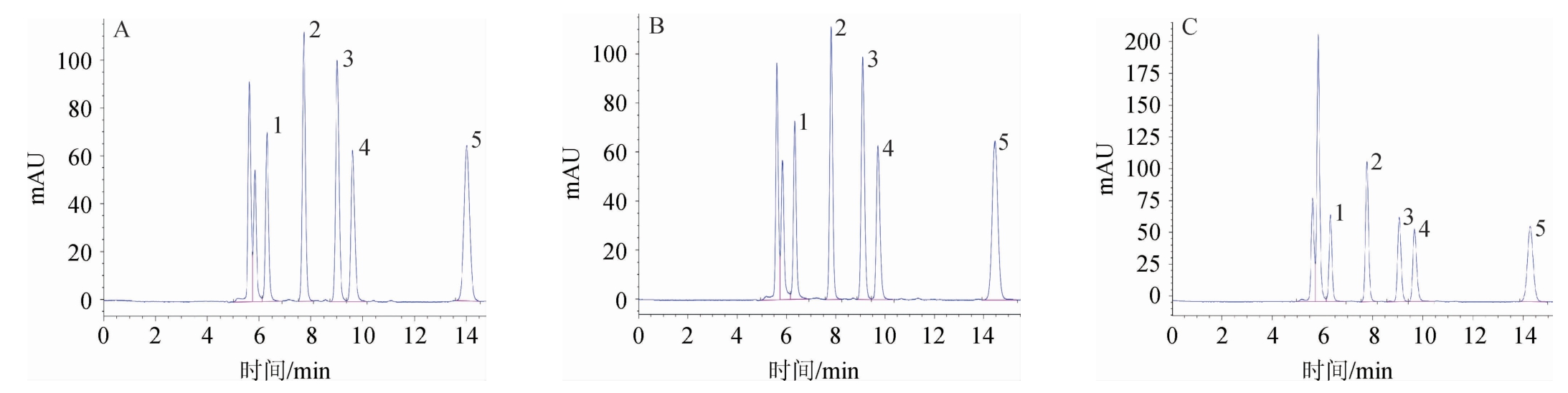
图1 不同浓度KH4PO4缓冲液作为流动相有机酸混合标准品的HPLC色谱图
Fig.1 HPLC chromatograms of mixed organic acid standards with different concentrations of KH2PO4 buffer as mobile phase
A:0.01 mol/L KH2PO4缓冲液;B:0.02 mol/L KH2PO4缓冲液;C:0.03 mol/L KH2PO4缓冲液;1.奎尼酸;2.苹果酸;3.乳酸;4.乙酸;5.柠檬酸。
2.1.3 流动相甲醇体积分数的选择
HPLC的流动相对改善有机酸的分离效果有重要的辅助作用,选择适宜的流动相对有机酸的分离和峰型起着重要作用,流动相中适量加入甲醇,可减弱有机酸疏水基与固定相之间的相互作用[25],能够缩短保留时间,有效改善峰型。分别对流动相中不同体积分数甲醇的有机酸分离效果进行对比,结果见图2。由图2可知,随着甲醇体积分数的增加,出峰时间缩短,流动相中甲醇体积分数为1%时,各有机酸分离效果最好;流动相中甲醇体积分数为2%时,奎尼酸与溶剂峰略有重叠,苹果酸、乳酸、乙酸、柠檬酸的分离效果明显,峰型好;流动相中甲醇体积分数为3%时,奎尼酸与溶剂峰重叠部分增加,其他有机酸有较好的分离;流动相中甲醇体积分数为4%时,奎尼酸与溶剂峰有明显重叠,且柠檬酸峰型发生畸变拖尾现象。因此,确定流动相中甲醇体积分数为1%。
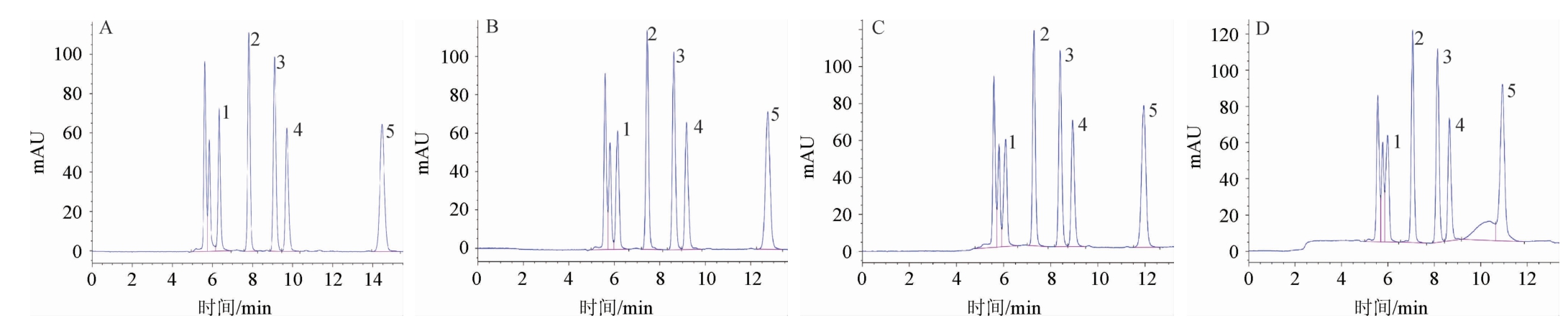
图2 不同体积分数甲醇作为流动相有机酸混合标准品的HPLC色谱图
Fig.2 HPLC chromatograms of mixed organic acid standards with different volume fraction of methanol as mobile phase
A:1%甲醇;B:2%甲醇;C:3%甲醇;D:4%甲醇;1.奎尼酸;2.苹果酸;3.乳酸;4.乙酸;5.柠檬酸。
2.1.4 流动相流速的选择
分别考察流动相不同流速对有机酸分离效果的影响,结果见图3。由图3可知,随着流速的增加,各有机酸保留时间缩短,分析时间也相应缩短,流速为0.6 mL/min时,各有机酸分离效果最好,峰型也较好;流速为0.8 mL/min时,各有机酸保留时间缩短,分析时间缩短,但奎尼酸与溶剂峰略有重叠;流速为1.0 mL/min时,奎尼酸峰型发生畸变,不能得到很好的分离。因此,选择0.6 mL/min为流动相的流速。
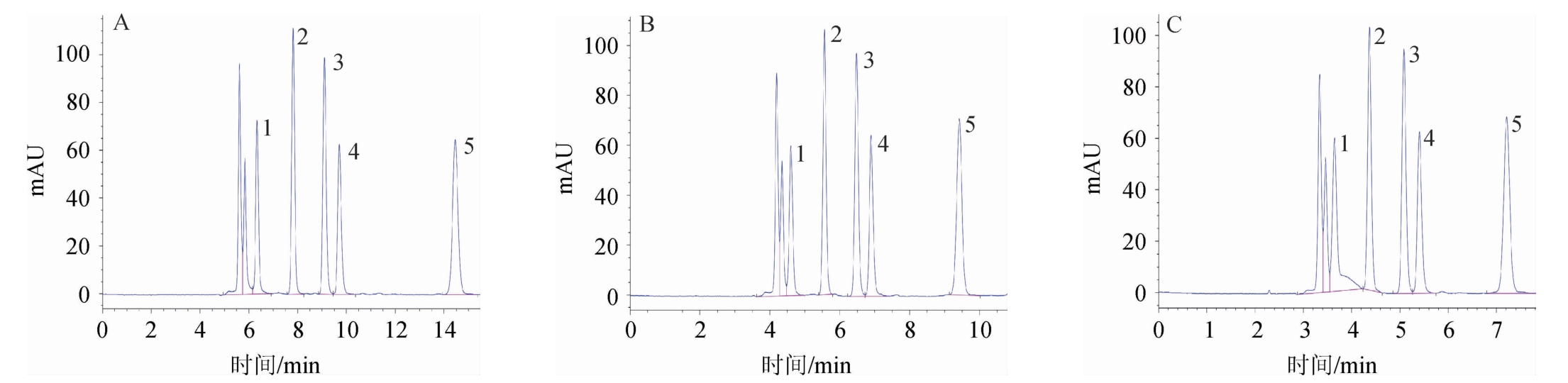
图3 不同流速条件下有机酸混合标准品的HPLC色谱图
Fig.3 HPLC chromatograms of mixed organic acid standards with different flow rates
A:0.6 mL/min;B:0.8 mL/min;C:1.0 mL/min;1.奎尼酸;2.苹果酸;3.乳酸;4.乙酸;5.柠檬酸。
2.1.5 流动相柱温的选择
升高柱温,可以降低流动相黏度、提高传质效率、加快分析速度、提高分析效率,但柱温太高不利于有机酸的分离,会影响色谱柱的使用寿命。分别考察不同柱温对有机酸分离效果的影响,结果见图4。由图4可知,当柱温为25 ℃时,各有机酸分离度及峰型较好,柱温升高至30 ℃和35 ℃时,奎尼酸和溶剂峰发生重叠,分离效果降低。因此,选择25 ℃为最佳流动相柱温。
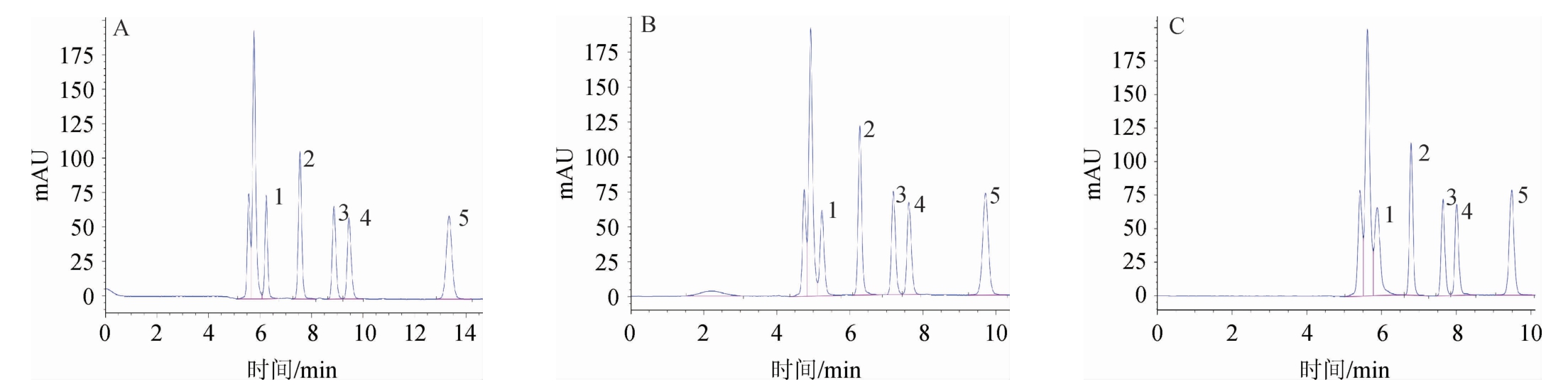
A:25 ℃;B:30 ℃;C:35 ℃;1.奎尼酸;2.苹果酸;3.乳酸;4.乙酸;5.柠檬酸。
2.2 有机酸标准曲线、线性范围、检出限和定量限
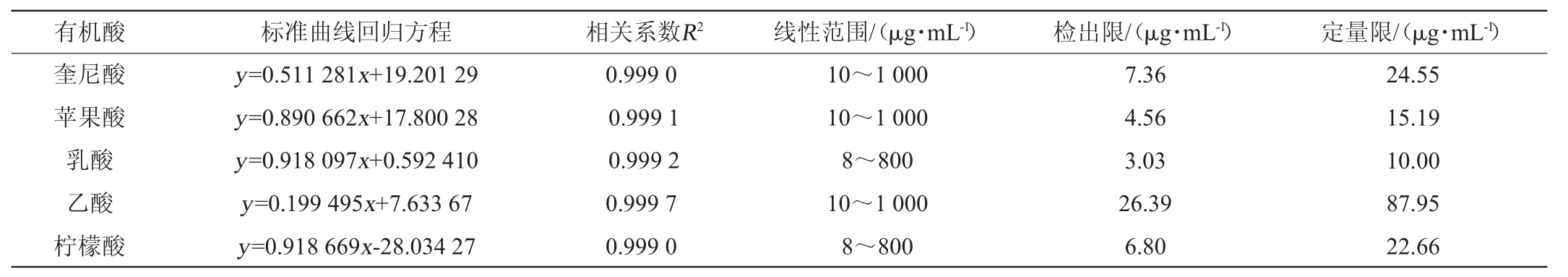
在确定HPLC色谱各优化条件下,对不同质量浓度的各有机酸标准品进行测定,以各有机酸质量浓度为横坐标(x),各组分的峰面积为纵坐标(y)绘制标准曲线,进行线性回归分析,根据信噪比确定有机酸组分的检出限(limit of detection,LOD)信噪比(S/N=3)以及定量限(limit of quantitation,LOQs)信噪比(S/N=10),所得各有机酸标准品的标准曲线和线性范围见表1。由表1可知,各有机酸线性关系良好,其相关系数R2范围为0.999 0~0.999 7,检出限为3.03~26.39 μg/mL,定量限为10.00~87.95 μg/mL。
表1 有机酸组分的标准曲线回归方程、相关系数、线性范围、检出限和定量限
Table 1 Standard curve regression equation,correlation coefficients,linear ranges,limit of detection and limit of quantitation of organic acids components
2.3 加标回收率试验
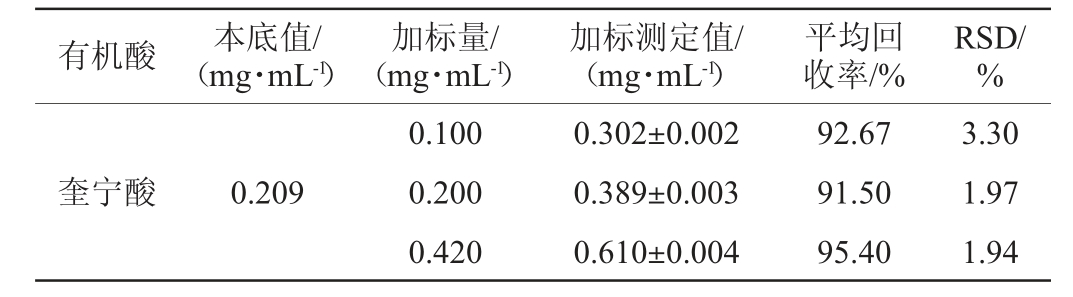
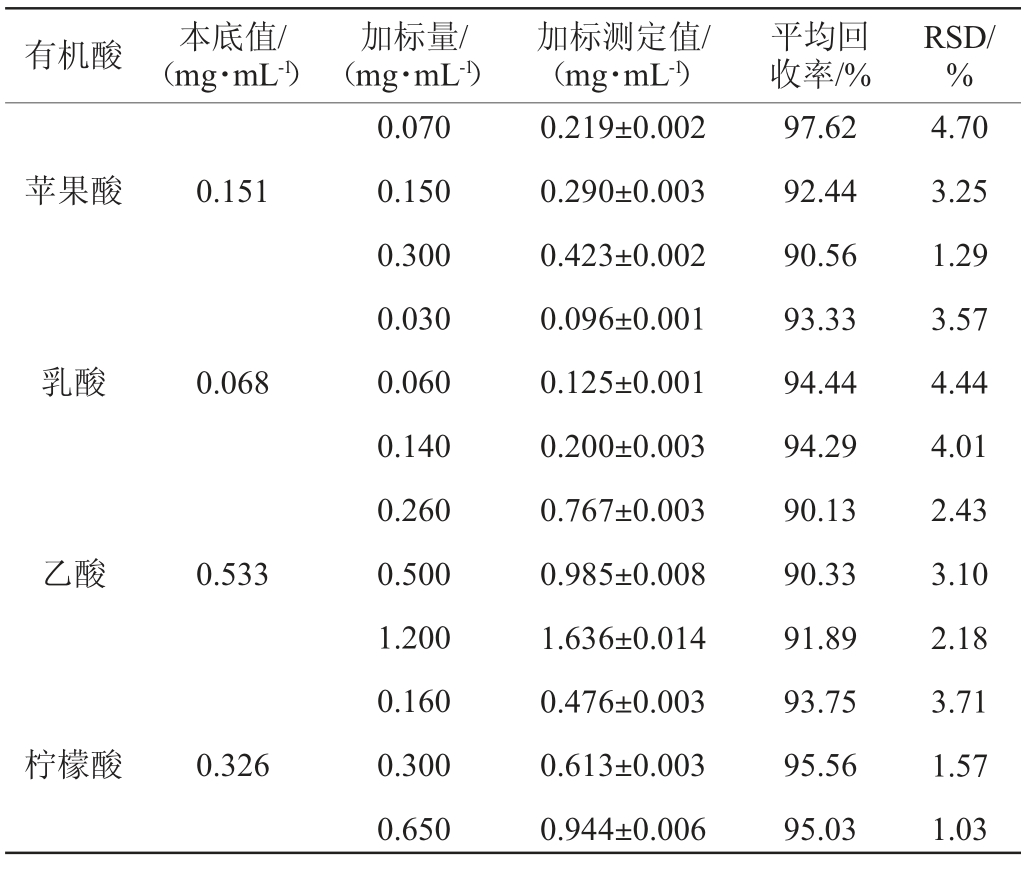
向己知5种有机酸含量的柿汁样品中分别加入高、中、低3个水平的混合标准溶液,按照1.3.2方法处理,平行测定3次,计算相应有机酸组分加标回收率,结果见表2。由表2可知,5种有机酸的平均加标回收率为90.13%~97.62%,回收率试验结果相对标准偏差(relative standard deviation,RSD)为1.03%~4.70%,均<5%,说明该方法准确性良好。
表2 有机酸组分的加标回收率试验结果
Table 2 Results of adding standard recovery tests of organic acids components
续表
2.4 精密度试验
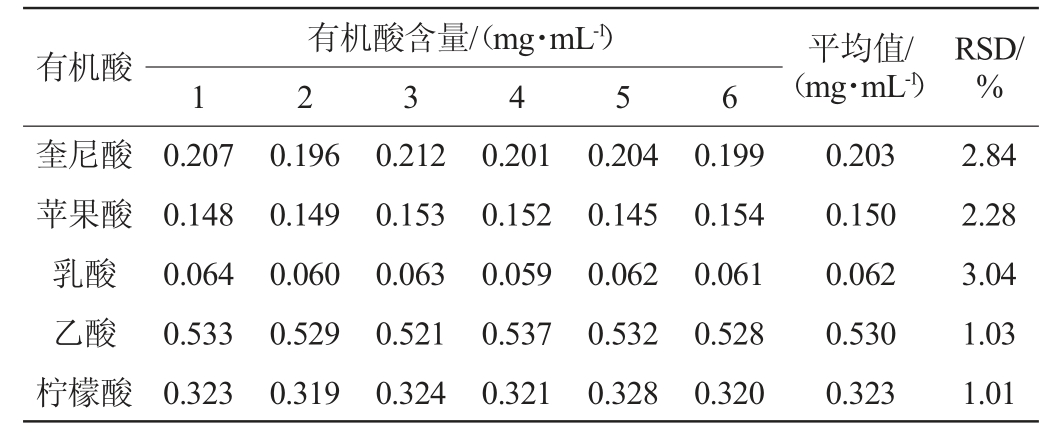
精确称取原柿汁样品6份,按照1.3.2方法处理,测定各有机酸组分含量,计算精密度结果见表3。由表3可知,该方法精密度试验结果相对标准偏差(RSD)在1.01%~3.04%,均<5%,说明该方法精密度良好。
表3 精密度试验结果
Table 3 Results of precision tests
2.5 样品有机酸含量的测定
通过对HPLC色谱条件的优化,对柿汁苹果酸、奎尼酸、乳酸、乙酸、柠檬酸5种有机酸同时定量测定,进行6组平行实验,结果见表4。由表4可知,30°Bx的真空浓缩汁和常压浓缩汁,与原汁对比,各有机酸含量均有不同程度的降低,有机酸含量变化范围分别为奎尼酸0.152~0.209 mg/mL、苹果酸0.129~0.151 mg/mL、乳酸0.030~0.068 mg/mL、乙酸0.239~0.533 mg/mL、柠檬酸0.297~0.326 mg/mL,由于浓缩过程中温度升高,使得柿汁发生一系列化学变化,导致有机酸减少。其中真空浓缩汁中乳酸、乙酸的含量明显低于原汁,且差异显著(P<0.05),旋转蒸发过程中,较长时间的加热使得柿汁中沸点低的乳酸、乙酸较其他有机酸更易挥发,损失明显;常压浓缩汁中苹果酸、奎尼酸、乳酸、乙酸、柠檬酸5种有机酸含量均明显低于原汁,且差异显著(P<0.05),浓缩温度升高至95 ℃时,虽然浓缩耗时较短,但由于浓缩温度较高,柿汁中挥发性酸在高温作用下迅速挥发,导致含量明显降低;常压浓缩汁中苹果酸、奎尼酸、乳酸、乙酸含量低于真空浓缩汁,且差异显著(P<0.05),常压浓缩温度为95 ℃,真空浓缩温度为55 ℃,由于真空浓缩是在较低温度下蒸发,避免了常压浓缩高温导致的挥发性酸迅速挥发和损失,可见热浓缩工艺在一定程度上会破坏柿汁的品质,降低有机酸的含量,而真空浓缩优于常压浓缩。
表4 不同浓缩方式柿汁有机酸含量测定结果
Table 4 Determination results of organic acid contents in persimmon juice with different concentration methods
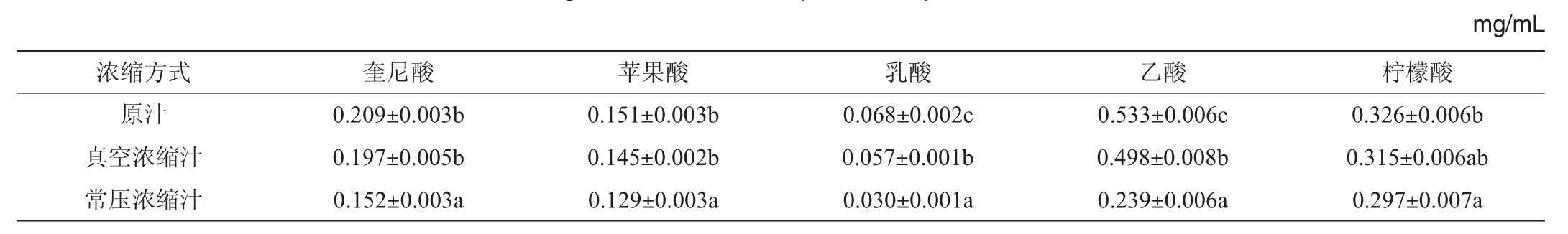
注:同列数据不同字母表示差异显著(P<0.05)。
3 结论
本研究通过采用Aglient TC-C18色谱柱为固定相,建立了同时测定牛心柿汁中5种有机酸的HPLC方法,优化后的色谱条件为:紫外检测器波长210 nm,流动相为甲醇:KH2PO4(0.01 mol/L,pH值2.7)=1∶99(V/V),流速:0.6 mL/min,柱温:25 ℃,所得各有机酸标准曲线相关系数R2为0.999 0~0.999 7,检出限为3.03~26.39 μg/mL,定量限为10.00~87.95 μg/mL,加标回收率为90.13%~97.62%,精密度试验结果RSD均<5%,该方法具有准确度高、精密度高等优点,利用优化后的HPLC法,牛心柿汁中5种有机酸得到良好分离。
浓缩是果汁加工处理的主要方式,起到便于果汁贮藏和运输的作用,但浓缩过程对果汁有机酸的含量会产生一定影响,通过测定不同浓缩柿汁中5种有机酸含量,结果表明,真空浓缩汁和常压浓缩汁中各有机酸含量较原汁均有不同程度的降低,含量变化范围分别为奎尼酸0.152~0.209 mg/mL、苹果酸0.129~0.151 mg/mL、乳酸0.030~0.068 mg/mL、乙酸0.239~0.533 mg/mL、柠檬酸0.297~0.326 mg/mL,真空浓缩优于常压浓缩处理,有机酸含量高且差异显著(P<0.05)。本研究建立的同时测定牛心柿汁中5种有机酸含量的方法,为进一步研究不同加工方式柿汁有机酸含量的变化规律提供技术支持和参考。
[1]李继萍.孝义市牛心柿发展中存在的问题及对策分析[J].山西林业科技,2021,5(1):65-66.
[2]王萍.不同品种柿汁理化品质及抗氧化特性研究[D].泰安:山东农业大学,2011.
[3]VEBERIC R,JURHAR J,MIKULIC-PETKOVSEK M,et al.Comparative study of primary and secondary metabolites in 11 cultivars of persimmon fruit(Diospyros kaki L.)[J].Food Chem,2010,119(2):477-483.
[4]GEA-BOTELLA S,AGULLO L,MARTI N,et al.Carotenoids from persimmon juice processing[J].Food Res Int,2021,141:1-8.
[5]CECILIA J,JESUS L,NURIA M,et al.Characterization of polyphenols,sugars,and other polar compounds in persimmon juices produced under different technologies and their assessment in terms of compositionalvariations[J].Food Chem,2015,182:282-291.
[6]LIN Q,WANG C Y,DONG W C,et al.Transcriptome and metabolome analyses of sugar and organic acid metabolism in Ponkan(Citrus reticulata)fruit during fruit maturation[J].Gene,2015,554(1):64-74.
[7]李佳秀,张春岭,刘慧,等.不同果汁中有机酸的组成及差异性分析[J].果树学报,2017,34(9):1192-1203.
[8]杨枫,杨燕,陈丹,等.果蔬汁饮料的研究现状[J].农产品加工,2017(22):65-67.
[9]高志强.安溪油柿柿饼加工工艺的研究[D].福州:福建农林大学,2008.
[10]ARTO L,LIISA K.Enzymatic methods for the preparation of enantiopure malic and aspartic acid derivatives in organic solvents[J].Tetrahedron Asymmetr,1999,10(22):4405-4415.
[11]DANIELCZUK J,JAKUBOWSKI A,CZARNECKA A.The comparative examination of L-ascorbic acid determination by enzymatic method and methods according to the Polisch standards in selected fruit and vegetable juices[J].Prace Instytutow I Laboratoriow Badawczych Przemyslu Spozywczego,2000,3(5):27-47.
[12]桑大席,张孔海.加压毛细管电色谱法分析调味果蔬汁饮品中5种有机酸[J].食品研究与开发,2020,41(18):177-182.
[13]汪慧敏,孙森,屈锋.毛细管电泳法同时分析水、乳、膏类化妆品中5种有机酸[J].色谱,2019,37(7):773-777.
[14]赵海杰,梁文辉,李震,等.毛细管离子色谱-串联质谱法测定热纤梭杆菌发酵液中的低相对分子质量有机酸[J].色谱,2017,35(3):264-268.
[15]SOUZA J C,SILVA J L,FABRAO R M,et al.Electroactive sugars,or-ganic acids and sugar alcohol analysis in wine using anion-exchange chromatography with electrochemical detection[J].Microchem J,2019,147:972-978.
[16]郭柏坤,周鑫.离子色谱法测定水果中的有机酸[J].发酵科技通讯,2018,47(3):47-51.
[17]李桂镇,范伢,穆凯艳,等.固相萃取-离子色谱法测定中药萝芙木中常见有机酸和阴离子[J].分析试验室,2015,34(8):913-917.
[18]袁华伟,杨泽刚,兰著玺,等.气相色谱法测定己酸菌发酵液中的己酸等有机酸含量[J].酿酒科技,2018(3):102-105.
[19]DARKO E,KEVIN B.Thurbide,active control of selectivity in organic acid analysis by gas chromatography[J].Anal Chim Acta,2020,1106:216-223.
[20]曾竟蓝,马胤鹏,秦丹,等.果酒中有机酸的作用及检测方法研究[J].中国酿造,2018,37(6):183-187.
[21]段云飞,吴光斌,叶洪,等.HPLC法同时测定采后莲雾果实7种有机酸的含量[J].食品科学,2021,42(4):175-180.
[22]王珍珍,沙如意,王高坚,等.HPLC法同时测定食用植物酵素中12种有机酸[J].食品工业科技,2020,41(19):279-285.
[23]郝俊光,陈婉玲,杨丽,等.红茶菌发酵罗城毛葡萄13种有机酸的同时检测[J].食品工业科技,2020,41(22):260-266.
[24]刘晨明,曹宏斌,曹俊雅,等.梯度洗脱高效液相色谱法快速检测厌氧菌代谢物中的有机酸[J].分析化学,2006,34(9):1231-1234.
[25]高海燕,廖小军,王善广,等.反相高效液相色谱法测定果汁中11种有机酸条件的优化[J].分析化学,2004,32(12):1645-1648.