桑葚(Fructus mori)是桑科桑属多年生木本植物桑树的果实,含有丰富的糖类、有机酸、维生素、氨基酸和微量元素,具有极高的营养价值和保健功能[1]。桑树各器官中含有丰富的1-脱氧野尻霉素(1-deoxynojirimycin,DNJ),DNJ分子结构类似葡萄糖,能够竞争性抑制α-葡萄糖苷酶的活性,从而降低血糖浓度,是桑叶等中药治疗糖尿病的功效物质[2]。桑葚果实不易贮藏,但酿造成酒后容易贮藏且可以提高经济效益。桑葚酒因可以保留桑葚果实中黄酮、多酚、花色苷、生物碱等生物活性物质而受到广泛关注[3]。桑葚酿酒工艺流程包括选果、洗果、破碎打浆、成分调整、主发酵、分离、后发酵、初滤、调整、陈酿、澄清、精滤、装瓶、杀菌等工序[4]。关于桑葚酒的研究主要集中在桑葚品种[5]、酵母菌种[6]、加工工艺[7]等方面。
在桑葚酒生产过程中可以通过提高桑葚酒发酵速度来缩短发酵时间,从而提高设备利用率。酵母菌在酿酒过程中利用碳源、氮源、无机盐、有机酸、维生素等营养物质生长、繁殖和代谢,将糖转化成乙醇。酵母菌能够直接利用的氮源主要有游离α-氨基酸态氮,小分子肽和游离铵离子,这些物质被称为酵母可同化氮[8]。添加酵母可同化氮对葡萄酒发酵影响的研究较多,在葡萄酒发酵过程中添加酵母可同化氮可以显著提高葡萄酒发酵速度和乙醇产量[9]。目前,关于桑葚酿酒过程中添加可同化氮的研究也有相关报道[10],但尚未见添加可同化氮对桑葚酒功能成分的影响的研究报道。
本研究以桑葚原浆为原料制备桑葚酒,添加生产中常用的硫酸铵提高可同化氮含量,测定发酵过程中的总黄酮、总酚、花色苷、1-脱氧野尻霉素(DNJ)等功能成分含量,并采用1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-trinitrophenyl,DPPH)、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(2,2'-azinobis-(3-ethylbenzthiazoline-6-sulfonic acid)ammonium salt,ABTS)自由基清除能力、铁还原能力,研究添加可同化氮对桑葚酒抗氧化活性的影响,以期为提高桑葚酒的保健功能,加快桑葚酒产业化生产提供科学依据。
1 材料与方法
1.1 材料与试剂
1.1.1 原料与菌株
桑葚:5月份于河南讯联耕创农业科技有限公司果桑基地采摘新鲜成熟桑葚,采摘后迅速带回实验室,-20 ℃保存;La Bayanus酿酒酵母(Saccharomyces cerevisiae):法国Oenofrance公司。
1.1.2 试剂
果胶酶(酶活>35 000 U/g)、偏重亚硫酸钾、山梨酸钾(均为分析纯):烟台帝伯仕有限公司;1,1-二苯基-2-三硝基苯肼(DPPH)(分析纯)、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)(分析纯)、水溶性维生素E(Trolox)标准品、1-脱氧野尻霉素(DNJ)标准品(纯度均≥98.0%):美国Sigma公司;芴甲氧羰酰氯(9-fluorenylmethyl chloroformate,FMOC-Cl)标准品(分析纯):美国Sigma-Aldrich公司;NaOH、葡萄糖、乙醇、HCl、醋酸钠、KCl、Na2CO3、铁氰化钾、NaH2PO4、Na2HPO4、没食子酸、三氯乙酸(均为分析纯)、乙腈(色谱纯):国药集团化学试剂有限公司。
1.2 仪器与设备
UV1901PCS紫外可见分光光度计:上海佑科仪器仪表有限公司;5810R高速冷冻离心机:德国Eppendorf公司;L18-Y68破壁机:山东九阳小家电有限公司;LC98Ⅱ氨基酸分析仪:北京温分分析仪器技术开发有限公司;雷磁PHS-3E型酸度计:上海仪电科学仪器股份有限公司;LC98Ⅱ高效液相色谱(high performance liquid chromatography,HPLC)系统:北京温分分析仪器技术开发有限公司;Waters XTERRA MSC18柱(150 mm×4.6 mm,5 μm):美国Waters公司。
1.3 试验方法
1.3.1 桑葚酒酿造工艺流程及操作要点
桑葚预处理→匀浆→调整成分→主发酵→过滤→后发酵→桑葚酒成品
操作要点:
桑葚预处理:将桑葚解冻、去梗、清水冲洗,再通过热风风干。
匀浆:用破壁机将桑葚打浆,得到桑葚原浆。
调整成分:将桑葚原浆中添加蔗糖13 g/100 g、偏重亚硫酸钾120 mg/kg和果胶酶30 mg/kg,并接入0.02%的活性干酵母。
主发酵、过滤:将调整成分后的桑葚原浆搅拌均匀,分装入瓶,发酵温度控制在(20±1)℃,发酵时间为10 d,当还原糖含量<4 g/L时主发酵结束。主发酵结束后采用300目滤网袋过滤,即得滤液。
后发酵:将滤液于16 ℃温度后发酵,当还原糖含量基本保持不变时,加入320 mg/kg偏重亚硫酸钾和200 mg/kg的山梨酸钾终止发酵。后发酵完成后获得桑葚酒成品。
1.3.2 试验处理
调整成分后添加硫酸铵,以不添加硫酸铵为对照,处理组的硫酸铵添加量分别为120 mg N/L、240 mg N/L、480 mg N/L、720 mg N/L,共计5个处理,每个处理重复3次。主发酵前10 d每天取发酵液,随后在第14、17、20天取样,每次取10 mL至50 mL离心管,高速冷冻离心机中,将样品在10 000 r/min条件下离心15 min,取上清液用于总酚、总黄酮、花色苷、抗氧化能力及1-脱氧野尻霉素(DNJ)的测定。
1.3.3 分析检测
(1)总酚的测定
参考朱明明等[11]的福林-酚法。以没食子酸含量(X)为横坐标,以吸光度值(Y)为纵坐标,绘制没食子酸标准曲线,得到回归方程为Y=4.583 8X+0.168 3,相关系数R2=0.999 2,按照标准曲线回归方程计算样品中总酚含量。
(2)总黄酮的测定
参考亚硝酸钠-硝酸铝比色法[12]。以芦丁含量(X)为横坐标,以吸光度值(Y)为纵坐标,绘制芦丁标准曲线,得到回归方程为Y=0.187 5X+0.006 3,相关系数R2=0.998 9,按照标准曲线回归方程计算样品中总黄酮含量。
(3)花色苷的测定
花色苷含量的测定参考郭浩然等[13]的pH示差法。
(4)DNJ含量的测定
参考KIM J W等[14]的HPLC方法。准确量取1mL酒样于10 mL的离心管中,加入2.5 mL 0.05 mol/L的盐酸溶液,涡旋15 s,12 000 r/min离心15 min,取上清液,残渣再加入2.5 mL 0.05 mol/L的盐酸溶液同前重复提取一次,合并两次提取液,加蒸馏水定容至6 mL后加入芴甲氧羰酰氯(FMOCCl)衍生化。LC98Ⅱ高效液相色谱(HPLC)条件:Waters XTERRA MSC18色谱柱(150 mm×4.6 mm,5 μm)柱温25 ℃;紫外检测器检测波长254 nm;流动相乙腈-0.1%醋酸(55∶45,V/V);流速1.0 mL/min;进样量50 μL。绘制DNJ标准曲线,得到回归方程为Y=136.16X+3.368,相关系数R2=0.999 3,按照标准曲线回归方程计算样品DNJ含量。
(5)抗氧化性能的测定
DPPH自由基和ABTS自由基清除能力的测定:参考杨道强等[15]的方法。DPPH自由基清除能力的测定:将200 μL稀释后的样品置于10 mL比色管中,加3 mL 1,1-二苯基-2-三硝基苯肼(DPPH)溶液,混匀静置30 min,利用紫外-可见分光光度计,在波长517 nm处测定吸光度值(A517nm),以水溶性维生素E含量(X)为横坐标,以吸光度值(Y)为纵坐标,绘制水溶性维生素E(Trolox)的标准曲线,得到回归方程为Y=5.283 7X+0.358 2,相关系数R2=0.999 3,按照标准曲线计算样品的DPPH自由基清除能力。
ABTS自由基清除能力的测定:将200 μL稀释后的样品,加3 mL 2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)溶液,在暗室反应30 min,利用紫外-可见分光光度计,在波长734 nm处测定吸光度值(A734nm)。以水溶性维生素E含量(X)为横坐标,以吸光度值(Y)为纵坐标,绘制水溶性维生素E(Trolox)的标准曲线,得到回归方程为Y=16.447 6X+1.711 9,相关系数R2=0.999 0,按照标准曲线计算样品的ABTS自由基清除能力。
铁离子还原能力的测定:参考屈慧鸽等[16]的方法,采用普鲁士蓝法测定桑葚酒中铁离子还原的能力。以没食子酸含量(X)为横坐标,以吸光度值(Y)为纵坐标,绘制没食子酸的标准曲线,得到回归方程为Y=0.067 8X-0.036 41,相关系数R2=0.999 2,按照标准曲线回归方程计算样品还原铁离子的能力。
2 结果与分析
2.1 酵母可同化氮对桑葚酒发酵的影响
添加酵母可同化氮对桑葚酒还原糖(a)和酒精度(b)的影响见图1。
由图1a可知,随着发酵时间在0~10 d范围内的增加,各处理组的还原糖含量逐渐降低,从第3天到第6天降低最快,其中添加240 mg N/L酵母可同化氮的处理还原糖含量下降最快,到第7天即可降至最低水平3.26 g/L;添加120 mg N/L酵母可同化氮处理到第8天降至最低水平;其他处理均在第9天降至最低水平。还原糖降低趋势与胡永正等[17]的结果一致,但下降速度明显低于他们的研究结果,主要原因可能和所用酵母及发酵条件不同有关。
由图1b可知,随着发酵时间在0~10 d范围内的增加,发酵液中酒精度逐渐提高,从第3天到第6天提高最快,其中添加240 mg N/L酵母可同化氮的处理提高最快,到第7天即可提高至最高水平9.57%vol;添加120 mg N/L酵母可同化氮的处理到第8天提高至最高水平;其他处理均在第9天提高最高水平。其原因可能是,发酵初期还原糖含量较高,对酵母生长具有抑制作用,酵母需要适应外界环境,还原糖质量浓度和乙醇含量变化较小,随后由于酵母繁殖进入对数生长时期,酵母生长活跃,还原糖质量浓度迅速降低,酒精度迅速提高[18-19]。
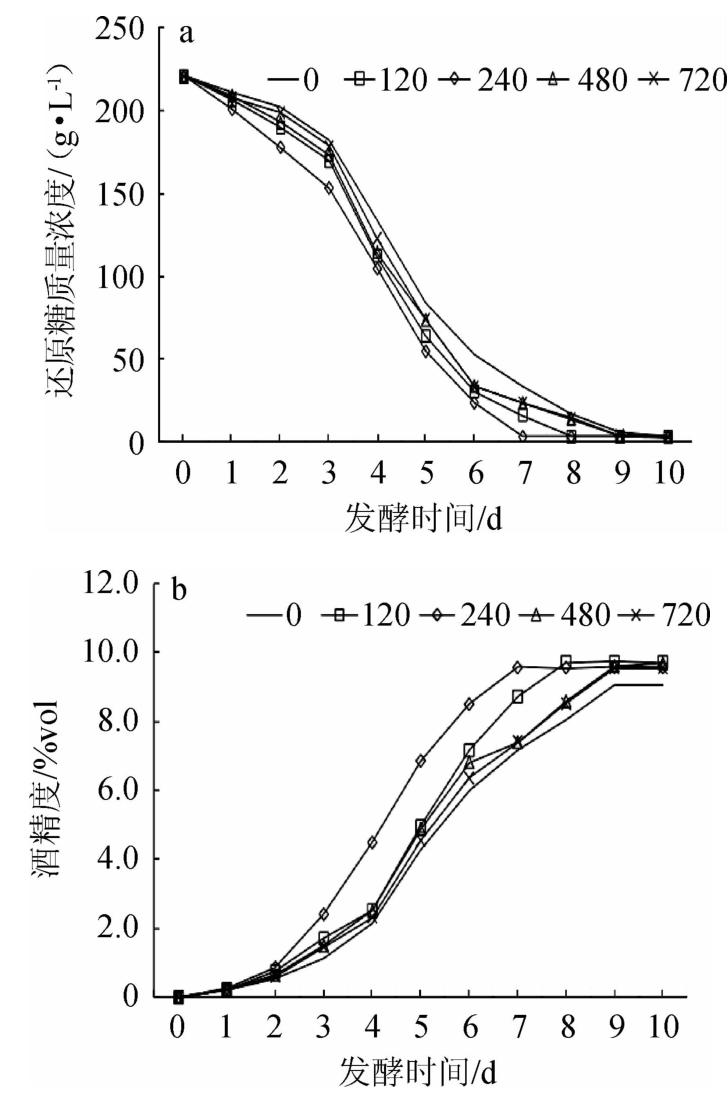
图1 添加酵母可同化氮对桑葚酒还原糖含量(a)和酒精度(b)的影响
Fig.1 Effect of yeast assimilable nitrogen addition on reducing sugar contents (a) and alcohol content (b)
酵母可同化氮的添加量为240 mg N/L,可使发酵时间提前2~3 d。
2.2 添加酵母可同化氮对总酚、总黄酮、花色苷的影响
添加酵母可同化氮对总酚、总黄酮、花色苷含量的影响见图2。
由图2a可知,随着发酵时间在0~5 d范围内的延长,各处理组的总酚含量均在此范围内达到最高值;随着发酵时间的继续增加,多酚含量逐渐降低并趋于平缓。其原因可能是,随着发酵的进行,乙醇浓度提高,桑葚中的酚类物质不断溶出,导致桑葚酒的总酚含量升高。但酚类物质不稳定,容易发生氧化反应,降解反应等以及酚类物质中单宁类化合物发生聚合反应,使其含量降低[19]。酵母可同化氮添加量为240 mg N/L时,可使总酚含量到达最高值的时间提前2 d,当发酵时间为3 d时,总酚含量为3 432.57 mg/L。这与赵红宇等[20]研究的桑葚果酒全渣发酵过程的多酚含量变化趋势一致。
由图2b可知,随着发酵时间在0~4 d范围内的延长,各处理组总黄酮含量均在此范围内达到最高值;随着发酵时间的继续增加,总黄酮含量逐渐降低并趋于平缓。这与孙时光等[10]的研究结果一致。其原因可能是,总黄酮类物质随着发酵过程进行不断溶出,与发酵过程中产生的其他代谢物发生反应,随着发酵液环境的改变,部分黄酮分解,导致黄酮含量逐渐下降[21]。与其他处理相比,酵母可同化氮添加量为240 mg N/L的处理可提高黄酮含量,可使总黄酮含量到达最高值的时间提前1 d,当发酵时间为3 d时,含量为965.48 mg/L,适量添加酵母可同化氮可以加快桑葚酒的发酵速度,提高乙醇生成速度,增加总黄酮溶出量。
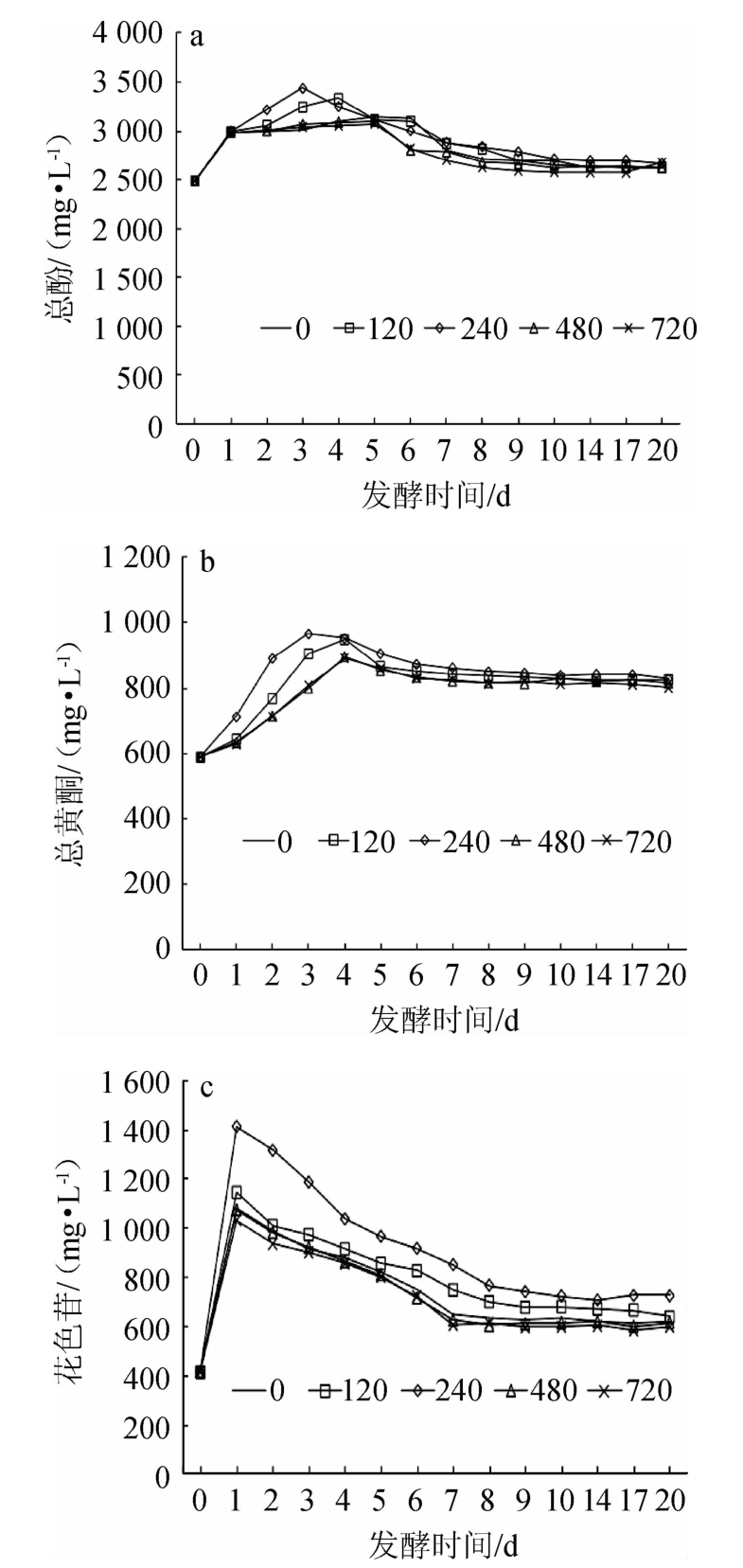
图2 添加酵母可同化氮对总酚(a)、总黄酮(b)、花色苷(c)含量的影响
Fig.2 Effect of yeast assimilable nitrogen addition on total phenols(a),total flavonoids (b) and anthocyanins (c) contents
由图2c可知,随着发酵时间在0~1 d范围内的延长,各处理组的花色苷含量均上升;当发酵时间为1 d时,花色苷含量均达到最高值;随着发酵时间的继续增加,花色苷含量逐渐降低并趋于平缓,这与殷浩等[22]的结果一致。其原因可能是,花色苷是重要的呈色物质,容易与发酵过程中产生的代谢产物丙酮酸和乙醛等小分子物质发生聚合反应生成吡喃花色苷[23];酵母在酒精发酵期间产生的β-葡萄糖苷酶,能水解花色苷的糖苷键[24];发酵后期酵母细胞死亡,细胞壁吸附大量花色苷[25]。与其他处理相比,当发酵时间为3 d时,酵母可同化氮添加量为240 mg N/L的处理比对照提高花色苷30.0%。其原因可能是,酵母可同化氮的添加可加快发酵速度,加快细胞结构破坏,增多花色苷溶出量[26],但随着添加量的继续增大,花色苷含量降低。
酵母可同化氮的添加量为240 mg N/L,可使总酚、黄酮功能成分溶出提前1~2 d,当发酵时间分别为3 d时,总酚、总黄酮、花色苷含量分别提高14.0%、17.6%、30.0%。
2.3 添加酵母可同化氮对DNJ含量的影响
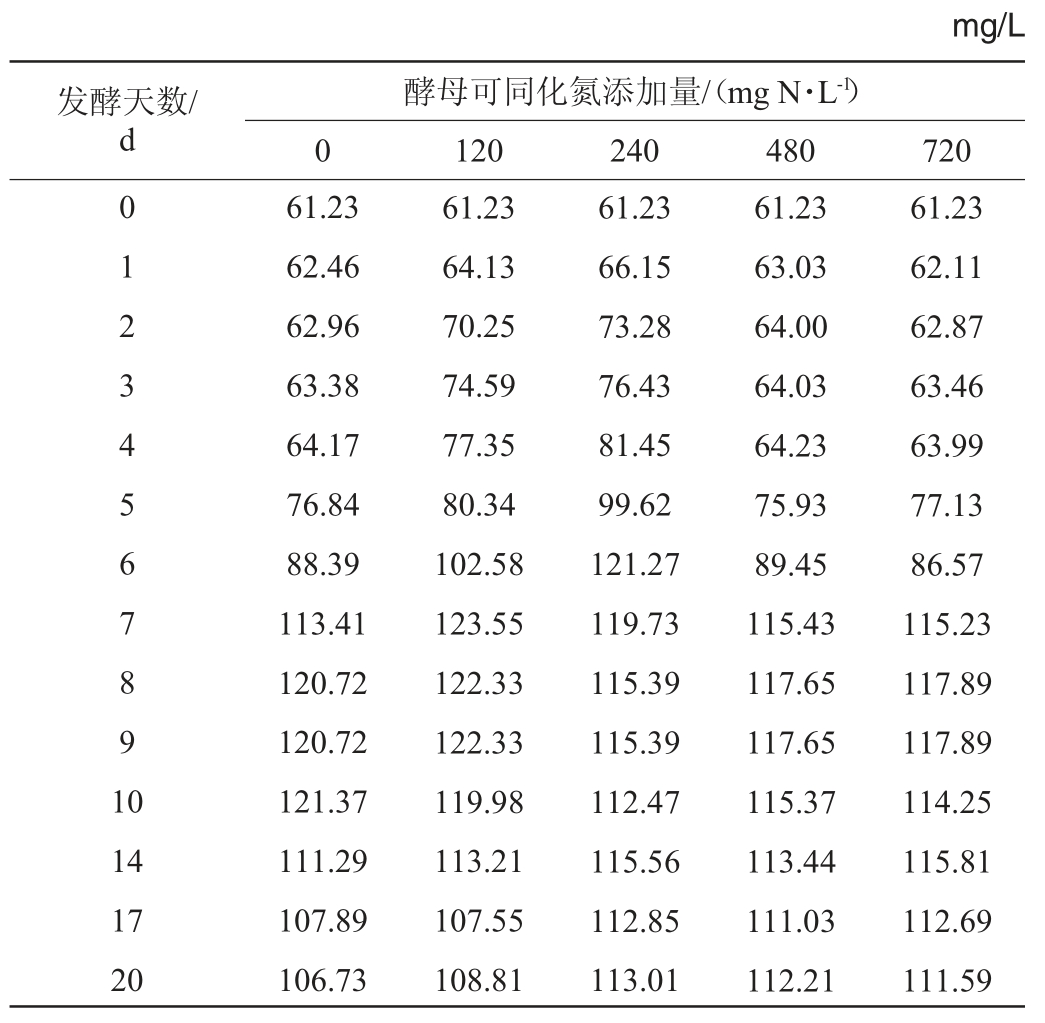
添加酵母可同化氮对DNJ含量的影响见表1。由表1可知,随着发酵时间在0~20 d范围内的延长,各处理组桑葚酒中DNJ含量在发酵初期逐渐升高,在发酵后期缓慢降低。其他处理相比,酵母可同化氮添加量为240 mg N/L的处理可使DNJ含量达到最高值的时间提前4 d。其原因可能是,DNJ容易溶解于水中,提高发酵速率,可加快桑葚细胞的破裂,加快其溶出速率[27]。综合考虑,在发酵过程中,添加240 mg/L可同化氮效果最好,当发酵时间为6 d时,DNJ含量为121.27 mg/L,可促进DNJ的溶出。
表1 添加酵母可同化氮对1-脱氧野尻霉素含量的影响
Table 1 Effect of yeast assimilable nitrogen addition on 1-deoxynojirimycin contents
2.4 添加酵母可同化氮对抗氧化能力的影响
添加酵母可同化氮对DPPH自由基、ABTS自由基、铁还原能力的影响见图3。由图3a可知,随着发酵时间在0~3 d范围内的增加,各处理组桑葚酒的DPPH自由基清除能力呈逐渐增加的趋势;当发酵时间为3 d时,DPPH自由基清除能力达到最大值;继续增加发酵时间,DPPH清除能力逐渐下降并趋于平稳。这与孙时光等[10]的结果一致。其原因可能是,在桑葚酒的发酵初期,随着乙醇体积分数的增加,酒液中酚类、总黄酮类物质溶出加快,其清除DPPH自由基能力提高。在桑葚酒的发酵后期,桑葚酒中的酚类物质、花色苷类物质受温度和pH值的影响发生聚合和氧化反应[28]。与其他处理相比,酵母可同化氮添加量为240 mg N/L处理清除DPPH自由基能力较好,当发酵时间为3 d时,DPPH自由基清除能力是1 459.46 mg/L。
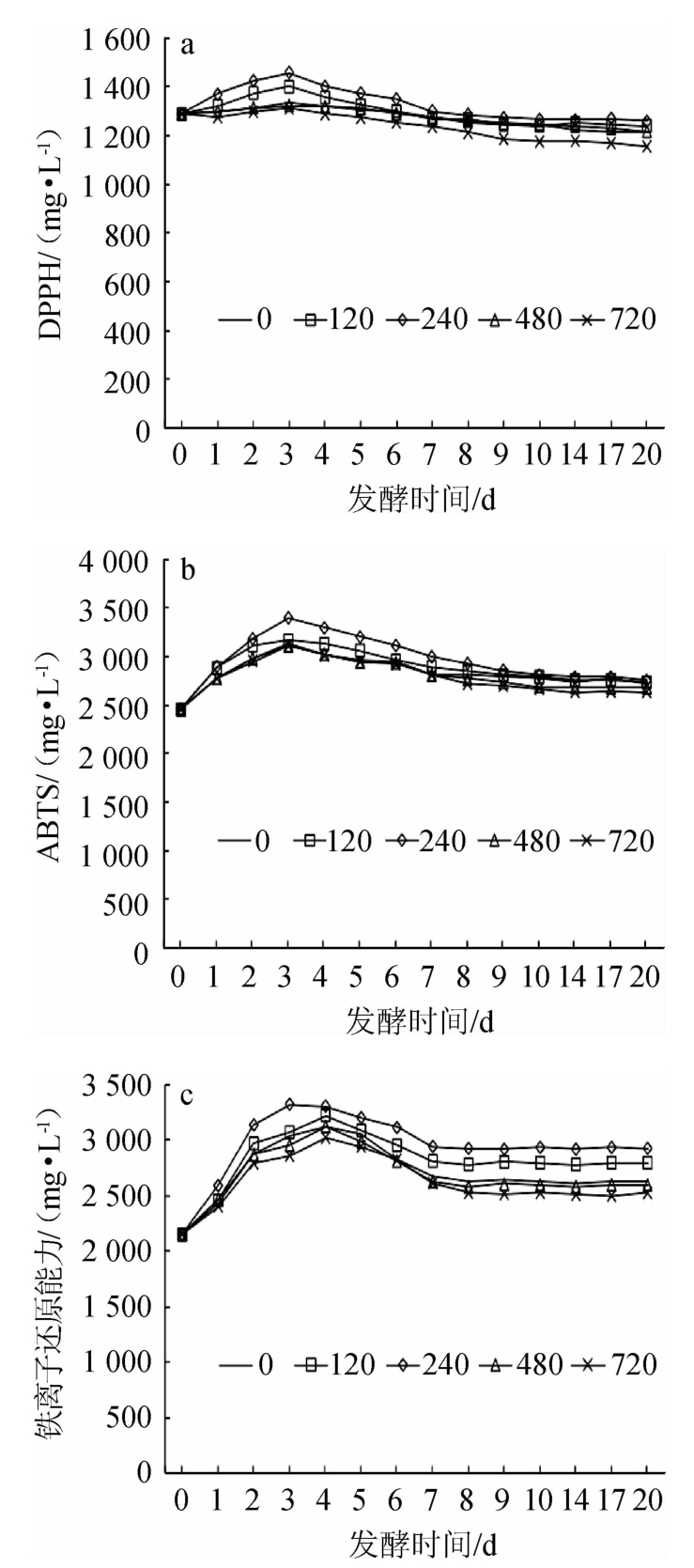
图3 添加酵母可同化氮对DPPH自由基(a)、ABTS自由基(b)清除能力及铁离子还原能力(c)的影响
Fig.3 Effect of yeast assimilable nitrogen addition on scavenging activity of DPPH radical (a),ABTS radical (b) and ferric ion reducing ability (c)
由图3b可知,随着发酵时间在0~3 d范围内的增加,各处理组桑葚酒的ABTS自由基清除能力呈逐渐增加的趋势;当发酵时间为3 d时,ABTS自由基清除能力均达到最大值;继续增加发酵时间,ABTS自由基清除能力逐渐下降并趋于平稳。这与刘书晶等[29]的结果一致。与其他处理组相比,酵母可同化氮添加量为240 mgN/L的处理清除ABTS自由基能力较好,当发酵时间为3 d时,清除ABTS自由基能力是3 400.43 mg/L。
由图3c可知,随着发酵时间在0~3 d范围内的延长,各处理组的铁离子还原能力均在此范围内达到最高值;随着发酵时间的继续增加,铁离子还原能力逐渐降低并趋于平缓。这与WANG L H等[30]的结果一致。其原因可能是,抗氧化能力和多酚、总黄酮、花色苷等物质的含量呈正相关[31]。与其他处理相比,酵母可同化氮添加量为240 mg N/L的处理还原铁能力较高,当发酵时间为3 d时,铁离子还原能力为3 323 mg/L。
本研究中,酵母可同化氮添加量为240 mg N/L的处理可提高发酵速率,缩短桑葚酒的发酵时间2 d,提高总酚、总黄酮、花色苷含量,提高DPPH自由基、ABTS自由基清除能力、铁离子还原能力。
3 结论
在桑葚酒发酵过程中,添加240 mg N/L的酵母可同化氮可以提高桑葚酒的发酵效率,可在发酵前期加快总酚、总黄酮和DNJ成分溶出,当发酵时间为3 d、3 d、6 d时,其含量可达到最大值,当发酵时间为3 d时,DPPH、ABTS自由基清除能力、铁离子还原能力最好。因此,添加酵母可同化氮可以提高桑葚酒功能成分含量,从而提高其抗氧化活性。
[1]李俊芳,马永昆,张荣,等.不同果桑品种成熟桑椹的游离氨基酸主成分分析和综合评价[J].食品科学,2016,37(14):132-137.
[2]郭时印,李林,周虹,等.1-脱氧野尻霉素对α-葡萄糖苷酶的抑制作用机制[J].食品科学,2019,40(5):45-50.
[3]何雪梅,孙健,梁贵秋,等.广西地区13个主栽桑品种的桑椹营养与药用品质综合评价[J].食品科学,2018,39(10):250-256.
[4]唐虎利,谢亚玲.桑葚酒的加工技术研究[J].酿酒科技,2004(1):61-62.
[5]唐翠明,吴继军,罗国庆,等.不同果桑品种的桑椹酿酒试验[J].蚕业科学,2008(1):24-27.
[6]徐佳,黄雪芹,杨建飞,等.酿酒酵母中BAT2基因敲除对桑葚酒中高级醇产生的影响[J].食品与发酵工业,2021,47(1):1-10.
[7]胡永正.桑葚酒发酵工艺优化及动力学研究[D].成都:西华大学,2018.
[8] KEVVAI K,K譈TT M L,NISAMEDTINOV I,et al.Simultaneous utilization of ammonia,free amino acids and peptides during fermentative growth of Saccharomyces cerevisiae[J].J I Brewing,2016,122(1):110-115.
[9]郭在力,栾静,孙玉梅.可同化氮对葡萄酒发酵影响的研究进展[J].中国酿造,2016,35(4):19-23.
[10]孙时光,左勇,徐佳,等.外源添加物对桑椹果酒高级醇的影响[J].食品与发酵工业,2019,45(19):180-187.
[11]朱明明,何鸿举,樊明涛,等.新型发酵剂对沙棘果酒品质及抗氧化性的影响[J].食品工业科技,2018,39(15):15-20.
[12]焦扬,宋海,张勇,等.3种野生浆果果酒中活性物质及抗氧化活性比较[J].食品与发酵工业,2015,41(1):60-65.
[13]郭浩然,郑心怡,张静,等.桑葚酒中花青素含量的测定方法优化[J].食品工业科技,2020,41(9):255-259.
[14]KIM J W,KIM S U,LEE H S,et al.Determination of 1-deoxynojirimycin in Morus alba L.leaves by derivatization with 9-fluorenylmethyl chloroformate followed by reversed-phase high-performance liquid chromatography[J].J Chromatogr A,2003,1002(1-2):93-99.
[15]杨道强,陆胜民,夏其乐,等.灵芝酒浸提过程中主要功能成分的变化及抗氧化作用研究[J].食品与生物技术学报,2016,35(2):205-210.
[16]屈慧鸽,徐栋梁,徐磊,等.放汁法同时酿造干红和桃红葡萄酒及其酒质和抗氧化活性分析[J].食品科学,2016,37(15):179-184.
[17]胡永正,李明元,李梅,等.桑葚果酒分批发酵动力学研究[J].食品与机械,2016(12):7-11,44.
[18]刘学铭,吴继军,廖森泰,等.桑椹汁乙醇发酵过程中主要成分和功能成分的动态变化[J].食品与发酵工业,2006,32(12):138-141.
[19]尹爱国,曾霞,程水明,等.白桑椹柠檬果酒发酵工艺研究[J].食品研究与开发,2020,41(8):169-175.
[20]赵红宇,陈敦洪,邓良,等.桑葚果酒全渣发酵过程中生物活性物质及其抗氧化活性变化的研究[J].食品工业科技,2015,36(23):182-185.
[21] MORATA A,G魷MEZ-CORDOV魪S M C,COLOMO B,et al.Pyruvic acid and acetaldehyde production by different strains of Saccharomyces cerevisiae:relationship with vitis in A and B formation in red wines[J].J Agr Food Chem,2003,51(25):7402-7409.
[22]殷浩,王丽,王香君,等.桑果酒生产过程中花色苷的变化规律[J].食品工业,2019,40(4):79-82.
[23]张珍珍,邓玉杰,赵艳,等.葡萄酒酿造过程中内部因素对颜色稳定性影响分析[J].食品研究与开发,2016,37(5):15-19.
[24]周笑犁,夏雪冰,王瑞,等.不同条件对蓝莓皮渣花色苷稳定性的影响[J].食品与发酵工业,2017,43(4):192-196.
[25] MORATA A,G魷MEZ-CORDOV魪S M C,SUBERVIOLA J,et al.Adsorption of anthocyanins by yeast cell walls during the fermentation of red wines[J].J Agric Food Chem,2003,51(14):4084-4088.
[26]王卫国,林强,张仟伟.葡萄皮花色苷的生理活性及稳定性研究进展[J].中国酿造,2016,35(9):5-10.
[27]王艺霖.桑葚干红酿造工艺及功能性成分的变化研究[D].南京:南京农业大学,2017.
[28]郭在力,栾静,孙玉梅.可同化氮对葡萄酒发酵影响的研究进展[J].中国酿造,2016,35(4):19-23.
[29]刘书晶,吴彩娥,范龚健,等.桑葚酒发酵期间花色苷及抗氧化活性变化[J].食品与生物技术学报,2018,37(6):624-631.
[30]WANG L H,SUN X Y,LI F,et al.Dynamic changes in phenolic compounds,colour and antioxidant activity of mulberry wine during alcoholic fermentation[J].J Funct Foods,2015,18:254-265.
[31]孔燕,杨蕊羽,张明慧,等.酵母菌株及陈酿时间对桑葚酒主要理化指标和抗氧化能力的影响[J].食品与发酵工业,2020,46(6):67-72.