我国蛋白质饲料资源严重短缺,大量依赖外国进口,以大豆为例,2019年的大豆进口总量占年使用量的85%,而棉籽粕的年利用率却不足30%,棉籽粕粗蛋白含量在44%左右,代谢能量为7.4~11.99 MJ/kg,是较好的杂粕蛋白资源[1]。但因其中含有的内源毒性物质-游离棉酚,可促进临床中毒、肝损伤、生殖毒性和免疫危害,限制了其在畜牧养殖业的有效利用[2-5]。
为了改善棉籽粕的营养品质,国内外许多学者对棉酚的脱除方法进行了大量研究,包括物理、化学和生物脱毒法[6-9]。微生物生长代谢过程中会产生大量生物酶,这些酶可以与棉籽粕中的有害物质发生反应,生成无毒无害的化合物,这种利用生物技术脱毒的方法称为生物脱毒法,包括:酶解法、微生物发酵法、菌酶协同发酵法。微生物发酵技术是改善棉籽粕营养价值、提高棉籽粕饲用品质的一个重要手段,棉籽粕经微生物发酵后可产生大量的生物酶和益生菌[10],近年来成为棉粕脱毒的研究热点。
芽孢杆菌(Bacillus)作为理想的发酵菌种,属兼性厌氧菌,对外界有害因子抵抗力较强。芽孢杆菌在棉粕脱毒的同时可释放出高活性的分解酵素,还能产生多种营养物质,如维生素、氨基酸、促生长因子等,减少抗营养因子对动物消化利用的影响。芽孢杆菌定植于肠道可以有效阻止致病菌与肠道黏膜受体结合,抑制病原菌的扩散;且能消耗大量的氧气,阻止肠道中部分有害需氧菌的繁殖,为乳酸菌、双歧杆菌等有益厌氧菌的生长提供条件,使肠道菌群得以稳定[11-12]。芽孢杆菌还可改善肠道形态,强化免疫力,增强动物肠道健康[13-16]。
对于游离棉酚的脱除菌株,国内外大量研究集中于真菌,包括土曲霉[17]、黑曲霉[18]、红曲霉[19]以及产朊假丝酵母[20]、热带假丝酵母[21-22]等,对于芽孢杆菌的报道较少。亓秀晔等[23]利用枯草芽孢杆菌(Bacillus subtilis)BLCC1-0039和植物乳酸菌(Lactobacillus plantarum)BLCC2-0092复配厌氧发酵棉粕72 h,游离棉酚脱除率达到了61.58%,聂蓬勃[24]选出一株对棉粕中游离棉酚降解效果较好的蜡状芽孢杆菌(Bacillus cereus)B2,菌株发酵周期为48 h,料水比1∶1(g∶mL),接种量2%,温度28.0 ℃,游离棉酚的降解率达最大51.7%。海米代·吾拉木[25]从棉花秸秆中分离出死谷芽孢杆菌(Bacillus vallismortis)和漠海威芽孢杆菌(Bacillus mojavensis),对棉籽油的脱毒率分别为21.1%和22.2%。
本研究以藜麦茎叶和番茄杆为原料,分离出高效游离棉酚脱除菌株,并通过人工胃液、人工肠液耐受实验,抗生素敏感实验及表面特性实验对菌株的体内定植效果进行研究,通过形态学观察、生理生化试验及16S rDNA序列分析对筛选菌株进行鉴定,以期为棉籽粕生物脱毒提供优良菌株,为棉籽粕在畜禽生产中的合理利用奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料藜麦茎叶:采自甘肃省甘南藏族自治州临潭县;番茄杆:采自河北省承德市围场满族蒙古族自治县。
1.1.2 化学试剂
蛋白胨、牛肉膏、酵母粉、琼脂粉(均为生化试剂)、药敏纸片、微生物微量生化反应管:杭州微生物试剂有限公司;细菌脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:北京索莱宝科技有限公司;磷酸二氢钾、磷酸二氢钠、磷酸氢二钠、氯化钠、硫酸铵、正己烷(均为分析纯):天津大茂化学试剂厂;胃蛋白酶、胰蛋白酶(均为生化试剂):国药集团化学试剂(上海)有限公司。
1.1.3 培养基
LB肉汤培养基:蛋白胨10g/L,酵母粉5g/L,氯化钠5g/L,pH值7.0±0.2。121 ℃灭菌20 min。LB固体培养基为LB液体培养基中添加18 g/L琼脂。
降解棉酚选择培养基采用无糖查氏醋酸棉酚液体培养基:硫酸铵5 g/L、磷酸二氢钾1 g/L、氯化钠0.1 g/L、硫酸镁0.5 g/L、氯化钙1 g/L、酵母粉0.2 g/L、醋酸棉酚0.3%,pH自然。固体培养基为上述液体培养基加15~20 g/L琼脂。121 ℃灭菌20 min。
棉粕固态培养基:称取过60目筛经粉碎的棉籽粕84.1 g、麸皮9.4 g、红糖6.5 g于500 mL发酵袋中,121 ℃灭菌20 min,后将其冷却至室温,加入灭菌蒸馏水66 mL待用。
1.2 仪器与设备
MLS-3750全自动高压灭菌器:日本三洋公司;GL-21M高速冷冻离心机:赛特湘仪离心机仪器有限公司;BX51T-32P01数码光学显微镜:日本奥林巴斯公司;1285生物安全柜:美国热电公司;UV-2450PC紫外可见分光光度计:日本岛津公司;HH.B11.600-BS-II电热恒温培养箱:上海跃进医疗器械厂;DHG-9140A 新型电热恒温鼓风干燥箱:宁波江南仪器厂;110X50 ZHWY往复式水浴恒温摇床:上海智诚分析仪器制造有限公司;DYY-12电泳仪:北京市六一仪器厂;T960聚合酶链式反应(polymerase chain reaction,PCR)仪:上海力康生物医疗控股有限公司;MX-E涡旋混匀仪:上海力朗仪器设备有限公司。
1.3 方法
1.3.1 菌种的分离纯化
分别称取5 g藜麦茎叶样本和番茄杆样本,剪碎分别装入50 mL无菌生理盐水中,于250 mL三角瓶中摇床振荡20 min摇匀,静置备用。采用梯度稀释法进行菌种的分离,挑取单菌落,通过平板反复划线纯化菌株,经镜检确认为纯种后斜面保藏至4 ℃冰箱。
1.3.2 游离棉酚脱除菌株的初筛
将分纯菌株点种在降解棉酚选择培养基上,37 ℃恒温静置培养72 h,观察其菌落生长情况。菌落生长记为“+”,菌落不生长记为“-”,每组处理3 个重复。
1.3.3 游离棉酚脱除菌株的复筛
将初筛菌株以3%的接种量,接种于棉粕固态培养基中,充分混合均匀,37 ℃静置发酵72 h。将棉粕固态培养基在45 ℃烘干24 h,最终检测各菌株的棉酚脱除效果,每组处理3个重复。
1.3.4 菌株产蛋白酶实验
将具有棉酚降解能力的菌株点种在酪蛋白选择培养基上37 ℃培养72 h,测定平板上水解圈直径D(mm),每组处理3 个重复。
1.3.5 分析检测
蛋白酶活性测定:参照商业行业标准SB/T 10317—1999《蛋白酶活力测定法》。利用福林法测得酪氨酸标准曲线,曲线回归方程为y=0.008 9x+0.011 2,相关系数R2=0.998 1。按照酪氨酸标准曲线回归方程计算样品中蛋白酶活性。
蛋白酶活力单位定义:在40 ℃下每1 min水解酪蛋白产生1 μg 酪氨酸所需的酶量为1个酶活单位(U/mL)。
棉酚含量测定:参照国际标准化组织(international standardization organization,ISO)6866—1985《游离棉酚和总棉酚的测定》。游离棉酚含量计算公式如下:
式中:X为游离棉酚含量,mg/kg;A为吸光度值;m为试样质量,g;V为测定用滤液的体积,mL;a为游离棉酚质量吸收系数,62.5 L/(g·cm)。
游离棉酚脱除率计算公式如下:
式中:X为游离棉酚脱除率,%;X0为培养0 h游离棉酚含量,mg/kg;Xt为培养72 h游离棉酚含量,mg/kg。
1.3.6 菌株耐人工胃液、肠液实验
菌株种子液制备:从冰箱保存的斜面培养基上挑取一至三环菌接入含5 mL LB肉汤培养基的50 mL三角瓶中,置于恒温摇床中振荡培养37 ℃,200 r/min培养20 h,得到一级种子液。将一级种子液转接至装液量为50 mL/250 mL液体培养基中,于37 ℃、200 r/min 振荡培养20 h,得到最终发酵用种子液。
菌悬液的制备:吸取10 mL种子液,8 000 r/min离心10 min,去上清,用无菌水洗涤菌体2次,用Na2HPO4-NaH2PO4缓冲液(0.2 mol/L,pH值7.0)重悬菌体,得到终浓度为108 CFU/mL的菌悬液。微生物计数采用稀释平板计数法。
菌株活化后制成菌体浓度为108 CFU/mL的菌悬液,按4%的接种量接入人工胃液、肠液(配制方法分别参见文献[26-27])中,分别于0、2 h、4 h从发酵液中吸取菌悬液,进行10倍梯度稀释,涂布至LB固体培养基上,37 ℃倒置培养,选取菌落数30~300之间的平板进行计数,每组处理3个重复,取平均值。计算菌株对人工胃液、肠液的耐受力,其计算公式如下:
式中:N为菌株对人工胃液(肠液)的耐受力,%;Nt为各时间段培养基活菌数,CFU/mL;N0为培养基初始活菌数,CFU/mL。
1.3.7 菌株表面特性测定
(1)表面疏水性
采用微生物粘着碳烃化合物法(microbial adhesion to hydrocarbons,MATH)[28]。取筛选菌株种子液离心(8000r/min,10 min),弃上清液,用磷酸盐缓冲液(phosphate buffer solution,PBS)洗涤菌体3次后将菌重悬,调整菌悬液的OD600nm值为0.8。在试管内加入4 mL菌悬液、1 mL正己烷,对照组不加正己烷,封口,用旋涡振荡仪剧烈振荡60 s,静置15 min至液体分层。吸取下相水溶液3 mL,以PBS为空白对照,在波长600 nm条件下测定其吸光度值,细菌细胞表面疏水性(cell-surface hydrophobicity,CSH)按如下公式计算:
式中:CSH为细胞表面疏水性,%;A0为对照组吸光度值;AS为实验组吸光度值。
(2)表面凝集性
菌株种子液离心(8 000 r/min,10 min),弃上清液,用磷酸盐缓冲液洗涤菌体3次后将菌重悬,调整菌悬液的OD600nm值为0.8。取5 mL菌悬液于37 ℃恒温箱静置培养2 h后,轻轻吸取200 μL上层悬浮液,不摇动,测定其在600 nm波长处的吸光度值,菌体凝集性计算公式如下:
式中:A为菌体凝集性,%;OD0为菌悬液初始吸光度值;ODt为菌悬液静置后吸光度值。
1.3.8 菌株对抗生素的敏感实验
采用药敏纸片琼脂扩散法(又称(Kirby-Bauer)K-B法)进行药敏试验来评价菌株的抗生素耐药性[29]。
1.3.9 菌株的鉴定
形态学观察:观察菌落形状、大小、颜色、表面特征等;对目标菌株进行简单染色、革兰氏染色,在显微镜下观察菌体形态、大小、革兰氏染色结果。
生理生化试验:采用微量生化反应管对目标菌株进行过氧化氢酶、硫化氢、糖发酵等生理生化试验,参照《常见细菌系统鉴定手册》[30]和《伯杰氏细菌鉴定手册》[31],对菌株的生理生化特征进行分析,确定目标菌株种属。
分子生物学鉴定:将菌株在LB固体培养基上划线培养,37 ℃条件下静置培养20 h,在培养基中挑取菌体,使用Solarbio的DNA试剂盒提取菌株基因组DNA,以其为模板,采用16S rDNA通用引物27 F和1492 R扩增目标菌株16S rDNA基因序列。PCR扩增体系:菌体DNA1μL,PCRPremix25μL,27f(20 pmol/μL)0.5 μL,1492r(20 pmol/μL)0.5 μL,16S-free H2O 23 μL。PCR扩增条件:94 ℃5 min;94 ℃1 min,55 ℃1 min,72 ℃1.5 min,30个循环;72 ℃5 min。取5 μL进行1%琼脂糖凝胶电泳。PCR产物测序由大连美仑生物技术有限公司完成。将所得结果提交至美国国家生物技术信息中心(national center of biotechnology information,NCBI)的GenBank基因库中进行基本局部比对搜索工具(basic local alignment search tool,BLAST)检索,选取同源性较高的已知菌种的16S rDNA序列,采用MEGA 7.0软件中的邻接法(neighbor-joining,NJ)构建系统发育树。
2 结果与分析
2.1 游离棉酚脱除菌株筛选、分离及纯化
分别称取5 g藜麦茎叶样本和番茄杆样本,剪碎分别装入于250 mL三角瓶中,加入无菌水摇床振荡20 min,采用梯度稀释涂平板法,反复划线分离,最终得到16株菌株,通过显微镜观察发现,16株菌均为杆菌,芽孢存在于菌体中央、顶端,以中央芽孢居多。具体菌落形态特征见表1。由表1可知,大部分分离菌株菌落表面粗糙,不规则,菌落较大,颜色呈灰白色,不透明,是绝大多数芽孢杆菌的典型菌落特征。
表1 筛选菌株的菌落形态特征
Table 1 Colony morphological characteristics of screened strains
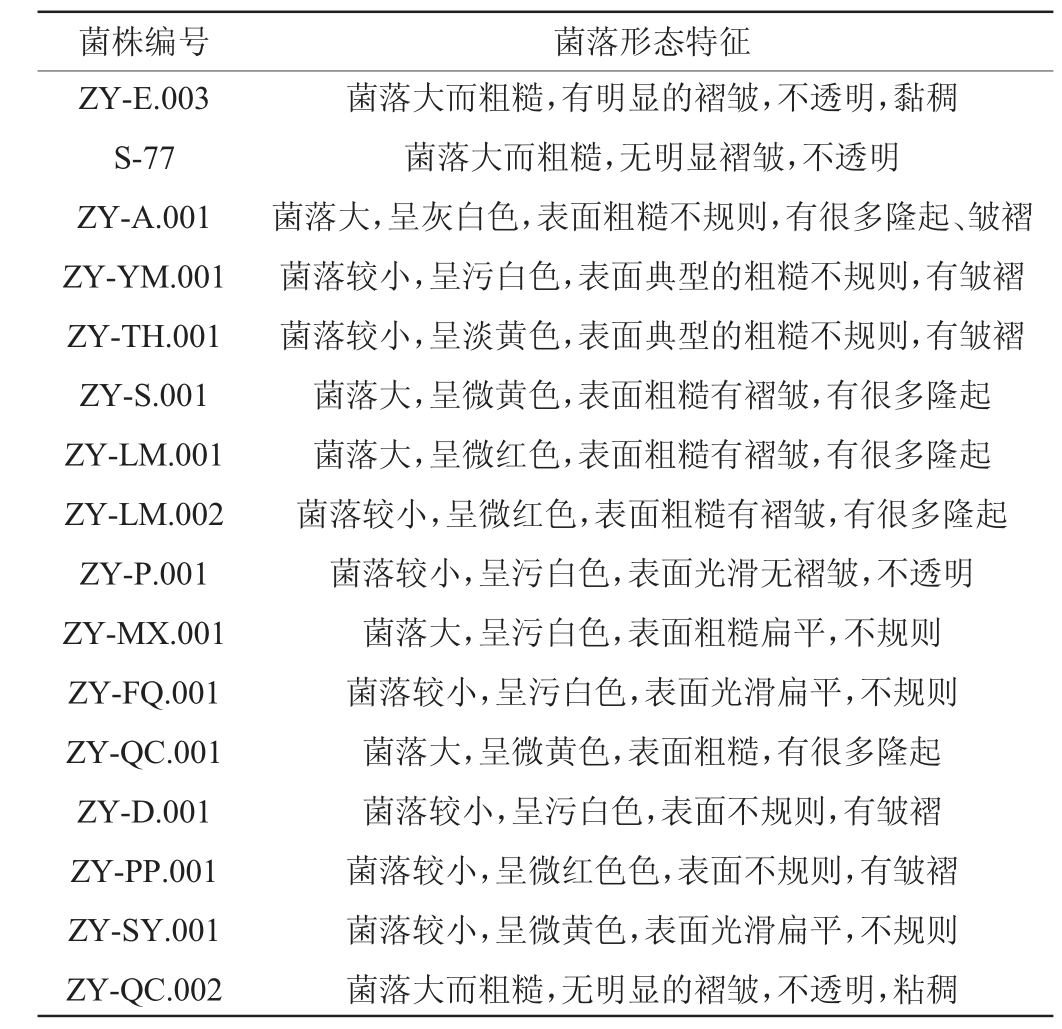
注:菌株编号ZY开头代表从番茄杆分离的菌株,S开头代表从藜麦茎叶分离的菌株。
2.2 游离棉酚脱除菌株初筛
将16株分纯菌株利用醋酸棉酚无糖查氏培养基进行初筛,37 ℃恒温静置培养72 h,各菌株的生长情况见表2。由表2可知,有9株菌在0.3%醋酸棉酚无糖查氏培养基上能生长,其余菌株均不生长,选取生长最快的菌株ZY-P.001、S-77和ZY-A.001进行复筛实验。
表2 游离棉酚脱除菌株初筛结果
Table 2 Primary screening results of free gossypol-degrading strains
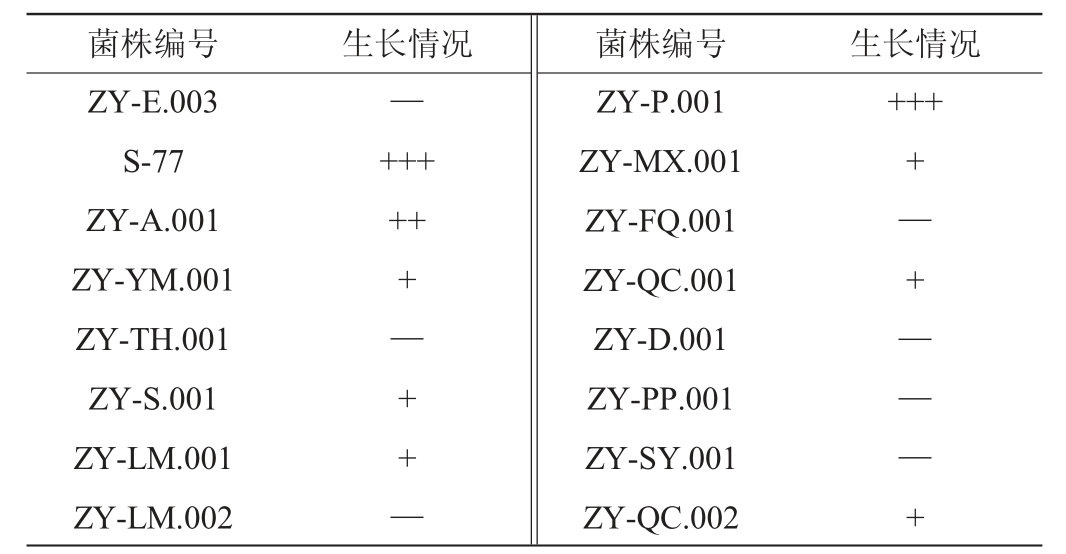
注:“+”表示菌株能生长(72 h长出);“++”表示菌株能生长(60 h长出);“+++”表示菌株能生长(36 h长出);“—”表示菌株不生长。
2.3 游离棉酚脱除菌株的复筛结果
参照ISO 6866—1985《游离棉酚和总棉酚的测定》方法,测得3株菌的游离棉酚脱除率见表3。由表3可知,菌株S-77对于棉酚脱除率为81.30%,显著高于菌株ZY-P.001和菌株ZY-A.001(P<0.05),菌株ZY-P.001与ZY-A.001棉酚脱除率也存在显著差异(P<0.05),选取棉酚脱除率最高的菌株S-77和ZY-P.001进行蛋白酶产酶实验研究。
表3 游离棉酚脱除菌株筛选结果
Table 3 Screening results of free gossypol-degrading strains

注:不同字母表示差异显著(P<0.05)。
2.4 菌株ZY-P.001及S-77产蛋白酶实验
菌株ZY-P.001和S-77点种在酪蛋白选择培养基上37 ℃培养72 h,测定平板上水解圈直径D(mm),菌株S-77表现出较好的产酶特性,透明圈直径为24.2 mm,而菌株ZY-P.001透明圈直径为10.7 mm,选取菌株S-77进行进一步测定蛋白酶活性,为767.27 U/g。蛋白酶产生有利于抗营养因子的消除,可以将大分子蛋白降解成小分子肽、酸溶蛋白,可以提高发酵风味,增加适口性,改善营养物质消化吸收能力,提高机体代谢水平,具有促进生长、降低腹泻率功效。因此,选取高产蛋白酶菌株对发酵蛋白饲料有着重要意义。选取产酶高的菌株S-77进行后续实验研究。
2.5 菌株耐人工胃液、肠液实验
食物进入胃中一般停留4~5 h排空,因此,菌株要在动物体内定植,需要对人工胃液、肠液有一定耐受性。菌株S-77对人工胃液、肠液耐受性测定结果见图1。
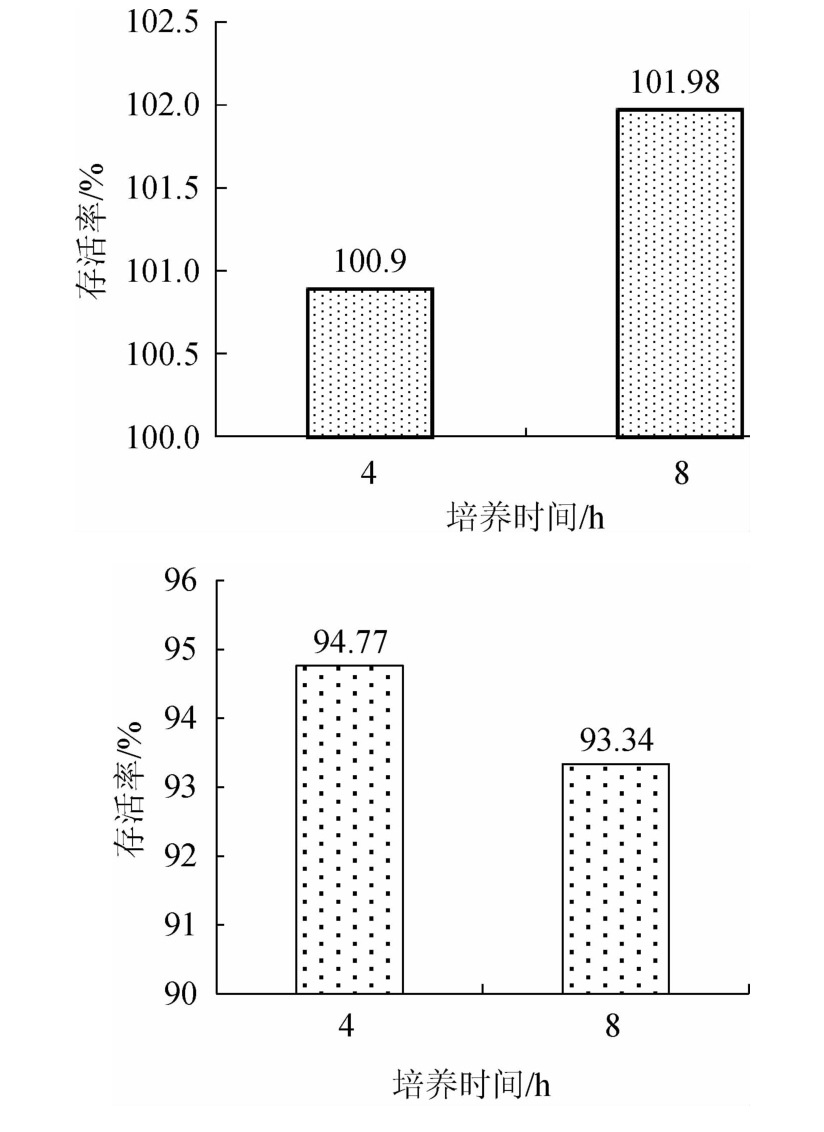
图1 菌株S-77人工胃液(a)及肠液(b)耐受性
Fig.1 Tolerance of strain S-77 to simulated gastric juice (a) and simulated intestinal fluid (b)
由图1可知,菌株S-77随着培养时间的增加,存活率出现了一定程度的下降,且在0~2 h存活率显著下降(P<0.05),4 h后菌株存活率虽有下降,但仍能达到71.16%,大部分菌株可由胃部进入肠道。菌株S-77随着培养时间的增长,在人工肠液中的存活率出现了下降,但一直保持90%以上,8 h后的菌株存活率为93.34%,菌株展现出了对人工肠液的强力耐受性。
2.6 菌株S-77表面特性实验
菌株能否较好地黏附并定植于肠道内取决于菌株的表面特性,只有有效定植才能发挥其益生功能。对菌株S-77的表面疏水性和表面凝集性进行测定,菌株S-77的表面疏水性为60.89%,表面凝集性为72.27%,表明菌株S-77能较好黏附到肠道上皮细胞和黏膜表面上,得以发挥其益生功效。
2.7 菌株S-77对抗生素的敏感实验
菌株S-77对抗生素的敏感实验结果见表4。由表4可知,菌株S-77对常用抗生素青霉素表现为耐药,对庆大霉素表现为相对耐药,对其余抗生素均表现出敏感,敏感率、抗药率和中介率分别为83.33%、8.33%、8.33%。结果表明,菌株S-77作为功能菌株添加入棉粕动物饲料是安全的,其无耐药基因,不会将其携带的耐药基因水平传达给肠道中的致病类菌,导致此类菌获得耐药性。
表4 菌株S-77药敏实验结果
Table 4 Results of drug sensitivity tests of strain S-77
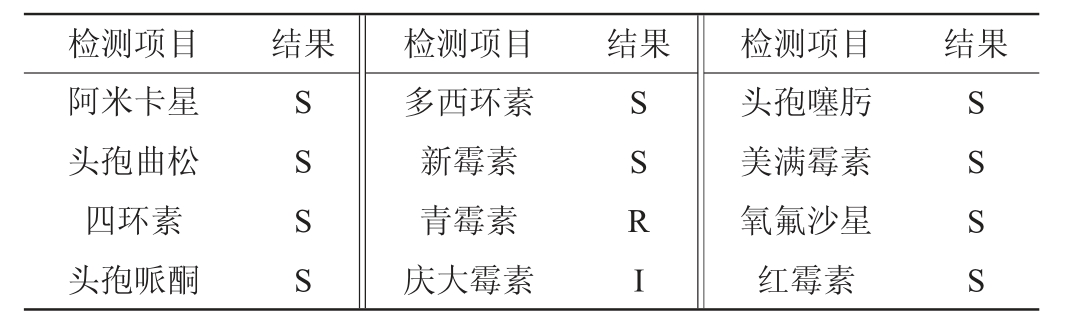
注:“S”表示敏感;“I”表示中介;“R”表示耐药。
2.8 游离棉酚脱除菌株S-77的鉴定
2.8.1 菌株S-77的形态学观察
菌株S-77的菌落及细胞形态见图2。由图2a可知,S-77菌落呈乳白色,不透明,菌落较大,表面粗糙,边缘不整齐,无明显褶皱;由图2b可知,菌株S-77为革兰氏阳性菌,杆状,单个、成对存在,芽孢位于菌体中央,卵圆。
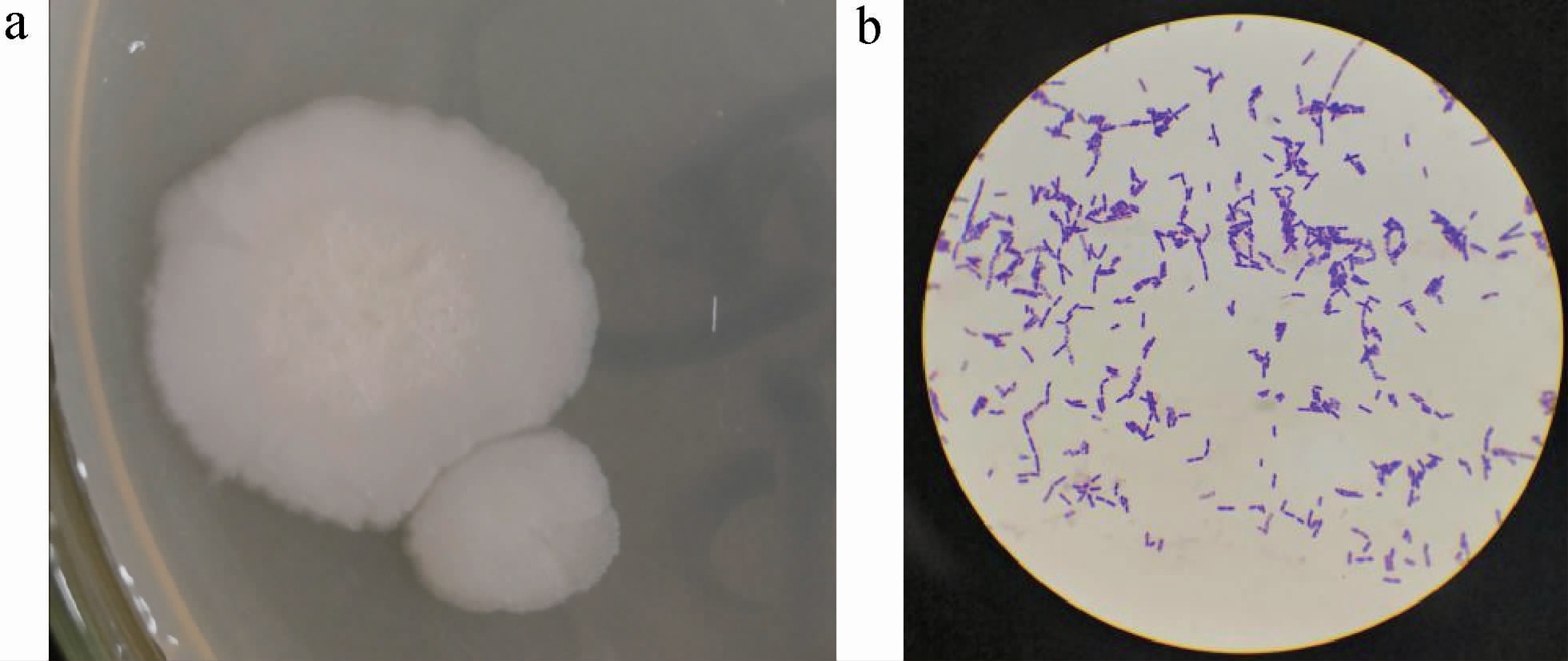
图2 菌株S-77菌落(a)及细胞(b)形态
Fig.2 Colony (a) and cell (b) morphology of strain S-77
2.8.2 菌株S-77的生理生化试验
菌株S-77的生理生化实验结果见表5。由表5可知,菌株S-77可还原硝酸盐,可液化明胶,可在6.5%的高盐溶液中生存,对于绝大多数糖类不可利用,但可利用葡萄糖、麦芽糖、果糖、棉子糖和蕈糖,菌株不产尿素酶,接触酶反应为阴性。
表5 菌株S-77生理生化试验结果
Table 5 Results of physiological and biochemical tests of strain S-77
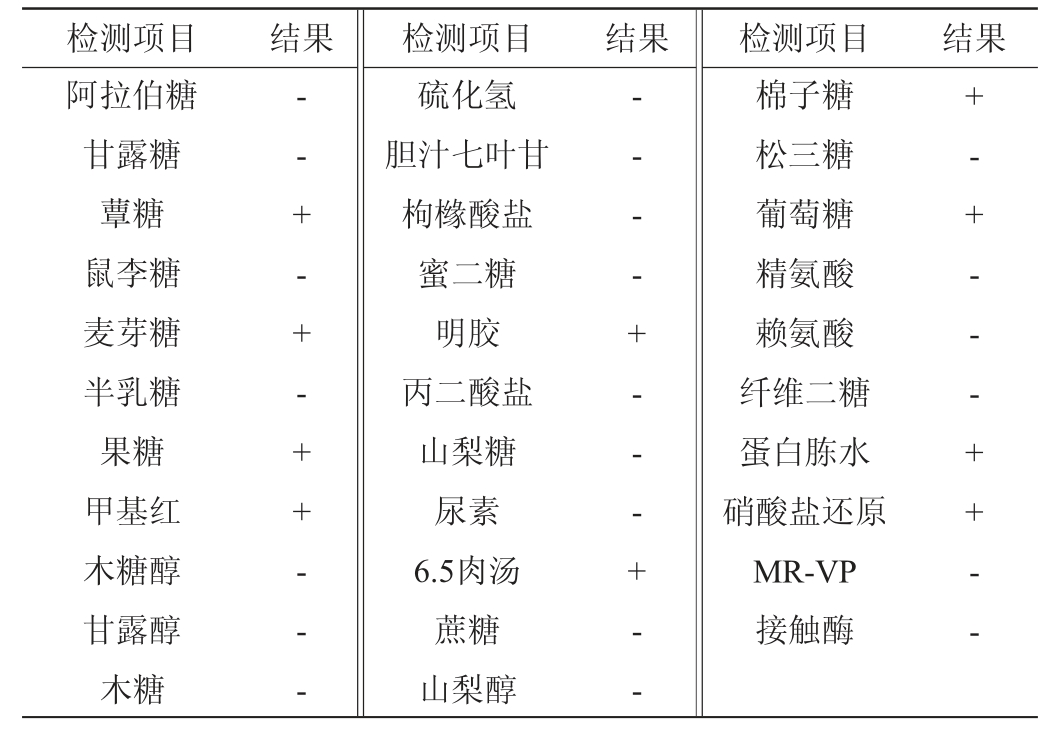
注:“+”表示结果呈阳性;“-”表示结果呈阴性。
2.8.3 菌株S-77的分析生物学鉴定
提取菌株S-77的基因组DNA,并进行16S rDNA扩增,将扩增产物进行琼脂糖凝胶电泳,结果见图3。由图3可知,菌株S-77在1 500 bp附近有明显条带,经过测序,菌株S-77的16S rDNA序列长度为1 400 bp。
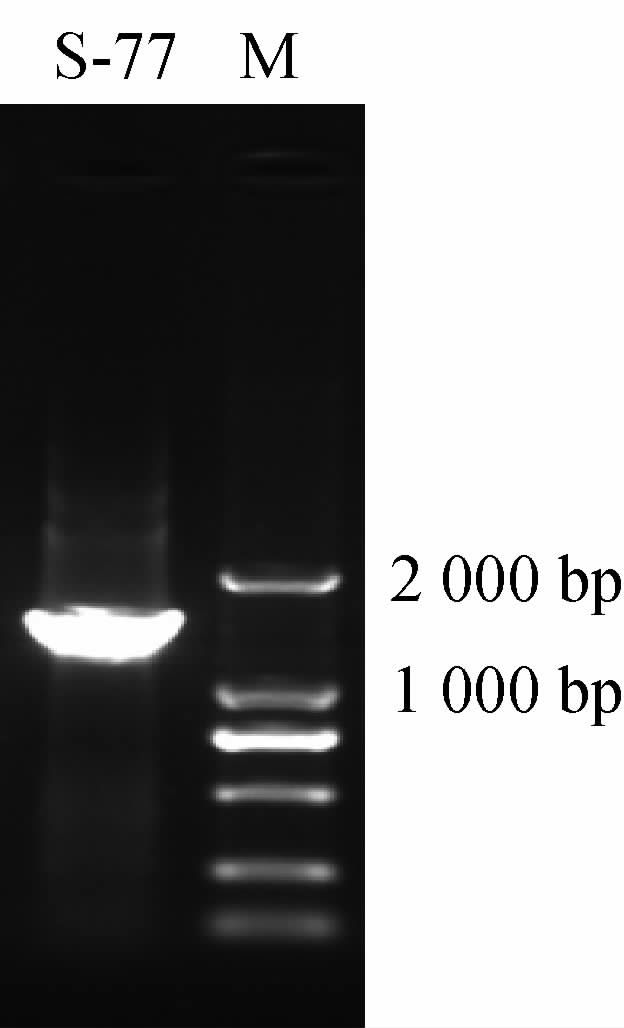
图3 菌株S-77 16S rDNA基因PCR扩增产物琼脂糖凝胶电泳结果
Fig.3 Agarose gel electrophoresis results of 16S rDNA gene PCR amplification products of strain S-77
M为Marker。
将扩增得到的16S rDNA送至大连美仑生物技术有限公司进行测序。测序完成提交菌株S-77的16S rDNA序列在NCBI数据库中进行比对,构建系统发育树,结果见图4。由图4可知,菌株S-77与Bacillus toyonensis strain BCT-7112同源性为99.43%,覆盖率100%,因此结合形态学观察及生理生化特征,菌株S-77被鉴定为东洋芽孢杆菌(Bacillus toyonensis)。

图4 基于16S rDNA序列菌株S-77的系统发育树
Fig.4 Phylogenetic tree of strain S-77 based on 16S rDNA sequence
3 结论
从河北省承德市围场满族蒙古族自治县番茄杆分离得到一株降解棉酚芽孢杆菌,菌株S-77经形态学观察、生理生化及16S rDNA序列分析,鉴定菌株S-77为芽孢杆菌属(Bacillus)东洋芽孢杆菌(Bacillus toyonensis)。
菌株S-77具有高效的游离棉酚脱毒能力,棉酚脱毒率为81.30%,其在使其游离棉酚含量降低的同时,菌株产蛋白酶活性为767.27 U/g。菌株S-77具有很好的耐人工胃液、肠液效果,且具有良好的表面特性,具备黏附于宿主肠壁细胞的能力,可定植在肠道内发挥其益生作用。菌株S-77对抗生素敏感,作为益生菌添加入动物饲料是安全的。
目前,对于棉籽粕的脱毒研究还处于试验阶段,研究集中于对脱毒菌株的筛选及脱毒工艺的优化,对其脱毒机理方面尚无研究,因此,棉籽粕脱毒机理及其在畜禽生产应用方面将是下一步研究的重点内容。
[1] DEVANABOYINA N,RAO S,PANDA A K,et al.Cottonseed meal in poultry diets:A review[J].J Poultry Sci,2007,44(1):19-34.
[2]陈生琴,陈丽娟,程茂基.高效降解棉酚菌株的选育及发酵棉粕最佳工艺的研究[J].中国油脂,2016,41(4):19-24.
[3]倪海球,孙杰,杨玉娟,等.棉籽粕膨化前后品质变化及对生长育肥猪生长性能、血清生化指标及营养物质表观消化率的影响[J].动物营养学报,2018,30(5):1936-1949.
[4] CAMARA A C L,DO VALE A M,MATTOSO C R S,et al.Effects of gossypol from cottonseed cake on the blood profile in sheep[J].Trop Anim Health Prod,2016,48(5):1037-1042.
[5]GADELHA I C N,FONSECA N B S,OLORIS C S,et al.Gossypol toxicity from cottonseed products[J].Sci World J,2014,2014:231635.
[6]王薇薇,周天兵,李爱科,等.棉籽粕化学脱除棉酚的试验研究[J].动物营养学报,2016,28(2):564-571.
[7]斯热吉古丽·阿山,艾尼瓦尔·艾山,崔卫东,等.七种脱毒法对棉副产品的脱毒效果比较—根据游离棉酚含量分析[J].黑龙江畜牧兽医,2016(1):132-134.
[8]PELITIRE S M,DOWD M K,C HEN G H N.Acidic solvent extraction of gossypol from cottonseed meal[J].Anim Feed Sci Tech,2014,195(1):120-128.
[9]杨文婷,陈程,张文举.棉酚降解酶及热带假丝酵母ZD-3对棉籽粕脱毒的对比研究[J].饲料工业,2019,40(24):32-35.
[10]刘建成,吴川川,马贵军,等.发酵棉粕的营养价值及其在动物生产中应用的研究进展[J].中国畜牧兽医,2018,45(5):1258-1265.
[11]吴丽娟,邱光忠,谢乔,等.枯草芽孢杆菌对畜禽肠道健康影响的研究进展[J].饲料研究,2020,43(7):126-129.
[12]黄东彦,朱剑锋,周海泳,等.益生菌群维持肠道健康分子机制的研究进展[J].湖南生态学报,2016,3(2):43-50.
[13]谢开春.枯草芽孢杆菌制剂和有机硒在肉兔生产中的应用研究[D].南京:南京农业大学,2011.
[14]黄玉岚,霍小东,姚宏明,等.枯草芽孢杆菌WEI-62 体外益生评价及其对仔猪生长性能、肠道形态和肠道菌群的影响[J].中国畜牧杂志,2020,56(11):140-145.
[15] XING Y,WANG S,FAN J,et al.Effects of dietary supplementation with lysine-yielding Bacillus subtilis 10 on gut morphology,cecal microflora,and intestinal immune response of Linwu ducks[J].J Anim Sci,2015,93(7):3449-3457.
[16]张雯,王芳婷,倪莉.枯草芽孢杆菌对冰鲜罗非鱼肠道菌群的调节及保鲜作用[J].中国食品学报,2020,20(9):173-179.
[17]赵静.高效降解棉酚菌株的分离、鉴定及其降解机理的研究[D].新乡:河南师范大学,2017.
[18]周媛媛.高效棉酚降解菌的筛选及黑曲霉AN-1高通量转录组测序分析[D].合肥:安徽农业大学,2016.
[19]龙良雨.高效降解游离棉酚菌株的筛选及固态发酵工艺的初步研究[D].曲阜:曲阜师范大学,2016.
[20]邓江华.膨化脱毒棉粕的制备技术及应用效果研究[D].武汉:武汉轻工大学,2015.
[21]杨文婷,陈程,张文举.棉酚降解酶及热带假丝酵母ZD-3对棉籽粕脱毒的对比研究[J].饲料工业,2019,40(24):32-35.
[22]ZHANG W J,XU Z R,SUN J Y,et al.Effect of selected fungi on the reduction of gossypol levels and nutritional value during solid substrate fermentation of cottonseed meal[J].Journal of Zhejiang University(Science B),2006,7(9):690-692.
[23]亓秀晔,谢全喜,陈振,等.高效降解游离棉酚并改善棉籽粕营养品质的菌株筛选[J].动物营养学报,2017,29(9):3258-3266.
[24]聂蓬勃.发酵法降低棉粕中游离棉酚含量及提高其营养价值的研究[D].武汉:华中农业大学,2008.
[25]海米代·吾拉木.棉酚分解菌的分离鉴定及其特性研究[D].乌鲁木齐:新疆大学,2016.
[26]刘秀侠,徐海燕,辛国芹,等.11株枯草芽孢杆菌益生特性研[J].中国畜牧兽医,2017,44(8):2333-2341.
[27]李文,陈银元,陈立明,等.两株魏斯氏菌的益生特性比较[J].食品与发酵工业,2019,45(15):37-43.
[28]赵晴,张甲耀,陈兰洲,等.疏水性石油烃降解菌细胞表面疏水性及降解特性[J].环境科学,2005,26(5):132-136.
[29]谭瑶,赵清,舒为群,等.K-B纸片扩散法药敏试验[J].检验医学与临床,2010,7(20):2290-2291.
[30]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:168-229.
[31]布坎南R E,吉布斯N E.伯杰氏细菌鉴定手册(第8版)[M].中国科学院微生物研究所译.北京:科学出版社,1984:660-721.