红枣又称大枣,鼠李科(Rhamnaceae)枣属(Zizyphus),是原产于我国的特色树种[1]。国家统计局数据显示,2019年我国红枣产量高达746万t,近20年增长了4.7倍。红枣产量的快速增加与精深加工技术的缺乏导致了红枣价格暴跌[2]。因此,探索红枣精深加工技术,丰富红枣产品种类,提高红枣附加值和经济效益,是红枣产业未来发展的大势所趋。近年来,益生菌发酵果蔬汁饮料引起了人们的高度关注。以果蔬汁为发酵基质,经益生菌发酵而得的果蔬汁饮料,不仅营养美味,而且具有多种生理功能,迎合了素食主义者、乳糖不耐受和高胆固醇人群的特定需求[3-4],具有良好的市场发展前景。
近年来,国内外研究人员在果蔬汁发酵及冷藏方面做了大量研究,探讨了多种果蔬汁的益生菌发酵和冷藏过程的理化特性及生物活性变化。果蔬汁通过发酵获得了更佳的营养特性,由于果蔬汁中的生物活性成分在发酵过程中被益生菌转化、降解形成新的化合物,从而赋予发酵果蔬汁新的营养功能特性。发酵果汁在贮藏过程中的成分变化是产品质量的重要限制因素[5-6]。如MANTZOURANI I等[7]用副干酪乳杆菌K5发酵石榴汁,探究了冷藏过程中挥发性化合物、抗氧化活性和总酚含量的变化,发现与未发酵石榴汁相比,发酵石榴汁在冷藏(4 ℃)3周后获得了更好的感官品质。FILHO A等[8]评估了发酵可可汁在冷藏(4 ℃)条件下的益生菌存活情况,发现可可汁是适宜益生菌生长的良好基质,可在为期42 d的保质期内保持良好活力。
目前有关红枣发酵产品的研究主要集中于红枣酒和红枣醋等传统发酵食品,未见益生菌发酵红枣汁饮品的研究报道。前期研究结果已证实,红枣是一种适宜益生菌发酵的基质[9],本研究主要探究发酵枣汁中植物乳杆菌在贮藏期间的存活能力,分析发酵枣汁在贮藏过程中植物化学特性、抗氧化能力和风味特征的变化,以期为益生菌发酵枣汁产品的冷藏工艺提供理论依据。
1 材料与方法
1.1 材料与试剂
陕北木枣、新疆和田枣:分别购自陕西清涧和新疆和田;植物乳杆菌(Lactobacillus plantarum)90(Lp90):江苏微康生物科技有限公司。
MRS培养基、苯酚、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、3,5-二硝基水杨酸、浓硫酸、邻苯二甲酸氢钾、福林酚、浓盐酸、氯化铁:国药集团化学试剂有限公司;2-辛醇、甲醇、甲酸、乙腈和酒石酸、苹果酸、乳酸、柠檬酸、没食子酸、原儿茶酸、绿原酸、表儿茶素、芦丁、咖啡酸、对香豆酸、阿魏酸、槲皮素、肉桂酸、环磷酸腺苷:北京索莱宝科技有限公司。以上试剂均为国产分析纯或色谱纯。
1.2 仪器与设备
CR-5型色彩色差仪:柯尼卡美能达公司;DYJX超低温冰箱:鼎耀机械有限公司;GL-10MD大容量高速冷冻离心机:湖南湘仪仪器开发有限公司;HC-3018R高速冷冻离心机:安徽中科中佳科学仪器有限公司;LRH-250CL低温培养箱:上海一恒科学仪器有限公司;SW-CJ-1FD超净工作台:苏州安泰空气技术有限公司;UV1800PC紫外可见分光光度计、LC-30A超高效液相色谱仪、LC-20A高效液相色谱仪、GCMS-QP2010 Ultra 气相色谱-质谱联用仪(gas chromatography-mass spectrometry,GC-MS):日本岛津公司。
1.3 方法
1.3.1 菌株活化与扩大培养
取1 mL保存于-80 ℃甘油管中的植物乳杆菌菌液接种至10 mL MRS液体培养基中,于37 ℃活化培养24 h后,再取1 mL混合培养液接种至100 mL MRS液体培养基中进行扩大培养(37 ℃、12 h),离心(6 000 r/min、4 ℃、10 min)收集菌体并用无菌生理盐水清洗2次,备用。
1.3.2 红枣汁制备、发酵与冷藏
选取成熟、干燥、无霉变的红枣,洗净、破碎后浸泡至饮用水中(25 g/L),于40~50 ℃浸提4 h后,用尼龙布进行过滤,得到枣汁。用饮用水将枣汁的可溶性固性物含量调至10°Bx,用食品级NaHCO3调pH至5.0。将制备好的枣汁巴氏杀菌(80 ℃、10 min)后冷却至室温备用。将菌悬液接种(0.5 mL/L)至枣汁中于37 ℃发酵48 h,然后在4 ℃条件下贮藏28 d,每隔7 d取样,离心后(6 000 r/min、4 ℃、10 min)进行分析检测。发酵陕北木枣汁缩写为MJLp,发酵新疆和田枣汁缩写为HJLp。
1.3.3 理化指标测定
活菌数:采用标准平板计数法进行植物乳杆菌活菌数的测定;可滴定酸:采用酸碱滴定法测定,结果以乳酸含量表示;总糖、还原糖:采用苯酚-硫酸法测定,结果以葡萄糖含量计算。
1.3.4 有机酸测定
取1 mL样品过0.45 μm水系滤膜。色谱条件[10]:色谱柱为Waters C18色谱柱(250 mm×4.6 mm,5 μm);流动相为0.01 mol/L KH2PO4-H3PO4(pH 2.7)与甲醇的混合物(97∶3,V/V);洗脱程序为等浓度洗脱;流速为0.6 mL/min;紫外可见光谱检测波长为210 nm;柱温为30 ℃;进样量为10 μL。
1.3.5 环磷酸腺苷测定
枣汁中环磷酸腺苷的含量采用高效液相法测定[11]:取1 mL样品过0.22 μm水系滤膜。测定条件:流动相为KH2PO4(0.02 mol/L,pH 2.7)与甲醇的混合物(90∶10,V/V);洗脱程序为等浓度洗脱;流速0.2 mL/min;检测波长254 nm;检测温度40 ℃;进样量1 μL。
1.3.6 总酚、总黄酮测定
采用福林酚比色法测定枣汁中总酚含量[12]:将2 mL福林酚试剂(10%)添加至1 mL经稀释过的枣汁中,后加入2 mL 75 g/L Na2CO3溶液振荡1 min,避光反应40 min,于紫外波长760 nm处测定枣汁样品的吸光度值,结果以没食子酸当量(gallic acid equivalent,GAE)(mg GAE/L)表示。
采用AlCl3比色法测定枣汁中总黄酮含量[13]:将500 μL 50 g/L的NaNO2溶液和3 mL蒸馏水加入1 mL枣汁样品中,振荡1 min并静置5 min,然后加入1 mL 100 g/L的AlCl3溶液,振荡1 min并静置5 min,再加入2 mL的2 mol/L NaOH溶液反应5 min,于紫外波长510 nm处测定枣汁样品的吸光度值,结果以芦丁当量(rutin equivalent,RE)(mg RE/L)表示。
1.3.7 抗氧化能力测定
1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除能力[14]:在1 mL稀释后的枣汁样品中加入2 mLDPPH甲醇溶液(45 mg/L)中避光反应30 min,于紫外波长517 nm处测定吸光度值,结果以DPPH自由基清除率(radical scavenging activity,RSA)表示。公式如下:
式中:Acontrol为空白组的吸光度值;Asample为样品组的吸光度值。
铁离子还原力(ferricion reducing antioxidant power,FRAP)[15]:将1 L醋酸盐缓冲液(0.3 mol/L,pH 3.6)、100 mL 2,4,6-三吡啶基三嗪(2-4-6-tris(2-pyridyl)-s-triaz,TPTZ)溶液(0.01 mol/L)和100 mL FeCl3(0.02 mol/L)混合并在37 ℃反应30 min得到FRAP工作液。将0.2 mL样品与6 mL FRAP工作液混合并在37 ℃反应30 min,于紫外波长593 nm处测定吸光度值,以Trolox为当量,样品的Fe3+还原能力为mmol Trolox/L。
1.3.8 单体酚测定
参照WU C等[16]的方法进行测定。
1.3.9 风味物质测定
采用GC-MS对枣汁样品中的风味物质进行测定[17]:将8 mL枣汁和2 g NaCl加入20 mL顶空瓶中,以2-辛醇作为内标物,加盖密封后上机待测。通过与谱库中标准品的保留时间和质谱进行风味物质的定性分析,保留指数(retention index,RI)>85的结果,通过内标物浓度进行定量分析。
1.3.10 数据处理与分析
数据结果以3个独立试验的“平均值±标准差”表示。利用Minitab 18、SPSS 18和OriginPro 9.0软件对数据进行统计汇总、显著性分析(P<0.05)和图形绘制。
2 结果与分析
2.1 植物乳杆菌发酵枣汁冷藏过程中理化指标的变化
由图1A可以看出,植物乳杆菌在两种枣汁中生长良好,发酵结束时活菌数均高于10.8 lg(CFU/mL)。冷藏过程中枣汁中活菌数逐渐减少,可能是由于发酵后枣汁内部酸性与外界低温的环境条件抑制了菌体的生长,甚至导致菌体损伤和死亡[18]。冷藏28 d后枣汁中活菌数降至6.9 lg(CFU/mL),虽然在冷藏28 d后发酵枣汁的活菌数略低于最初接种量7.5 lg(CFU/mL),但仍高于联合国粮食及农业组织(food and agriculture organization of the united nations,FAO)/世界卫生组织(world health organization,WHO)国际食品法典委员会(codex alimentarius commission,CAC)推荐的最小值6.0 lg(CFU/mL)[3],说明冷藏28 d后的发酵枣汁仍可发挥其促进机体健康的作用。
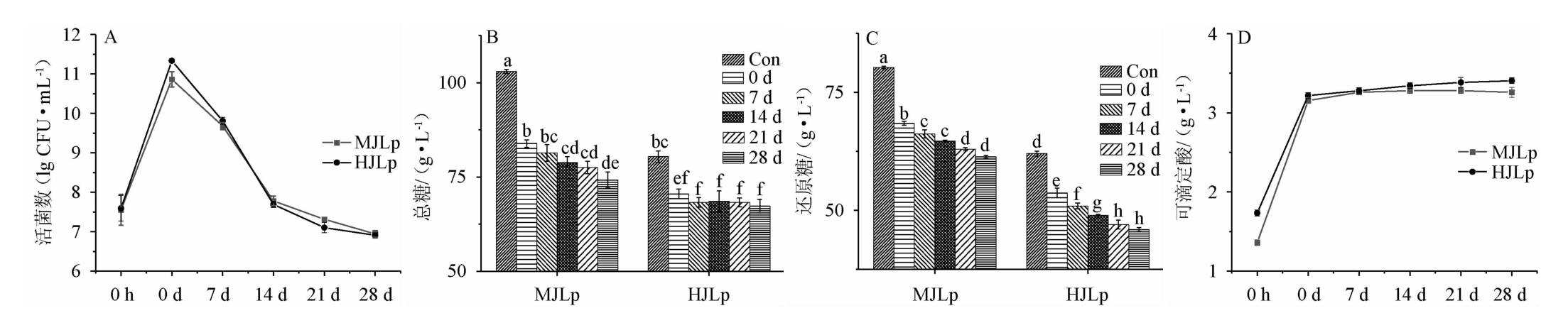
图1 植物乳杆菌发酵枣汁冷藏期间理化指标变化
Fig.1 Changes in physicochemical indices of jujube juice fermented by Lactobacillus plantarum during refrigeration storage
注:0 h和Con样品代表发酵前的枣汁;0 d、7 d、14 d、21 d、28 d样品分别代表冷藏0 d、7 d、14 d、21 d、28 d的发酵枣汁,下同。
由图1B~图1D可以看出,在冷藏28 d之后,发酵木枣汁的总糖含量与还原糖含量分别为74 g/L和61 g/L,相较冷藏前的发酵木枣汁降低了11.6%和10.4%;发酵和田枣汁的总糖含量与还原糖含量分别为67 g/L和45 g/L,相较冷藏前的发酵木枣汁降低了4.5%和14.5%,说明在冷藏过程中植物乳杆菌仍在缓慢进行代谢[19]。与未发酵枣汁相比,发酵枣汁中的可滴定酸含量显著增加,在冷藏28 d之后,发酵木枣汁与和田枣汁的可滴定酸含量分别为3.3 g/L和3.4 g/L,相较冷藏前的发酵枣汁分别增加了3.5%和5.9%。
2.2 植物乳杆菌发酵枣汁冷藏过程中酚类物质含量及抗氧化活性的变化
由图2A、图2B可知,与未发酵枣汁相比,发酵枣汁总酚含量显著增加,总黄酮含量显著降低(P<0.05),发酵后的木枣汁与和田枣汁总酚含量分别为1.10 g GAE/L和1.11 g GAE/L,相较未发酵枣汁分别增加了7.8%和6.7%;总黄酮含量分别为220 mg RE/L和162 mg RE/L,相较未发酵枣汁分别降低了14.1%和15.6%。在冷藏过程中,发酵木枣汁和发酵和田枣汁的总酚含量均在冷藏21 d时达到最低,分别为1.01 g GAE/L和0.98 g GAE/L,相较冷藏前的发酵枣汁降低了8.2%和11.7%;发酵木枣汁的总黄酮含量在冷藏7 d时达到最低,为205 mg RE/L,相较冷藏前的发酵枣汁降低了6.8%,发酵和田枣汁的总黄酮含量在冷藏21 d时达到最低,为127 mg RE/L,相较冷藏前的发酵枣汁降低了21.6%。冷藏结束后两种枣汁的总酚含量和总黄酮含量均高于未冷藏的发酵枣汁,主要是由于植物乳杆菌具有去糖基化和从植物细胞壁释放可溶性共轭或不溶性结合酚类化合物的能力,在冷藏过程中植物乳杆菌代谢产生的糖苷酶将大分子酚类化合物水解成活性更高的小分子酚类化合物[20-21]。
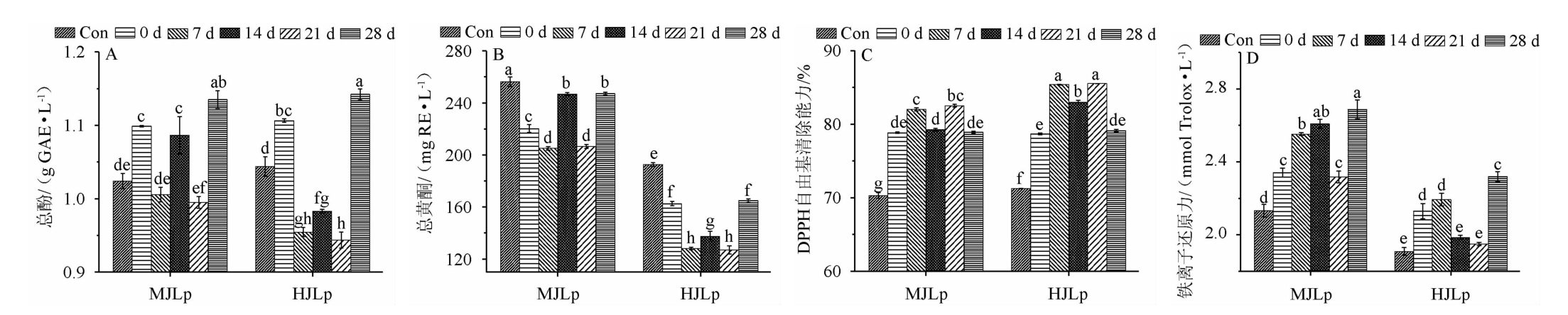
图2 植物乳杆菌发酵枣汁在冷藏期间总酚、总黄酮及抗氧化活性的变化
Fig.2 Changes in total phenols,total flavonoids and antioxidant activity of jujube juice fermented by Lactobacillus plantarum during refrigeration storage
由图2C、图2D可知,发酵枣汁中的DPPH自由基清除率和铁离子还原力相较于未发酵枣汁显著增加(P<0.05),说明植物乳杆菌发酵可以提高枣汁的抗氧化活性。在冷藏过程中,两种发酵枣汁的DPPH自由基清除率和铁离子还原力呈动态变化的趋势。发酵木枣汁和发酵和田枣汁的DPPH自由基清除率均在冷藏21 d时达到最高,分别为83%和86%,在冷藏28 d后两种发酵枣汁的DPPH自由基清除率与冷藏前的发酵枣汁无明显差异;在冷藏28 d后两种发酵枣汁的铁离子还原力达到最高,分别为2.7 mmol Trolox/L和2.3 mmol Trolox/L,与冷藏前的发酵枣汁相比分别提高了15.0%和8.9%。
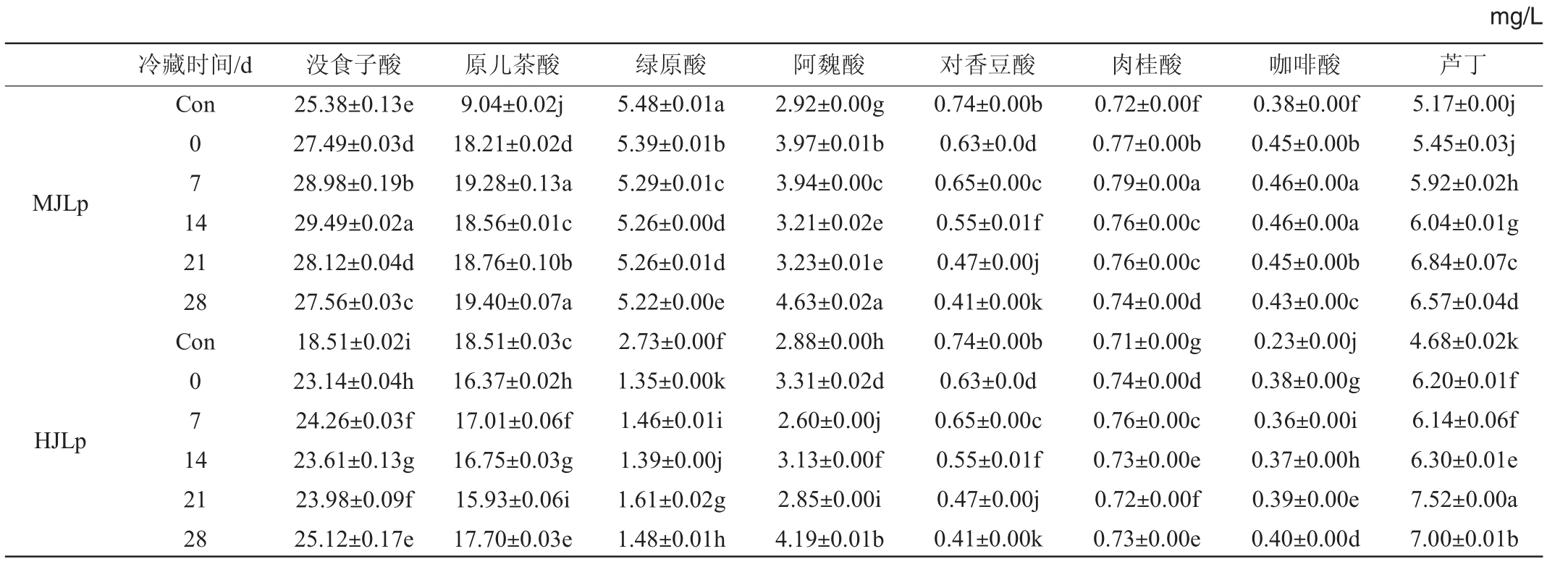
由表1可知,发酵木枣汁在冷藏7 d时单体酚含量达到最高,为68.0 mg/L,发酵和田枣汁在冷藏28 d时单体酚含量达到最高,为59.2 mg/L。发酵木枣汁与发酵和田枣汁的没食子酸、阿魏酸和芦丁含量在冷藏过程中有所上升,而绿原酸含量有所降低;发酵木枣汁在冷藏过程中原儿茶酸含量有所增加,而发酵和田枣汁中原儿茶酸含量有所下降,可能是由于发生了脱羧反应将原儿茶酸代谢成儿茶酚[22-23],在冷藏过程中,植物乳杆菌会水解并利用酚类化合物结合的糖类物质,从而产生空间位阻较低的游离苷元,进而影响枣汁中单体酚的组成与含量[24]。
表1 植物乳杆菌发酵枣汁冷藏过程中的单体酚含量
Table 1 Free phenol content of jujube juice fermented by Lactobacillus plantarum during refrigeration storage
主成分分析(principal component analysis,PCA)被用来探究植物乳杆菌发酵不同枣汁在冷藏期间酚类物质变化与抗氧化活性之间的关系[25]。由图3A可知,PC1可表示44.7%的变量,PC2可表示27.0%的变量,两者共同解释了71.7%的变量。由图3B可知,未发酵枣汁、发酵木枣汁、发酵和田枣汁分别聚成三组。发酵木枣汁位于PC1的正向端,由载荷图可知阿魏酸、肉桂酸、咖啡酸、没食子酸和表儿茶素分布于PC1正向端,表明发酵木枣汁与上述单体酚之间存在正相关关系。发酵和田枣汁表现出更高的DPPH自由基清除能力。未发酵枣汁位于PC1的负向端,在载荷图中槲皮素和对香豆酸分布于PC1负向端,表明未发酵枣汁与上述物质含量之间存在正相关关系。
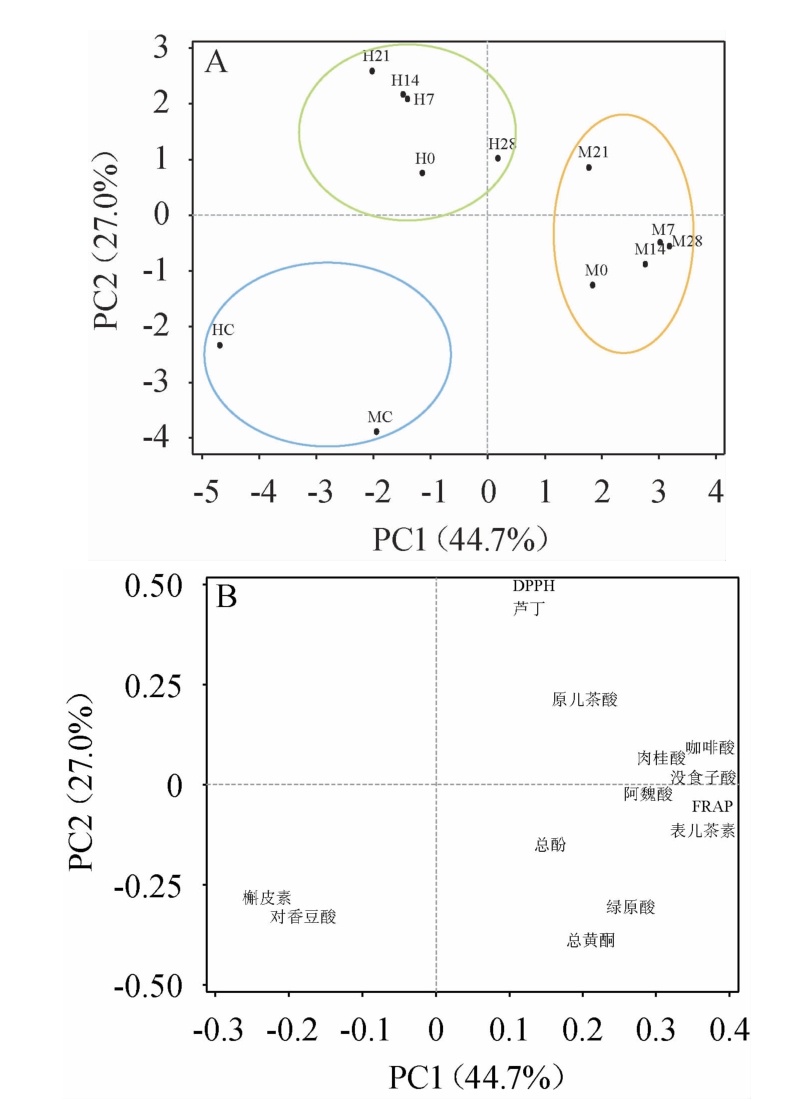
图3 植物乳杆菌发酵枣汁冷藏期间样品主成分分析的分值图(A)和载荷图(B)
Fig.3 Score figure (A) and loading diagram (B) of principal component analysis of jujube juice fermented by Lactobacillus plantarum during refrigeration storage
注:M(0~28)代表冷藏期间的发酵木枣汁;H(0~28)代表冷藏期间的发酵和田枣汁。
2.3 植物乳杆菌发酵枣汁冷藏过程中风味物质的变化
植物乳杆菌发酵枣汁中的风味物质是影响其感官品质的重要因素。如图4所示,经聚类分析后的样品被分为3簇,分别为未发酵枣汁、发酵木枣汁、发酵和田枣汁。在冷藏期间发酵枣汁中共鉴定出52种风味物质,其中包括12种醇类、11种醛类、9种酸类、12种酮类和8种酯类化合物。未发酵枣汁和发酵枣汁中最主要的风味物质均为酸类,其次为醛类、醇类和酮类,酯类含量最低。经植物乳杆菌发酵后,枣汁中的风味物质总含量显著增加(P<0.05),而冷藏后发酵枣汁中风味物质总含量显著降低(P<0.05),这与MANTZOURANI I等[26]报道的植物乳杆菌发酵石榴汁冷藏过程中风味物质含量的变化结果一致。
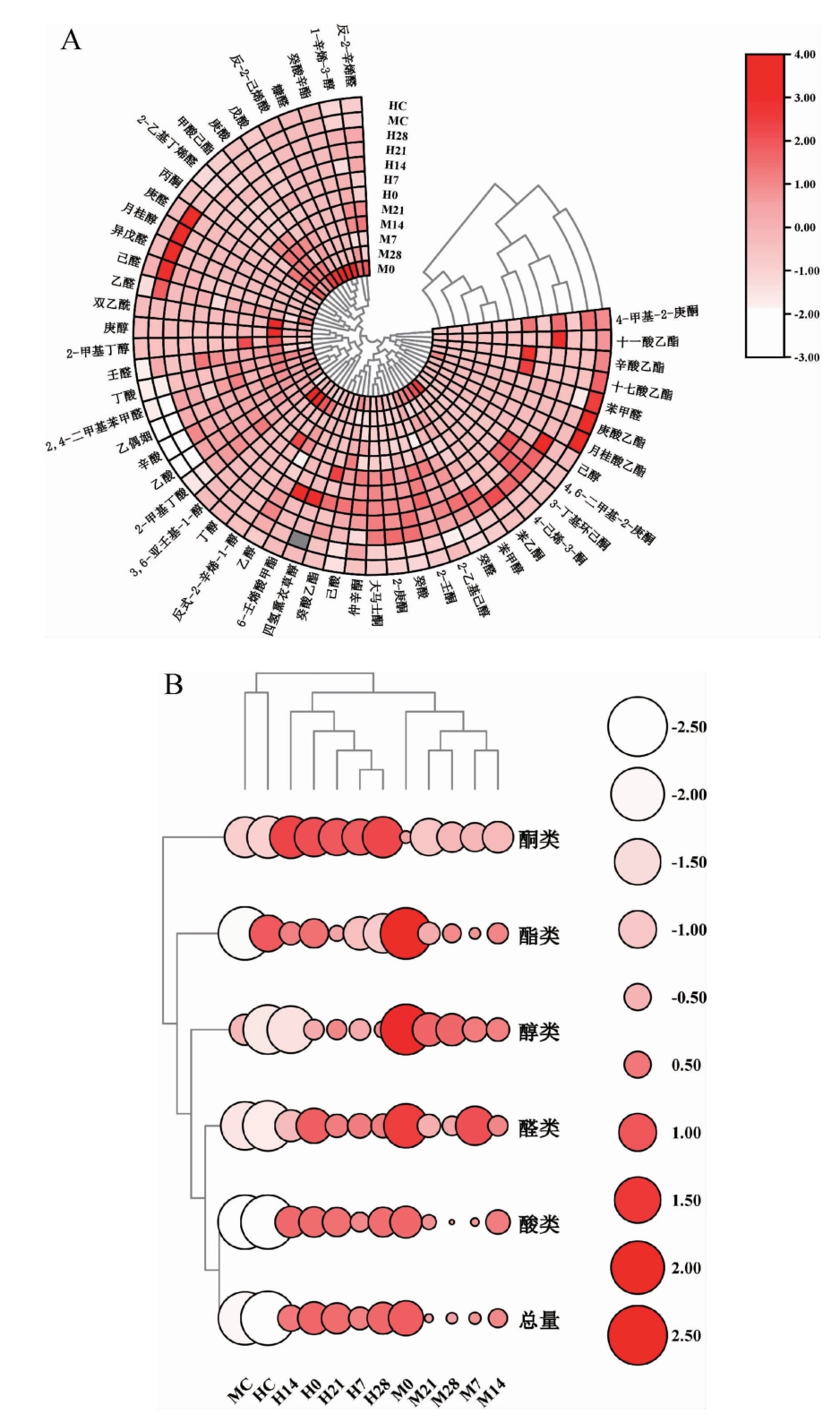
图4 植物乳杆菌发酵枣汁在冷藏期间52种挥发性化合物(A)及各类挥发性香气物质(B)的聚类热图
Fig.4 Cluster heat map of 52 volatile aroma substances (A) and different kinds of volatile aroma substances (B) in jujube juice fermented by Lactobacillus plantarum during refrigeration storage
植物乳杆菌发酵木枣汁在冷藏28 d后,枣汁中风味物质总含量最低,为1.3 g/L,相较冷藏前的发酵枣汁降低了27.1%,而发酵和田枣汁的风味物质总含量则是在冷藏7 d后达到最低,为1.5 g/L,相较冷藏前的发酵枣汁降低了11.8%。冷藏后的发酵枣汁中最主要的醇类化合物是辛烯醇、苯甲醇和2-乙基己醇,这些醇类化合物可以赋予枣汁玫瑰花的香味。2,4-二甲基苯甲醛和壬醛是冷藏后的发酵枣汁中最主要的醛类化合物,壬醛具有柑桔的香气,可以丰富枣汁的果味。两种发酵枣汁冷藏后醛类化合物的含量都有所降低,冷藏后发酵枣汁中酸类化合物的含量相较于冷藏前发酵枣汁也有所降低,特别是发酵木枣汁。发酵枣汁中主要存在的酸类化合物是辛酸、己酸和乙酸,为枣汁增添了酸味。发酵枣汁在冷藏过程中乙酸的含量呈动态变化,主要是由于冷藏过程中乙酸既可以作为植物乳杆菌代谢产物,也可以作为合成酯类化合物的前体物质[27]。此外,发酵木枣汁在冷藏过程中辛酸含量有所增加,赋予枣汁奶酪的香味,发酵和田枣汁在冷藏过程中癸酸含量有所增加。酮类化合物与酯类化合物往往会使食品的气味更加吸引消费者。发酵木枣汁中最主要的酮类化合物是乙偶姻,而发酵和田枣汁中最主要的酮类化合物则是2-庚酮和大马士酮。在冷藏过程中发酵木枣汁的酮类化合物含量有所降低,主要是由于2-庚酮含量的减少,而发酵和田枣汁在冷藏后大马士酮的含量有轻微增加,可能是由于植物乳杆菌代谢产生的糖基化酶切断糖苷键进而形成了大马士酮[28]。
冷藏过程中发酵枣汁的风味物质是不断变化的,并且植物乳杆菌发酵枣汁香气的形成和变化是一个复杂且动态的过程,虽然发酵枣汁在冷藏后挥发性化合物含量有所减少,但仍高于未发酵枣汁,发酵枣汁仍具有丰富的花香和果香。
3 结论
植物乳杆菌发酵枣汁在28 d的冷藏过程中活菌数逐渐减少,但28 d后仍满足FAO/WHO推荐的能够发挥健康作用的最小活菌数水平。在冷藏过程中,发酵枣汁的总酚含量有所升高,但总黄酮含量有所降低,DPPH自由基清除率和铁离子还原力呈动态变化趋势,但始终高于未发酵枣汁。经过冷藏后的发酵枣汁中风味物质总含量相较于冷藏前的发酵枣汁有所降低,但高于未发酵枣汁,28 d的冷藏过程维持了植物乳杆菌发酵赋予枣汁的花香和果香。
[1]韩丹.陕西红枣生产分析与发展对策研究[D].杨凌:西北农林科技大学,2018.
[2]王雨,李占林,斯琴,等.新疆红枣产业发展现状及今后发展思路[J].农村科技,2019(3):60-64.
[3]FAO/WHO.2002.Working group report on drafting guidelines for the evaluation of probiotics in food FAO/WHO[R].London,Ontario:FAO/WHO,2002.
[4] ROBERTS D,REYES V,BONILLA F,et al.Viability of Lactobacillusplantarum NCIMB 8826 in fermented apple juice under simulated gastric and intestinal conditions[J].LWT-Food Sci Tech,2018,97:144-150.
[5]邵齐.乳酸菌发酵果蔬浆加工及藏期间品质的变化研究[D].南昌:南昌大学,2018.
[6] DOS SANTOS F,FREITAS H,RODRIGUES S,et al.Production and stability of probiotic cocoa juice with sucralose as sugar substitute during refrigerated storage[J].LWT-Food Sci Tech,2019,99:371-378.
[7]MANTZOURANI I,KAZAKOS S,TERPOU A,et al.Assessment of volatile compounds evolution,antioxidant activity,and total phenolics content during cold storage of pomegranate beverage fermented by Lactobacillus paracasei K5[J].Fermentation,2018,4(4):95.
[8]FILHO A,FREITAS H V,RODRIGUES S,et al.Production and stability of probiotic cocoa juice with sucralose as sugar substitute during refrigerated storage[J].LWT-Food Sci Tech,2018,99:371-378.
[9]LI T,JIANG T,LIU N,et al.Biotransformation of phenolic profiles and improvement of antioxidant capacities in jujube juice by select lactic acid bacteria[J].Food Chem,2021,339:127859.
[10]李维妮,张宇翔,魏建平,等.益生菌发酵苹果汁工艺优化及有机酸的变化[J].食品科学,2017,38(22):87-94.
[11]CHEN Q,BI J,WU X,et al.Drying kinetics and qualityattributes of jujube(Zizyphus jujuba Miller)slices dried by hot-air and short-and mediumwave infrared radiation[J].LWT-Food Sci Tech,2015,64:2.
[12] LI Z,TENG J,LYU Y,et al.Enhanced antioxidant activity for apple juice fermented with Lactobacillus plantarum ATCC14917[J].Molecules,2019,24:1-12.
[13] KWAW E,MA Y,TCHABO W,et al.Impact of ultrasonication and pulsed light treatments on phenolics concentration and antioxidant activities of lactic-acid-fermented mulberry juice[J].LWT-Food Sci Tech,2018,92:61-66.
[14] RAMIREZ J,ZAMBRANO R,SEPC′LVEDA B,et al.Anthocyanins and antioxidant capacities of six Chilean berries by HPLC-HR-ESI-ToFMS[J].Food Chem,2015,176:106-114.
[15]NATIC′ M M,DABIC′ D C姚,PAPETTI A,et al.Analysis and characterisation of phytochemicals in mulberry (Morus alba L.) fruits grown in Vojvodina,North Serbia[J].Food Chem,2015,171:128-136.
[16]WU C,LI T,QI J,et al.Effects of lactic acid fermentation-based biotransformation on phenolic profiles,antioxidant capacity and flavor volatiles of apple juice[J].LWT-Food Sci Tech,2020,122:109064.
[17] KONG C,LI A,JIN G,et al.Evolution of volatile compounds treated with selected non-Saccharomyces extracellular extract during Pinot noir winemaking in monsoon climate[J].Food Res Int,2019,119:177-186.
[18]FILANNINO P,AZZI L,CAVOSKI I,et al.Exploitation of the healthpromoting and sensory properties of organic pomegranate(Punica granatum L.)juice through lactic acid fermentation[J].Int J Food Microbiol,2013,163:2-3.
[19] LUCIANO W A,MATTE T C,PORTELA I A,et al.Effects of Lactobacillus acidophilus LA-3 on physicochemical and sensory parameters of a觭aí and mango based smoothies and its survival following simulated gastrointestinal conditions[J].Food Res Int,2018,114:159-168.
[20]王鑫.黄河滩枣饮料加工工艺的研究及贮藏期品质观察[D].邯郸:河北工程大学,2020.
[21] MANTZOURANI I,KAZAKOS S,TERPOU A,et al.Assessment of volatile compounds evolution,antioxidant activity,and total phenolics content during cold storage of pomegranate beverage fermented by Lactobacillus paracasei K5[J].Fermentation,2018,4:95-105.
[22]BENINCASA C,MUCCILLI S,AMENTA M,et al.Phenolic trend and hygienic quality of green table olives fermented with Lactobacillus plantarum starter culture[J].Food Chem,2015,186:271-276.
[23] FILANNINO P,BAI Y,DI CAGNO R,et al.Metabolism of phenolic compounds by Lactobacillus spp.during fermentation of cherry juice and broccoli puree[J].Food Microbiol,2015,46:272-279.
[24] MANTZOURANI I,NOUSKA C,TERPOU A,et al.Production of a novel functional fruit beverage consisting of cornelian cherry juice and probiotic bacteria[J].Antioxidants,2018,7:163-164.
[25]LIU D,QI Y,ZHAO N,et al.Multivariate analysis reveals effect of glutathione-enriched inactive dry yeast on amino acids and volatile components of kiwi wine[J].Food Chem,2020,329:127086.
[26] MANTZOURANI I,KAZAKOS S,TERPOU A,et al.Potential of the probiotic Lactobacillus plantarum ATCC 14917 strain to produce functional fermented pomegranate juice[J].Foods,2018,8:4-16.
[27]IOANNA M,ANTONIA T,ARGYRO B,et al.Functional pomegranate beverage production by fermentation with a novel synbiotic L.paracasei biocatalyst[J].Food Chem,2020,308:125658.
[28]RICCI A,CIRLINI M,LEVANTE A,et al.Volatile profile of elderberry juice:effect of lactic acid fermentation using L.plantarum,L.rhamnosus and L.casei strains[J].Food Res Int,2018,105:412-422.