辣木(Moringa oleifera)又称“油辣木”、“鼓槌树”、“山葵木”、“马罗卜”、“不死树”、“罗卜树”等,为辣木科(Moringaceae)辣木属(Moringa)多年热带亚热带落叶乔木,是一种“药菜两用”、“药食同源”的天然木本植物之一[1]。辣木作为一种新资源全营养食品,含有丰富的蛋白质、多糖、维生素和矿物质等营养成分,而辣木蛋白质极易引起腹泻等过敏现象,影响人体对蛋白质的消化吸收[2]。
目前,用于降低食物致敏性的加工方式很多,但多数致敏成分具有稳定的过敏原表位,难以被常规技术如高温等加工方式降解。微生物发酵可降低食物过敏原性,并已证实。微生物通过自身及其分泌的酶系作用,把不溶性高分子物质分解成为可溶性低分子化合物,导致机体产生过敏反应的大分子蛋白质致敏活性丧失并易被机体吸收利用,或者微生物直接将致敏物质通过转化降为脱敏物质,目前选择合适的微生物发酵成为极具潜力的食物脱敏方式[3-4]。杨慧等[5]研究发现,枯草芽孢杆菌发酵豆粕中β-伴大豆球蛋白的α'和α亚基消失,β亚基条带和大豆球蛋白的酸性亚基条带密度减,同时大豆球蛋白与β-伴大豆球蛋白的抗原性明显降低。SONG Y S等[6]研究发现,天然的大豆发酵制品致敏性很低甚至没有致敏性。CHEN J S等[7]研究发现,在发酵豆粕中大豆球蛋白几乎全部被降解。吴民熙等[8]采用解淀粉芽孢杆菌和栗褐芽孢杆菌发酵菜籽饼,结果表明菜籽饼粗蛋白明显被降解。皮潇文[9]研究发现,花生经纳豆芽孢杆菌液态发酵后,产生大量的蛋白酶可将花生蛋白降解成小分子物质,但是目前辣木发酵脱敏的研究报道较少。
本研究以辣木叶粉为原料,采用自然发酵和接种7株不同菌发酵并对其理化指标和主要蛋白的降解情况进行分析,旨在筛选出降解辣木过敏蛋白的优良菌株,为研究辣木发酵脱敏、功能价值以及辣木产品的开发具有积极意义。
1 材料与方法
1.1 材料与试剂
辣木叶粉:云南农业大学辣木研究所提供;毛霉(Mucor)40899、鲁氏酵母(Saccharomyces rouxii):购于中国工业微生物菌种保藏管理中心;发酵乳杆菌(Lactobacillus fermentum)(基因库登记号为EU419592.1)、植物乳杆菌(Lactobacillusplantarum)(基因库登记号为MG551235.1)、棉籽糖乳球菌(Lactococcus raffinolactis)(基因库登记号为MT851867)、纳豆芽孢杆菌(Bacillus natto)(基因库登记号为EU56705)、酿酒酵母(Saccharomyces cerevisiae)(基因库登记号为MF769586):由实验室分离获得。
MRS改良培养基、MRS肉汤、营养琼脂、营养肉汤、马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:广东环凯微生物科技有限公司;牛血清白蛋白、考马斯亮蓝、福林酚、干酪素、酪氨酸、碳酸钠、三氯乙酸、甲醛、氢氧化钠、Tris-HCl、30%制胶液、10%十二烷基磺酸钠(sodium dodecyl sulfonate,SDS)、过硫酸铵(ammonium persulphate,APS)、四甲基乙二胺(tetramethylethylenediamine,TEMED)(均为分析纯):北京索莱宝科技有限公司。
1.2 仪器与设备
1645050 Bio-Red电泳仪、Gel Doc XR+凝胶成像系统、SpectraMax iD5光栅型多功能酶标仪:赛默飞世尔有限公司;UV-2450紫外可见分光光度计:日本岛津公司;H2100R冷冻离心机:浙江赛德仪器设备有限公司;SW-CK-1F超净工作台:苏州安泰空气技术有限公司;雷磁PHS-3C精密pH计:上海精密科学仪器有限公司。
1.3 实验方法
1.3.1 发酵剂的活化与制备
发酵乳杆菌、植物乳杆菌、棉籽糖乳球菌、纳豆芽孢杆菌的培养条件为37 ℃静置培养24 h;酿酒酵母和鲁氏酵母培养条件为30 ℃,180 r/min培养36 h;毛霉40899培养条件为30 ℃培养96 h;分别活化3次,将培养液于4 000 r/min,4 ℃离心10 min,倾去上清,用无菌生理盐水冲洗沉淀两次,再用无菌水稀释,将菌悬液的浓度调整为1.0×108CFU/mL,4 ℃保存备用。
1.3.2 发酵样品的制备
自然发酵样品:称取10 g辣木叶粉作为发酵基质,以1∶10(g∶mL)的料液比加入蒸馏水,分别在37 ℃条件下自然发酵0 h、12 h、24 h、36 h、48 h、60 h、72 h、96 h进行取样,冷冻干燥,-80 ℃保存备用。
接菌发酵样品:称取10 g辣木叶粉作为发酵基质,以1∶10(g∶mL)的料液比加入蒸馏水,调节初始pH为7,按5%(V/V)的接种量分别添加菌种,在37 ℃条件下,分别发酵0 h、12 h、24 h、36 h、48 h、60 h、72 h、96 h进行取样,冷冻干燥,-80 ℃保存备用。
1.3.3 测定方法
pH的测定:参照喻世哲等[10]的方法,并稍作修改。将不同发酵阶段的样品振荡摇匀,取适当发酵液采用pH计测定发酵样品pH。
蛋白酶活力的测定:粗酶液制备是将不同发酵阶段的辣木样品于8 000 r/min、4 ℃离心20 min,取上清液即为粗酶液。粗酶液现做现用,不重复使用。蛋白酶活力的测定参照王欣宇[11]的方法进行测定。
总酸的测定:参照GB/T 12456—2008《食品中总酸的测定》进行测定[12]。
氨基酸态氮的测定:参照GB/T 5009.235—2016《食品中氨基酸态氮的测定》进行测定[13]。
辣木蛋白的提取与含量测定:参照YANG H等[14-15]的方法,采用超声辅助提取法提取辣木叶蛋白。准确称取冻干发酵样品5 g,加入蒸馏水50 mL,混合均匀,调节pH至8,超声6 min,45 ℃水浴60 min后,取适当体积提取液于8 000 r/min、4 ℃离心20 min,收集上清液,-80 ℃分装储存待测。参照代佳和等[15]的考马斯亮蓝法进行测定。
1.3.4 十二烷基硫酸钠聚丙烯酰胺凝胶电泳验证试验
蛋白提取及定量:蛋白提取采用1.3.2辣木蛋白提取的方法进行提取,然后采用二喹啉甲酸(bicinchoninic acid,BCA)蛋白浓度测定试剂盒法测定蛋白样品浓度,-20 ℃保存,备用。
电泳条件:参照TAIWO A等[16]的方法并稍作修改。浓缩胶和分离胶配方如表1所示。电压为恒压,分离胶120 V,150 min;浓缩胶50 V,30 min;上样质量固定为40 μg;上样缓冲液为5 μL。电泳结束后,电泳凝胶用雅酶快速染液染色1 h,用蒸馏水进行脱色至电泳条带清晰可见,电泳凝胶采用凝胶成像仪扫描凝胶成像。
表1 浓缩胶和分离胶配方
Table 1 Formula of concentrated glue and separating glue
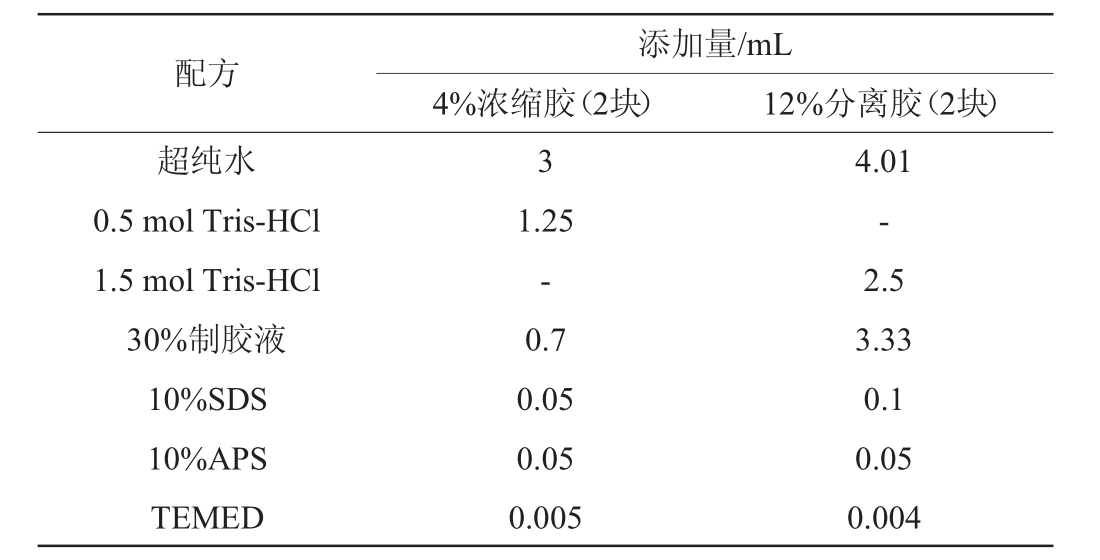
注:“-”表示不添加。
1.3.5 数据处理
各指标采用SPSS 18.0对数据进行整理分析,Origin 9.0进行绘图;电泳图采用GelDocXR+凝胶成像系统扫描成像。
2 结果与分析
2.1 发酵过程中pH的变化
辣木叶在不同发酵时期pH变化见图1。由图1可知,在发酵过程中,自然发酵的pH维持在5.60~5.66范围内,发酵乳杆菌、植物乳杆菌、棉籽糖乳球菌、纳豆芽孢杆菌在0~48 h的发酵阶段pH值逐渐下降,随后pH值稳定在4.7左右。酿酒酵母、鲁氏酵母、毛霉40899在发酵过程中pH值呈上升趋势。不同的菌种在相同条件下发酵的pH值存在一定差异,这可能是因为菌种在发酵过程中产酸、产蛋白酶和糖化酶能力不同,从而导致pH值存在差异[17-18]。
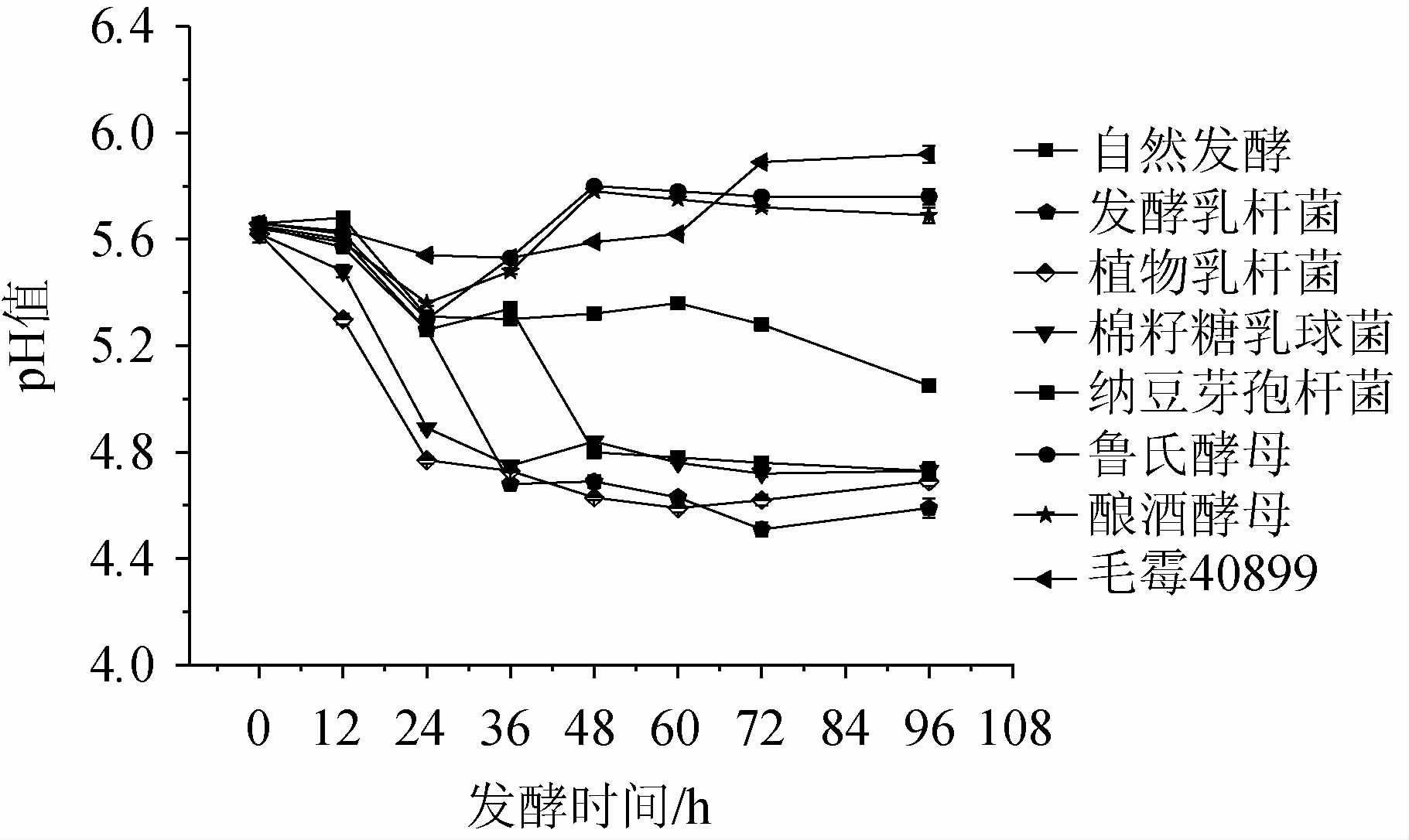
图1 辣木叶粉在不同发酵时期pH变化
Fig.1 Changes of pH of Moringa oleifera leaf powder during different fermentation periods
2.2 发酵过程中总酸的变化
辣木叶在不同发酵阶段总酸变化见图2。由图2可知,发酵乳杆菌、植物乳杆菌、棉籽糖乳球菌、纳豆芽孢杆菌发酵辣木叶的总酸随着pH下降而上升,最后趋于稳定。酿酒酵母、鲁氏酵母、毛霉40899发酵至36 h时总酸开始逐渐下降,这一变化与pH变化相一致,这可能是因为微生物产蛋白酶,蛋白酶加快蛋白质降解,产生了小肽、游离氨基酸和胺类等碱性物质,使得pH值升高,总酸含量下降[10,19]。
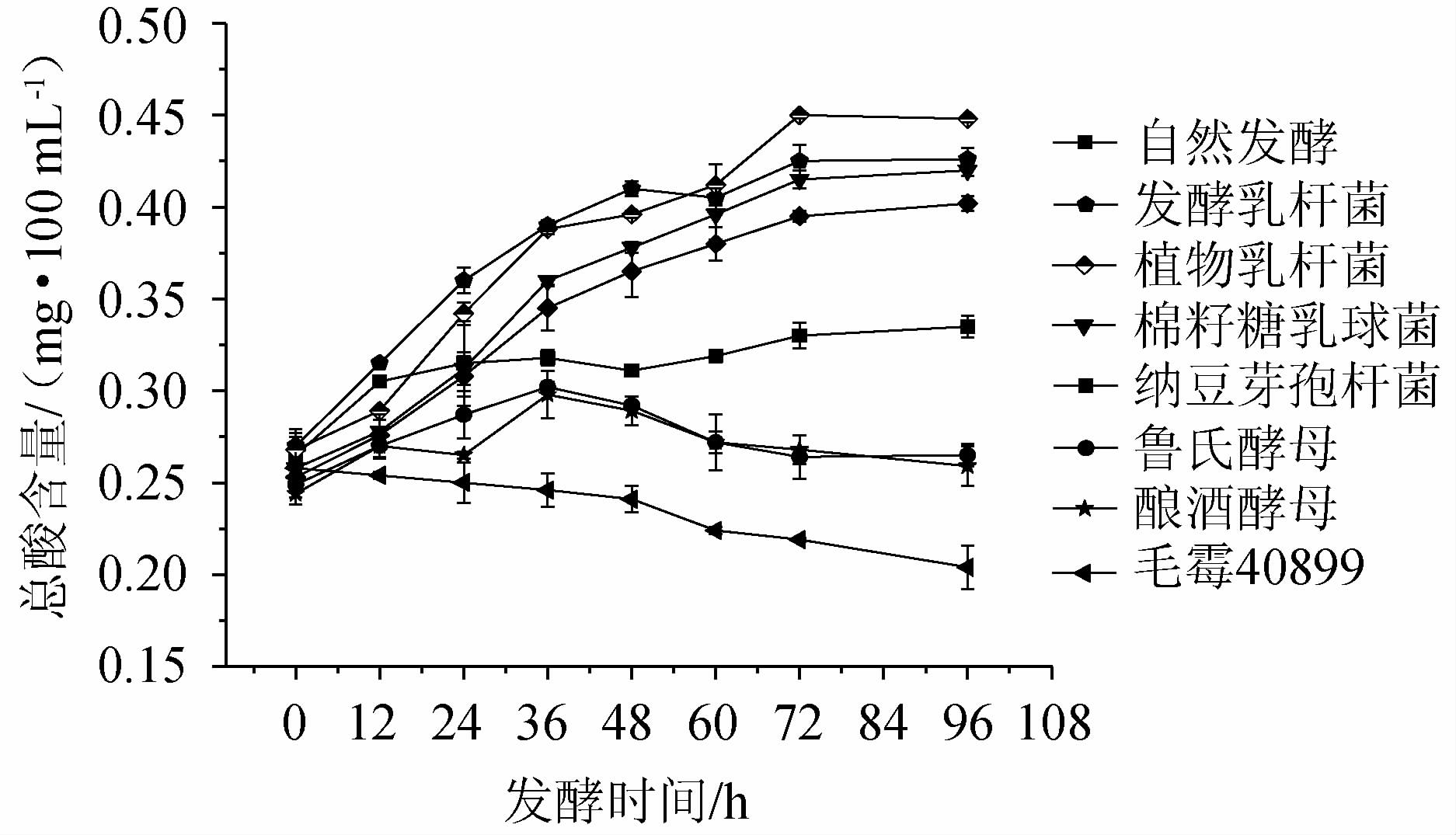
图2 辣木叶粉在不同发酵时期总酸含量的变化
Fig.2 Changes of total acid contents of Moringa oleifera leaf powder during different fermentation periods
2.3 发酵过程中蛋白酶活力的变化
微生物发酵过程中产生的蛋白酶能够将部分蛋白质降解成分子质量较小的肽类物质和氨基酸[20]。辣木叶经不同菌种在不同发酵阶段的蛋白酶活力变化如图3所示。由图3可知,发酵过程中蛋白酶活力总体呈先上升后下降的趋势。发酵至48 h时,纳豆芽孢杆菌蛋白酶活力最高为270.58 U/mL,棉籽糖乳球菌发酵蛋白酶活力为248.34 U/mL,发酵乳杆菌发酵蛋白酶活力为236.26U/mL,而酿酒酵母在60h时达到最大活性为217.90U/mL,鲁氏酵母在72 h时达到最大活性为222.74 U/mL,毛霉40899在96 h时达到最大活性为231.31 U/mL,植物乳杆菌在发酵过程中蛋白酶活力较低。
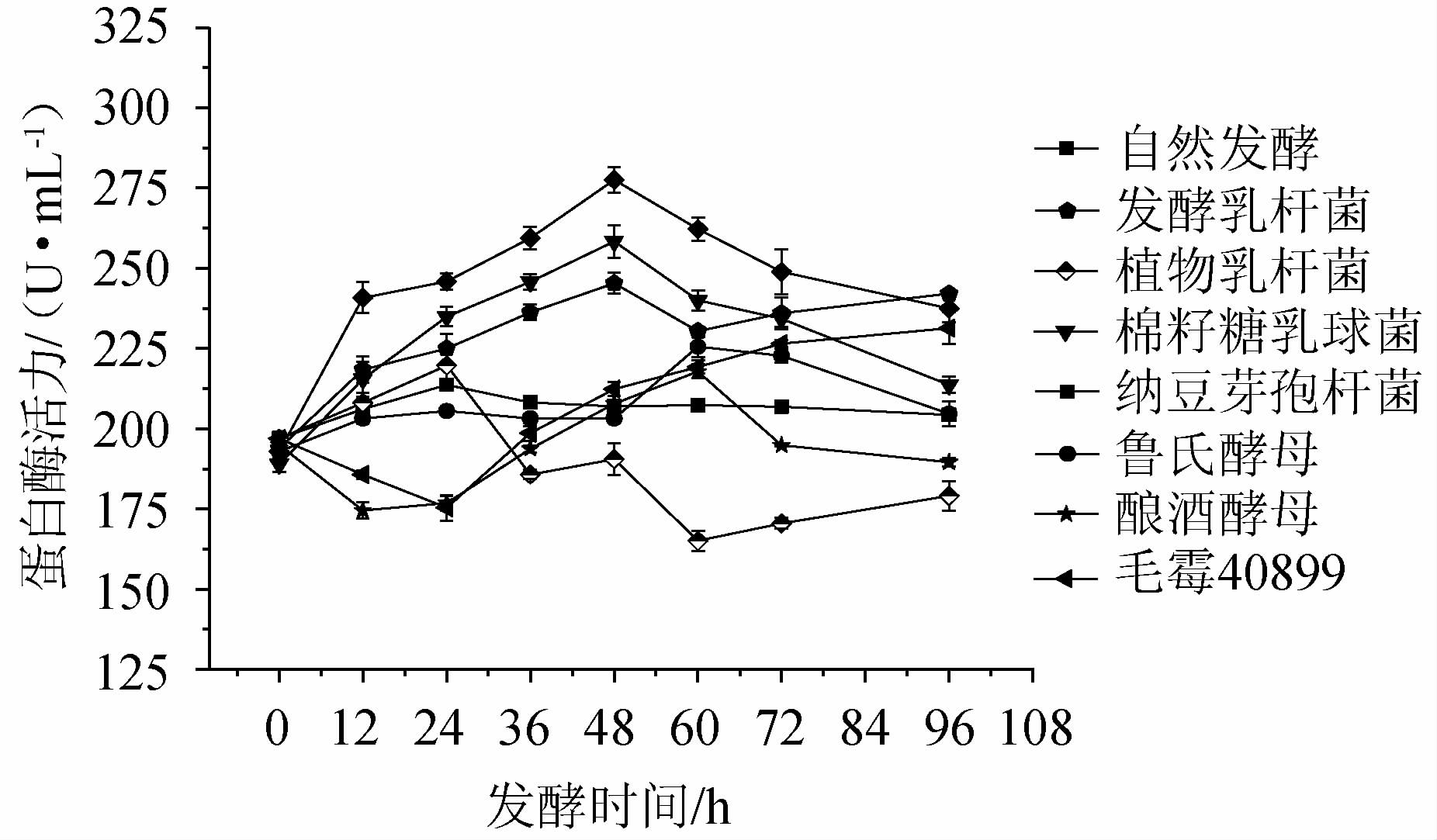
图3 辣木叶粉在不同发酵时期蛋白酶活力的变化
Fig.3 Changes in the protease activity of Moringa oleifera leaf powder during different fermentation periods
2.4 发酵过程中蛋白含量的变化
辣木叶粉经不同菌种在不同发酵阶段的蛋白含量变化见图4。
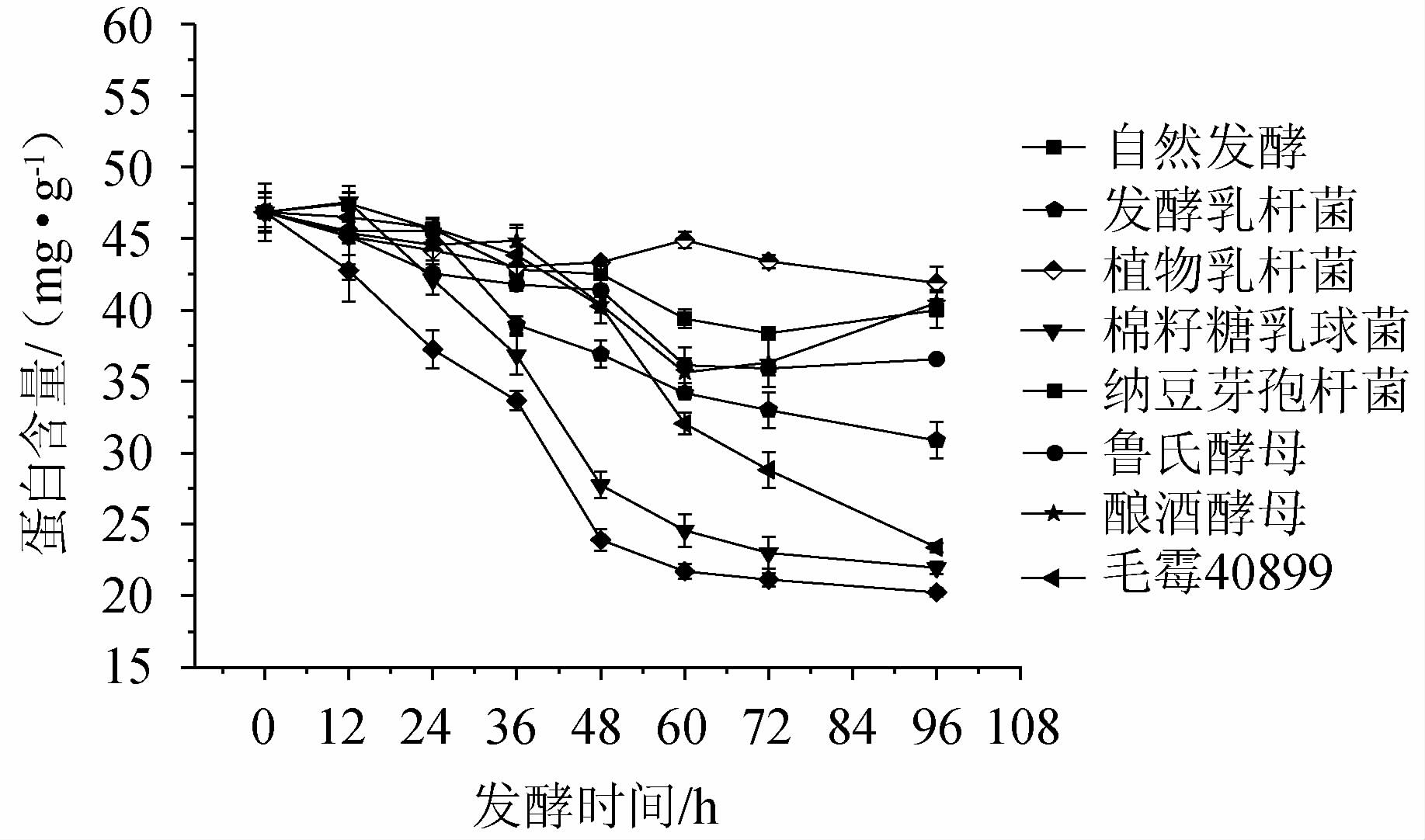
图4 辣木叶粉在不同发酵时期蛋白含量的变化
Fig.4 Changes of protein content of Moringa oleifera leaf powder during different fermentation periods
由图4可知,辣木叶粉经发酵后蛋白质均有所降解,其中对蛋白降解效果最明显的为棉籽糖乳球菌、纳豆芽孢杆菌和毛霉40899,发酵过程中蛋白含量分别由47.56 mg/g、42.77 mg/g、44.49 mg/g 下降至21.95 mg/g、20.24 mg/g、23.38 mg/g。棉籽糖乳球菌和纳豆芽孢杆菌在0~96 h发酵阶段,蛋白含量逐渐下降,其蛋白含量明显低于自然发酵组。随着发酵时间的延长,蛋白降解速度明显下降,这可能是因为菌株生长到一定时间后,菌群快速繁殖消耗了大量的营养物质,使得菌株产蛋白酶能力减弱,从而导致蛋白溶解性下降[21-22]。而毛霉40899发酵至36 h时,蛋白含量开始缓慢下降,发酵时间处于48~96 h阶段,蛋白质含量下降较为明显,这是由于毛霉最佳生长时间为96 h,在发酵初始阶段,毛霉缓慢生长,产蛋白酶能力较弱,随着发酵时间延长至96 h时,毛霉快速生长,产生大量的蛋白酶加快了蛋白质的降解[23]。
2.5 发酵过程中氨基酸态氮的变化
微生物发酵过程中氨基酸态氮含量是反映蛋白质水解的重要指标[10,24]。辣木叶粉经不同菌种在不同发酵阶段的氨基态氮含量变化见图5。由图5可知,辣木叶粉经发酵后氨基态氮含量随发酵时间的延长而上升,这主要是因为发酵过程中微生物不断生长繁殖,产生蛋白酶将蛋白质降解,导致氨基酸态氮的含量不断上升[25]。纳豆芽孢杆菌和棉籽糖乳球菌发酵液的最高氨基态氮含量分别为0.46 mg/100 mL、0.45 mg/100 mL,明显高于其他组,这一结果与蛋白含量变化相一致。
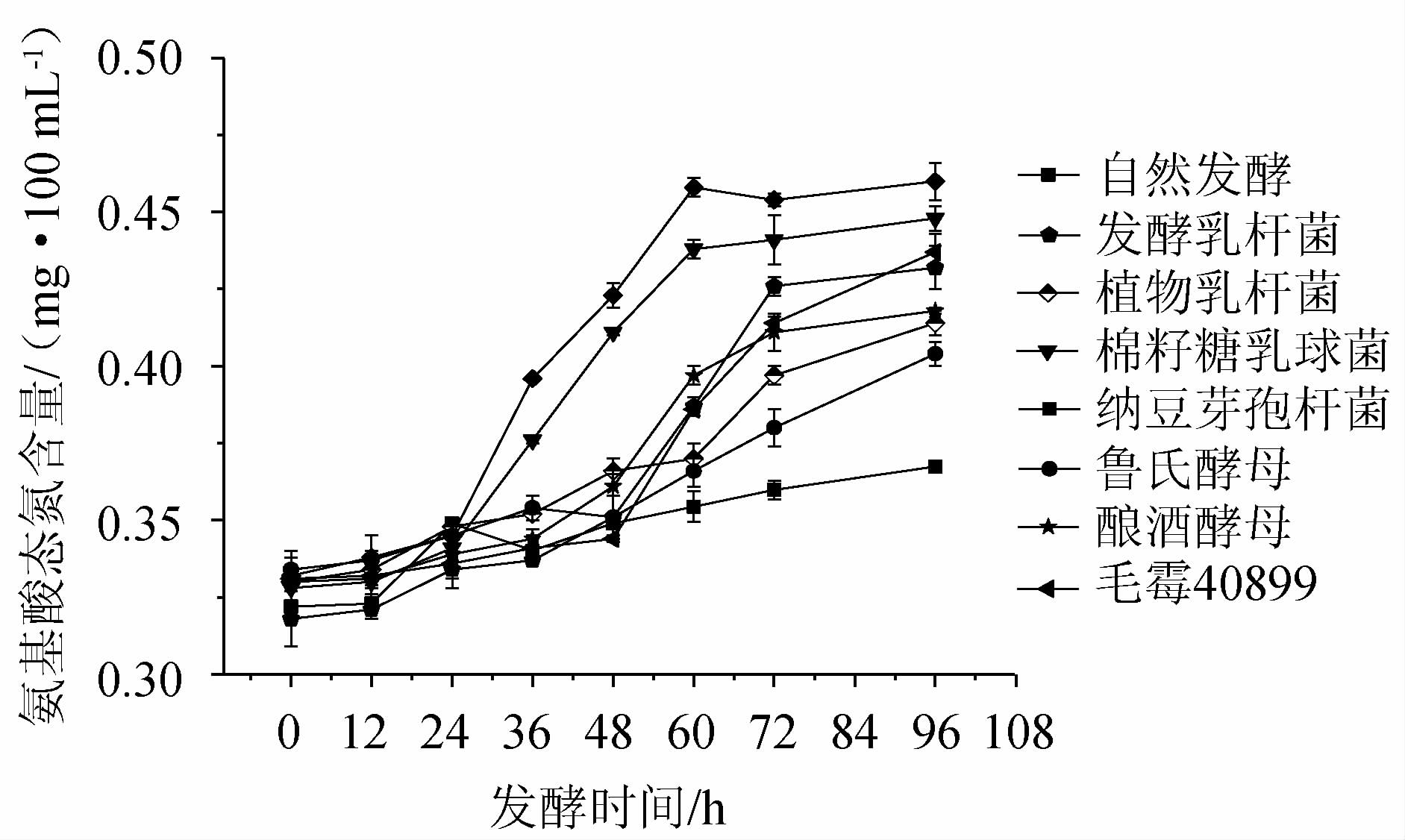
图5 辣木叶粉在不同发酵时期氨基态氮含量的变化
Fig.5 Changes of amino nitrogen content of Moringa oleifera leaf powder during different fermentation periods
2.6 发酵过程中蛋白降解的电泳分析
辣木叶粉经不同菌种在不同发酵时期的蛋白以及标准蛋白的十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)图谱见图6,根据电泳图谱的变化来探讨辣木叶粉蛋白的降解趋势。
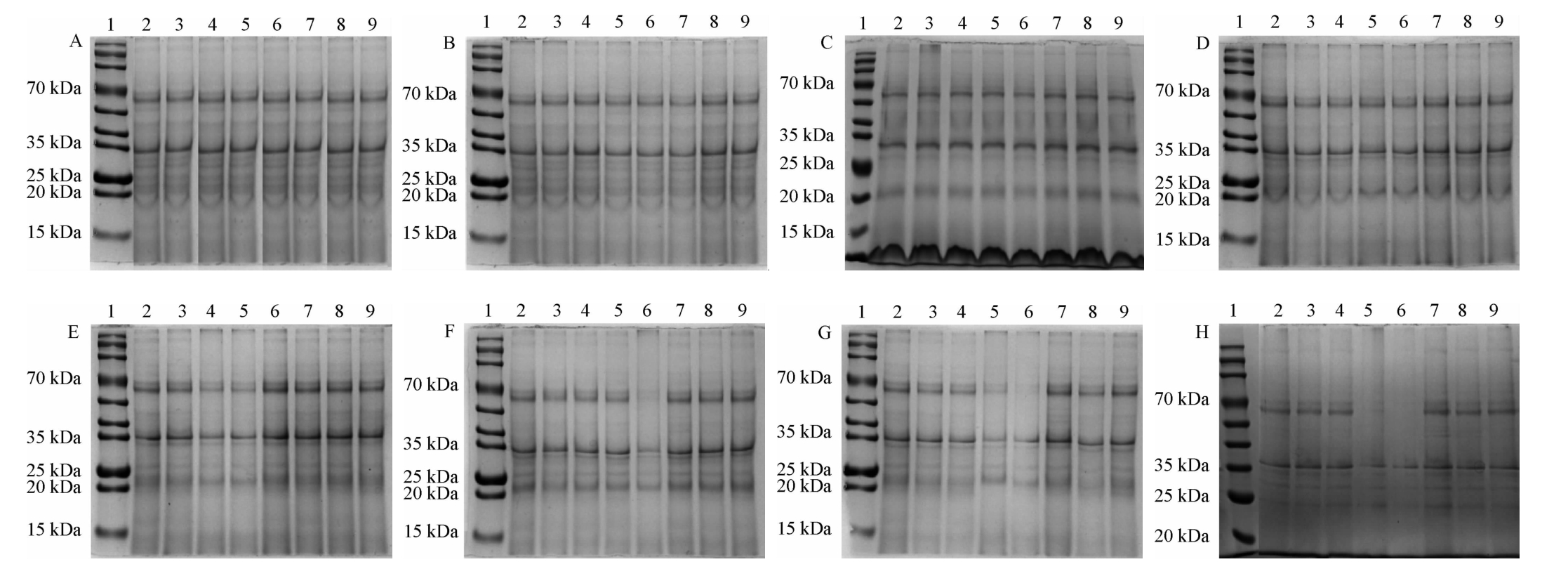
图6 辣木叶在不同发酵时期的SDS-PAGE电泳图谱
Fig.6 SDS-PAGE electrophoresis patterns of Moringa oleifera leaf powder during different fermentation stages
A:发酵0 h;B:发酵12 h;C:发酵24 h;D:发酵36 h;E:发酵48 h;F:发酵60 h;G:发酵72 h;H:发酵96 h。1:Maker;2:自然发酵;3:发酵乳杆菌发酵;4:植物乳杆菌发酵;5:棉籽糖乳球菌发酵;6:纳豆芽孢杆菌发酵;7:鲁氏酵母发酵;8:酿酒酵母发酵;9:毛霉40899发酵。
由图6可知,利用水溶液浸提的辣木叶粉蛋白主要为分子质量为70 kDa和35 kDa的两种蛋白。在0~48 h发酵阶段时,辣木叶粉经自然发酵与接种发酵乳杆菌、植物乳杆菌、棉籽糖乳球菌、纳豆芽孢杆菌、酿酒酵母、鲁氏酵母、毛霉40899的蛋白条带基本相同,70 kDa和35 kDa的蛋白几乎没有出现降解(见图6A~6E),这可能与蛋白酶活力以及酶作用时间有关[22]。RAHAMAN T等[26]研究也表明,对蛋白发挥降解作用的主要是蛋白酶类。
如图6F所示,发酵至60 h时,纳豆芽孢杆菌(泳道6)电泳条带显示70 kDa和35 kDa的蛋白明显被降解,说明纳豆芽孢杆菌对辣木蛋白具有降解作用。如图6G所示,发酵至72 h时,棉籽糖乳球菌(泳道5)和纳豆芽孢杆菌(泳道6)蛋白条带几乎全部被降解,棉籽糖乳球菌对辣木蛋白也表现出降解作用,这可能是因为在发酵前期阶段产生了大量的蛋白酶,在发酵后期虽然蛋白酶活力有所下降,但作用时间较长,使得蛋白质降解,蛋白含量下降[20]。总之,蛋白电泳图出现蛋白条带逐渐变浅或消失,说明了蛋白发生了降解或变性聚集,也说明了其含量不断降低,达到降解目的[27]。
如图6H所示,继续发酵至96 h时,棉籽糖乳球菌(泳道5)和纳豆芽孢杆菌(泳道6)的蛋白条带与上一时期无明显变化,70 kDa的蛋白均没有被检测到,35 kDa的蛋白几乎完全被降解。因此,本研究认为在发酵过程中对辣木叶蛋白降解效果最佳的菌株为纳豆芽孢杆菌和棉籽糖乳球菌。
3 结论
通过比较自然发酵与7种不同菌株发酵对辣木叶的理化指标及SDS-PAGE电泳图谱结果得出,纳豆芽孢杆菌、棉籽糖乳球菌、发酵乳杆菌能够很快适应发酵基质并快速产生蛋白酶,但对辣木蛋白降解效果较明显的主要为纳豆芽孢杆菌、棉籽糖乳球菌。发酵结束时,蛋白含量下将至20.24 mg/g、21.95 mg/g;氨基酸态氮含量随之升高;纳豆芽孢杆菌和棉籽糖乳球菌能够明显降解辣木70 kDa和35 kDa的两种主要蛋白;确定纳豆芽孢杆菌和棉籽糖乳球菌为发酵降解辣木蛋白的优良菌株,这对辣木发酵脱敏以及辣木产品的开发具有重要意义。纳豆芽孢杆菌和棉籽糖乳球菌虽在很大程度上降解了辣木叶蛋白,但未将其彻底消除,其发酵工艺、发酵后的致敏性以及发酵降解辣木蛋白的机理还需进一步研究。
[1]OYEYINKA A T,OYEYINKA S A.Oyeyinka.Moringa oleifera as a food fortificant:Recent trends and prospects[J].J Saudi Soc Agr Sci,2018,17(2):127-136.
[2]姜晓宇.纳豆芽孢杆菌发酵对辣木叶营养特性的影响[D].无锡:江南大学,2018.
[3]TENG D,GAO M Y,YANG Y L,et al.Bio-modification of soybean meal with Bacillus subtilis or Aspergillus oryzae[J].Biocatal Agr Biotechnol,2012,1(1):32-38.
[4]AGUIRRE L,GARRO M S,SAVOY D G.Enzymatic hydrolysis of soybean protein using lactic acid bacteria[J].Food Chem,2008,111(4),976-982.
[5]杨慧,曲也直,刘显琦,等.微生物发酵对豆粕抗原性的影响[J].粮食与油脂,2020,33(5):51-55.
[6]SONG Y S,FRIAS J,MARTINEZ-VILLALUENGA C,et al.Immunoreactivity reduction of soybean meal by fermentation,effect on amino acid composition and antigenicity of commercial soy products[J].Food Chem,2008,108(2):571-581.
[7]CHEN J S,WANG J,SONG P,et al.Determination of glycinin in soybean and soybean products using a sandwich enzyme-linked immunosorbent assay[J].Food Chem,2014,162(5):27-33.
[8]吴民熙,刘清术,刘前刚,等.降解菜籽饼粗蛋白耐盐菌的筛选、鉴定及固体发酵的初步研究[J].天然产物研究与开发,2014,26(3):309-313.
[9]皮潇文.高压蒸汽处理联合纳豆芽孢杆菌发酵对花生过敏性及其理化指标的影响[D].南昌:南昌大学,2019.
[10]喻世哲,刘晶晶,吴佳伦,等.外源蛋白酶对腐乳后发酵理化和感官特性的影响[J].食品科学,2018,39(8):64-68.
[11]王欣宇.地衣、枯草芽孢杆菌产酶能力分析及在辣木叶发酵中的应用[D].广州:华南农业大学,2018.
[12]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 12456—2008食品中总酸的测定[S].北京:中国标准出版社,2008.
[13]中华人民共和国国家卫生和计划生育委员会.GB 5009.235—2016食品安全国家标准食品中氨基酸态氮的测定[S].北京:中国标准出版社,2016.
[14] YANG H,QU Y,LI J,et al.Improvement of the protein quality and degradation of allergens in soybean meal by combination fermentation and enzymatic hydrolysis[J].LWT-Food Sci Technol,2020,128:109442.
[15]代佳和,罗旋飞,史崇颖,等.响应面法优化辣木叶中水溶性蛋白提取工艺研究[J].云南农业大学学报(自然科学),2020,35(1):130-138.
[16]TAIWO A,ADERINOLA A M,ALASHI I D,et al.In vitro digestibility,structural and functional properties of Moringa oleifera seed proteins[J].Food Hydrocolloid,2020,101(5):105574.
[17]崔宪,刘容旭,姜帆,等.植物乳杆菌发酵对大豆分离蛋白功能性质影响研究[J].食品工业科技,2016,37(3):177-180,186.
[18]陈倩,韩齐,孔保华,等.乳酸菌对发酵肉制品中肌肉蛋白降解作用的研究进展[J].食品科学,2014,35(9):279-284.
[19]CHEN X,LI J,ZHOU T,et al.Two efficient nitrite-reducing Lactobacillus strains isolated from traditional fermented pork(Nanx Wudl)as competitive starter cultures for Chinese fermented dry sausage[J].Meat Sci,2016,121:302-309.
[20]LIU J,HAN B,DENG S,et al.Changes in proteases and chemical compounds in the exterior and interior of sufu,a Chinese fermented soybean food,during manufacture[J].LWT-Food Sci Technol,2018,87:210-216.
[21]魏冠棉,张军伟,周鹏.油腐乳发酵过程中的品质分析[J].食品科学,2019,40(14):138-143.
[22]龙菊,吴拥军,何映霞,等.高大毛霉腐乳发酵过程中主要成分的变化[J].食品研究与开发,2012,33(6):162-165.
[23]沈会玲,曾磊,江锋,等.鱼腐乳前发酵过程中蛋白质的降解及工艺的优化[J].中国酿造,2018,37(6):46-50.
[24]张建萍,解春芝.不同腐乳酱营养、功能及呈味氨基酸量化表征[J].食品科学,2020,41(6):246-251.
[25]许家威,李一红,叶芒,等.腐乳前酵期微生物与理化成分的动态分析[J].中国酿造,2019,38(1):84-88.
[26]RAHAMAN T,VASILJEVIC T,RAMCHANDRAN L.Effect of processing on conformational changes of food proteins related to allergenicity[J].Trend Food Sci Technol,2016,49:24-34.
[27]韦诚.发酵过程中酸肉蛋白质的变化及其对食用品质的影响[D].重庆:西南大学,2018.