红曲菌(Monascus spp.)又称为红曲霉,能产生红曲色素、Monacolin K等有益次生代谢产物,以及淀粉酶、蛋白酶、酯化酶等多种酶类,是天然食用色素[1-2]、黄酒[3-4]、食醋[5-6]、降血脂药物[7-8]等发酵生产中的重要工业丝状真菌,在东亚有两千多年的应用历史[9]。据统计,在我国,仅色素用红曲的年产量就超过2万t[9]。近年来,随着红曲菌代谢产物的抗癌[10-12]、抗炎[13]、抗氧化[14-15]、降血压[15-18]、预防肥胖[19-22]、抑菌[23]等生物活性的不断证实,红曲菌发酵产品的市场前景越来越广阔,需求量不断增大。
产生孢子是大部分丝状真菌进行繁殖的主要方式,一般在营养匮乏、高温、干燥等对菌体生长不利的逆境条件下大量产生[24-25],是丝状真菌对逆境的一种应答方式。在丝状真菌的发酵生产及实验室研究过程中,通常需要培养与收集大量的高浓度孢子,用于菌种保藏、发酵接种、诱变育种和基因工程菌株构建等过程[26]。同时,孢子的抗逆性较营养细胞强,存活时间长,是制作直投式发酵剂的良好原料。因此,提高孢子产量,对工业丝状真菌具有重要意义。研究表明,碳源、氮源、碳氮比、温度、光照、含水量、pH等培养条件均能影响丝状真菌产孢,通过优化培养条件,可以提高孢子产量[24,27]。
红曲菌具有无性繁殖和有性繁殖两种繁殖方式。其无性繁殖时可在菌丝顶端产生分生孢子,多为单生,可见双生或串生;有性繁殖则产生闭囊壳,闭囊壳内形成多个子囊孢子[28]。相对曲霉、毛霉、根霉等常见食品工业丝状真菌,红曲菌的产孢能力较弱,产孢量偏少,造成了红曲菌工业发酵生产和实验室基础及应用研究的障碍。为了提高红曲菌的孢子产量,目前已有研究探讨了培养基成分和环境条件等对红曲菌产孢量的影响,发现中性pH条件更利于红曲菌产孢[29-31]。pH是一种重要的环境因子,对微生物的生长、繁殖及代谢有着重要影响。虽然红曲菌生长的pH范围为pH 2.5~8.0,但最适生长pH范围为3.5~5.0[29],与其最佳产孢pH条件差异较大。因此,利于红曲菌产孢的pH条件对其生长有一定影响。在丝状真菌形成生殖器官和孢子之前往往需要经过一段时间的营养体生长,前期过少的菌丝生长量必然会制约后期产孢量的提高。
本研究以红色红曲菌(Monascus ruber)M7为研究对象,探讨不同pH对其孢子萌发、菌落生长、有性繁殖和无性繁殖的影响,分析其生长、繁殖两个不同阶段对环境pH的需求差异,从而在孢子培养过程中对pH进行分段控制,以期减小产孢条件对菌丝生长的影响,提高孢子产量,为菌株M7工业发酵生产和实验室研究过程中的孢子培养技术提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
红色红曲菌(Monascus ruber)M7:华中农业大学农业微生物国家重点实验保藏中心保藏,编号为CCAM070120。
1.1.2 化学试剂
葡萄糖、硝酸钠、磷酸氢二钾、氯化钾、硫酸镁、硫酸亚铁、蔗糖、柠檬酸、磷酸氢二钠(均为分析纯):国药集团化学试剂有限公司;琼脂、酵母膏(均为生化试剂):北京奥博星生物技术有限公司。
1.1.3 培养基
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:取去皮马铃薯200 g切丁,加1 000 mL去离子水煮沸20~30 min,用8层纱布过滤后定容到1 000 mL,加入20 g葡萄糖,15 g琼脂,pH自然。
2×PDA培养基:取去皮马铃薯400 g切丁,加1 000 mL去离子水煮沸20~30 min,用8层纱布过滤后定容到1 000 mL,加入40 g葡萄糖,30 g琼脂,pH自然。
马铃薯葡萄糖肉汤(potato dextrose broth,PDB)培养基:制备方法同上述PDA培养基,不含琼脂,pH自然或根据需要用HCl和NaOH调至5.0。
2×PDB培养基:制备方法同上述2×PDA培养基,不含琼脂,pH自然或根据需要用HCl和NaOH调至5.0。
察氏酵母膏琼脂(Czapek yeast extract agar,CYA)培养基:硝酸钠3 g/L,磷酸氢二钾1 g/L,氯化钾0.5 g/L,硫酸镁(MgSO4·7H2O)0.5 g/L,硫酸亚铁(FeSO4·7H2O)0.01 g/L,酵母膏5.0 g/L,蔗糖30 g/L,琼脂15.0 g/L,pH自然。
察氏酵母膏液体(Czapek yeast extract broth,CYB)培养基:配方同上述CYA培养基,不含琼脂,用HCl和NaOH调至pH5.0。
上述培养基均在121 ℃灭菌20 min。
1.2 仪器与设备
PB-10 pH计:德国赛多利斯(中国)有限公司;SPX-250B-Z生化培养箱:上海博迅实业有限公司医疗设备厂;HFsafe-1200生物安全柜:上海力申科学仪器有限公司;IS-RDS3恒温摇床:美国精骐有限公司;Allegra X-30R离心机:德国Beckman公司;HVE-50高压灭菌锅:日本株式会社平山制作所;BM1000光学显微镜:南京江南永新光学有限公司;G6-1412116全自动菌落分析仪:杭州迅数科技有限公司;BX63+DP73正置显微镜:日本奥林巴斯公司;DHC-9073BS电热恒温鼓风干燥箱:上海新苗医疗器械制造有限公司。
1.3 方法
1.3.1 菌株M7的活化
将保藏的红色红曲菌(M.ruber)M7接种到PDA平板中进行活化,28 ℃恒温培养7 d后备用。
1.3.2 菌株M7孢子液的制备参照LI L等[32]的方法,从CYA斜面收集孢子并用血球计数板测定孢子浓度,调整孢子浓度至5×105个/mL。
1.3.3 菌株M7的培养
将2×PDA培养基趁热分别与等体积的0.1 mol/L的柠檬酸-磷酸氢二钠缓冲液(pH为3.0、4.0、5.0、6.0、7.0或8.0)或0.1mol/L的Tris-HCl缓冲液(pH为8.5或9.0)混匀后倒平板,在平板中心点接活化好的红色红曲菌M7,28 ℃恒温培养10 d。
1.3.4 菌株M7菌落生长速度的测定
在1.3.3菌种培养期间每隔2 d观察菌落生长状况并测量菌落直径,绘制红色红曲菌M7的菌落生长曲线,确定其生长所需的最适pH。
1.3.5 菌株M7繁殖结构的显微观察及孢子计数
菌株M7的培养方法同1.3.3,显微观察和孢子计数均在第10天进行。显微观察时,用灭菌的牙签在菌落表面刮取少量菌丝制备水浸片,观察无性繁殖结构(分生孢子)和有性繁殖结构(闭囊壳)的形态。孢子计数时,先用全自动菌落分析仪中测量菌落的面积S(cm2);再向培养皿中加入一定量的去离子水,用接种环轻轻刮下菌落表面的孢子,得到孢子悬浮液,体积记为VC(mL);然后将孢子悬浮液转移到装有玻璃珠的三角瓶中,25 ℃、200 r/min振摇20 min,参考LI L等[32]的实验方法利用双层擦镜纸过滤除去菌丝,滤液用血球计数板进行孢子计数,孢子浓度记为CC(个/mL)。每种pH条件接种3~5个平板,每个平板得到的孢子悬液计数3次。单位菌落面积的产孢量计算公式如下:
式中:PC为单位菌落面积的产孢量,个/cm2;CC为孢子浓度,个/mL;VC为孢子悬液体积,mL;S为菌落面积,cm2。
1.3.6 菌株M7孢子萌发率的测定
取200 μL新鲜制备的孢子液(5×105个/mL)于无菌的1.5mL离心管中,10 000 r/min离心5 min,用移液器小心取出清液,孢子则以沉淀形式保留在离心管中。向离心管中加入100 μL 2×PDB和100 μL 0.1 mol/L的柠檬酸-磷酸氢二钠缓冲液(pH为3.0、4.0、5.0、6.0、7.0、8.0)或0.1 mol/L的Tris-HCl缓冲液(pH为8.5或9.0),用移液器吸吹使孢子悬浮,于30 ℃恒温静置培养。分别在培养的第4和第8小时取样,用血球计数板观察并计数已萌发和未萌发的孢子,分别记为a(个/mL)和b(个/mL)。每种pH条件设置3个平行,每个样品计数3次。孢子萌发率计算公式如下:
式中:X为孢子萌发率,%;a为已萌发孢子数量,个/mL;b为未萌发孢子数量,个/mL。
1.3.7 菌株M7孢子培养过程中的pH分段控制
孢子培养所用的培养基为PDB和CYB培养基,其初始pH用HCl和NaOH溶液调到5.0。取0.5 mL新鲜制备的孢子液(5×105个/mL)接种到装液量为35 mL/250 mL PDB或CYB培养基中,于28 ℃恒温静置培养8 d。此时,菌丝体的生长进入平台期,在液体培养基表面形成一层菌膜。静置培养8 d后,向培养液中加入等体积的无菌的0.1 mol/L的柠檬酸-磷酸氢二钠缓冲液(pH为7.0或8.0),继续在28 ℃培养4 d。对照组不加缓冲液,其他培养条件与实验组一致。培养结束后,用接种针挑出菌膜至装有玻璃珠的锥形瓶中,用两根接种针将菌膜划破,使菌丝分散开来,加入适量的蒸馏水(VL,mL),25 ℃、200 r/min振摇20 min,孢子计数方法同1.3.5,孢子浓度记为CL(个/mL);双层擦镜纸上收集到的菌丝用70 mL无菌水洗涤,60 ℃烘干至恒质量)。每组实验接种3~5瓶,每个样品的孢子浓度计数3次。单位质量菌丝的产孢量计算公式如下:
式中:PL为单位质量菌丝的产孢量,个/g;CL为孢子浓度,个/mL;VL为孢子悬液体积,mL;m为菌丝干质量,g。
1.3.8 数据处理
使用Excel 2016进行均值计算、标准偏差计算和差异显著性分析,用Origin 7.0软件进行绘图。
2 结果与分析
2.1 pH对菌株M7孢子萌发的影响
孢子萌发是孢子发育成营养细胞或菌丝的过程,是丝状真菌营养生长过程中的关键步骤。在极端pH值、干燥、低温、营养贫乏等环境条件下,孢子代谢不活跃,处于休眠状态,当pH、湿度、温度、营养等环境条件适宜时,孢子开始萌发生长出菌丝[24,33]。不同pH条件下菌株M7孢子萌发随时间变化见图1。由图1可知,酸性条件下的孢子萌发速度和萌发率均显著高于中碱性条件。在pH 3.0~6.0条件下,培养4 h后的萌发率为75%以上,其中pH 4.0和pH 5.0最高,分别为(84.8±2.5)%和(86.3±4.9)%,培养8 h后的萌发率均达100%;在pH 7~9条件下,培养4 h后,未观察到孢子萌发,培养8 h后,pH 7.0和pH 8.0时有少量孢子萌发,萌发率分别为(22.7±1.6)%和(1.0±0.8)%,而pH 8.5~9.0时仍未观察到孢子萌发。由此可见,pH>8.0的碱性条件为红色红曲菌M7孢子萌发的极端pH条件,在该条件下孢子不易萌发;pH 3.0~6.0为孢子萌发的适宜pH条件,孢子可100%萌发。因此,最适的孢子萌发pH值为4.0~5.0。
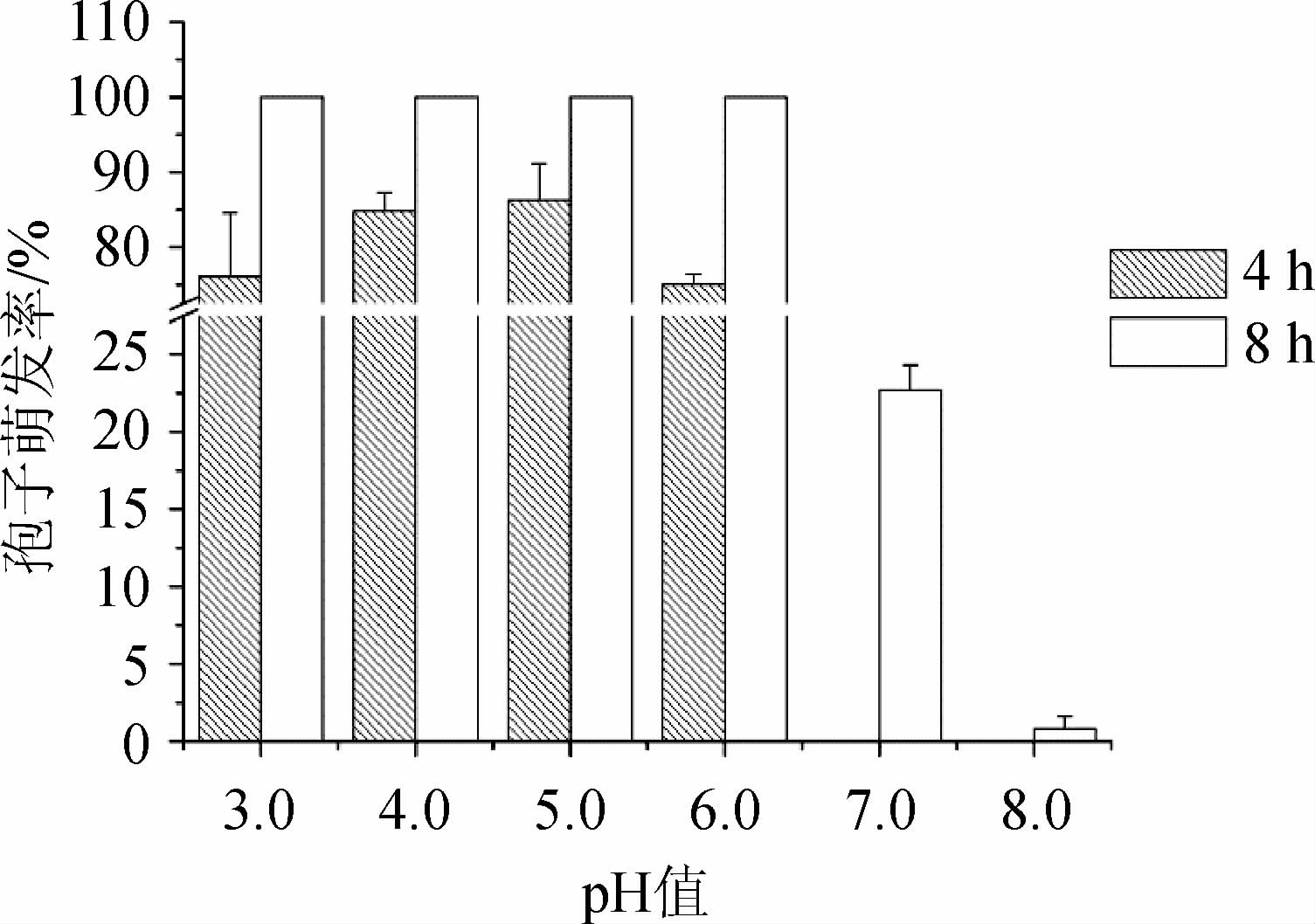
图1 不同pH值条件下菌株M7的孢子萌发率
Fig.1 Spore germination rate of strain M7 under different pH conditions
2.2 pH对菌株M7生长速度的影响
不同pH条件下红色红曲菌M7菌落直径随时间的变化见图2。
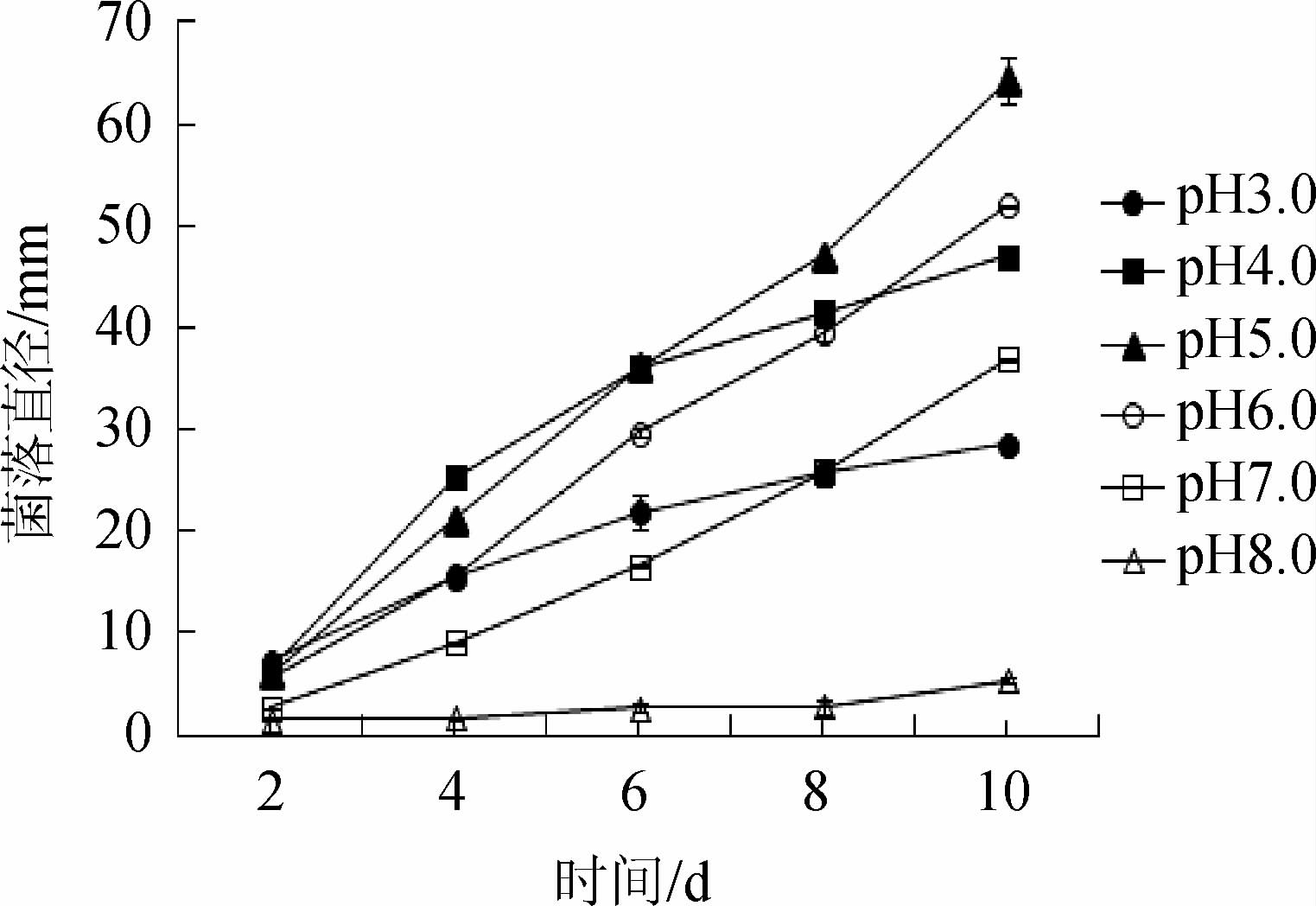
图2 不同pH值条件下菌株M7的菌落生长
Fig.2 Colony growth of strain M7 under different pH conditions
由图2可知,在pH 4.0~6.0范围内,红色红曲菌生长较快,形成的菌落较大,其中pH 5.0最佳,第10天时菌落直径为(64.0±2.3)mm;在pH 3.0和pH 7.0时,菌落生长明显减慢,第10天时菌落直径分别约为(28.5±0.5)mm和(36.9±0.1)mm;而在pH 8.0~9.0时,红色红曲菌M7的生长受到严重抑制,在第10天时,pH 8.0条件下的菌落直径很小,为(5.4±0.3)mm,pH 8.5~9.0条件下未见菌落生长。由此可见,pH>8.0的碱性条件为红曲菌M7菌丝生长的极端pH条件,在该条件下菌丝不生长或者死亡。因此,pH 4.0~6.0为生长的适宜pH条件,其中pH 5.0时菌落生长最快,为最佳的pH条件。
2.3 pH对菌株M7繁殖的影响
由上述孢子萌发和菌落生长实验结果可知,红色红曲菌M7生长的pH范围为3.0~8.0,pH>8.0的碱性条件为超出其生长的极端pH条件。在红色红曲菌M7生长的pH范围内,分析了pH对其繁殖的影响,闭囊壳、分生孢子的显微观察及产孢量结果分别见图3~图5。

图3 不同pH值条件下菌株M7闭囊壳的显微观察
Fig.3 Microscopic observation of cleistothecia of strain M7 under different pH conditions
箭头所示结构为闭囊壳;标尺长度为50 μm。
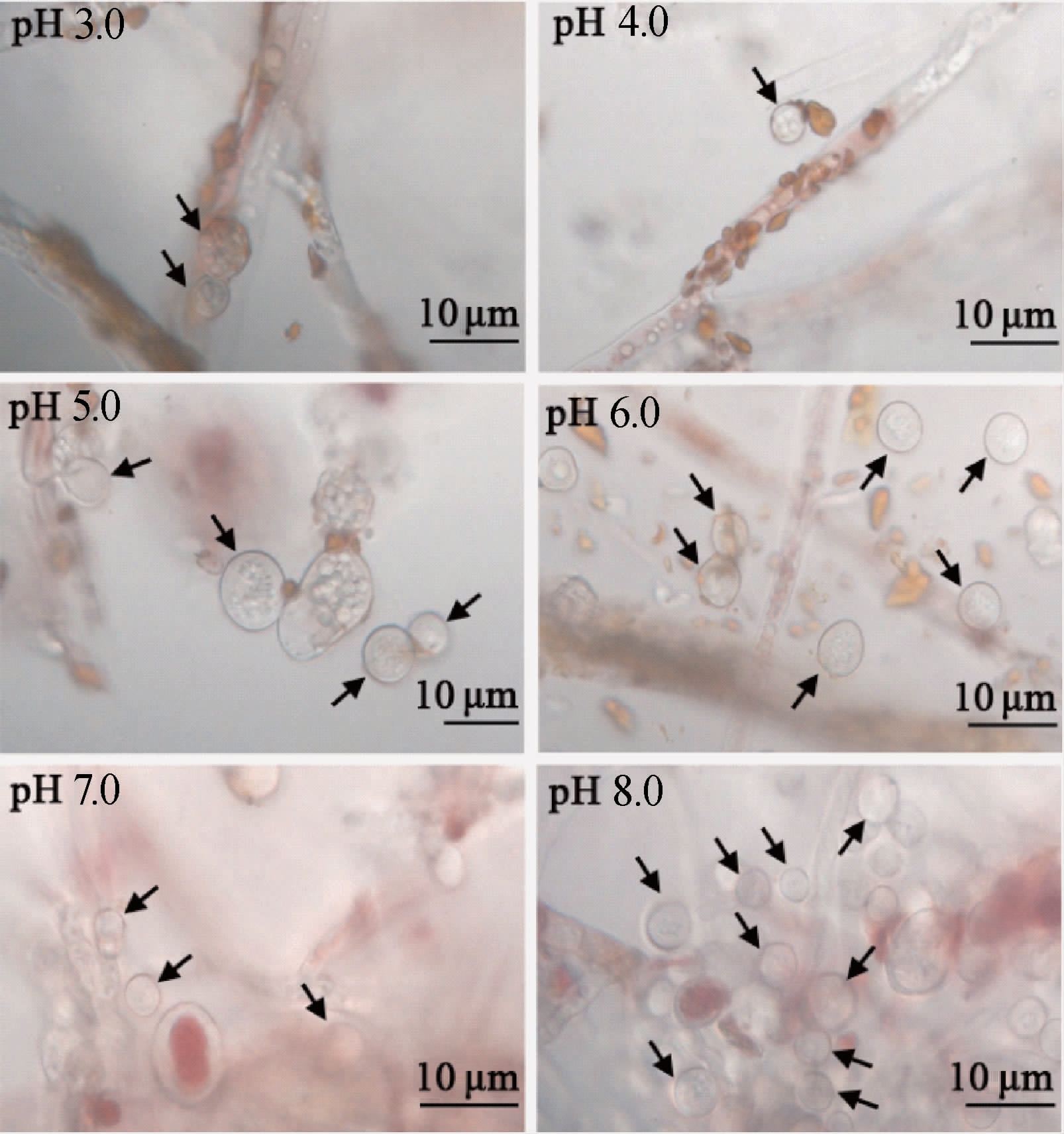
图4 不同pH条件值下菌株M7分生孢子的显微观察
Fig.4 Microscopic observation of conidia of strain M7 under different pH conditions
箭头所示结构为分生孢子;标尺长度为10 μm。
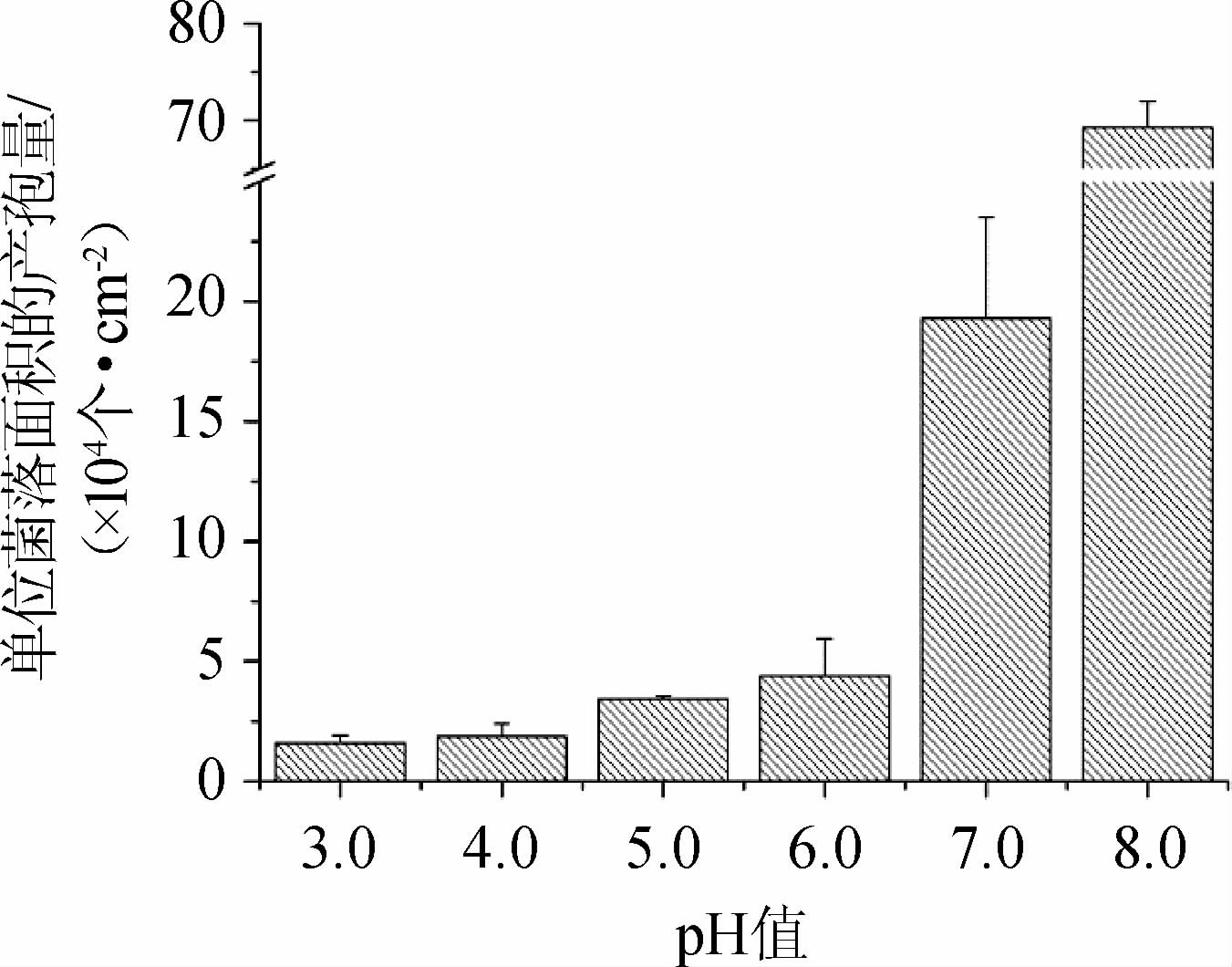
图5 不同pH值条件下菌株M7的产孢量
Fig.5 Spore production of strain M7 under different pH conditions
由图3和图4可知,在酸性条件下(pH 3.0~6.0),红色红曲菌既能进行无性繁殖,也能进行有性繁殖,可见分生孢子和闭囊壳两种繁殖结构;在中碱性条件下(pH 7.0~8.0),红曲菌以无性繁殖为主,可见大量分生孢子,但未观察到闭囊壳。由图5可知,红曲菌的产孢能力随着pH的升高而提高,提高幅度在中碱性条件下显著增大。在pH 7.0和pH 8.0时,单位菌落面积的产孢量分别为(19.3±4.2)×104个/cm2和(69.3±2.6)×104个/cm2,分别为pH 3.0~6.0时的4~12倍和15~43倍,是较好的产孢pH条件。
2.4 pH分段控制对菌株M7产孢的促进效果
由上述研究结果可知,红色红曲菌M7适宜的产孢pH条件(pH 7.0~8.0)与其适宜的孢子萌发pH条件(pH 3.0~6.0)和菌丝生长条件(pH 4.0~5.0)存在较大差异,该结果与不良生长环境能诱导微生物产孢的报道一致[24,27]。由于孢子的产生需要建立在菌丝大量生长的前提下,因此有必要根据红色红曲菌生长和繁殖对pH的需求差异,对产孢培养过程中的pH进行分段控制。利用PDB和CYB两种液态培养基对红曲菌进行产孢培养,其初始pH设置为最佳生长的pH条件(pH 5.0),以利于培养前期的孢子萌发和菌丝生长;当生长进入平台期(8 d后),加入pH 7或8的缓冲液将培养液的pH调整至适宜的产孢pH条件(pH 7.0~8.0),以促进培养后期大量产孢。pH分段控制对菌株M7产孢的促进效果结果见图6。
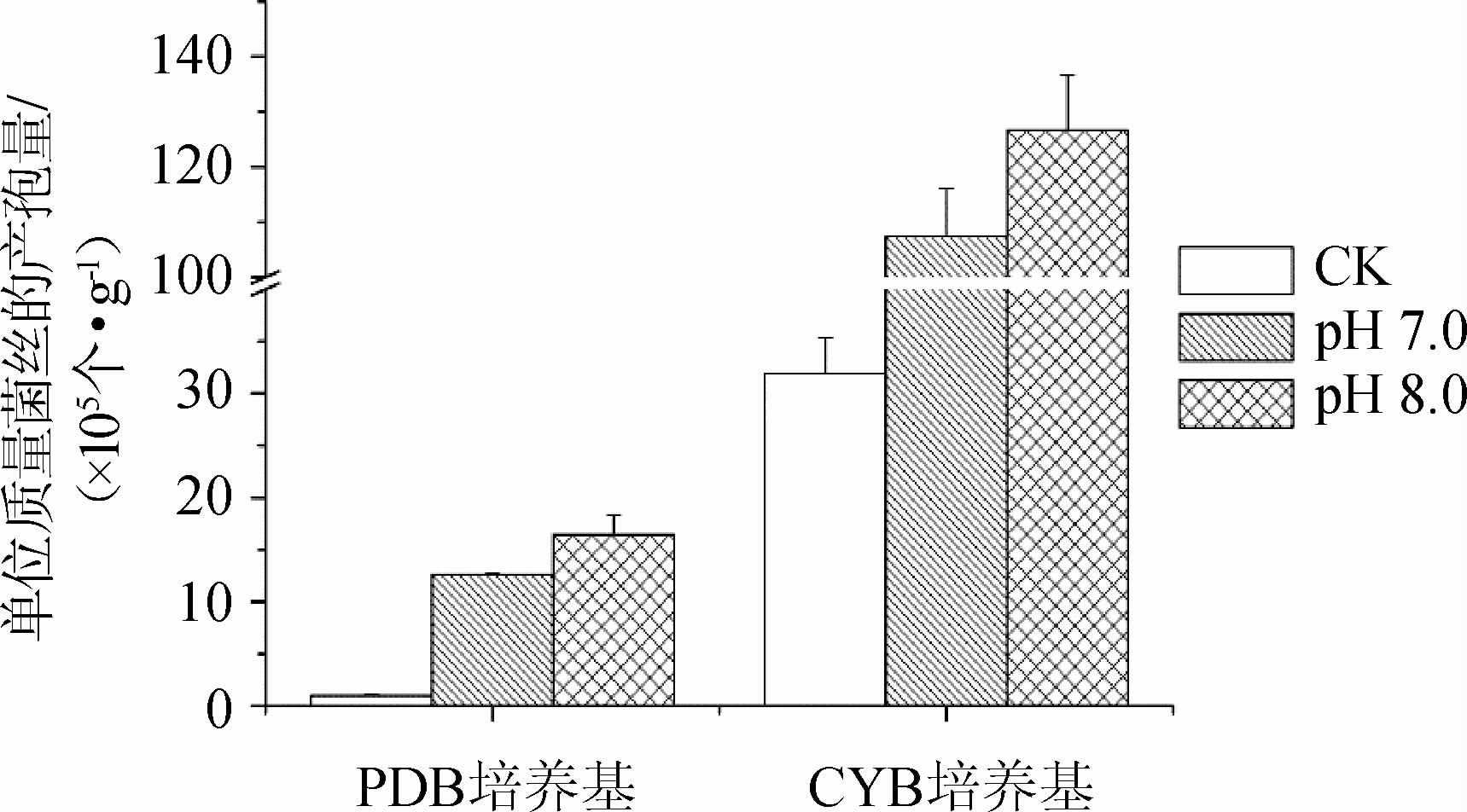
图6 pH分段控制条件下菌株M7产孢量
Fig.6 Spore production of strain M7 under pH subsection control
由图6可知,pH分段控制不影响菌丝的生长,但能显著地促进产孢量,调整培养后期的pH至7.0、8.0,在PDB中的单位质量菌丝的产孢量分别为(12.6±0.1)×105个/g和(16.5±1.9)×105个/g,相比对照组提高了12倍和16倍,在CYB中的单位质量菌丝的产孢量分别为(10.7±0.9)×106个/g和(12.7±1.0)×106个/g,相比对照组提高了3倍和4倍。
3 结论
菌株M7孢子萌发的较适pH范围为pH 3.0~6.0,最佳pH范围为pH 4.0~5.0,在pH 7.0~8.0时孢子萌发受到显著抑制;菌株M7菌落生长的较适pH范围为4.0~6.0,最佳pH为5.0,在pH 3.0和7.0时菌落生长明显减慢,pH 8.0时菌落生长受到严重抑制;pH>8.0的碱性条件为极端pH条件,孢子萌发和菌落生长完全被抑制。在菌株M7生长的pH范围内,其产孢能力随着pH的升高而提高,适宜的产孢pH范围为pH 7.0~8.0,产孢量为pH 3.0~6.0时的4~43倍。该结果表明,不良生长pH条件能诱导红色红曲菌M7大量产孢。根据菌株M7生长和繁殖对pH的需求差异,通过对产孢培养过程中的pH进行分段控制,显著提高了孢子产量,当控制培养前期pH为5.0、后期pH为7.0~8.0时,PDB培养基中的产孢量提高了12~16倍,CYB培养基中的产孢量提高了3倍和4倍。本研究结果可为红曲菌工业发酵生产和实验室研究过程中孢子培养技术提供参考。
[1]SCHWEIGGERT R M.Perspective on the ongoing replacement of artificial and animal-based dyes with alternative natural pigments in foods and beverages[J].J Agr Food Chem,2018,66(12):3074-3081.
[2]盛眀健,万培耀,刘兰晓.高安全性红曲色素生产菌种的筛选及在传统老抽着色中的应用[J].江苏调味副食品,2019(3):10-14.
[3]蔡琪琪,周康熙,刘志彬,等.红曲黄酒酿造过程中红曲霉生长抑制因素初探[J].中国食品学报,2019,19(10):143-149.
[4]张文森.红曲黄酒“三曲二酶”结合活性干酵母低温发酵的工艺研究[J].食品工业科技,2017(11):177-182.
[5]查婧.福建传统红曲醋中功能微生物的分离鉴定及生产性能研究[D].合肥:安徽农业大学,2014.
[6]PATEL S.Functional food red yeast rice(RYR)for metabolic syndrome amelioration:a review on pros and cons[J].World J Microbiol Biotechnol,2016,32(5):87.
[7]FOGACCI F,BANACH M,MIKHAILIDIS D P,et al.Safety of red yeast rice supplementation:a systematic review and meta-analysis of randomized controlled trials[J].Pharm Res,2019,143:1-16.
[8]高雅娟.红曲中非他汀物质降血脂机理的初步研究[D].天津:天津科技大学,2016.
[9] CHEN W P,FENG Y L,MOLN魣R I,et al.Nature and nurture:confluence of pathway determinism with metabolic and chemical serendipity diversifies Monascus azaphilone pigments[J].Nat Prod Rep,2019,36(4):561-572.
[10]HO B Y,PAN T M.The Monascus metabolite monacolin K reduces tumor progression and metastasis of Lewis lung carcinoma cells[J].J Agr Food Chem,2009,57(18):8258-8265.
[11]HSU W H,PAN T M.Monascus purpureus-fermented products and oral cancer:a review[J].Appl Microbiol Biotechnol,2012,93(5):1831-1842.
[12]YANG T,LIU J W,LUO F J,et al.Anticancer properties of Monascusmetabolites[J].Anticancer Drugs,2014,25(7):735-744.
[13]WU H C,CHENG M J,WU M D,et al.Three new constituents from the fungus of Monascus purpureus and their anti-inflammatory activity[J].Phytochem Lett,2019,31:242-248.
[14] NIGAM P S,LUKE J S.Food additives:production of microbial pigments and their antioxidant properties[J].Curr Opin Food Sci,2016,7:93-100.
[15] LIN C H,LIN T H,PAN T M.Alleviation of metabolic syndrome by monascin and ankaflavin:the perspective of Monascus functional foods[J].Food Funct,2017,8(7):2102-2109.
[16]刘晶,崔建华.高脂血症的中药治疗进展[J].天津药学,2017,29(3):70-74.
[17]WANG T J,LIEN A S Y,CHEN J L,et al.A randomized clinical efficacy trial of red yeast rice(Monascus pilosus)against hyperlipidemia[J].Am J Chin Med,2019,47(2):323-335.
[18]黄敏欣,洪泽淳,赵文红,等.红曲对广东客家黄酒发酵及产γ-氨基丁酸的影响[J].中国酿造,2016,35(10):46-50.
[19]CHOE D,JUNG H H,KIM D,et al.In vivo evaluation of the anti-obesity effects of combinations of Monascus pigment derivatives[J].RSC Adv,2020,10(3):1456-1462.
[20]KIM J H,KIM H J,KIM C,et al.Development of lipase inhibitors from various derivatives of Monascus pigment produced by Monascus fermentation[J].Food Chem,2007,101(1):357-364.
[21]CHOE D,LEE J,WOO S,et al.Evaluation of the amine derivatives of Monascus pigment with anti-obesity activities[J].Food Chem,2012,134(1):315-323.
[22]LEE C L,WEN J Y,HSU Y W,et al.Monascus-fermented yellow pigments Monascin and Ankaflavin showed anti-obesity effect via the suppression of differentiation and lipogenesis in obese rats fed a high-fat diet[J].J Agr Food Chem,2013,61(7):1493-1500.
[23]AGBOYIBOR C,KONG W B,CHEN D,et al.Monascus pigments production,composition,bioactivity and its application:A review[J].Biocatal Agr Biotechnol,2018,16:433-447.
[24]SETLOW P.Spore germination[J].Curr Opin Microbiol,2003,6(6):550-556.
[25] LOUNDS C,EAGLES J,CARTER A T,et al.Spore germination in Mortierella alpina is associated with a transient depletion of arachidonic acid and induction of fatty acid desaturase gene expression[J].Arch Microbiol,2007,188(4):299-305.
[26] ANDO A,SUMIDA Y,NEGORO H,et al.Establishment of Agrobacterium tumefaciens-mediated transformation of an oleaginous fungus,Mortierella alpina 1S-4,and its application for eicosapentaenoic acid producer breeding[J].Appl Environ Microbiol,2009,75(17):5529-5535.
[27]唐鑫,顾舒婕,常璐璐,等.高山被孢霉产孢培养基的筛选[J].中国油脂,2021,46(4):123-127.
[28]任志远.培养条件对红曲霉CG-6生长及莫纳可林K代谢的影响[D].天津:天津科技大学,2018.
[29]高慧民.红曲菌的分类鉴定及其固态发酵产孢条件的优化[D].天津:天津科技大学,2015.
[30]谭文辉.橙色红曲菌AS3.4384产孢及原生质体制备和再生条件的优化[D].南昌:南昌大学,2006.
[31]腾军伟,周芷寒,刘振民,等.紫红曲霉M-4液态发酵产孢子工艺优化[J].乳业科学与技术,2019,42(6):13-20.
[32]LI L,CHEN S,GAO M X,et al.Acidic conditions induce the accumulation of orange Monascus pigments during liquid-state fermentation of Monascus ruber M7[J].Appl Microbiol Biotechnol,2019,103(20):8393-8402.
[33]汪军,杨腊英,毛超,等.淡紫拟青霉E7菌株固体放大发酵产孢培养基和工艺条件研究[J].热带作物学报,2013,34(10):2038-2045.