甘露聚糖是自然界中含量仅次于木聚糖的半纤维素,是由甘露糖以β-1,4糖苷键连接形成主链,由半乳糖和葡萄糖参与形成一些侧链的高聚物,广泛分布在高等植物和一些藻类的细胞壁及一些豆科植物的种子中[1-3]。在多种行业中甘露聚糖都会影响到相关植物类原料的利用,例如,当饲料中含有较多甘露聚糖时,就会在动物肠道中形成高黏度的胶状物质而影响肠道内消化酶对饲料的消化,而降低动物对饲料的利用效率[4-6];在生物能源、造纸、纺织等工业中,甘露聚糖都会产生不利的影响[2,7]。所以,在许多情况下需要对原料中的甘露聚糖进行水解。
由于甘露聚糖结构复杂,对其彻底水解需要多种酶的参与,包括β-甘露聚糖酶、β-甘露糖苷酶、β-葡萄糖苷酶、α-半乳糖苷酶、脱乙酰酯化酶等,其中β-甘露聚糖酶主要水解β-1,4糖苷键连接形成的主链,其作用最为关键[1-2,8-9]。所以在上述行业中β-甘露聚糖酶被用于消除甘露聚糖的消极影响[2,4-7,10]。此外,在食品行业中β-甘露聚糖酶可以应用于甘露寡糖的制备[11-12],在石油开采行业中β-甘露聚糖酶用于降解压裂液而增加压裂液的反排率[2],在洗涤剂中添加β-甘露聚糖酶可以增加洗涤剂对衣物上甘露糖的洗涤效果[13]。所以,β-甘露聚糖酶类产品有着广阔的应用市场。
而在许多情况下,β-甘露聚糖酶的制备与应用过程中需要经历高温环境,因此开发β-甘露聚糖酶产品首先需要选取耐热性良好的β-甘露聚糖酶[14-16]。β-甘露聚糖酶在自然界中广泛存在,其中因微生物来源的β-甘露聚糖酶相对于动植物来源的β-甘露聚糖酶更适宜于生产应用而得到更广泛的研究,其中大多数已知的β-甘露聚糖酶并不具备耐热性,而在丝状真菌和一些芽孢菌中发现了一些耐热β-甘露聚糖酶[2,17-21],为了进一步改良这些β-甘露聚糖酶的酶学性质,使其更适用于生产应用,提高生产效率,一般通过分子生物学的手段对其进行基因改造[21-23]。本研究利用易错聚合酶链式反应(polymerase chain reaction,PCR)与定点突变的方法对一个黑曲霉来源的糖苷水解酶(glycoside hydrolase,GH)家族5的耐热型酸性β-甘露聚糖酶ManA进行了耐热突变体筛选,获得耐热性提升的突变体,并对突变位点进行分析,为GH5家族β-甘露聚糖酶的改造提供参考依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株、质粒和基因
大肠杆菌(Escherichia coli)Top10感受态细胞:江苏康为世纪生物科技有限公司;毕赤酵母(Pichia pastoris)GS115细胞、毕赤酵母表达载体pGAPZαA:武汉淼灵生物科技有限公司;黑曲霉β-甘露聚糖酶基因manA:根据Genebank中登录的氨基酸序列(XM_001390670.1),委托华大基因股份有限公司进行密码子改造后合成。
1.1.2 化学试剂
限制性内切酶EcoRⅠ(20000U/mL)、NotⅠ(20000U/mL)、AvrⅡ(5000U/mL):北京NEB公司;T4连接酶(5000U/mL):美国Thermo公司;Taq酶(2×Taq Plus MasterMix):江苏康为世纪生物科技有限公司;脱氧核糖核酸(deoxyribonucleic acid,DNA)回收试剂盒:天根生物科技有限公司;Pfu DNA聚合酶(2 500 U/mL)和DNA Marker:全式金生物科技有限公司;蛋白Marker:生工生物工程股份有限公司;3,5-二硝基水杨酸(dinitrosalicylic acid,DNS):北京酷来博科技有限公司;二喹啉甲酸(bicinchoninic acid,BCA)法蛋白浓度测定试剂盒:北京普利莱基因技术有限公司;其他分析纯试剂均为国药集团化学试剂有限公司;引物:华大基因股份有限公司合成。
1.1.3 培养基
细菌培养采用Luria Bertani(LB)培养基:胰蛋白胨10 g/L、酵母粉5 g/L、NaCl 5 g/L和琼脂糖15 g/L。
酵母培养和转化采用酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基:胰蛋白胨20 g/L、酵母粉10 g/L和葡萄糖20 g/L。
酵母浸出粉胨葡萄糖山梨醇(yeast extract peptone dextrose sorbitol,YPDS)培养基:胰蛋白胨20 g/L、酵母粉10 g/L、葡萄糖20 g/L、山梨醇182 g/L和琼脂糖15 g/L。
上述培养基灭菌条件均为121 ℃灭菌20 min。
1.2 仪器与设备
Tpersonal型PCR仪:德国Biometra公司;3001型全波长扫描式读数仪:美国Thermo公司;ChemiDocTM XRS+型凝胶成像仪、Genepulser Mx Cell型电穿孔仪、0.2 cm电转杯:美国Bio-Rad公司;DNP-9082型电热恒温培养箱:上海精宏设备有限公司;HYG-A型恒温摇床:太仓市豪诚实验仪器制造有限公司;DYY-6C型电泳仪:北京六一仪器厂。
1.3 方法
1.3.1 β-甘露聚糖酶基因manA重组表达载体的构建
根据Genebank 中登录的ManA 氨基酸序列(XM_001390670.1)合成黑曲霉β-甘露聚糖酶基因manA,用DNA限制性核酸内切酶EcoRⅠ和NotⅠ对基因manA和毕赤酵母组成型表达载体pGAPZαA同时进行双酶切,之后用T4 DNA连接酶将基因manA连接进载体pGAPZαA中,转化大肠杆菌Top10感受态细胞,涂布在含有30 μg/mL博来霉素的低盐LB平板上筛选阳性克隆,提取重组质粒pGAPZαA-manA。
1.3.2 毕赤酵母转化
挑取GS115单克隆至5mLYPD培养基中,30℃、200r/min摇床培养过夜;取1 mL培养物转接至100 mL YPD培养基中,30 ℃、200 r/min培养至对数生长期(OD600nm=1.0~1.3),取1 mL菌液分装到1.5 mL离心管中,4 ℃、10 000 r/min离心1 min,弃上清,沉淀用无菌水(4 ℃预冷)重悬,同样条件下离心,弃上清;加入1 mL处理液[100 mmol/L LiAc;10 mmol/L二硫苏糖醇(dithiothreitol,DTT);0.6mol/L山梨醇;10 mmol/L Tris-HCl(pH7.5)]重悬细胞,室温放置20min;4℃、10000r/min离心1 min,弃上清,加入1 mL 1 mol/L的山梨醇溶液重悬后离心,重复一次,之后将细胞重悬在80 μL的1 mol/L山梨醇溶液中,制成感受态细胞;在80 μL感受态细胞中加入1~10 μg的AvrⅡ线性化的质粒,混合均匀后转移至预冷的2 mm电转杯中,冰上放置5 min;设置电压1.5 kV,脉冲6 ms(1.5 kV,200 Ω,25 μF),电击一次;电击后迅速加入1 mL预冷的1 mol/L山梨醇溶液重悬细胞,转移至离心管中,30 ℃静置1 h后,将其涂布于含有100 μg/mL博来霉素的YPDS培养基上,30 ℃避光培养3 d。
1.3.3 易错PCR
以pGAPZαA-manA为模板,采用引物GAP-mF:5'-CCTAGGAAATTTTACTCTGCTGGAG-3',GAP-mR:5'-GACGGTAACGGGCGGTGGAAGGAGAG-3',以Taq酶作为聚合酶,进行PCR,在反应体系中补加0.1 mmol/L的MnCl2和0.5 mmol/L的脱氧鸟苷三磷酸(deoxyguanosine triphosphate,dGTP);PCR扩增程序:95 ℃预变性5 min;95 ℃变性30 s、52 ℃退火30 s、72 ℃延伸5 min,循环30次;72 ℃反应10 min;即得pGAPZαA-manA突变文库,用DNA回收试剂盒回收后乙醇沉淀,直接用于毕赤酵母转化(不需要AvrⅡ酶切)。
1.3.4 β-甘露聚糖酶酶活测定
β-甘露聚糖酶酶活参考国家标准GB/T 36861—2018《饲料添加剂β-甘露聚糖酶活力的测定分光光度法》进行测定。β-甘露聚糖酶酶活定义:在37 ℃、pH值5.5条件下,每分钟从3 mg/mL的甘露聚糖溶液中释放1 μmol还原糖所需的酶量为1个酶活单位(U)。
1.3.5 β-甘露聚糖酶耐热克隆筛选
将pGAPZαA-manA突变体文库电转化到毕赤酵母GS115感受态细胞中,涂布在含100 μg/mL博来霉素的YPDS培养基平板上,30 ℃倒置培养3 d筛选阳性克隆;挑取YPDS平板上的所有克隆,分别接入2 mL的YPD培养基中,30 ℃、200 r/min摇床培养3 d;取发酵液,12 000 r/min离心2 min,收集上清,取200 μL于75 ℃加热30 min后凉水冷却至室温,以DNS法分别测定上清加热前后的β-甘露聚糖酶活性,计算加热后发酵液与加热前发酵液的酶活比值作为相对酶活,筛选相对酶活显著高于野生型(wt)ManA的突变克隆。
1.3.6 β-甘露聚糖酶定点突变
以pGAPZαA-manA为模板,Pfu酶作为聚合酶进行聚合酶链式反应,PCR扩增程序是:95 ℃预变性5 min;95 ℃变性30 s、52 ℃退火30 s、72 ℃延伸10 min,循环15次;72 ℃反应10 min;以表1中的引物分别将β-甘露聚糖酶283位组氨酸(histidine,H)突变为其他氨基酸,PCR结束后在反应体系中加入限制性内切酶DpnⅠ,37 ℃反应消化原始模板后转化大肠杆菌Top10感受态,涂布在含有30 μg/mL博来霉素的低盐LB培养基平板上,37 ℃培养过夜筛选阳性克隆,提取突变体质粒后,基因测序确定突变成功。
表1 283位氨基酸定点突变引物
Table 1 Primers for site-directed mutagenesis of H283

续表

1.3.7 β-甘露聚糖酶纯化与浓度测定
挑取β-甘露聚糖酶ManA毕赤酵母工程菌至2 mL YPD培养基中,30 ℃摇床培养过夜;转接培养物至100 mL YPD培养基中,30 ℃、200 r/min培养3 d,12 000 r/min离心20 min,收集上清,与用结合缓冲液(20 mmol/L Tris-HCl,150 mmol/L NaCl,10 mmol/L咪唑,pH 7.9)平衡后的镍柱填料(HisPurTM Ni-NTA Superflow Agarose,Thermo)混合,用结合缓冲液漂洗3次,然后用洗脱缓冲液(20 mmol/L Tris-HCl,150 mmol/L NaCl,300 mmol/L 咪唑,pH 7.9)洗脱,收集洗脱液;用超滤膜浓缩洗脱液后用分子筛柱子(SuperdexTM 200 10/300GL)进一步纯化(缓冲液为150 mmol/L NaCl),十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)检测纯化结果,用BCA法测定β-甘露聚糖酶浓度。
1.3.8 β-甘露聚糖酶酶学性质测定
最适反应温度测定:在pH4.0条件下测定不同温度(45℃、50 ℃、55 ℃、60 ℃、65 ℃、70 ℃、75 ℃、80 ℃、85 ℃、90 ℃)下β-甘露聚糖酶酶活,计算各温度条件下酶活与最高酶活的比值作为相对酶活;最适反应pH值测定:在80 ℃条件下测定不同pH(3.0、3.5、4.0、4.5、5.0,100 mmol/L 柠檬酸钠)条件下β-甘露聚糖酶酶活,计算各pH条件下酶活与最高酶活的比值作为相对酶活,并计算pH 4.0条件下β-甘露聚糖酶比酶活;温度耐受性检测:取200 μL酶液于不同温度(70 ℃、75 ℃、80 ℃、85 ℃)条件下加热30 min后凉水冷却至室温,然后测定加热前后的β-甘露聚糖酶酶活,以相应温度条件下加热后酶活与加热前酶活的比值作为相对酶活;pH耐受性检测:将酶液于50 ℃在不同pH值(2.0、3.0、4.0、5.0、6.0(50 mmol/L柠檬酸钠)、7.0(50 mmol/L磷酸钠)、8.0、9.0(50 mmol/L Tris-HCl))条件下处理24 h后测定β-甘露聚糖酶酶活,以相应pH条件下处理后酶活与处理前酶活的比值作为相对酶活。
1.3.9 数据处理
使用Excel 2016软件分析实验数据并制作图表;蛋白结构B因子图及蛋白结构信息图用Pymol 2.3.2软件作图;蛋白序列在ClustalW2网站(https://www.ebi.ac.uk/Tools/msa/clustalo/)进行序列比对。
2 结果与分析
2.1 酵母重组表达载体构建
利用质粒小提试剂盒从连接转化后的Top10感受态中提取重组质粒pGAPZαA-manA,经DNA限制性内切酶EcoRⅠ和NotⅠ酶切后,琼脂糖凝胶电泳检测结果见图1。由图1可知,得到3 100 bp和1 000 bp的DNA片段,与预期相符,证明质粒pGAPZαA-manA构建成功。
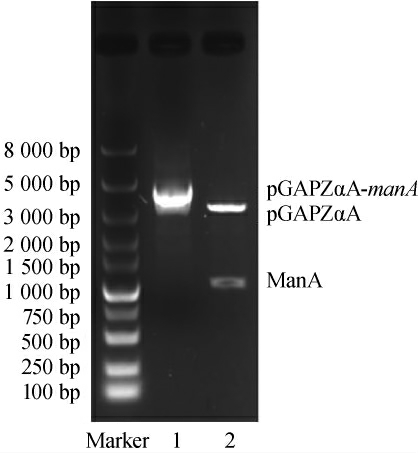
图1 质粒pGAPZαA-manA酶切琼脂糖凝胶电泳结果
Fig.1 Agarose gel electrophoresis results of digestion of plasmid pGAPZαA-manA
1:质粒pGAPZαA-manA;2:EcoRⅠ和NotⅠ酶切pGAPZαA-manA。
2.2 易错PCR与耐热突变体筛选
将以pGAPZαA-manA为模板进行的易错PCR得到的产物见图2A。由图2A可知,通过易错PCR得到了特异性的PCR条带。将PCR产物纯化后电转化至毕赤酵母GS115中,在含100 μg/mL博来霉素的YPDS平板上筛选阳性克隆结果见图2B。由图2B可知,毕赤酵母转化成功,平板上长有较多的阳性克隆。并对所有克隆的发酵液的β-甘露聚糖酶耐热性进行检测,筛选到2号克隆在75 ℃加热30 min后的相对酶活为76.95%,较野生型的26.66%相对酶活有显著提高。提取2号克隆的基因组DNA,以其为模板,以通用引物GAP-F和3'AOX1进行PCR,对PCR产物进行测序,经序列比对后确定2号克隆中基因manA的848位的腺嘌呤(adenine,A)突变为鸟嘌呤(guanine,G),相应的蛋白ManA的283位组氨酸(H)突变为精氨酸(arginine,R)。
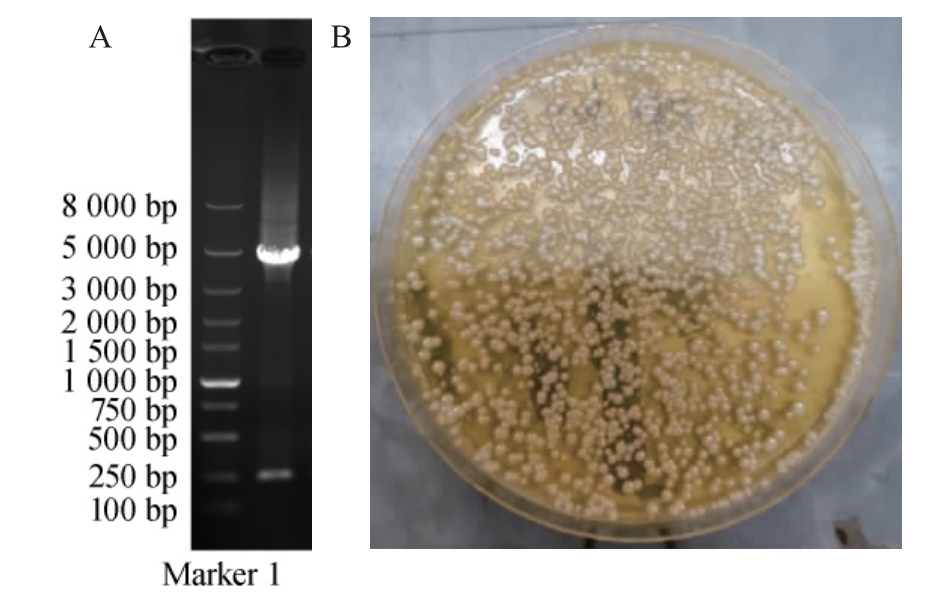
图2 质粒pGAPZαA-manA易错PCR(A)与GS115转化克隆(B)
Fig.2 Error-prone PCR (A) of plasmid pGAPZαA-manA and transformants of GS115 (B)
1为质粒pGAPZαA-manA易错PCR产物。
2.3 ManA 283位氨基酸定点突变与耐热性提高突变体筛选
以pGAPZαA-manA为模板进行定点突变将ManA的第283为组氨酸(H)分别突变为除精氨酸(R)外的其他18种常见氨基酸,提取突变质粒,并分别电转化毕赤酵母GS115表达ManA突变体蛋白,并测定ManA各个突变体在75 ℃加热30 min后的相对酶活结果见图3。由图3可知,在这些突变体中仅有H283K突变体的相对酶活较野生型显著提高,相对酶活达到83.57%,而其他突变体的相对酶活均在10%以下,显著低于野生型。
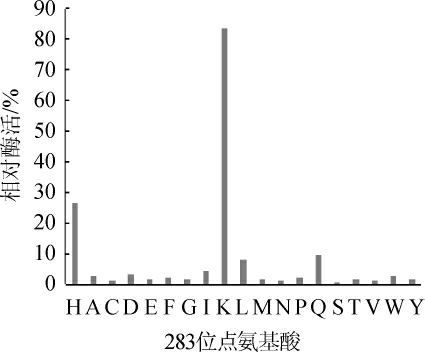
图3 283位氨基酸突变耐热性筛选
Fig.3 Screening of heat resistant mutants at amino acid position 283
2.4 野生型与突变体ManA蛋白的酶学性质比较
纯化ManA的野生型和H283K、H283R突变体蛋白的SDS-PAGE结果见图4。由图4可知,纯化后的ManA野生型及突变体蛋白都达到了较高的纯度。
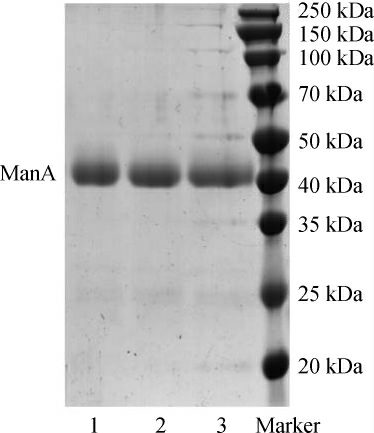
图4 纯化后的野生型及突变体蛋白的SDS-PAGE结果
Fig.4 SDS-PAGE results of purified wild type and mutant protein
1:野生型;2:H283K:3:H283R。
分别测定野生型和H283K、H283R突变体蛋白在70 ℃、75 ℃、80 ℃、85 ℃下加热30 min后的酶活,计算相对酶活,其热稳定性结果见图5A。由图5A可知,在75 ℃加热30 min后,H283K、H283R突变体的相对酶活分别为76.95%和83.57%,显著高于野生型的相对酶活(26.66%),在80 ℃加热30 min后,H283K、H283R突变体的相对酶活分别为11.65%和27.35%,同样显著高于野生型的相对酶活(0.52%)。测定野生型和H283K、H283R突变体的不同反应温度条件下的酶活,相对酶活计算结果见图5B。由图5B可知,野生型和H283K、H283R突变体的最适反应温度均为80 ℃。野生型和H283K、H283R突变体的最适反应pH值及pH稳定性分别见图5C和图5D。由图5C可知,野生型和H283K、H283R突变体的最适反应pH值均为4.0。由图5D可知,在pH3.0~9.0的条件下,50 ℃保存24 h,H283K突变体与野生型的相对酶活均>90%,而H283R突变体在pH3.0时稳定性较野生型有所降低,相对酶活下降到84.72%。
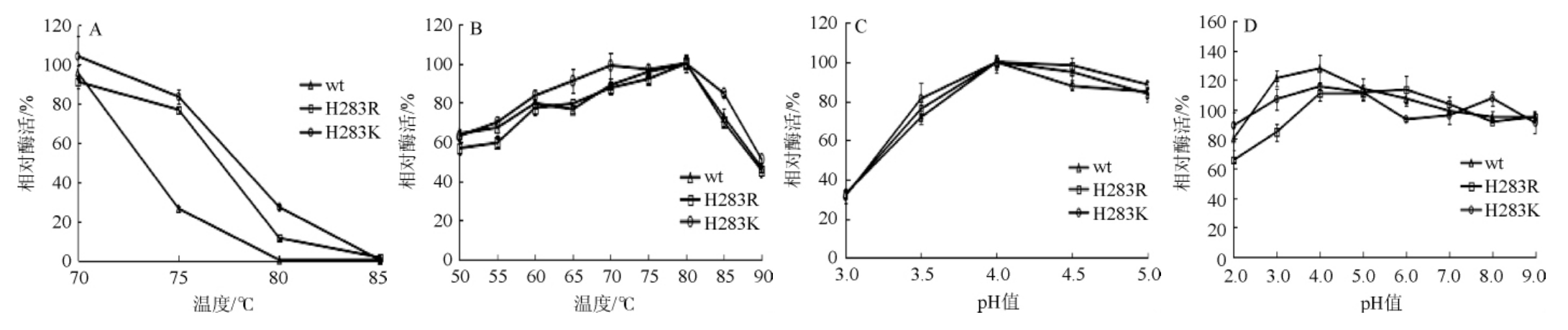
图5 野生型与突变体蛋白酶学性质检测结果
Fig.5 Determination results of enzyme property of protein produced by wild type and mutant
A:耐温性;B:最适反应温度;C:最适反应pH;D:pH耐受性。
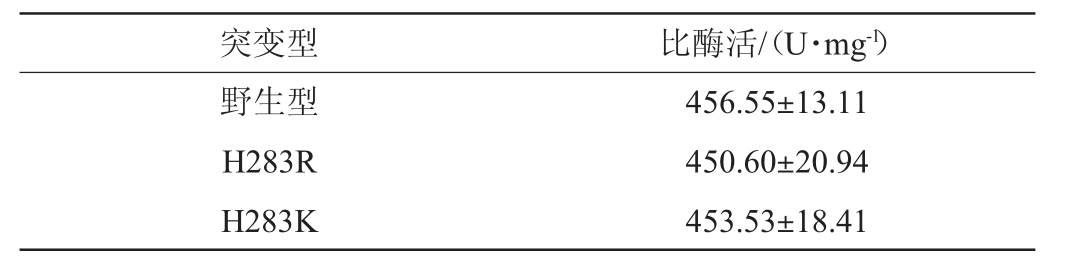
计算野生型和H283K、H283R突变体在80 ℃、pH4.0条件下的比酶活,结果见表2。由表2可知,这两种突变体与野生型的比酶活没有显著变化,说明这两种突变在提升β-甘露聚糖酶ManA耐热性的同时对其比酶活没有明显影响。
表2 野生型与突变体的比酶活
Table 2 Specific activities of wild type and mutants
2.5 讨论
由以上实验结果可以看到将黑曲霉β-甘露聚糖酶ManA的第283位组氨酸(H)突变为精氨酸(R)或赖氨酸(K)后,其耐热性有显著的提升,为寻找其耐热性提升的原因,将黑曲霉β-甘露聚糖酶ManA的蛋白晶体结构信息(蛋白质数据库(protein data bank,PDB)号:3WH9)与另外2种的GH5家族的β-甘露聚糖酶(PDB号:3WFL)、(PDB号:3ZIZ)的结构信息进行比较,根据B因子(B-factor)对其进行作图,如图6A、6B、6C所示,可以看到3WH9中H283位点的B因子明显大于相应的3WFL的K283位点和3ZIZ的R293位点,而B因子的大小可以反应出原子、氨基酸侧链以及整个区域的灵活度,B因子越低时一般热稳定性越高[24-26]。与之相符的是通过蛋白晶体结构中氨基酸的相互作用可以看到3WH9中H283位点的侧链参与了2个氢键的形成(见图6D),而3WFL的K283位点的侧链与其他3个氨基酸(G321、Y322、T323)的主链形成了3个氢键(见图6E),3ZIZ的R293位点的侧链与3个氨基酸(Y289、F334、T335)的主链和1个氨基酸(Q297)的侧链形成了4个氢键(见图6F),所以相对于3WH9,3WFL和3ZIZ在该位点处的原子相互作用更强,结构也更加稳定。比对3WH9、3WFL、3ZIZ以及另外2种GH5家族的β-甘露聚糖酶的氨基酸序列(见图6G),可以看到与3WFL的K283和3ZIZ的R293形成氢键的氨基酸在这5种GH5家族的β-甘露聚糖酶中具有较高的保守性,而且因为这些氨基酸多数是由主链参与氢键形成,所以氨基酸的种类对其氢键的形成影响应该不大,所以将黑曲霉β-甘露聚糖酶ManA的H283位点突变为K或者R时极有可能形成与3WFL和3ZIZ中相似的结合状态,相对于野生型,该处的氢键会增多,稳定性会提高,这有可能就是H283K和H283R突变体相对于野生型耐热性提高的原因。所以,本研究成果也将为改良一些与ManA结构相近的GH5家族的β-甘露聚糖酶提供借鉴。
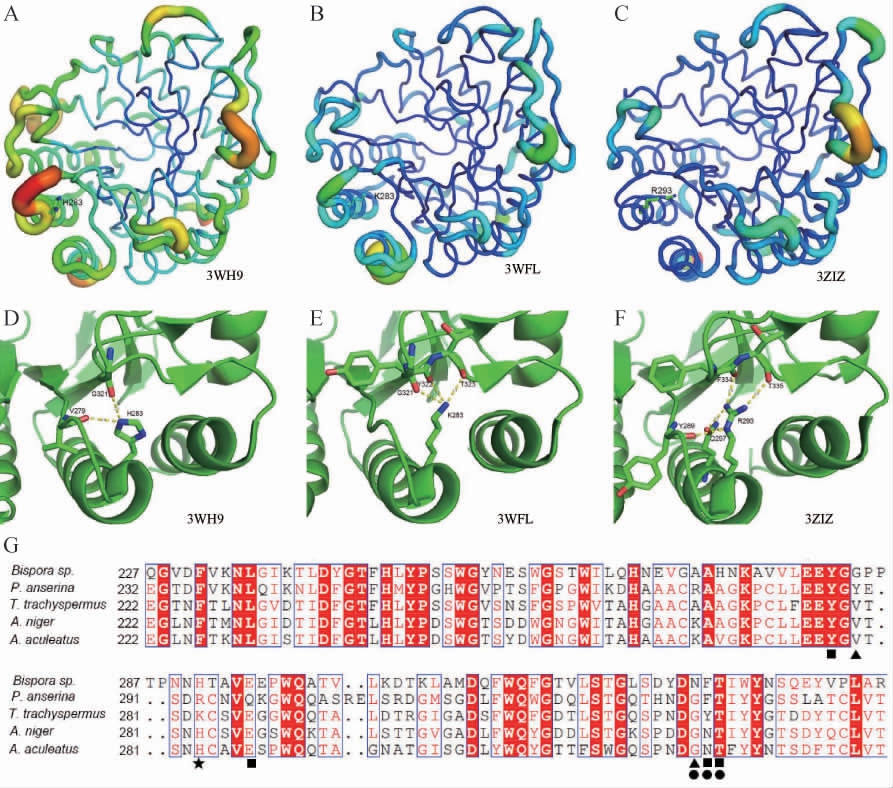
图6 ManA与其他GH5家族β-半乳糖苷酶的蛋白结构与序列比较
Fig.6 Comparison of the protein structure and sequence of ManA with other GH5 β-mannanases
以B因子值作图对3WH9(A)、3WFL(B)和3ZIZ(C)的结构紧凑度进行比较(线条蓝细代表结构紧凑,红粗代表结构松散);比较3WH9的H283位点(D)、3WFL的K283位点(E)和3ZIZ的R293位点(F)的侧链参与的相互作用;G:黑曲霉β-甘露聚糖酶ManA(3WH9)与双孢菌、柄孢霉(3ZIZ)、糙刺蓝状菌(3WFL)及棘孢曲霉来源的GH5家族的β-甘露聚糖酶的部分氨基酸序列比对(★指示3WH9的H283位点,▲指示与3WH9的H283侧链相互作用的位点,●指示与3WFL的K283侧链相互作用的位点,■指示与3ZIZ的R293侧链相互作用的位点)。
3 结论
本研究通过易错PCR与定点突变的方法获得了两个黑曲霉来源β-甘露聚糖酶ManA的耐热突变体,分别为H283R和H283K,这两个突变体与野生型相比耐热性得到明显提升,而其他酶学性质变化较小,但将H283位点突变为其他氨基酸时,酶的热稳定性显著降低,说明ManA的283位组氨酸对于该酶的热稳定性很关键。通过与同源的GH5家族β-甘露聚糖酶的蛋白结构与序列进行比较,可以看到对该位点进行突变也可能适用于改良其他结构相近的GH5家族β-甘露聚糖酶的耐热性。
[1]张建新,宋宜乐,冯军厂,等.微生物β-甘露聚糖酶的研究进展[J].中国酿造,2019,38(4):7-10.
[2]罗长财.一种耐高温β-甘露聚糖酶在毕赤酵母中高效表达及其耐高温机理分析[D].无锡:江南大学,2018.
[3]GIDLEY M J,MCARTHUR A J,UNDERWOOD D R.13C NMR characterization of molecular structures in powders hydrates and gels of galactomannans and gulcomannans[J].Food Hydrocoll,1991,5(1-2):129-140.
[4]谢建华.半纤维素降解酶体系的挖掘和协同作用以及在提高饲料利用率上的应用研究[D].广州:华南理工大学,2020.
[5] PETTEY L A,CARTER S D,SENNE B W,et al.Effects of beta-mannanase addition to corn-soybean meal diets on growth performance,carcass traits,and nutrient digestibility of weanling and growing-finishing pigs[J].J Animal Sci,2002,80(4):1012-1019.
[6]JACKSON M E,FODGE D W,HSIAO H Y.Effects of beta-mannanase in corn-soybean meal diets on laying hen performance[J].Narnia,1999,78(12):1737-1741.
[7]YANG M,CAI J,WANG C,et al.Characterization of endo-β-mannanase from Enterobacter ludwigii MY271 and application in pulp industry[J].Bioprocess Biosyst Eng,2017,40(1):35-43.
[8]王瑶,王睿琪,那金,等.甘露聚糖酶协同水解甘露聚糖研究进展[J].中国农学通报,2017,33(21):21-26.
[9]MALGAS S,DYK J S,PLETSCHKE B I.A review of the enzymatic hydrolysis of mannans and synergistic interactions between β-mannanase,β-mannosidase and α-galactosidase[J].World J Microbiol Biotechnol,2015,31(8):1167-1175.
[10]殷运菊,闫昭明,陈清华,等. β-甘露聚糖酶的结构、特性及其在畜禽生产中的应用[J].动物营养学报,2021,35(5):2535-2543.
[11]杨绍青,刘学强,刘瑜,等.酶法制备几种功能性低聚糖的研究进展[J].生物产业技术,2019(4):16-25.
[12]温永平,唐季清,韩冬,等.魔芋甘露寡糖对酸奶免疫调节活性的影响[J].食品科学,2021,42(17):133-142.
[13] SRIVVASTAVA P K,KAPOOR M.Production,properties,and applications of endo-β-mannanases[J].Biotechnol Adv,2017,35(1):1-19.
[14]LUO Z,MIAO J,LI G,et al.A recombinant highly thermostable β-mannanase(ReTMan26)from thermophilic Bacillus subtilis(TBS2)expressed in Pichia pastoris and its pH and temperature stability[J].Appl Biochem Biotechnol,2017,182(4):1259-1275.
[15]田庚,高伟强,陈晓波,等.热稳定性高β-甘露聚糖酶产生菌的筛选、鉴定及酶学性质研究[J].食品工业科技,2020,41(19):127-131.
[16]AULITTO M,FUSCO S,LIMAURO D,et al.Galactomannan degradation by thermophilic enzymes:a hot topic for biotechnological applications[J].World J Microbiol Biotechnol,2019,35(2):32.
[17]LUO H,WANG Y,WANG H,et al.A novel highly acidic beta-mannanase from the acidophilic fungus Bispora sp.MEY-1:gene cloning and overexpression in Pichia pastoris[J].Appl Microbiol Biotechnol,2009,82(3):453-461.
[18]YU S,LI Z,WANG Y,et al.High-level expression and characterization of a thermophilic β-mannanase from Aspergillus niger in Pichia pastoris[J].Biotechnol Lett,2015,37(9):1853-1859.
[19]KATSIMPOURAS C,DIMAROGONA M,PETROPOULOS P,et al.A thermostable GH26 endo-β-mannanase from Myceliophthora thermophila capable of enhancing lignocellulose degradation[J].Appl Microbiol Biotechnol,2016,100(19):8385-8397.
[20]CHEN X,WANG X,LIU Y,et al.Biochemical analyses of a novel thermostable GH5 endo β-1,4-mannanase with minor β-1,4-glucosidic cleavage activity from Bacillus sp.KW1 and its synergism with a commercial α-galactosidase on galactomannan hydrolysis[J].Int J Biol Macromol,2021,166:778-788.
[21]王彩虹,牛灿芳,罗会颖,等.嗜热β-甘露聚糖酶的研究进展[J].生物技术进展,2014,(5):340-345.
[22]胡海艳,甘祥武,黄秀敏,等.基于易错PCR的β-甘露聚糖酶体外分子定向进化研究[J].轻工学报,2020,35(4):8-15.
[23]张稳.β-甘露聚糖酶基因的克隆表达及分子改造[D].南京:南京农业大学,2016.
[24]SUN Z,LIU Q,QU G,et al.Utility of B-factors in protein science:interpreting rigidity,flexibility,and internal motion and engineering thermostability[J].Chem Rev,2019,119(3):1626-1665.
[25] LARSEN D M,NYFFENEGGER C,SWINIARSKA M M,et al.Thermostability enhancement of an endo-1,4-β-galactanase from Talaromyces stipitatus by site-directed mutagenesis[J].Appl Microbiol Biotechnol,2015,9(10):4245-4253.
[26]PARRA C R,JAGER C M,LAU P L,et al.Rational design of thermostable carbonic anhydrase mutants using molecular dynamics simulations[J].J Phys Chem B,2018,122(36):8526-8536.