目前,我国对病原真菌的防治主要是化学农药[1-2],但使用化学农药容易造成环境污染,所以需要寻找一种对环境安全且防治效果显著的替代品[3]。芽孢杆菌(Bacillus)生长过程中,能够合成脂肽类抗生素[4]、细菌素[5]和抑菌蛋白[6]等,其中,脂肽类抗生素主要有伊枯草菌素(iturin)[7]、芬芥素(fengycin)[8]和表面活性素(surfactin)[9]等,其对于常见的植物病原真菌具有良好的抑菌活性,可作为传统化学农药的替代品[10-11]。
iturins家族的化合物对许多具有致病性的酵母菌和霉菌有强烈抑制能力。Iturin A是一种β-氨基脂肪酸连成环的脂肽类抗生素,属于iturin家族,其具有抑制某些病原菌尖孢镰刀菌(Fusarium oxysporum sp.)[12]、炭疽病菌(Colletotrichum spp.)[13]和大丽轮枝菌(Verticillium dahliae)[14]等生长的特性,在生物防治上具有潜在的开发价值。陈华等[15]采用电喷雾电离-质谱(electrospray ionization mass spectrometry,ESI-MS)法鉴定枯草芽孢杆菌(Bacillus subtilis)JA产生的抗菌物质为脂肽类抗生素iturin A,其对植物病原菌具有抗性作用;刘京兰等[16-17]研究发现,一株解淀粉芽孢杆菌(Bacillus amyloliquefaciens)不仅对水稻纹枯病菌(Rhizoctonia solani)和链格孢菌(Alternaria alternata)具有强烈的抑制作用,还对小麦赤霉病和小麦白粉病等植物病害也具有防治作用,鉴定其产生的抗真菌活性物质主要也是iturin A。
iturin A及其同系物的发酵工艺控制难度大,制约着工业化生产和商业化应用[18],因此,高产菌株的选育和优良的培养基成分对iturin A产量的提高具有重大意义[19-20]。本研究首先以大丽轮枝菌V991为病原指示菌,采用平板对峙法初筛获得具有抗菌能力的菌株,然后通过高效液相色谱(high performance liquid chromatography,HPLC)法定量筛选获得iturin A高产菌株,并对其16S rDNA基因序列进行分析,鉴定其种属。最后对菌株产iturin A发酵培养基的成分和条件进行研究,为工业化发酵产iturin A、廉价发酵原料的利用和生防菌剂的开发提供理论基础。
1 材料和方法
1.1 材料与试剂
1.1.1 供试菌株
菌株Y1、Y2、Y3、Y4、Y6、Y7、SF5、ND:分离自石河子土壤中,保存于石河子大学生命科学412实验室;大丽轮枝菌(Verticillium dahliae)V991:石河子大学生命科学学院101实验室提供。
1.1.2 培养基
LB固体培养基:NaCl 10 g/L、酵母提取物5 g/L、胰蛋白胨10 g/L、琼脂18 g/L,pH 7.2~7.4,121 ℃高压蒸汽灭菌20 min。LB液体培养基中不添加琼脂。
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:将马铃薯200 g切块后煮沸20 min,滤液定容至1 L,添加葡萄糖20 g,琼脂18 g,121 ℃高压蒸汽灭菌20 min。PDA液体培养基中不添加琼脂。
初始Landy发酵培养基[21]:葡萄糖20 g/L、L-谷氨酸钠2 g/L、MgSO4·7H2O 0.5 g/L、KH2PO4 1.0 g/L、KCl 0.5 g/L,微量元素:FeSO4·7H2O 0.15 mg/L、MnSO4·H2O 5 mg/L、CuSO4·5H2O 0.16 mg/L,121 ℃高压蒸汽灭菌20 min。
1.1.3 化学试剂
iturin A标准品(分析纯):美国Sigma公司;葡萄糖(分析纯):天津市致远化学有限公司;甘油(分析纯):天津市北联精细化工有限公司;胰蛋白胨(生化试剂):赛默飞世尔科技(中国)有限公司;酵母浸粉(生化试剂):北京奥博星生物技术有限公司;液体样本甘油酶法测定试剂盒:北京普利莱基因技术有限公司。
1.2 仪器与设备
安捷伦1200高效液相色谱仪:安捷伦科技(中国)有限公司;ZHWY-111B恒温培养振荡器(摇床):上海智城分析仪器制造有限公司;SW-CJ-1F超净工作台:苏州净化设备有限公司;DNP-9052电热恒温培养箱:上海精宏实验设备有限公司;BWS-10恒温水槽与水浴锅:上海一恒科学仪器有限公司;XEVO TQ-S三重四级杆串联质谱仪、X3R高速冷冻离心机Fro Fle X聚合酶链式反应(polymerase chain reaction,PCR)仪:赛默飞世尔科技(中国)有限公司。
1.3 方法
1.3.1 拮抗菌株的初筛
指示菌的制备:将大丽轮枝菌V991接种于PDA液体培养基,28℃、200r/min条件下恒温振荡培养2 d,无菌纱布过滤除去病原菌菌丝,将滤液孢子浓度稀释至106~107CFU/mL,备用。
供试菌株的活化:将供试菌株Y1、Y2、Y3、Y4、Y6、Y7、SF5和ND接种于LB培养基平板,37 ℃活化16 h,备用。
抑菌活性的测定:取200 μL大丽轮枝菌V991孢子悬液均匀涂布于PDA培养基平板上,分别挑取单菌落接种于平板中,每板接种4株待测菌株。记录是否有抑菌圈的产生,并测定抑菌圈直径。
1.3.2 高产iturin A菌株的筛选
将初筛得到的拮抗菌株的单菌落分别接种于含有30mL的LB液体培养基中,在37 ℃、200 r/min条件下培养18 h制成种子液。按10%(V/V)的接种量将种子液转接至含有30 mL的初始Landy发酵培养基,在32 ℃、200 r/min条件下发酵4 d。取发酵液1 mL,加入3 mL无水甲醇,漩涡振荡10 min,10 000 r/min离心15 min后取上清[22],采用HPLC法测定发酵液中iturin A的含量[23],筛选高产iturin A的菌株。
1.3.3 高产iturin A菌株的鉴定
采用十六烷基三甲基溴化铵(hexadecyl trimethyl ammonium bromide,CTAB)法提取高产iturin A菌株的基因组总脱氧核糖核酸(deoxyribonucleic acid,DNA)[24],以其为模板,采用通用引物27F(5'-AGAGTTTGATCCTGGCTCAG-3')和1492R(5'-TACGGYTACCTTGTTACGACTT-3')对菌株的16S rDNA进行PCR扩增,PCR扩增体系:DNA模板1 μL,2×Taq PCR Master Mix 10 μL,引物27F(5 μmol/L)1 μL,1492R(5 μmol/L)1 μL,双蒸水(ddH2O)12 μL。PCR扩增条件:95 ℃预变性5 min;95 ℃变性30 s,55 ℃退火35 s,72 ℃延伸75 s,共30个循环;72 ℃再延伸10 min。PCR扩增产物经过1%琼脂糖凝胶电检测,委托生工生物工程(上海)股份有限公司进行测序,将测序结果提交至美国国家生物技术信息中心(national center of biotechnology information,NCBI)的GenBank数据库中,采用基本局部比对搜索工具(basic local alignment search tool,BLAST)进行同源性比对搜索,选取同源性较高的模式菌株的16S rDNA基因序列,使用MEGA6.0软件中的邻接(neighbor-joining,NJ)法构建系统发育树。
1.3.4 菌株产iturin A发酵工艺的研究
发酵培养基成分的优化:额外添加NaCl[25]和酵母浸粉[16]有可能会提升iturin A的产量,因此在初始Landy发酵培养基的基础上,依次考察碳源种类(葡萄糖、D-麦芽糖、可溶性淀粉、D-木糖、甘露醇、甘油和蔗糖)(添加量2%)、氮源种类(大豆蛋白胨、花生饼粉、生黄豆粉、豆粕粉、玉米蛋白粉和棉籽粉)(添加量8%)、碳源添加量(2%、3%、4%、5%、6%、7%、8%、9%)、氮源添加量(6%、8%、10%、12%、14%)、NaCl添加量(0、0.5%、1.0%、1.5%、2.0%)、酵母浸粉添加量(1.2%、1.4%、1.6%、1.8%、2.0%)、KCl添加量(0、0.05%、0.10%、0.15%、0.20%)及L-谷氨酸钠添加量(0、0.05%、0.10%、0.15%、0.20%)对菌株发酵产iturin A的影响。初始发酵条件为初始pH值6,32 ℃、200 r/min条件下发酵4 d。
发酵条件的优化:采用优化后的培养基,考察装液量(12%、16%、20%、24%)、初始pH值(6.0、7.0、8.0、9.0)、接种量(3%、5%、10%、15%)、培养温度(25 ℃、28 ℃、32 ℃、37 ℃、40 ℃)对菌株产iturin A的影响。
最佳发酵时间的确定:高产菌株在最适的培养基成分和培养条件下生产iturin A,每24 h取样检测发酵液中pH、iturin A含量和甘油残余量,确定最佳发酵时间。
1.3.5 数据处理
所有试验重复3次,结果以“平均值±标准差”表示,采用MicrosoftExcel2010、Origin2018进行数据处理、分析及绘图。
2 结果和分析
2.1 高产iturin A菌株的筛选
2.1.1 拮抗菌株的初筛
8株供试菌株对大丽轮枝菌V991的抑菌效果见图1,抑菌圈直径见表1。由图1及表1可知,6株供试菌株能产生抑菌圈,分别为菌株Y1、Y4、Y6、Y7、SF5和ND,抑菌圈直径分别为1.11 cm、1.09 cm、1.13 cm、1.19 cm、1.31 cm和1.23 cm。其中,菌株SF5的抑菌圈直径最大,其次是菌株ND。
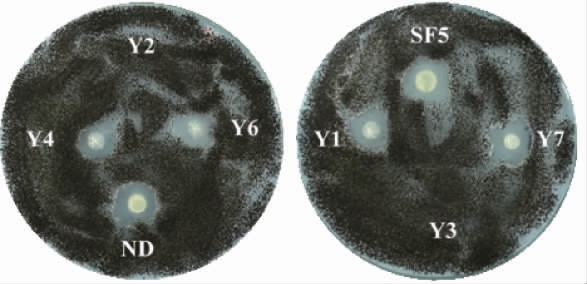
图1 8株供试菌株对大丽轮枝菌V991的抑制效果
Fig.1 Inhibitory effect of 8 tested strains on Verticillium dahliae V991
表1 8株供试菌株对大丽轮枝菌V991的抑菌圈直径
Table 1 Inhibition zone diameters of 8 tested strains against Verticillium dahliae V991
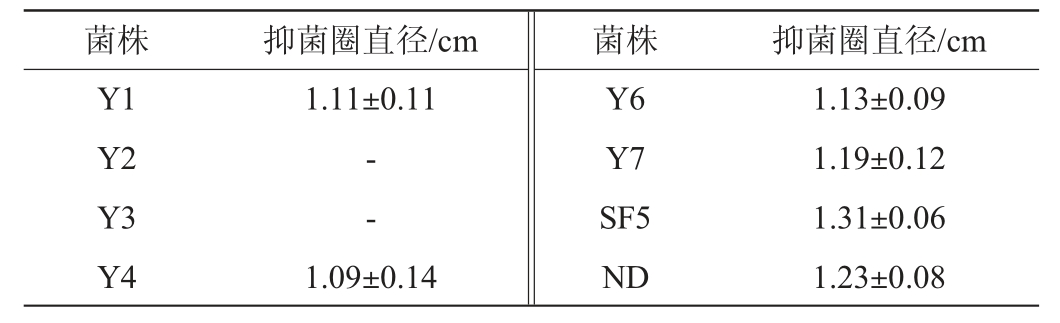
注:“-”表示无抑菌圈。
2.1.2 高产iturin A菌株的筛选
6株拮抗菌株的iturin A产量见图2。由图2可知,菌株Y1、Y4、Y6、Y7、SF5和ND的iturinA产量分别为0.22g/L、0.19g/L、0.25 g/L、0.32 g/L、0.03 g/L、0.35 g/L,其中菌株ND的iturin A产量最高,其次为菌株Y7。初筛中菌株SF5的抑菌圈直径最大,但iturin A产量最低,分析原因可能是菌株SF5中对大丽轮枝菌V991产生抑菌活性的是iturin家族中的其他脂肽类物质。因此,选取菌株ND作为高产iturin A的菌株。
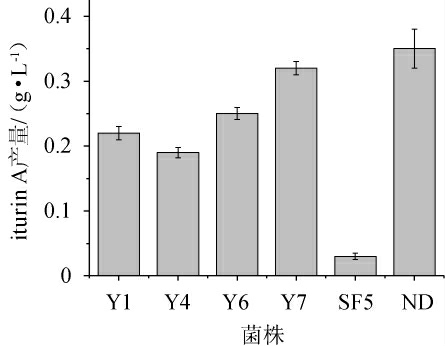
图2 高产iturin A菌株的筛选
Fig.2 Screening of high yield iturin A-producing strains
2.2 高产iturin A菌株ND的鉴定
基于16S rDNA基因序列菌株ND的系统发育树见图3。由图3可知,菌株ND与贝莱斯芽孢杆菌(Bacillus velezensis)聚于一支,亲缘关系最近,因此,鉴定该菌株为贝莱斯芽孢杆菌(Bacillus velezensis)。

图3 基于16S rDNA基因序列菌株ND的系统发育树
Fig.3 Phylogenetic tree of strain ND based on 16S rDNA gene sequence
2.3 菌株ND产iturin A发酵工艺研究
2.3.1 发酵培养基成分
碳、氮源种类对菌株ND产iturin A的影响见图4。由图4可知,甘油、豆粕粉分别作为碳、氮源时,iturin A的产量最高,分别为0.39 g/L、2.49 g/L。分析原因可能由于豆粕粉是迟效氮源,菌体利用豆粕作为氮源时,生长速率较低,有利于次级代谢产物iturin A的合成[26]。因此,选择甘油和豆粕粉作为贝莱斯芽孢杆菌ND产iturinA的最优碳、氮源。
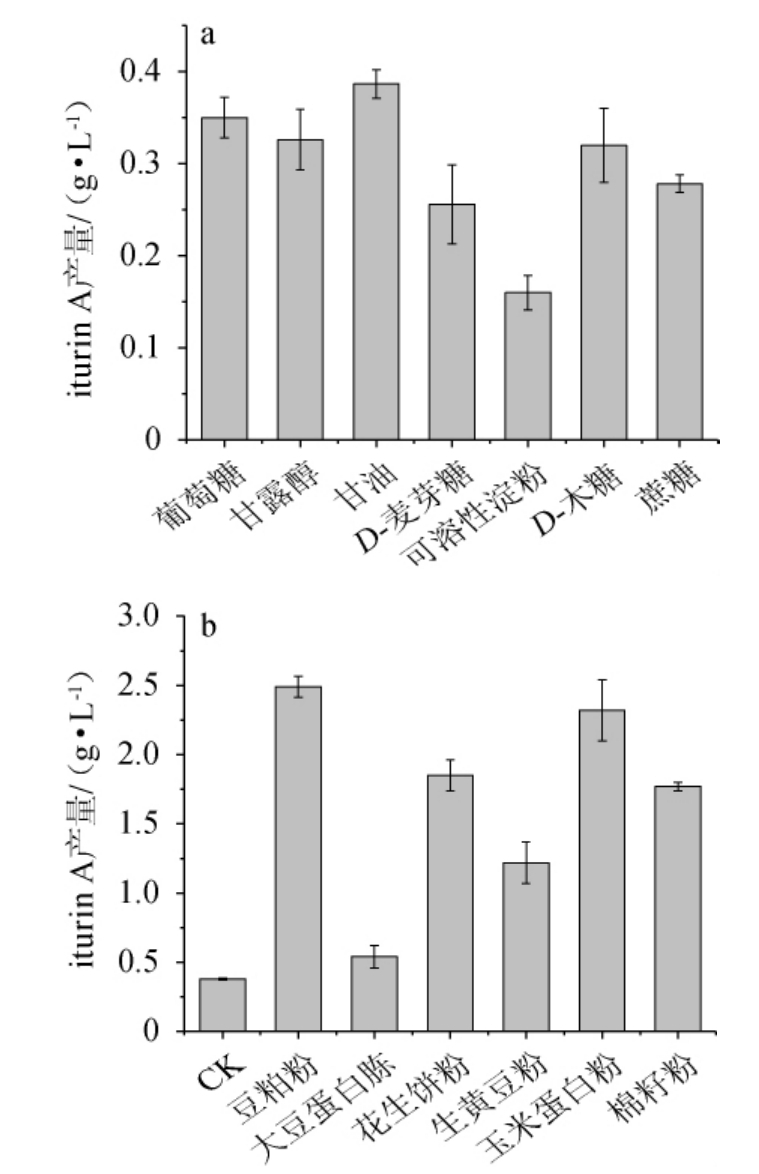
图4 碳源种类(a)和氮源种类(b)对菌株ND产iturin A的影响
Fig.4 Effects of types of carbon source (a) and nitrogen source (b)on iturin A produced by strain ND
甘油和豆粕粉添加量对菌株ND产iturin A的影响见图5。由图5可知,随着甘油添加量的升高,iturin A产量呈先降低后升高再降低的趋势,分析原因可能是当甘油添加量为2%~4%时,利于菌体的生长,营养成分用于菌体生长进而减少iturin A的合成[26];次级代谢是微生物以初级代谢产物为前体,合成一些无明确功能的物质,当甘油添加量增加至7%时,菌体初级代谢产物增加,导致后期菌体能够进行次级代谢,使iturin A产量达到最高,为2.71 g/L[27]。由图5亦可知,随着豆粕粉添加量的升高,iturin A产量呈先升高后下降的趋势,分析原因可能是高浓度豆粕粉导致培养基水分骤减,不利于氧气的传递,导致菌体的呼吸速率减慢,限制了iturin A产量的进一步提高[26]。当豆粕粉添加量为12%时,iturin A产量最高,为3.24 g/L。因此,确定甘油和豆粕粉的最优添加量分别为7%、12%。
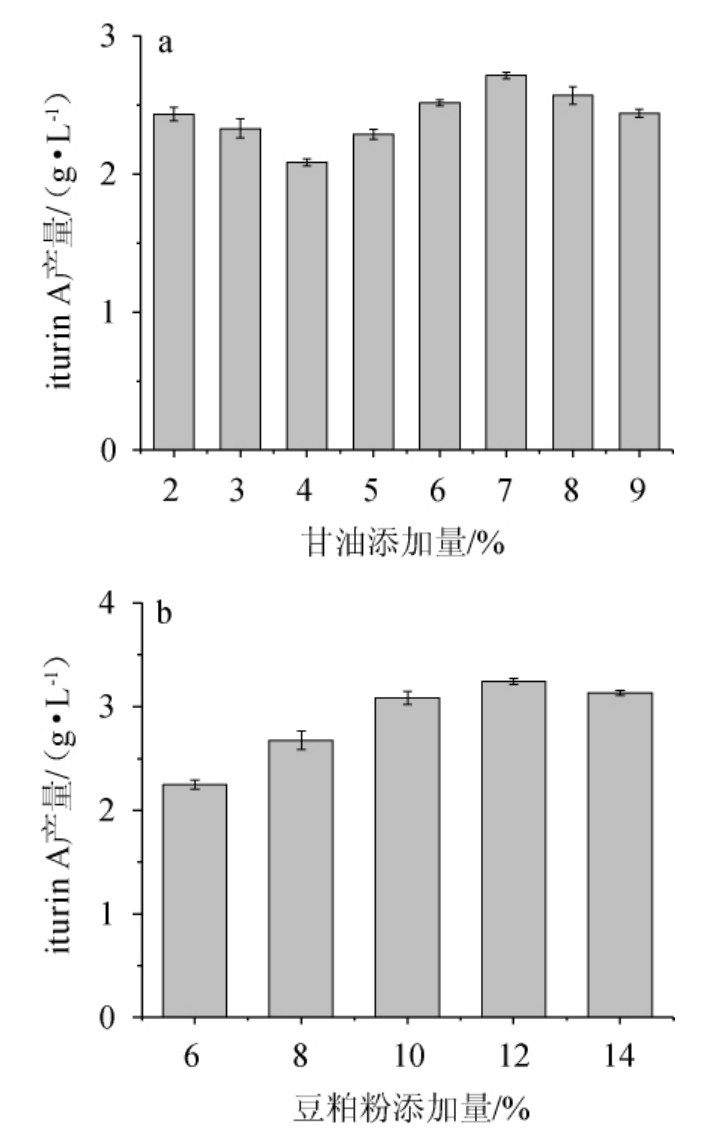
图5 甘油(a)和豆粕粉(b)添加量对菌株ND产iturin A的影响
Fig.5 Effects of glycerol (a) and soybean meal (b) addition on iturin A produced by strain ND
NaCl、酵母浸粉、KCl、L-谷氨酸钠添加量对菌株ND产iturin A的影响见图6。
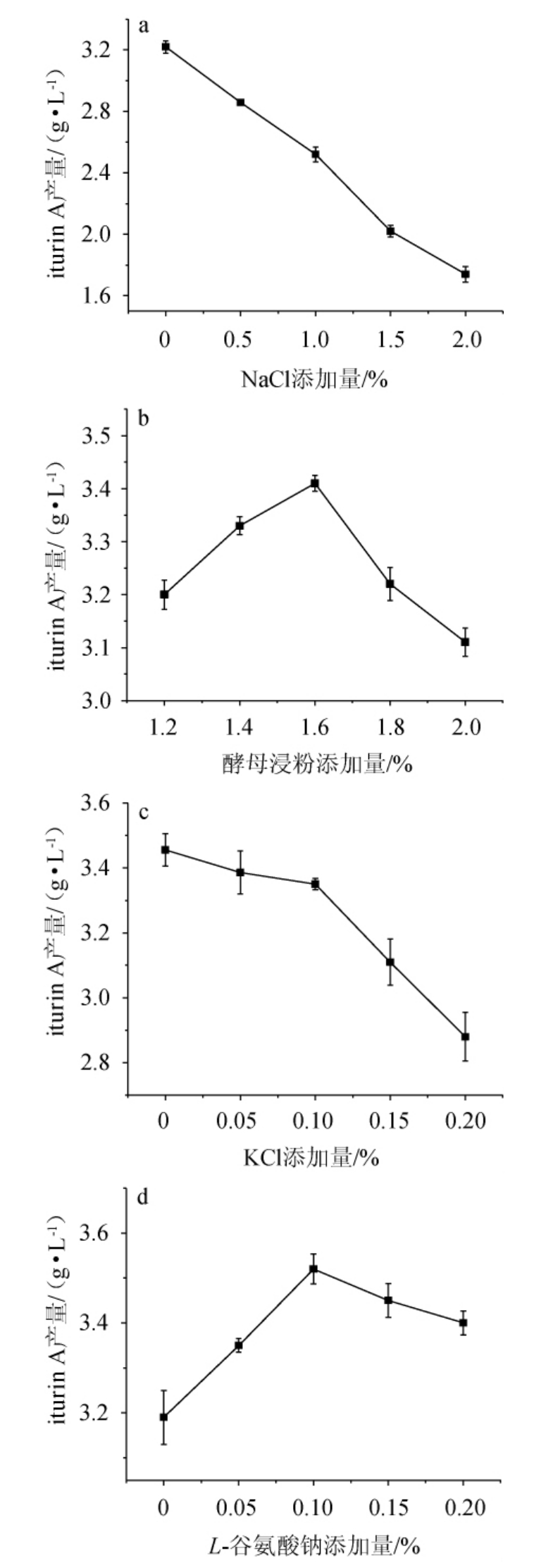
图6 NaCl(a)、酵母浸粉(b)、KCl(c)及L-谷氨酸钠(d)添加量对iturin A产量的影响
Fig.6 Effects of NaCl (a),yeast extract powder (b),KCl (c) and L-sodium glutamate (d) addition on the yield of iturin A
由图6可知,随着NaCl和KCl添加量的增加,iturin A产量分别从3.22 g/L、3.46 g/L下降至1.74 g/L、2.88 g/L。随着酵母浸粉和L-谷氨酸钠添加量的增加,iturinA产量均呈先升高后降低的趋势,当酵母浸粉和L-谷氨酸钠的添加量分别为1.6%和0.1%时,iturin A产量最高,分别为3.41 g/L和3.52 g/L。由于NaCl和KCl的抑制作用,在后续发酵过程不添加NaCl和KCl,并确定酵母浸粉和L-谷氨酸钠的最优添加量分别为1.6%、0.1%。
2.3.2 发酵条件的优化
装液量、初始pH、接种量、温度对菌株ND产iturin A的影响见图7。
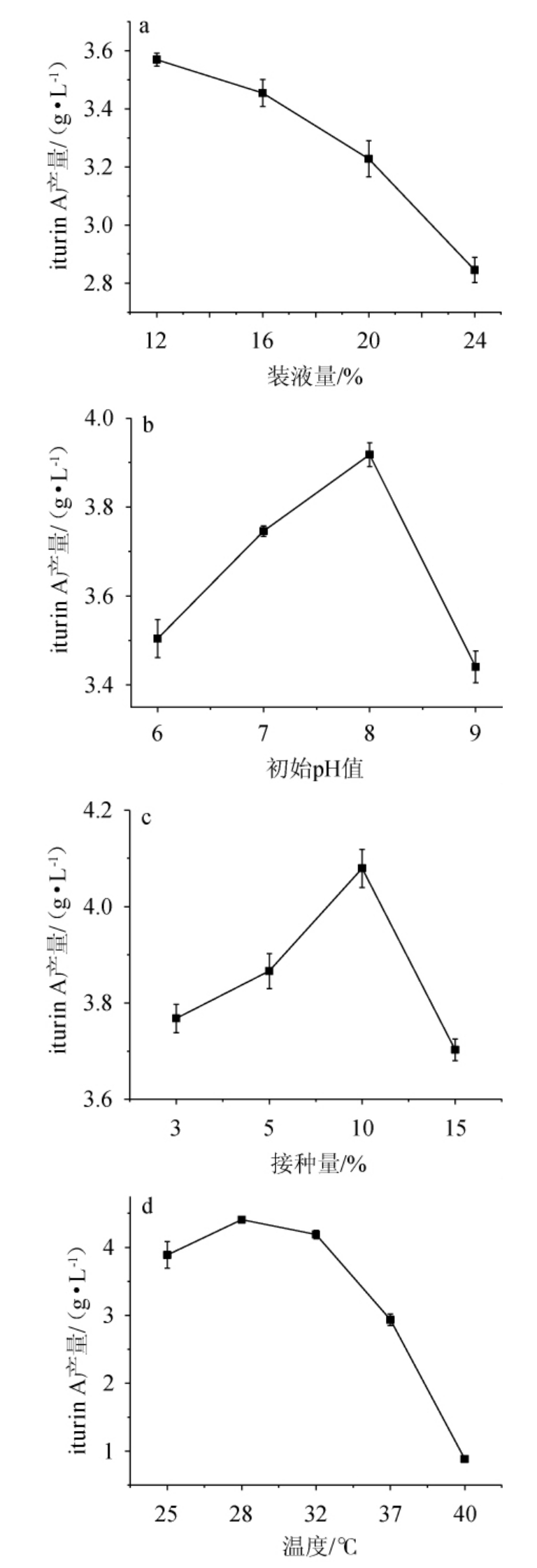
图7 装液量(a)、pH(b)、接种量(c)及温度(d)对iturin A产量的影响
Fig.7 Effects of liquid volume (a),pH (b),inoculum (c) and temperature (d) on iturin A yield
由图7可知,随着装液量的增加,iturin A产量逐渐下降,分析原因可能是培养基成分占比的增加,会导致溶氧速率下降,进而阻碍菌体的生长发育[28]。随着初始pH值的升高,iturin A产量呈先升高后下降的趋势,当初始pH值为8.0时,iturin A产量最高,为3.92 g/L,说明碱性环境利于iturin A的产生。随着接种量的升高,iturin A产量呈先升高后下降的趋势,当接种量为10%时,iturin A产量最高,达到4.08 g/L。随着培养温度的升高,iturin A产量呈先升高后下降的趋势,当培养温度为28 ℃时,iturin A产量最高,达到4.41 g/L,分析原因可能是随着温度升高,水分蒸发速度过快,培养基变得干燥,菌体无法生长存活[29]。因此,确定最优装液量、接种量、初始pH值、培养温度分别为12%、10%、8.0、28 ℃。
2.3.3 最佳发酵时间的确定
菌株ND发酵过程中,pH值、iturin A产量、甘油残余量的变化见图8。
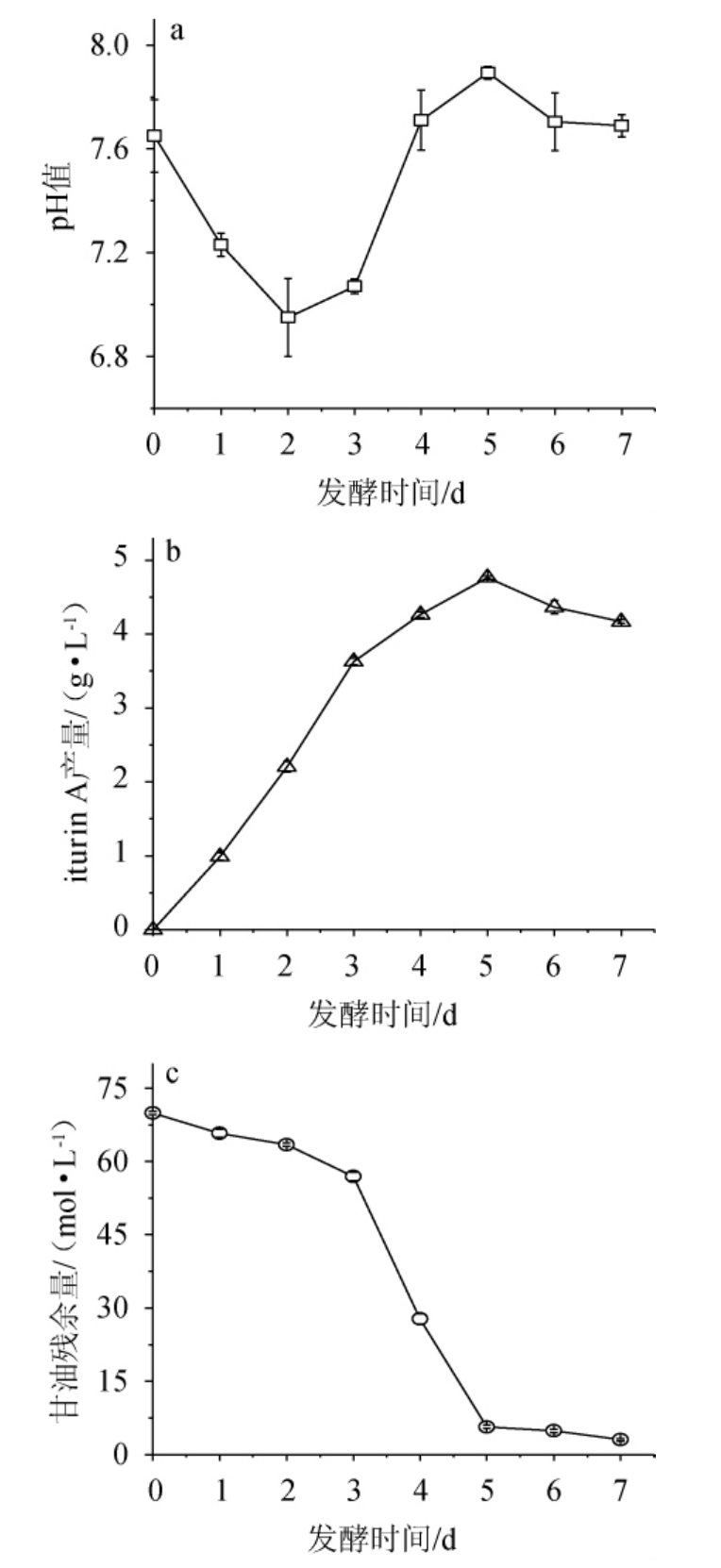
图8 pH(a)、iturin A产量(b)和甘油残余量(c)随发酵时间的变化
Fig.8 Changes of pH (a),iturin A yield (b) and glycerol residue content (c) with fermentation time
由图8可知,菌株ND发酵过程中,pH值呈先降低后升高的趋势,分析原因可能是由于发酵初期,细胞的生长和呼吸消耗了大量碳源产生有机酸,使得pH下降;当菌体生长到一定数量,有机酸的利用速率加快,pH升高[30]。iturin A产量呈先升高后下降的趋势,在第5天时,iturin A产量达到最大,为4.76 g/L,后期iturin A产量降低可能是由于营养成分不足,菌体利用菌体产生的次级代谢物质维持生命活动所致[16]。甘油残余量呈下降的趋势,在第3~5天时消耗程度最大,分析原因可能是在此阶段为了满足菌体的生长发育和次级代谢产物的形成导致了甘油的大量消耗[22]。因此,确定最佳发酵时间是5 d,在此条件下的iturin A产量居于较高的水平[31-36]。
3 结论
本研究采用平板对峙及高效液相色谱法筛选获得一株高产iturin A的菌株,编号为ND,经分子生物学技术鉴定其为贝莱斯芽孢杆菌(Bacillusvelezensis)。菌株ND产iturinA的最佳培养基成分为豆粕粉120 g/L、酵母浸粉16 g/L、L-谷氨酸钠1 g/L、甘油70 mL/L、MgSO4·7H2O 0.5 g/L、KH2PO4 1.0 g/L,其余微量元素不变(FeSO4·7H2O 0.15 mg/L、MnSO4·H2O 5 mg/L、CuSO4·5H2O 0.16 mg/L);最佳培养条件为装液量12%、初始pH值8、接种量10%、培养温度28 ℃、培养时间5 d。在最优条件下,菌株ND的iturin A产量为4.76 g/L,是优化前(0.35 g/L)的13.6倍。
[1]沙月霞,隋书婷,曾庆超,等.贝莱斯芽孢杆菌E69预防稻瘟病等多种真菌病害的潜力[J].中国农业科学,2019,52(11):1908-1917.
[2]王晓冬.油菜菌核病菌拮抗菌的筛选鉴定及其应用基础[D].杭州:浙江大学,2019.
[3]王炎峰.生防细菌与农药组合对苦瓜枯萎病的防治效果及机理研究[D].泰安:山东农业大学,2019.
[4]刘安,赵华,张朝正.贝莱斯芽孢杆菌抑菌物质的分析及提取优化[J].中国酿造,2019,38(12):63-68.
[5]BUTKHOT N,SOODSAWAENG P,NIMRAT S,et al.Characterisation and biosafety evaluation of a novel bacteriocin produced by Bacillus velezensis BUU004[J].Int Food Res J,2019,26(5):1617-1625.
[6]刘安,赵华,张朝正.贝莱斯芽孢杆菌抑菌物质的分析及提取优化[J].中国酿造,2019,38(12):63-68.
[7] KIM Y T,KIM S E,LEE W J,et al.Isolation and characterization of a high iturin yielding Bacillus velezensis UV mutant with improved antifungal activity[J].PLoS ONE,2020,15(12):e0234177.
[8]WANG B Q,LIU C,YANG X M,et al.Genomics-guided isolation and identification of active secondary metabolites of Bacillus velezensis BA-26[J].Biotechnol Biotec Eq,2021,35(1):895-904.
[9] PARK G,NAM J,KIM J,et al.Structure and mechanism of surfactin peptide from Bacillus velezensis antagonistic to fungi plant pathogens[J].B Korean Chem Soc,2019,40(7):704-709.
[10] CAO Y,PI H L,CHANDRANGSU P,et al.Antagonism of two plantgrowthpromotingBacillusvelezensis isolates against Ralstonia solanacearum and Fusarium oxysporum[J].Sci Rep,2018,8(1):43-60.
[11]吴李芳.西红花球茎腐烂病的致病菌鉴定及其生防菌解淀粉芽孢杆菌C612的筛选和应用[D].杭州:浙江大学,2019.
[12]王欢,贾田惠,杨可欣,等.枯草芽胞杆菌8-32对病原真菌的拮抗效应及对植物促生长机制[J].农业生物技术学报,2019,27(5):152-162.
[13]王雨,谭峥,韦丹丹,等.贝莱斯芽胞杆菌HN-2的鉴定及对杧果炭疽菌的抑菌活性研究[J].中国生物防治学报,2020,36(2):220-230.
[14]李晓林.防治棉花黄萎病生防菌的筛选及其一个新病原菌的发现[D].杭州:浙江大学,2019.
[15]陈华,袁成凌,蔡克周.枯草芽孢杆菌JA产生的脂肽类抗生素iturin A的纯化及电喷雾质谱鉴定[J].微生物学报,2008,48(1):116-120.
[16]刘京兰,薛雅蓉,刘常宏.内生解淀粉芽孢杆菌CC09产iturin A摇瓶发酵条件优化[J].微生物学通报,2014,41(1):75-82.
[17]杨洪凤,薛雅蓉,余向阳,等.内生解淀粉芽孢杆菌CC09菌株在小麦叶部的定殖能力及其防治白粉病效果研究[J].中国生物防治学报,2014,30(4):481-488.
[18]金虎,李坤朋,黄凤洪,等.振荡和静态组合式培养改善伊枯草菌素A表达水平[J].食品安全质量检测学报,2015(10):4019-4024.
[19]张国漪,程林,黄立莹,等.菌根真菌协同死谷芽孢杆菌抑制棉花黄萎病[J].浙江农业学报,2018,30(6):8.
[20]孟兆丽.枯草芽孢杆菌HS-A38高产抗菌肽突变株筛选及抑菌机理的研究[D].大连:大连工业大学,2019.
[21]孙力军,陆兆新,别小妹,等.培养基对解淀粉芽孢杆菌ES-2菌株产抗菌脂肽的影响[J].中国农业科学,2008(10):3389-3398.
[22]金虎.基于菜粕氮源的脂肽伊枯草菌素A高效发酵过程调控研究[D].北京:中国农业科学院,2015.
[23]陈莉.Bacillus atrophaeus B44产生iturin A及其对棉苗立枯病的防病促生作用[D].石河子:石河子大学,2015.
[24]李哲.芽孢杆菌促生作用及具有促生作用的挥发物质研究[D].南京:南京农业大学,2013.
[25]赵鹏鹏,雷淑珍,徐晓光,等.培养基组成对贝莱斯芽孢杆菌产抑真菌成分的影响[J].食品与发酵工业,2020,46(5):151-155.
[26]姚德惠.伊枯草菌素A高产菌株的选育及其发酵工艺研究[D].武汉:华中农业大学,2011.
[27]DEMAIN M,钦葆纯.抗生素生物合成控制[J].国外药学(抗生素分册),1981(3):27-38.
[28]林忠,罗众球,窦洁,等.菌体比生长速率及不同培养基成分变化对解脂假丝酵母中RNA累积的影响[J].中国药科大学学报,2011(2):169-175.
[29]乔俊卿,刘邮洲,张荣胜,等.枯草芽胞杆菌T-500产脂肽类抗生素的摇瓶发酵工艺优化[J].南京农业大学学报,2018,41(3):65-73.
[30]翟亚楠,郭昊,魏浩,等.芽孢杆菌(Bacillus sp.)脂肽抗生素发酵工艺及分离纯化[J].中国生物工程杂志,2011,31(11):114-122.
[31] MIZUMOTO S,HIRAI M,SHODA M.Production of lipopeptide antibiotic iturin A using soybean curd residue cultivated with Bacillus subtilis in solid-state fermentation[J].Appl Microbiol Biot,2006,72(5):869-875.
[32]付茂红,钟娟,谭忠元,等.改进型人工神经网络优化Iturin A发酵培养基研究[J].广东农业科学,2015(17):102-107.
[33]杨代凯,陈守文,黎煊.解淀粉芽孢杆菌ZM9液体发酵伊枯草菌素A培养基优化[J].应用化工,2015(3):428-430.
[34] KUMAR P N,SWAPNA T H,KHAN M Y,et al.Statistical optimization of antifungal iturin A production from Bacillus amyloliquefaciens RHNK22 using agro-industrial wastes[J].Saudi J Biol Sci,2017,24(7):1722-1740.
[35]CHEN W C,LI X,MA X L,et al.Simultaneous hydrolysis with lipase and fermentation of rapeseed cake for iturin A production by Bacillus amyloliquefaciens CX-20[J].BMC Biotechnol,2019,19(1):1-10.
[36] YUE H,ZHONG J,LI Z M,et al.Optimization of iturin A production from Bacillus subtilis ZK-H2 in submerge fermentation by response surface methodology[J].3 Biotech,2021,11(2):1-11.