对于中国名优白酒而言,大曲不仅起到提供原料供给、糖化发酵的作用,其所含大量风味物质会直接或间接地进入到酒体中,对白酒的香型、风味品格具有重要的影响[1-3]。大曲的风味香气特性主要受到制曲原料、工艺条件和微生物群系的影响。近年来,越来越多的研究者将目光聚焦在酱香型白酒酿造过程所使用的高温大曲,对酱香型白酒高温大曲的微生物组成、风味组成进行研究[4-7],明确了高温大曲中部分菌株对基酒风味的贡献,如发现了芽孢杆菌(Bacillus)主要代谢具有烘焙香的吡嗪类物质[8],以及拟青霉(Paecilomyces)主要代谢具有花香的苯乙醇物质等[9]。
库德里阿兹威氏毕赤酵母(Pichia kudriavzevii)是白酒酿造过程重要的酵母菌,通过ITS扩增子测序技术表明P.kudriavzevii是酱香型白酒发酵微生物群落中的核心酵母[10],具有良好的耐受性,能够在极端环境下快速生长[11]。同时,P.kudriavzevii可代谢产生多种重要风味物质,产酯种类多,能力强[12],对酱香型白酒风味代谢产物形成有重要作用[13-15]。有研究表明,酱香型白酒高温大曲在前期发酵过程中存在大量的酵母菌,主要包括毕赤酵母属(Pichia)、假丝酵母属(Candida)和酿酒酵母属(Saccharomyces)等,但随着发酵温度的升高,发酵后期酵母菌数量急剧减少[16],其中,P.kudriavzevii是高温大曲中除霉菌外相对占比较高的酵母菌[17],关于该过程中酵母菌的生长代谢对大曲风味品质的影响的研究还较少。
小麦作为酱香型白酒高温大曲酿造的唯一原料[18],其品种对大曲风味的调控和作用并不明确。为探索酱香型白酒制曲原料对风味的调控作用,本研究拟选取了制曲生产常用的不同品种小麦为原料,接入大曲中的优势酵母菌之一—P.kudriavzevii进行纯种发酵,初步研究小麦品种对酵母风味代谢特征的影响,同时,对不同品种小麦中游离氨基酸与酵母代谢的挥发性风味物质进行典型关联分析(canonical correlation analysis,CCA),考察不同品种小麦中游离氨基酸的差异对发酵风味的影响,为筛选获得更适合生产酱香型白酒高温大曲的小麦品种提供一定参考借鉴意义。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与原料
库德里阿兹威氏毕赤酵母(Pichia kudriavzevii)MT-Y01:分离于贵州茅台酒酿造过程,保藏于中国工业微生物菌种保藏管理中心(China center of industrial culture collection,CICC);小麦:取自不同省份,共8种不同品种,分别为豫麦18(M1)、百农201(M2)、淮麦32(M3)、天民198(M4)、郑麦1769(M5)、鄂麦596(M6)、郑麦1354(M7)和徐麦35(M8)。
1.1.2 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基:葡萄糖20 g/L,蛋白胨20 g/L,酵母浸粉10 g/L,pH自然。固体培养基中添加琼脂20 g/L,115 ℃高压蒸汽灭菌15~20 min。
小麦发酵培养基[19]:取15 g粉碎后的小麦于250 mL三角瓶中,加入100 mL无菌水,121 ℃高压蒸汽灭菌15 min。
1.1.3 主要试剂
葡萄糖、蛋白胨、酵母浸粉、琼脂(均为分析纯或生化试剂):国药集团化学试剂有限公司;氨基酸化合物标准品、香茅醇(均为分析纯):美国Sigma Aldrich公司;磺基水杨酸(分析纯):中国BBI生命科学公司;Ultra Physiological FluidChenicalKit:英国Biochrmo公司;糖化酶(10万U/mL):上海源叶生物科技有限公司。
1.2 仪器与设备
7890A-5975C气相色谱质谱联用(gas chromatographymass spectrometer,GC-MS)仪:美国Agilent公司;Biochrom 30+氨基酸分析仪:英国Biochrom公司;MIKRO 220R台式高速冷冻离心机:德国Hettich公司。
1.3 方法
1.3.1 小麦基本理化性质的测定
蛋白质含量的测定[20]:参照GB/T 5511—2008《谷物和豆类氮含量测定和粗蛋白质含量计算凯氏法》。
硬度的测定[21]:参照GB/T 21304—2007《小麦硬度测定硬度指数法》。
总淀粉及支链淀粉含量的测定:取烘干的小麦籽粒用实验室粉碎机打成粉末状态,参照文献[22]的方法。
1.3.2 小麦游离氨基酸的测定采用茚三酮衍生法对小麦游离氨基酸进行测定,具体方法见参考文献[23]。
1.3.3 发酵实验
种子液的制备:将库德里阿兹威氏毕赤酵母(Pichia kudriavzevii)MT-Y01划线于YPD固体培养基,30 ℃条件下培养2 d,然后利用接种环挑选平板上的单菌落接种于装液量为50 mL/250 mL的YPD液体培养基中,30 ℃、180 r/min条件下培养12 h。
小麦发酵实验:在小麦发酵培养基中加入0.5 mL无菌糖化酶,然后将P.kudriavzevii MT-Y01种子液接种于小麦发酵培养基中,接种后液体培养基中初始细胞浓度为106 CFU/mL,30 ℃、180 r/min发酵3 d,发酵结束后测定挥发性风味物质含量。
1.3.4 挥发性风味物质的测定[12]
样品前处理:发酵结束后,将发酵液8 000 r/min离心10 min,取上清液10 mL装于顶空进样瓶中,加入10 μL内标(香茅醇),香茅醇在体系中的终质量浓度为1.021 mg/L,最后加入3 g氯化钠。通过顶空固相微萃取技术(headspace solid phase microextraction,HS-SPME)进行萃取,再利用气相色谱质谱联用仪进行检测。
气相色谱条件:柱温初始温度为60 ℃,以6 ℃/min的升温速率升至230 ℃,停留15 min;柱流量1.6 mL/min,采用恒压模式;进样口温度230 ℃。
质谱条件:电子电离(electron ionization,EI)源,电子能量70 eV;四极杆温度150 ℃;离子源温度230 ℃;采用全扫描模式,质量扫描范围35~550amu;溶剂延迟时间5 min。
定性定量方法:将未知物质图谱与美国国家标准技术研究所(national institute of standards and technology,NIST)08a.L Database中的标准图谱进行比对,进行定性分析。采用内标法定量。
1.3.5 数据处理
试验平行重复3次,结果以“平均值±标准差”表示。对挥发性风味物质含量进行归一化处理,然后利用R语言的pheatmap程序包绘制热图并进行聚类分析;利用Vegan程序包进行氨基酸与风味的CCA[24]。
2 结果与分析
2.1 不同品种小麦基本理化性质的分析
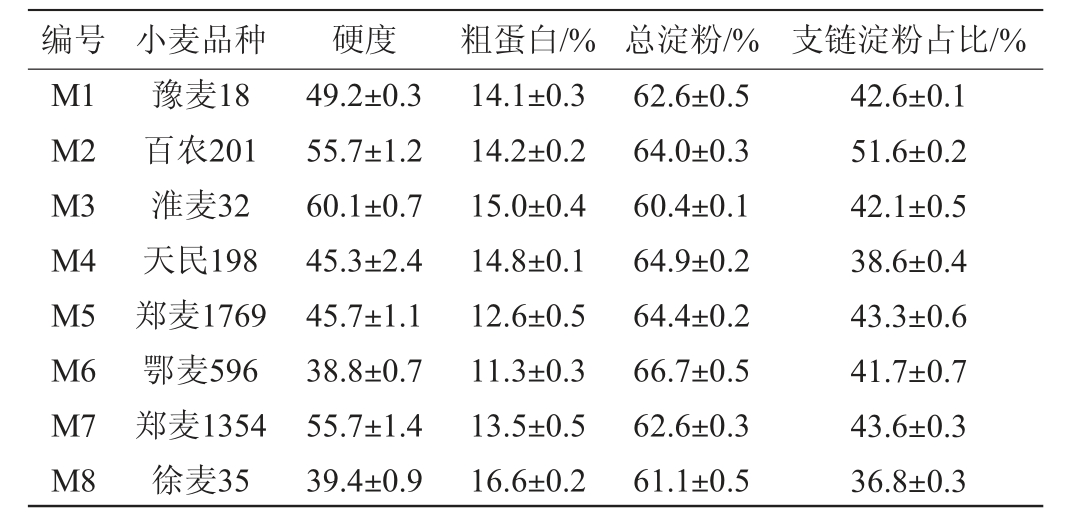
8种小麦的基本理化性质见表1。由表1可知,各品种小麦硬度存在较大差异,根据小麦硬度指数分类标准[25],鄂麦596和徐麦35为软质麦,淮麦32为硬质麦,其余小麦均为混合麦。各品种小麦的粗蛋白、淀粉含量存在差异,其中鄂麦596(M6)和郑麦1769(M5)的粗蛋白含量低,分别为11.3%和12.6%;徐麦35(M8)粗蛋白含量最高,达到16.6%。各品种小麦的总淀粉含量在60%~67%,其中鄂麦596(M6)的总淀粉含量最高(66.7%),淮麦32(M3)的总淀粉含量最低(60.4%)。不同品种小麦支链淀粉占比(36.8%~51.6%)的差异较大,徐麦35支链淀粉占比最低为36.8%。以上结果表明,8种小麦的基本理化特性存在一定的差异。研究表明,小麦硬度、粗蛋白、硬度等理化指标与其所制大曲质量相关[26-28],因此,推测不同品种小麦理化特性可能对P.kudriavzevii MT-Y01的发酵特性产生影响。
表1 不同小麦品种基本理化指标的测定结果
Table 1 Determination results of basic physical and chemical indexes of different wheat varieties
2.2 不同品种小麦游离氨基酸的分析
不同品种小麦中游离氨基酸的组成及含量见表2。
表2 不同品种小麦游离氨基酸的测定结果
Table 2 Determination results of free amino acids in different wheat varieties

注:天冬氨酸(aspartic acid,Asp);苏氨酸(threonine,Thr);丝氨酸(serine,Ser);天冬酰胺(asparagine,Asn);谷氨酸(glutamic acid,Glu);甘氨酸(glycine,Gly);丙氨酸(alanine,Ala);缬氨酸(valine,Val);半胱氨酸(cysteine,Cys);蛋氨酸(methionine,Met);异亮氨酸(isoleucine,Ile);亮氨酸(leucine,Leu);酪氨酸(tyrosine,Tyr);苯丙氨酸(phenylalanine,Phe);鸟氨酸(ornithine,Orn);赖氨酸(lysine,Lys);组氨酸(histidine,His);精氨酸(arginine,Arg);脯氨酸(proline,Pro)。下同。
由表2可知,从8种小麦中均检测到19种氨基酸,不同品种小麦的氨基酸组成结构较为相似,与吴琴燕等[29]的研究结果一致。但8种小麦在氨基酸的含量上存在一定的差异,其中郑麦1769(M5)、豫麦18(M1)、徐麦35(M8)和郑麦1354(M7)的游离氨基酸含量明显高于其他品种小麦,分别为2 763.9 μg/g、2 298.6 μg/g、2 288.5 μg/g和2 194.1 μg/g,小麦游离氨基酸含量的升高可能增加发酵环境中的游离氨基酸水平。不同品种小麦丝氨酸、天冬酰胺、半胱氨酸、蛋氨酸等氨基酸存在较大差异。丝氨酸、天冬酰胺、蛋氨酸等氨基酸在毕赤酵母发酵过程中能有效积累,酵母菌在氨基酸代谢中展现出特征代谢物、代谢强度的差异[30],这些差异很可能与最终风味物质的差异存在一定的联系。
2.3 发酵小麦挥发性风味物质的分析
8种小麦分别经P.kudriavzevii MT-Y01有氧发酵后,测定挥发性风味物质,结果见图1。由图1可知,不同品种小麦对P.kudriavzevii MT-Y01的代谢特性影响较大。从总风味物质含量上看,发酵后的鄂麦596(M6)中挥发性风味物质总含量最高,为568.5 mg/L;发酵后的天民198(M4)和郑麦1769(M5)中挥发性风味物质总含量较低,分别为127.2 mg/L和96.8 mg/L;其他5种小麦发酵后挥发性风味物质含量在209.8~348.5 mg/L范围内。从代谢物质类型上看,以小麦为基质,P.kudriavzevii的主要代谢产物为高级醇和酯类物质,占总挥发性风味物质含量的80%以上。
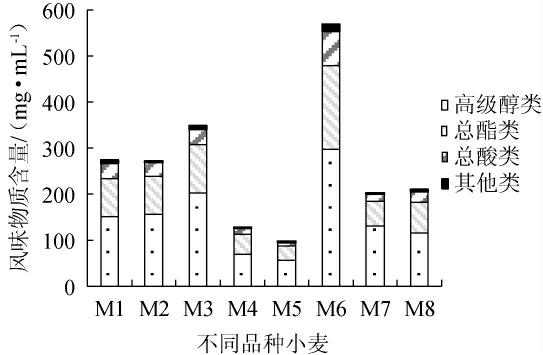
图1 库德里阿兹威氏毕赤酵母MT-Y01以不同品种小麦为基质发酵产生的挥发性风味物质种类及总含量
Fig.1 Types and total contents of volatile flavor compounds produced by Pichia kudriavzevii MT-Y01 fermented with different wheat varieties
进一步分析各品种小麦对P.kudriavzevii MT-Y01代谢不同风味物质的影响,结果见图2。由图2可知,P.kudriavzevii MT-Y01在这8种小麦为基质条件下主要代谢31种挥发性风味物质,这些物质都是酱香型白酒中重要的风味化合物,包括3种醇类、7种酸类、9种酯类和12种其他类风味物质。从不同风味物质种类及含量上看,利用不同品种小麦为基质,P.kudriavzevii MT-Y01的代谢产物有较大差异:以鄂麦596(M6)为基质时,各代谢产物含量均较高,与其他品种小麦的代谢特点有显著不同;以天民198(M4)和郑麦1769(M5)为基质时,各代谢产物含量均较低;以百农201(M2)为基质时,P.kudriavzevii MT-Y01代谢产生的3-甲硫基丙醇含量最高,为0.39 mg/L;以淮麦32(M3)为基质时,P.kudriavzevii MT-Y01代谢产生的己酸乙酯含量最高,为0.45 mg/L;以徐麦35(M8)为基质时,P.kudriavzevii MT-Y01代谢产生的苯甲醛含量最高,为1.51 mg/L。结果表明,不同小麦基质影响P.kudriavzevii代谢挥发性风味物质的特性。
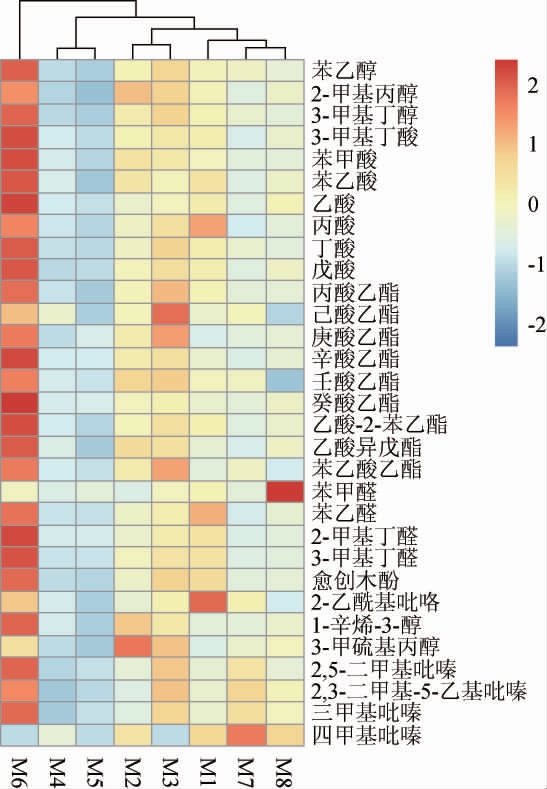
图2 库德里阿兹威氏毕赤酵母MT-Y01以不同品种小麦为基质发酵产生的挥发性风味物质的热图
Fig.2 Heat map of volatile flavor compounds produced by Pichia kudriavzevii MT-Y01 fermented with different wheat varieties
样品中的风味物质含量经标准化后的对比,颜色越趋向于红色表明其检出含量越高,趋向于蓝色则越低。
2.4 小麦氨基酸与酵母代谢产生的挥发性风味物质的典型关联分析
营养底物对酵母的代谢有重要的影响,发酵过程中,氨基酸为酵母生长代谢提供营养成分,参与胞内氨基酸和蛋白质的生物合成,以及为副产物代谢提供前体物质[31]。不同种类的氨基酸参与不同的风味代谢途径,因此小麦中氨基酸的种类组成及含量对酵母发酵性能和风味形成有着显著影响[32-34]。将小麦中的氨基酸与酵母MT-Y01代谢产生的挥发性风味物质进行典型关联分析,考察不同小麦品种氨基酸的差异对发酵风味的影响,结果见图3。
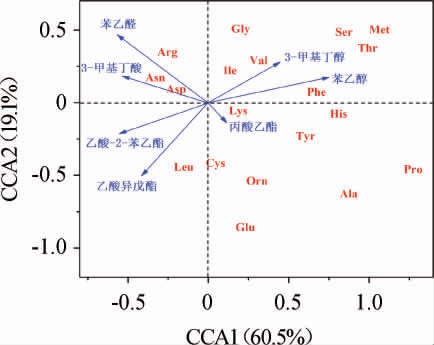
图3 小麦游离氨基酸与酵母代谢风味物质的典型关联分析结果
Fig.3 Results of canonical correlation analysis between free amino acids in wheat and flavor substances metabolized by Pichia kudriavzevii MT-Y01
由图3可知,3-甲基丁醇、苯乙醇、3-甲基丁酸、苯乙醛、丙酸乙酯、乙酸异戊酯、乙酸-2-苯乙酯这7种挥发性风味物质与19种氨基酸关联性强,其中3-甲基丁醇与缬氨酸相关性强,苯乙醇与苯丙氨酸相关性强,表明高级醇(3-甲基丁醇、苯乙醇)的合成受到其对应氨基酸的影响大,推测主要是因为高级醇通过氨基酸分解代谢(Ehrlich途径)形成[35-36]。3-甲基丁酸受天冬氨酸和天冬酰胺影响大,在研究葡萄酒风味物质与氨基酸关系中曾发现,葡萄酒中的3-甲基丁酸与葡萄汁中天冬氨酸、蛋氨酸成正相关,与组氨酸成负相关,与本研究结果较为一致[37]。苯乙醛受精氨酸影响大,丙酸乙酯、乙酸异戊酯、乙酸-2-苯乙酯与酸类、醇类呈负相关关系,受亮氨酸、半胱氨酸和赖氨酸影响大。在发酵过程中,酯类物质是在酵母细胞内由酰基辅酶A及脂肪酸和醇类在相关酶的催化作用下生成的,主要分为乙酸酯和乙基酯两类[38-39]。酵母对酯类物质的合成主要受到基质中氨基酸种类和含量的影响[36],相关研究表明,提高基质中氨基酸浓度有利于酯类物质的合成[40]。
3 结论
本研究初步分析了不同小麦品种对P.kudriavzevii MT-Y01风味代谢特性的影响。结果表明,8种小麦的基本理化指标存在一定的差异,游离氨基酸组成相似,但含量存在较大差异。P.kudriavzevii MT-Y01以小麦为基质时代谢产生的挥发性风味物质主要为高级醇和酯类物质,占总风味物质含量的80%以上。但小麦品种不同,其代谢产生的挥发性风味物质的含量和种类有较大差异,酵母MT-Y01以小麦品种鄂麦596为基质时,代谢产生的挥发性风味物质总含量最高,为568.5 mg/L;以小麦品种天民198和郑麦1769为基质时,代谢产生的挥发性风味物质总含量较低,分别为127.2 mg/L和96.8 mg/L;以百农201(M2)为基质时,代谢产生的3-甲硫基丙醇含量最高;以淮麦32(M3)为基质时,代谢产生的己酸乙酯含量最高;以徐麦35(M8)为基质时,代谢产生的苯甲醛含量最高。同时,对不同品种小麦中游离氨基酸与酵母代谢的挥发性风味物质进行了关联分析,发现不同种类的氨基酸参与不同的风味代谢途径,对酵母代谢风味形成有着显著影响。其中,3-甲基丁醇与缬氨酸相关性强,苯乙醇与苯丙氨酸相关性强,3-甲基丁酸与天冬氨酸和天冬酰胺相关性强,苯乙醛受精氨酸影响大,丙酸乙酯、乙酸异戊酯、乙酸-2-苯乙酯与酸类、醇类呈负相关关系,受亮氨酸、半胱氨酸和赖氨酸影响大,说明小麦品种氨基酸的差异将影响大曲发酵过程风味物质的形成,并可能进一步影响白酒的风味品质。本研究对于筛选合适的小麦品种进行大曲生产具有一定的借鉴意义。
[1]HE G Q,HUANG J,ZHOU R Q,et al.Effect of fortified Daqu on the microbial community and flavor in Chinese strong-flavor liquor brewing process[J].Front Microbiol,2019,10:56.
[2]JIN G Y,ZHU Y,XU Y.Mystery behind Chinese liquor fermentation[J].Trends Food Sci Technol,2017,63:18-28.
[3]李豆南,黄魏,王晓丹,等.酱香型大曲中高温放线菌的筛选及风味成分分析[J].食品科学,2018,39(6):171-176.
[4]JIN Y,LI D Y,AI M,et al.Correlation between volatile profiles and microbial communities:A metabonomic approach to study Jiang-flavor liquor Daqu[J].Food Res Int,2019,121:422-432.
[5]WANG P,WU Q,JIANG X J,et al.Bacillus licheniformis affects the microbial community and metabolic profile in the spontaneous fermentation of Daqu starter for Chinese liquor making[J].Int J Food Microbiol,2017,250:59-67.
[6]YI Z L,JIN Y L,XIAO Y,et al.Unraveling the contribution of high temperature stage to Jiang-flavor Daqu,a liquor starter for production of Chinese Jiang-flavor Baijiu,with special reference to metatranscriptomics[J].Front Microbiol,2019,10:472.
[7] ZHANG R,WU Q,XU Y.Aroma characteristics of Moutai-flavour liquor produced with Bacillus licheniformis by solid-state fermentation[J].Lett Appl Microbiol,2013,57(1):11-18.
[8]MENG X,WU Q,WANG L,et al.Improving flavor metabolism of Saccharomyces cerevisiae by mixed culture with Bacillus licheniformis for Chinese Maotai-flavor liquor making[J].J Ind Microbiol Biotechnol,2015,42(12):1601-1608.
[9]王和玉,刘延峰,张巧玲,等.一株来源于茅台酒酿造过程宛氏拟青霉MTDF-01的全基因组测序及分析[J].食品科学,2019,40(24):185-192.
[10]宋哲玮,杜海,聂尧,等.酱香型白酒发酵过程中核心酵母的鉴别及其功能[J].微生物学通报,2020,47(11):19-29.
[11]王晓丹,庞博,陆安谋,等.酱香型白酒堆积过程中酵母变化趋势研究[J].食品工业,2014,35(12):42-44.
[12]王莉,陈良强,杨帆,等.酱香型白酒耐乳酸酵母的筛选及特性研究[J].中国酿造,2018,37(12):28-32.
[13] DENG N,DU H,XU Y.Cooperative response of Pichia kudriavzevii and Saccharomyces cerevisiae to lactic acid stress in Baijiu fermentation[J].J Agr Food Chem,2020,68(17):4903-4911.
[14]贾丽艳,张丽,李惠源,等.果香风味导向的库德毕赤酵母FJZ的分离鉴定及生物学特性研究[J].中国食品学报,2021,21(1):276-282.
[15] WANG C L,SHI D J,GONG G L.Microorganisms in Daqu:a starter culture of Chinese Maotai-flavor liquor[J].World J Microbiol Biotechnol,2008,24(10):2183-2190.
[16]WANG M Y,YANG J G,ZHAO Q S,et al.Research progress on flavor compounds and microorganisms of Maotai flavor Baijiu[J].J Food Sci,2019,84(1):6-18.
[17]李静心,王艳丽,何宏魁,等.基于高通量测序技术解析高温大曲和中高温大曲的真菌群落结构[J].食品与发酵工业,2018,44(12):52-59.
[18]黄瑜,杨帆,李江华,等.小麦原料微生物组成对高温大曲风味的影响[J].食品与发酵工业,2021,47(20):22-29.
[19]王和玉,杨帆,林琳,等.地衣芽孢杆菌固态发酵代谢产物分析[J].酿酒科技,2011(9):32-34.
[20]宋晓燕,张艳,艾志录.小麦粉理化性质与发酵面团的褐变关系[J].食品与发酵工业,2017,43(2):73-78.
[21]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T21304—2007小麦硬度测定硬度指数法[S].北京:中国标准出版社,2007.
[22]赵永亮.一种同时测定小麦种子中直链淀粉、总淀粉含量的新方法——微量分光光度法[J].食品与发酵工业,2005,31(8):23-26.
[23]张巧玲,吕锡斌,秦兴,等.酱香型白酒高温大曲游离氨基酸比较分析[J].中国酿造,2019,38(4):53-57.
[24]RTEAM R,TEAM R D C,TEAM R,et al.R:a language and environment for statistical computing[J].Computing,2014,14:12-21.
[25]吴存荣,唐道五,虞泓,等.小麦硬度指数测定技术研究现状及应用前景[J].河南工业大学学报(自然科学版),2008(2):78-81.
[26]董永梅,吴海敏.小麦品种对大曲质量影响的初探[J].中小企业管理与科技(下旬刊),2012(10):317-318.
[27]刘淼,丁丽,赵梦梦,等.基于主成分分析的不同小麦品种大曲发酵动态品质评价[J].食品与发酵工业,2020,46(6):19-24.
[28]赵晓芳,尹大宽,袁豪,等.四川小麦新品种(系)的制曲品质性状评价[J].云南农业大学学报(自然科学),2018,33(3):390-396.
[29]吴琴燕,朱建飞,陈宏州,等.LC-MS测定不同品种小麦中氨基酸含量及PCA分析[J].生物加工过程,2021,19(1):91-98.
[30]李欣,黄石宽,陈雄,等.以小麦粉为基质的地衣芽孢杆菌与酵母混酵氨基酸代谢特征[J].食品工业科技,2019,40(23):88-92,97.
[31] CIANI M,COMITINI F.Yeast interactions in multi-starter wine fermentation[J].Curr Opin Food Sci,2015,1:1-6.
[32]PROCOPIO S,SPRUNG P,BECKER T.Effect of amino acid supply on the transcription of flavour-related genes and aroma compound production during lager yeast fermentation[J].LWT-Food Sci Technol,2015,63(1):289-297.
[33]商玉荟,朱萍,钟秋平.氨基酸添加对荔枝酒发酵动力及品质影响[J].中国酿造,2016,35(7):166-170.
[34]YIN H,HE Y,DONG J J,et al.Transcriptional profiling of amino acidsupplementation and impact on aroma production in a lager yeast fermentation[J].J I Brewing,2018,124(4):425-433.
[35] YIN H,HE Y,DENG Y,et al.Application of Plackett-Burman experimental design for investigating the effect of wort amino acids on flavouractive compounds production during lager yeast fermentation[J].J I Brewing,2017,123(3):300-311.
[36]HAZELWOOD L A,DARAN J M,MARIS A J A V,et al.The Ehrlich pathway for fusel alcohol production:a century of research on Saccharomyces cerevisiae metabolism[J].Appl Environ Microbiol,2008,74(8):2259-2266.
[37] HERNÁNDEZ-ORTE P,CACHO J F,FERREIRA V.Relationship between varietal amino acid profile of grapes and wine aromatic composition.Experiments with model solutions and chemometric study[J].J Agr Food Chem,2002,50(10):2891-2899.
[38]刘峻溪,王俊芳,韩爱芹,等.葡萄酒中酯类物质的生物合成及其影响因素[J].酿酒科技,2016(9):43-47.
[39]SUOMALAINEN H.Yeast esterases and aroma esters in alcoholic beverages[J].J I Brewing,1981,87(5):296-300.
[40]GARDE-CERDÁN T,ANCÍN-AZPILICUETA C.Effect of the addition of different quantities of amino acids to nitrogen-deficient must on the formation of esters,alcohols,and acids during wine alcoholic fermentation[J].LWT-Food Sci Technol,2008,41(3):501-510.