香气是评价葡萄酒品质的重要指标[1]。萜烯类化合物,尤其是单萜烯,是构成不同品种葡萄典型香气的重要化合物[2]。葡萄酒中的萜烯类化合物大多以糖苷的形式存在,降解之后可释放出挥发性香气物质,因此糖苷被称为香气前体物[3]。糖苷的降解主要通过酸解或酶解实现,实际生产中一般采用酶解的方法来降解糖苷[4]。
糖苷酶是降解糖苷物质的主要酶类,对葡萄酒香气的改善具有十分重要的作用[1]。糖苷酶广泛存在于各种微生物中,在葡萄酒发酵中,酵母菌的糖苷酶含量少、活性低,因此大部分糖苷仍留在葡萄酒中[5]。研究表明,酒类酒球菌(Oenococcus oeni)、植物乳杆菌(Lactobacillus plantarum)和片球菌(Pediococcus claussen)等乳酸菌都具有较高的糖苷酶活性[6]。双糖苷首先在α-L-阿拉伯糖苷酶、α-L-鼠李糖苷酶或β-D-芹菜糖苷酶作用下产生单糖苷,然后单糖苷在β-葡萄糖苷酶(β-glucosidase)EC 3.2.1.21作用下降解产生香气物质和葡萄糖;而单糖苷直接在β-葡萄糖苷酶作用下降解释放出香气物质和葡萄糖[7-8]。因此β-葡萄糖苷酶是降解糖苷产生香气物质的关键酶[9-11]。
葡萄酒酿造主要包括由酵母菌完成的乙醇发酵和由乳酸菌(lactic acid bacteria,LAB)完成的苹果酸乳酸发酵(malolactic fermentation,MLF)[12-13]。苹果酸乳酸发酵是葡萄酒酿造中继乙醇发酵后重要的二次发酵,在葡萄酒酿造中具有降低酸度、提高生物稳定性和增加葡萄酒香气、改善葡萄酒风味等作用,是葡萄酒生产中的重要步骤[1,14]。酒类酒球菌是苹果酸-乳酸发酵的主要启动者和执行者[3]。
酒类酒球菌是葡萄酒酿造中的重要乳酸菌,β-葡萄糖苷酶是结合态香气前体物质糖苷降解的关键酶,由于两者在葡萄酒酿造中的重要作用,越来越多的学者对酒类酒球菌的β-葡萄糖苷酶进行了研究。国外许多研究机构致力于β-葡萄糖苷酶的分子生物学研究,从基础领域研究酶的催化机制及表达调控机制[15-17];国内近年来对β-葡萄糖苷酶的研究逐渐成为热点,已由过去的研究β-葡萄糖苷酶的简单提取到现在的酶的培养条件优化以及粗酶液的纯化,β-葡萄糖苷酶基因的克隆表达也已得到实现[18]。
本文简单介绍了β-葡萄糖苷酶的定义、分类、作用机制和测定方法,阐述了酒类酒球菌β-葡萄糖苷酶活,探讨了pH值、发酵温度、乙醇浓度、糖含量和二氧化硫含量对酶活的影响,并在分子生物学水平上研究了酒类酒球菌β-葡萄糖苷酶基因,并对酒类酒球菌葡萄糖苷酶未来的研究热点和研究方向进行了展望。
1 β-葡萄糖苷酶
1.1 β-葡萄糖苷酶定义和分类
糖苷酶是自然界中最丰富的酶类之一,糖苷酶是一类以内切或外切方式水解各种含糖化合物中的糖苷键生成单糖、寡糖或糖复合物的酶[15]。β-葡萄糖苷酶是一种重要的糖苷酶。1837年,LIEBIGH和WOHLER在苦杏仁中首次发现,因此又被称为苦杏仁苷酶、龙胆二糖酶、纤维二糖酶和β-D-葡萄糖苷葡萄糖水解酶,是纤维素分解酶系中的重要组成成分,属于纤维素酶类,是能够催化水解结合于末端非还原性的β-D-葡萄糖糖苷键,释放出β-D-葡萄糖和相应配基的一种酶[15]。
在碳水化合物活性酶数据库(carbohydrate-active enzymes database,CAZy)中,β-葡萄糖苷酶被归类为糖苷水解酶家族[19-20],其主要功能为降解糖苷键。依据氨基酸序列的同源性和结构的相似性,已知的β-葡萄糖苷酶被分为GH1、GH3、GH5、GH9、GH30和GH116等6个家族,微生物来源的β-葡萄糖苷酶主要属于GH1和GH3,真菌来源的β-葡萄糖苷酶主要属于GH3家族[15]。
1.2 β-葡萄糖苷酶作用机制
葡萄与葡萄酒中的糖苷一般分为单糖苷和双糖苷,极少见三糖苷[9]。单糖苷风味前体物酶解,主要是在β-葡萄糖苷酶作用下,移除β-D-葡萄糖后释放出具有挥发性香气物质[21]。双糖苷的酶解可分为一步酶解法和两步酶解法(见图1)[22]。一步酶解法中,双糖苷在β-葡萄糖苷酶作用下直接生产二糖和挥发性香气物质;两步酶解法中,首先末端糖与β-D-葡萄糖之间的糖苷键在α-阿拉伯糖苷酶、β-洋芹糖苷酶或β-鼠李糖苷酶的作用下裂解,释放出相应的单糖和β-葡萄糖单糖苷,然后单糖苷再在β-葡萄糖苷酶作用下降解产生β-D-葡萄糖和挥发性香气物质。β-葡萄糖苷酶是糖苷水解过程中的关键酶,对香气物质的释放起着重要作用。
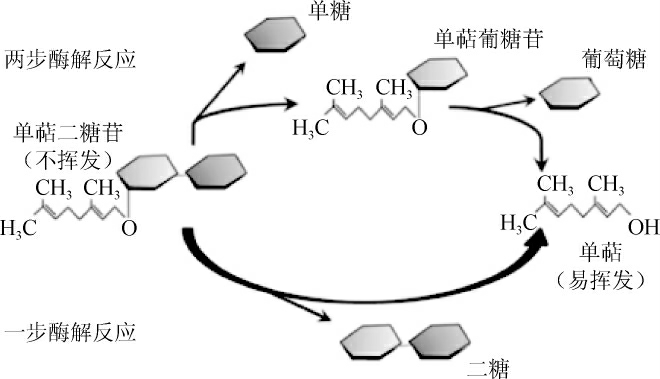
图1 双糖苷酶解示意图
Fig.1 Schematic diagram of enzymatic hydrolysis of diglycoside
1.3 β-葡萄糖苷酶酶活测定方法
测定β-葡萄糖苷酶酶活的方法主要有分光光度法、荧光法、京尼平苷显色法和比色法等[23-24]。
分光光度法是以水杨苷作为底物,将水杨苷裂解为水杨醇和葡萄糖,然后利用分光光度计对水杨醇和葡萄糖进行比色测定。此方法反应容易遭受干扰,检测的灵敏度也不是很高,因此不是目前测定葡萄糖苷酶的常用方法[25]。
荧光法是用4-甲基伞形酮葡萄糖苷作为底物,经酶解后产生4-甲基伞形酮,通过测定酶解出的4-甲基伞形酮的荧光吸光度来计算酶的活性。该方法灵敏度高且速度快,但由于实验过程复杂、重现性低,且成本昂贵,因此应用较少[26]。
京尼平苷显色法是对京尼平苷水解后产生的京尼平与氨基酸反应生成稳定的蓝色进行测定的一种方法。此方法检测结果稳定,操作简单,但其灵敏度较低,且耗时比较长[27-28]。
比色法是目前应用最为普遍的方法,它以对硝基苯基β-D-葡萄糖苷(p-nitrophenyl-glycosides,pNPG)为底物,底物水解后释放出的对硝基苯酚在波长400~420 nm可见光范围内有特征吸收峰,可直接进行比色测定。该法操作简单、快速,灵敏度高,且重现性好。
2 酒类酒球菌β-葡萄糖苷酶酶活
苹果酸-乳酸发酵可以显著提升葡萄酒的香气特征,提高葡萄酒的品质,酒类酒球菌是进行苹果酸-乳酸发酵的主要微生物,多数研究结果显示酒类酒球菌具有糖苷酶活性[29]。GUILLOUX-BENATIER M等[30]首次在人工合成的培养基中检测到了葡萄酒酿造乳酸菌(主要是酒类酒球菌)的β-葡萄糖苷酶活性;VIVAS N等[31]研究发现酒类酒球菌能够从二甲花翠素-3-葡萄糖苷中释放二甲花翠素,进一步证明了酒类酒球菌具有β-葡萄糖苷酶活性;MCMAHON H等[32]筛选了7株酒类酒球菌商业菌株,在合成底物培养基中没有检测到β-葡萄糖苷酶活性,因此认为培养基的组成可能是诱导葡萄糖苷酶活性的重要因素。GRIMALDI A等[33]用合成底物pNPG检测了12株商业酒类酒球菌的β-葡萄糖苷酶活性,发现11株酒类酒球菌的完整细胞和上清液中均不同程度的存在β-葡萄糖苷酶活性,并且在不同生长阶段均存在酶活,此外,还检测到了β-木糖苷酶活和α-阿拉伯糖苷酶活。GRIMALDI A等[34]还对其他22株商业酒类酒球菌菌株进行了检测,发现均存在β-葡萄糖苷酶活,但不同菌株之间酶活存在一定差异。LÓPEZ-SEIJAS J等[35]在研究的所有酒类酒球菌中都检测到了β-糖苷酶活,并表明有助于改善和提高区分阿尔巴尼奥葡萄酒的芳香成分。LI Y等[36]用合成底物和天然底物分别评价了酒类酒球菌SD-2a和31MBR完整细胞的β-葡萄糖苷酶活性,并对其部分特性进行了研究。为更好地探明酒酒球菌SD-2a的增香能力,LI Y等[37]还分别测定了SD-2a不同部位和不同生长时期的β-葡萄糖苷酶活,证明了酒类酒球菌SD-2a潜在的增香潜力。SAGUIR F M等[38]研究表明,从阿根廷葡萄酒中分离出的大多数酒类酒球菌在苹果酸乳酸发酵初期都可以检测到葡萄糖苷酶活性。MATURANO C等[39]研究了3株本地酒类酒球菌菌株,发现均具有β-葡萄糖苷酶、α-阿拉伯呋喃糖苷酶和α-鼠李糖吡喃糖苷酶活性;陈其玲等[40]从酒类酒球菌自身耐酸能力的视角去分析评估菌株糖苷酶活性;FIA G等[41]采用荧光法测定了31株酒类酒球菌的β-葡萄糖苷酶活性,发现在MRS培养液中β-葡萄糖苷酶在完整细胞和上清液中的活性水平和分布具有强的菌株依赖性。关于β-葡萄糖苷酶在酒类酒球菌中的位置,MANSFIELD A K等[29]研究发现,酒类酒球菌β-葡萄糖苷酶为胞外酶;而PÉREZ-MARTÍN F等[42]研究发现酒类酒球菌β-葡萄糖苷酶为胞内酶;其他研究也发现酒类酒球菌β-葡萄糖苷酶为胞内酶,且完整细胞也具有一定酶活[16,43-44]。这些研究表明了β-葡萄糖苷酶在酒类酒球菌中普遍存在,主要为胞内酶,酶活在不同菌株间有一定差异。
3 影响酒类酒球菌β-葡萄糖苷酶活性的因素
在苹果酸乳酸发酵中影响酒类酒球菌β-葡萄糖苷酶活的因素主要有pH值、发酵温度、乙醇浓度、糖含量和SO2含量等。
3.1 pH值对β-葡萄糖苷酶活性的影响
β-葡萄糖苷酶活性的最适pH值为5.0。MESAS J M等[43]在MRS培养基中观察不同pH下酒类酒球菌β-葡萄糖苷酶活性的变化,发现最适pH值在5.0左右;杨芮等[45]在MRS培养基中研究了10株酒类酒球菌β-葡萄糖苷酶活性随pH值变化,酒类酒球菌β-葡萄糖苷酶酶活呈钟罩形曲线,大部分菌株在pH值5.0时酶活最高;王玲等[46]在酸性番茄培养基(acidic tomato broth,ATB)中研究了pH值对两株酒类酒球菌β-葡萄糖苷酶活酶活影响,发现最适pH值也在5.0左右。β-葡萄糖苷酶分子上带有许多酸性、碱性氨基酸残基,pH值能影响这些氨基酸残基的解离状态,可能改变酶的空间结构,或影响与底物的结合和进一步催化反应,进而影响酶的活性。
3.2 温度对β-葡萄糖苷酶活性的影响
β-葡萄糖苷酶活性的最适温度为40.0~45.0 ℃。MICHLMAYR H等[16]在MRS培养基中通过改变温度来观察酒类酒球菌β-葡萄糖苷酶活性变化,发现在45 ℃时酶活最高;杨芮等[45]研究了温度对5株酒类酒球菌β-葡萄糖苷酶酶活的影响,商业酒类酒球菌OENO2的酶活在44.9 ℃达到最大,其他菌株酶活在32~39.3 ℃之间达到最大,菌株OENO2的酶活在温度高于44.9 ℃后迅速降低,其他菌株酶活在49 ℃时几乎为零;MESAS J M等[43]观察到,酒类酒球菌ST81的β-葡萄糖苷酶酶活在40 ℃时最高,在20~40 ℃范围内酶活随着温度升高而升高,当温度高于40 ℃时,酶活随着温度升高而降低。人们也对苹果酸乳酸发酵中酒类酒球菌的β-葡萄糖苷酶活进行了研究,发现不同菌株酶活不同,酶活最适温度也因菌株不同而具有一定差异[45]。
3.3 乙醇浓度对β-葡萄糖苷酶活性的影响
β-葡萄糖苷酶活性的最适乙醇体积分数为8%~16%。FIAG等[41]在MRS培养基中研究了乙醇对酒类酒球菌β-葡萄糖苷酶活性的影响,发现低浓度乙醇对酒类酒球菌β-葡萄糖苷酶酶活有促进作用,当乙醇体积分数超过8%时,乙醇对酒类酒球菌β-葡萄糖苷酶具有抑制作用;LI Y等[36]研究了乙醇对酒类酒球菌SD-2a和31MBR完整细胞β-葡萄糖苷酶活的影响,结果表明,SD-2a在乙醇体积分数为0~16%时具有较高酶活,当乙醇体积分数为24%时仍具有一定酶活,而菌株31MBR在乙醇体积分数为16%~24%时表现出较高酶活,在20%时活性最高,且体积分数16%~20%的乙醇对菌株31MBR完整细胞β-葡萄糖苷酶活具有一定的促进作用,这可能是完整细胞对细胞内β-葡萄糖苷酶的保护作用引起的;DIEZ-OZAETA I等[47]研究发现,低浓度乙醇对酒类酒球菌β-葡萄糖苷酶活影响较小,而体积分数12%~14%的乙醇使酒类酒球菌β-葡萄糖苷酶活显著下降。以上研究结果表明,不同浓度乙醇对酒类酒球菌β-葡萄糖苷酶活具有不同影响,低浓度乙醇对酒类酒球菌β-葡萄糖苷酶活具有促进作用,高浓度乙醇则表现出抑制作用。低浓度乙醇的促进作用可能是因为乙醇能够改变细胞膜的通透性,从而更容易获得细胞内的酶和底物,高浓度乙醇的抑制作用可能是因为乙醇使酶蛋白变性,从而改变酶的结构引起的。
3.4 糖含量对β-葡萄糖苷酶活性的影响
关于糖含量对酒类酒球菌β-葡萄糖苷酶活的影响,王玲等[46]研究发现,低质量浓度(0.1 g/L)葡萄糖对酒类酒球菌β-葡萄糖苷酶活影响较小,当葡萄糖质量浓度为1.0 g/L时,菌株β-葡萄糖苷酶活迅速下降,当葡萄糖质量浓度为10 g/L时,酶活几乎全部被抑制;杨芮等[45]研究了葡萄糖对10株酒类酒球菌β-葡萄糖苷酶活影响,结果表明,低浓度葡萄糖对酶活影响较小,当葡萄糖质量浓度为7.5 g/L时一些菌株的酶活被显著抑制,高浓度质量葡萄糖(20 g/L)时大多数菌株的酶活都被强烈抑制。由此可见,糖含量对酒类酒球菌β-葡萄糖苷酶活的影响存在菌株间差异。葡萄糖对β-葡萄糖苷酶活的抑制为非竞争性抑制,由于底物和抑制剂与酶的结合位点不同,酶可以同时与抑制剂和底物结合,这种结合引起糖苷酶分子构象变化,进而抑制酶活。
3.5 二氧化硫含量对β-葡萄糖苷酶活性的影响
目前关于pH值、温度、糖和乙醇对酒类酒球菌β-葡萄糖苷酶活的影响已有较多研究,而二氧化硫对酒类酒球菌β-葡萄糖苷酶活影响的报道目前还较少。MATURANO C等[39]研究了二氧化硫对酒类酒球菌β-葡萄糖苷酶活的影响,结果表明,在pH3.8条件下,80 mg/L二氧化硫对酒类酒球菌β-葡萄糖苷酶活没有影响;FIA G等[41]研究发现,增加游离二氧化硫质量浓度(0.2~0.6 mg/L),可使细菌生长和苹果酸乳酸发酵减慢,对β-葡萄糖苷酶活也有一定抑制作用。这是因为分子二氧化硫可穿过细菌细胞膜,通过扩散进入细胞,抑制细胞生长并破坏细胞内部结构,从而抑制β-葡萄糖苷酶活。
3.6 各因素协同作用对β-葡萄糖苷酶活性的影响
通常情况下,不同因素间对β-葡萄糖苷酶酶活的影响还存在一定的协同作用。FIA G等[41]研究表明,在pH 3.4的葡萄酒中进行苹果酸乳酸发酵,乙醇和二氧化硫表现出了协同抑制作用,这是导致β-葡萄糖苷酶活下降的根本原因;DIEZ-OZAETA I等[47]研究了pH和乙醇组合对β-葡萄糖苷酶活的影响,结果表明,pH和乙醇对酶活具有协同抑制效应,在一定乙醇浓度下,降低pH会导致酶活显著下降。
4 酒类酒球菌β-葡萄糖苷酶分子生物学研究
目前国内外主要利用基因工程和蛋白质工程来获取高活性的β-葡萄糖苷酶。国内对β-葡萄糖苷酶的研究起步较晚,从酶的提取、分离、纯化,已逐渐发展到对酶基因的研究,而国外对β-葡萄糖苷酶分子方面的研究已有较多报道。到目前为止,已有上百种不同来源(如动物、植物、微生物)的β-葡萄糖苷酶基因被成功克隆和测序[48]。酒类酒球菌PSU-1作为标准菌株,其全基因组已被测序,其中也包括β-葡萄糖苷酶基因的信息[49]。通过在美国国家生物技术信息中心(national center for biotechnology information,NCBI)数据库中查找分析得到酒类酒球菌PSU-1共含有5个不同的β-葡萄糖苷酶基因,分别为OEOE_RS07570、OEOE_RS05830、OEOE_RS01060、OEOE_RS01630、EOE_RS01635,其中OEOE_RS07570编码β-葡萄糖苷酶,其余4个基因编码6-磷酸(P)-β-葡萄糖苷酶。关于酒类酒球菌这些葡萄糖苷酶基因目前已有较多研究。
APALDO A等[17]对葡萄糖苷酶基因OEOE_RS01060、OEOE_RS01630和OEOE_RS01635进行了克隆和表达,并对其酶活性进行了测定。杨世玲等[50]从酒类酒球菌中成功克隆出了β-葡萄糖苷酶基因OEOE_RS07570,并对其编码的蛋白质进行了生物信息学分析,结果显示该蛋白疏水性较弱,无信号肽,无跨膜区,属于糖苷水解酶GH3。
杨世玲等[51]还对酒类酒球菌的6-P-β-葡萄糖苷酶基因OEOE_RS01060进行了克隆、测序,生物信息学分析显示其编码的蛋白质为可溶性酶,主要存在于细胞质内,属于糖苷酶GH1。LI Y等[36]对酒类酒球菌SD-2a和31MBR的β-葡萄糖苷酶基因OEOE_RS07570进行了克隆、测序及生物信息学分析,结果表明,两株菌株的β-葡萄糖苷酶基因高度同源(>99%),为胞内酶、主要存在细胞质中。陈其玲等[40]对胁迫突变酒类酒球菌菌株的6-P-β-葡萄糖苷酶基因OEOE_RS01060进行了测序,结果显示,大部分菌株的糖苷酶基因没有发生变化。SPANO G等[52]对6-P-β-葡萄糖苷酶基因OEOE_RS01060进行了表达量分析,结果证实了温度和乙醇胁迫对酒类酒球菌葡萄糖苷酶活具有一定的抑制作用。WANG J F等[53]对酒类酒球菌β-葡萄糖苷酶基因OEOE_RS07570和6-P-β-葡萄糖苷酶基因OEOE_RS01060进行了表达量分析,结果表明,这两个基因的高表达量导致了酒类酒球菌β-葡萄糖苷酶活的升高。LI Y等[37]对酒类酒球菌不同葡萄糖苷酶基因OEOE_RS05830、OEOE_RS07570和OEOE_RS01060的表达量进行了研究,通过对比酶活和不同基因表达水平,推测基因OEOE_RS01060和OEOE_RS05830可能与酒类酒球菌完整细胞的β-葡萄糖苷酶活相关,OEOE_RS07570与菌体破碎液的β-葡萄糖苷酶活相关。李亚辉[18]同时对酒类酒球菌中的5个糖苷酶基因(OEOE_RS07570、OEOE_RS05830、OEOE_RS01060、OEOE_RS01630、EOE_RS01635)进行了克隆和表达量分析,从分子水平上验证了“碳代谢抑制”理论,并从一定程度上揭示了基因OEOE_RS01060编码的6-P-β-葡萄糖苷酶是酒类酒球菌完整细胞具有β-葡萄糖苷酶活的原因。ZHANG J等[54]对酒类酒球菌中不同葡萄糖苷酶基因进行了同源性分析,并对基因OEOE_RS01060进行了克隆。MICHLMAYRH等[55]在大肠杆菌中成功表达了酒类酒球菌中的基因OEOE_RS07570,并对其活性进行了研究。由此可见,目前对酒类酒球菌葡萄糖苷酶基因的研究主要集中在OEOE_RS07570和OEOE_RS01060上,而对其他三个基因的研究还较少。6-P-β-葡萄糖苷酶的存在及其基因可以很好地解释酒类酒球菌细菌完整细胞具有β-葡萄糖苷酶活性的原因,但目前对其研究还较少。
葡萄糖苷酶中6-P-β-葡萄糖苷酶是细菌磷酸烯醇式丙酮酸转移酶系统(phosphoenolpyruvatephospho transferase system,PEP-PTS)中的重要组成部分,其只降解磷酸化的葡萄糖苷,对非磷酸化的底物不起作用[56]。细菌完整细胞通过PEP-PTS系统中转运酶将底物转运到细胞内,并在磷酸化酶作用下将其磷酸化,然后在胞内6-磷酸-β-葡萄糖苷酶作用下将其降解释放出葡萄糖糖基和相对应配体[57]。该机制首先在大肠杆菌中发现,现在已证明也存在于革兰氏阳性菌和阴性菌中,PEP-PTS是碳水化合物输入的重要机制,在乳酸菌碳水化合物分解代谢中也是一个常见机制,但关于乳酸菌PEP-PTS中糖苷酶活性的信息还很有限。关于酒类酒球菌β-葡萄糖苷酶,目前大多数研究只关注了其胞内、胞外或是分离纯化后的酶活,而对于实际生产具有重要意义的完整细胞的酶活则关注的较少[26,39-42,58]。6-磷酸-β-葡萄糖苷酶及其基因可以很好地解释为什么酒类酒球菌细菌完整细胞具有β-葡萄糖苷酶活性,而目前对其研究还较少。
6 总结及展望
研究酒类酒球菌β-葡萄糖苷酶对提升葡萄酒整体品质具有重要意义。糖苷在酒类酒球菌细胞内的代谢是一个复杂的体系,涉及多种酶的参与,并且机制错综复杂。目前关于酒类酒球菌和酒类酒球菌糖苷酶的研究非常有限。对酒类酒球菌糖苷酶的研究主要集中在β-葡萄糖苷酶的活性,以及提取、分离和纯化,而对酒类酒球菌6-P-β-葡萄糖苷酶的研究还较少,而6-P-β-葡萄糖苷酶是糖代谢途径磷酸烯醇式丙酮酸转移酶系统中的关键酶,也是酒类酒球菌完整细胞具有β-葡萄糖苷酶活的重要原因。因此,对酒类酒球菌6-P-β-葡萄糖苷酶的酶活、提取、分离、纯化,以及从分子水平上探明其诱导机制和表达过程将会是未来研究的重点和主要内容。
[1]BAE S,FLEET G H,HEARD G M.Lactic acid bacteria associated with wine grapes from several Australian vineyards[J].J Appl Microbiol,2010,100(4):712-727.
[2]MAICAS S,MATEO J J.Hydrolysis of terpenyl glycosides in grape juice and other fruit juices:a review[J].Appl Microbiol Biotechnol,2005,67(3):322-335.
[3]VILLENA M A,IRANZO J F  ,PÉREZ A I B.β-Glucosidase activity in wine yeasts:Application in enology[J].Enzyme Microb Tech,2007,40(3):420-425.
,PÉREZ A I B.β-Glucosidase activity in wine yeasts:Application in enology[J].Enzyme Microb Tech,2007,40(3):420-425.
[4]MATEO J J,JIMÉNEZ M.Monoterpenes in grape juice and wines[J].J Chromatogr A,2000,881(1-2):557-567.
[5]张阳,江璐,郭志君,等.利用β-葡萄糖苷酶提高葡萄酒香气的研究进展[J].现代食品科技,2020,36(4):316-324.
[6] CAPPELLO M S,ZAPPAROLI G,LOGRIECO A,et al.Linking wine lactic acid bacteria diversity with wine aroma and flavour[J].Int J Food Microbiol,2017,243:16-27.
[7]CID A G,GOLDNER M C,DAZ M,et al.The effect of endozym β-split,a commercial enzyme preparation used for aroma release,on tannat wine glycosides[J].S Afr J Enol Vitic,2012,33(1):51-57.
[8]GRIMALDI A,BARTOWSKY E,JIRANEK V.Screening of Lactobacillus spp.and Pediococcus spp.for glycosidase activities that are important in oenology[J].J Appl Microbiol,2005,99(5):1061-1069.
[9]张春芝,江志国.微生物对葡萄酒香气的影响综述[J].中国酿造,2013,32(9):28-31.
[10] WANG P X,LI A X,DONG M T,et al.Induction,purification and characterization of malolactic enzyme from Oenococcus oeni SD-2a[J].Eur Food Res Technol,2014,239:827-835.
[11]GAGNÉ S,LUCAS P M,PERELLO M C,et al.Variety and variability of glycosidase activities in an Oenococcus oeni strain collection tested with synthetic and natural substrates[J].J Appl Microbiol,2010,110(1):218-228.
[12]BARTOWSKY E J,COSTELLO P J,CHAMBERS P J.Emerging trends in the application of malolactic fermentation[J].Aust J Grape Wine R,2015,21(S1):663-669.
[13] LONVAUD-FUNEL A,JOYEUX A,LEDOUX O.Specific enumeration of lactic acid bacteria in fermenting grape must and wine by colony hybridization with non-isotopic DNA probes[J].J Appl Microbiol,1991,71:501-508.
[14] RIBÉREAU-GAYON P,GLORIES Y,MAUJEAN A,et al.Handbook of enology(The chemistry of wine stabilization and treatments)clarifying wine by filtration and centrifugation[M].New Jersey:John Wiley &Sons,Ltd.,2006:333-367.
[15]孟宪文,宋小红,陈历俊,等.β-葡萄糖苷酶的研究进展[J].中国乳业,2009(10):42-44.
[16] MICHLMAYR H,SCHÜMANN C,BARREIRA BRAZ DA SILVA N M,et al.Isolation and basic characterization of a β-glucosidase from a strain of Lactobacillus brevis isolated from a malolactic starter culture[J].J Appl Microbiol,2010,108(2):550-559.
[17]APALDO A,WALKER M E,FORD C M,et al.Beta-Glucoside metabolism in Oenococcus oeni:Cloning and characterisation of the phospho-betaglucosidase bgID[J].Food Chem,2011,125(2):476-482.
[18]李亚辉.酒类酒球菌SD-2a和31MBR的β-D-葡萄糖苷酶研究[D].杨凌:西北农林科技大学,2013.
[19]CANTAREL B L,COUTINHO P M,RANCUREL C,et al.The Carbohydrate-Active EnZymes database(CAZy):an expert resource for Glycogenomics[J].Nucleic Acids Res,2009,37:D233-D238.
[20] HENRISSAT B.Structural and sequence-based classification of glycoside hydrolases[J].Curr Opin Struct Biol,1997,7(5):637-644.
[21] LIU J B,ZHU X L,ULLAH N,et al.Aroma glycosides in grapes and wine[J].J Food Sci,2017,82(2):248-259.
[22] KÖNIG H,UNDEN G,FRÖHLICH J.Biology of microorganisms on grapes,in must and in wine[M].Berlin:Springer Berlin Heidelberg,2017:3-41.
[23]江昌俊,李叶云.茶叶中β-D-葡萄糖苷酶活性测定条件的研究[J].安徽农业大学学报,1999(2):212-215.
[24]梁华正,刘富梁,彭玲西,等.京尼平苷为底物测定β-葡萄糖苷酶活力的方法[J].食品科学,2006,27(4):182-185.
[25]陈守文,陈九武.利用黑曲霉β-葡萄糖苷酶改善葡萄酒的风味[J].中国酿造,1999,18(3):17-19.
[26]ROBINSON D.The fluorimetric determination of β-glucosidase:its occurrence in the tissues of animals,including insects[J].Biochem J,1956,63(1):39-44.
[27]周立华,牟德华,李艳.酵母菌β-D-葡萄糖苷酶酶学性质及对葡萄酒香气的影响研究进展[J].酿酒科技,2016(9):99-104.
[28]张阳.酿酒酵母高效表面展示β-葡萄糖苷酶提高葡萄酒香气的研究[D].杨凌:西北农林科技大学,2019.
[29] MANSFIELD A K,ZOECKLEIN B W,WHITON R S.Quantification of glycosidase activity in selected strains of Brettanomyces bruxellensis and Oenococcus oeni[J].Am J Enol Vitic,2002,53(4):303-307.
[30] GUILLOUX-BENATIER M,SON H S,BOUHIER S,et al.Osidasic and peptidasic activities in Leuconostoc oenos during bacterial growth.Influence of macromolecules of yeasts[J].Vitis,1993,32:51-57.
[31]VIVAS N,LONVAUD-FUNEL A,GLORIES Y.Effect of phenolic acids and anthocyanins on growth,viability and malolactic activity of a lactic acid bacterium[J].Food Microbiol,1997,14(3):291-299.
[32]MCMAHONH,ZOECKLEINBW,FUGELSANGK,et al.Quantification of glycosidase activities in selected yeasts and lactic acid bacteria[J].J Ind Microbiol Biot,1999,23:198-203.
[33] GRIMALDI A,MCLEAN H,JIRANEK V.Identification and partial characterization of glycosidic activities of commercial strains of the lactic acid bacterium,Oenococcus oeni[J].Am J Enol Vitic,2000,51:362-369.
[34]GRIMALDI A,BARTOWSKY E,JIRANEK V.A survey of glycosidase activities of commercial wine strains of Oenococcus oeni[J].Int J Food Microbiol,2005,105(2):233-244.
[35] LÓPEZ-SEIJAS J,GARCÍA-FRAGA B,SILVA A F D,et al.Evaluation of malolactic bacteria associated with wines from albarño variety as potential starters:screening for quality and safety[J].Foods,2020,9(1):99.
[36] LI Y,MA Y,FAN M,et al.Assessment of β-D-glucosidase activity of intact cells of two Oenococcus oeni strains with synthetic and natural substrates[J].Czech J Food Sci,2016,34:16-23.
[37] LI Y,WANG Y,FAN L,et al.Assessment of β-D-glucosidase activity and bgl gene expression of Oenococcus oeni SD-2a[J].PLoS One,2020,15(10):e0240484.
[38]SAGUIR F M,LOTO CAMPOS I E,MATURANO C,et al.Identification of dominant lactic acid bacteria isolated from grape juices.Assessment of its biochemical activities relevant to flavor development in wine[J].Int J Wine Res,2009,2009:175-185.
[39]MATURANO C,SAGUIR F M.Influence of glycosides on behavior of Oenococcus oeni in wine conditions:growth,substrates and aroma compounds[J].World J Microb Biot,2017,33(8):151.
[40]陈其玲,任晓宁,王玲,等.酒酒球菌β-葡萄糖苷酶活性与耐酸胁迫能力的相关性分析[J].食品科学,2017,38(2):133-138.
[41]FIA G,MILLARINI V,GRANCHI L,et al.Beta-glucosidase and esterase activity from Oenococcus oeni:screening and evaluation during malolactic fermentation in harsh condition[J].LWT-Food Sci Technol,2018,89:262-268.
[42]PÉREZ-MARTÍN F,SESEÑA S,IZQUIERDO P M,et al.Screening for glycosidase activities of lactic acid bacteria as a biotechnological tool inoenology[J].World J Microb Biot,2012,28:1423-1432.
[43]MESAS J M,RODRÍGUEZ M C,ALEGRE M T.Basic characterization and partial purification of β-glucosidase from cell-free extracts of Oenococcus oeni ST81[J].Lett Appl Microbiol,2012,55(3):247-255.
[44]MATURANO C,RIVERO L D V,RODRIGUEZ VAQUERO M J,et al.The effect of organic acids and sulfur dioxide on C4 compound production and β-glucosidase activity of Oenococcus oeni from wines under acidic conditions[J].Int J Wine Res,2016,8:19-28.
[45]杨芮,吕珍,文彦,等.酒类酒球菌中β-葡萄糖苷酶性质研究[J].食品科学,2013,34(23):206-211.
[46]王玲,卜潇,陈其玲,等.酒酒球菌β-葡萄糖苷酶产酶条件优化及酶学性质研究[J].西北农林科技大学学报(自然科学版),2017(45):138.
[47] DIEZ-OZAETA I,LAVILLA M,AMÁRITA F.Technological characterisation of potential malolactic starters from Rioja Alavesa winemaking region[J].LWT-Food Sci Technol,2020,134:109916.
[48]韩笑,陈介南,王义强,等.β-葡萄糖苷酶基因的克隆与表达研究进展[J].生物技术通报,2008(3):8-12.
[49] MILLS D A,RAWSTHORNE H,PARKER C,et al.Genomic analysis of Oenococcus oeni PSU-1 and its relevance to winemaking[J].FEMS Microbiol Rev,2005,29(3):465-475.
[50]杨世玲,刘叶,薛楚然,等.酒酒球菌β-葡萄糖苷酶基因克隆及生物信息学分析[J].中国食品学报,2017,17(7):204-212.
[51]杨世玲,陈其玲,李莹莹,等.酒酒球菌磷酸-β-葡萄糖苷酶基因的克隆及生物信息学分析[J].中国食品学报,2017,17(2):197-205.
[52]SPANO G,RINALDI A,UGLIANO M,et al.A β-glucosidase gene isolated from wine Lactobacillus plantarum is regulated by abiotic stresses[J].J Appl Microbiol,2010,98(4):855-861.
[53]WANG J F,YANG S L,MENG Q,et al.Molecular characterization and genetic expression profiles of two glycosidases from different Oenococcus oeni strains[J].J Microbial Biotechnol,2017,6(3):2320-3528.
[54]ZHANG J,ZHAO N,XU J N,et al.Homology analysis of 35 β-glucosidases in Oenococcus oeni and biochemical characterization of a novel β-glucosidase BGL0224[J].Food Chem,2021,334:127593.
[55] MICHLMAYR H,SCHÜMANN C,WURBS P,et al.A β-glucosidase from Oenococcus oeni ATCC BAA-1163 with potential for aroma release in wine:cloning and expression in E.coli[J].World J Microbiol Biot,2010,26:1281-1289.
[56]POSTMA P W,LENGELER J W,JACOBSON G R.Phosphoenolpyruvate:carbohydrate phosphotransferase systems of bacteria[J].Microbiol Rev,1993,57(3):543-594.
[57]WEBER B A,KLEIN J R,HENRICH B.Expression of the phospho-betaglycosidase ArbZ from Lactobacillus delbrueckii subsp. lactis in Lactobacillus helveticus:substrate induction and catabolite repression[J].Microbiology,2000,146(8):1941-1948.
[58]MICHLMAYR H,EDER R,KULBE K D,et al.β-Glycosidase activities of Oenococcus oeni:Current state of research and future challenges[J].Mitt Klosterneuburg,2012,62(3):87-96.