茶叶的成分大多具有营养特性及功能性,有消炎抑菌、降低血脂、血糖、血压、抗衰老、抗辐射、防癌等作用[1]。采用茶叶浸提、酿制或配制的保健酒既具有茶的芬芳典雅,也具有酒的深沉浑厚,是集营养、保健为一体的多功能饮品。随着人们保健意识的增强和社会观念的转变,近年来茶类保健酒受到人们的青睐。
柳州三江地区是广西主要的茶叶生产基地,广西三江县吉龙农业科技开发有限责任公司以当地的茶叶与矿泉水为原料,研制生产了国内首款蒸馏茶酒,目前已形成了一条年产1 000 t茶酒的生产线。在生产茶酒的过程中,会产生酒糟等副产品,茶酒糟主要由发酵后的茶叶组成,其富含茶多酚、茶多糖、茶皂素、茶蛋白、氨基酸、咖啡碱等活性成分,这些物质具有抗氧化、抗癌症、抗菌、减少胆固醇、降血压等功效。目前这些茶酒糟主要用作农家肥,对环境有一定的污染,同时造成了大量资源浪费。
茶多酚是一种天然抗氧剂,茶多酚的抗氧化机理是儿茶素分子结构上的羟基(-OH)起到供氢(H)体的作用,与脂肪酸中的游离基相结合而中断脂肪酸氧化的连锁反应,抑制氢过氧化物的形成,起到抗氧化作用[2],其抗氧活性高于一般非酚性或单酚羟基类抗氧剂,主要表现在具有消除人体自由基、抗癌、抗衰老、抑菌消炎、抑制黑色素合成等多种功效,具有很高的利用价值[3]。
目前,茶多酚的主要提取工艺有溶剂提取、离子沉淀、微波辅助提取、树脂吸附分离、超声波辅助提取、超临界流体萃取、酶提取等方法[4-6],不同的提取工艺都有各自的优势特点,提取使用的原料主要为茶叶或其加工后的副产物,而从经过发酵后的茶酒糟中提取茶多酚鲜见文献报道。
本研究以广西三江县吉龙农业科技有限公司生产茶酒过程中产生的酒糟为原料,采用水浴振荡乙醇提取茶多酚,并研究其抗氧化活性。以期为企业延长生产线,提高产品附加值,减少酒糟对环境的污染,最终实现茶酒酿造产生的废渣资料化利用提供理论依据。
1 材料与方法
1.1 材料与试剂
茶酒糟:广西三江县吉龙农业科技有限责任公司;体积分数95%乙醇(分析纯):成都金山化学试剂有限公司;溴化钾(光谱纯):北京兰博维尔科技有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)(分析纯):合肥巴斯夫生物科技有限公司;L-抗坏血酸、无水碳酸钠(均为分析纯):西陇科学股份有限公司;没食子酸(分析纯):天津市科密欧化学试剂有限公司;福林酚试剂:北京兰博维尔科技有限公司;30%过氧化氢(分析纯):西陇化工股份有限公司;水杨酸(分析纯):天津欧博凯化工有限公司。
1.2 仪器与设备
C3X-GF701-2-BS-1II电热恒温鼓风干燥箱:上海跃进医疗器械有限公司;800T粉碎机:永康市红太阳机电有限公司;THZ-82水浴恒温振荡器:杭州旌斐仪器科技有限公司;SHZ-D(III)循坏水式多用真空泵:上海力辰邦西仪器科技有限公司;RE-52AA旋转蒸发器:上海亚荣生化仪器厂;UV-9600紫外-可见分光光度计:北京北分瑞利分析仪器有限公司;HH-S4数显恒温水浴锅:金坛市医疗仪器厂;FR2004B电子分析天平:上海越平科学仪器有限公司;100-1000有限手动可调移液器:上海力辰邦西仪器科技有限公司;IRAffinity-1S傅里叶红外光谱仪:岛津企业管理(中国)有限公司。
1.3 方法
1.3.1 茶多酚的提取
将茶酒糟放置温度为60 ℃的恒温鼓风干燥箱,干燥48 h。将干燥好的茶酒糟粉碎,过40目筛,密封保存备用[7]。称取经预处理的茶酒糟粉末1.0 g,固定料液比为1∶30(g∶mL),加入体积分数为60%的乙醇,用保鲜膜封住锥形瓶瓶口(防止乙醇挥发),在温度为65 ℃条件下水浴振荡8 min提取茶多酚。
1.3.2 茶多酚含量的测定方法
碱性条件下,利用福林酚试剂氧化茶多酚中的-OH基团,反应之后显示蓝色,在最大吸收波长765 nm条件下,使用没食子酸作校正标准,配制质量浓度分别为10 μg/mL、20 μg/mL、30 μg/mL、40 μg/mL、50 μg/mL的没食子酸工作液。移取不同质量浓度没食子酸工作液各1 mL于刻度试管内,分别加入5 mL的10%福林酚试剂,反应3~8 min后再分别加入4.0 mL的7.5%Na2CO3溶液,加蒸馏水定容,室温下静置反应1 h。另移取1 mL蒸馏水按以上相同步骤作为空白对照,最后在波长765 nm条件下测定其吸光度值[8]。
1.3.3 没食子酸标准曲线的绘制[9]
以各没食子酸工作液浓度为X轴,吸光度值为Y轴,绘制没食子酸标准曲线,其线性回归方程为Y=0.167 7+0.004 8X,相关系数R2=0.999 0,说明在没食子酸质量浓度10~50 μg/mL范围内其线性关系良好,可以用于茶多酚提取量的测定。
1.3.4 茶多酚提取量的测定
待测液:移取提取液1 mL至10 mL容量瓶中,蒸馏水定容,摇匀,待测(若样液吸光度高于50 μg/mL的没食子酸标准液的吸光度值,则应重新稀释待测液,再次测定其吸光度值[18]。
移取1.0 mL待测液于刻度试管,再移取10%福林酚试剂5 mL,室温下反应3~8 min,然后加7.5% Na2CO3溶液4.0 mL,用蒸馏水定容,摇匀。室温下静置反应1 h。最后在波长765 nm条件下测定吸光度值,利用所测得的标准曲线回归方程,按下式计算茶多酚的提取量[10]:
式中:W为茶多酚提取量,mg/g;C为提取液中茶多酚质量浓度,μg/mL;V为茶多酚待测液体积,mL;N为提取液稀释倍数;M为茶酒糟粉末质量,g。
1.3.5 茶多酚提取条件优化单因素试验[11]
(1)乙醇体积分数对茶多酚提取量的影响
称取6份经预处理的茶酒糟粉末各1.0 g,固定料液比为1∶30(g∶mL),分别加入体积分数为30%、40%、50%、60%、70%、80%的乙醇,用保鲜膜封住锥形瓶瓶口(防止乙醇挥发),在温度为65 ℃条件下水浴振荡8 min提取茶多酚,研究不同乙醇体积分数对茶多酚提取量的影响。
(2)提取时间对茶多酚提取量的影响
称取6份茶酒糟粉末各1.0 g,固定乙醇体积分数60%,料液比为1∶30(g∶mL),瓶口密封,在水浴温度65 ℃条件下分别振荡2 min、4 min、6 min、8 min、10 min、12 min提取茶多酚,研究不同提取时间对茶多酚提取量的影响。
(3)料液比对茶多酚提取量的影响
称取6份茶酒糟粉末各为2.50 g、1.67 g、1.25 g、1.00 g、0.83 g、0.71 g,加入25 mL乙醇体积分数为60%的乙醇,即料液比分别为1∶10、1∶15、1∶20、1∶25、1∶30、1∶35(g∶mL),用保鲜膜封住瓶口,在温度65 ℃条件下水浴振荡10 min提取茶多酚,研究不同料液比对茶多酚提取量的影响。
(4)提取温度对茶多酚提取量的影响
称取6份茶酒糟粉末各1 g,固定料液比为1∶25(g∶mL)、乙醇体积分数为60%,瓶口封住,水浴温度分别为25 ℃、35 ℃、45 ℃、55 ℃、65 ℃、75 ℃,振荡10 min提取茶多酚,研究不同提取温度对茶多酚提取量的影响。
1.3.6 茶多酚提取工艺优化正交试验[13-15]
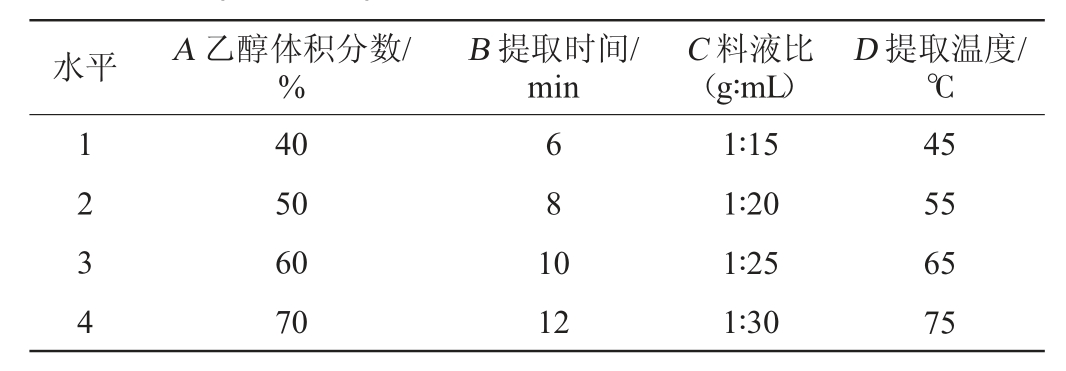
参照单因素试验的结果,选取乙醇体积分数(A)、提取时间(B)、料液比(C)、提取温度(D)为试验因素,采用L16(45)正交表进行试验,确定提取茶多酚最优工艺条件。正交试验因素与水平见表1。
表1 提取工艺优化正交试验因素与水平
Table 1 Factors and levels of orthogonal tests for extraction process optimization
1.3.7 红外光谱检测实验[17-19]
(1)茶多酚样品制备
将茶多酚提取液旋转蒸发浓缩至黏稠状,转移至平皿中,60 ℃条件下烘干,得到茶多酚粗制品,研磨成粉末状,-20 ℃保存[7],用于红外光谱检测。
(2)红外光谱检测方法
将茶多酚粉末按1∶100的质量比与溴化钾混合,研磨均匀后用压片机压制成薄片供测定,以溴化钾为背景,设置光谱范围为4 000~400 cm-1,光谱分辨率为2 cm-1,扫描次数为32次[11]。
1.3.8 茶多酚的抗氧化活性研究
(1)茶多酚提取液制备
根据正交试验得出的最佳提取工艺提取茶多酚,使用循环水式多用真空泵对其进行抽滤,通过60 ℃旋转蒸发浓缩,使溶液大约减少1/3,将所得溶液放置冰箱保存[16],用于研究茶多酚的抗氧化活性试验。
(2)羟自由基清除率测定[12]
移取1 mL不同浓度梯度的茶多酚提取液于试管,然后依次向试管分别加入9 mmol/L FeSO4、9 mmol/L水杨酸-乙醇溶液、8.8 mmol/L H2O2各1 mL,在37 ℃水浴条件下反应30 min,以蒸馏水为参比在波长510 nm处测定其吸光度值,记为Ai。按照以上步骤把1 mL茶多酚提取液换成1 mL蒸馏水,其余步骤相同,作空白对照,测定吸光度值,记为Ao。
考虑到色素本身的吸光度值,移取1mL不同浓度梯度的茶多酚提取液至试管,接着依次向试管分别加入9 mmol/L FeSO4和9 mmol/L 水杨酸-乙醇溶液各1 mL,最后不加H2O2启动反应,而是加1 mL蒸馏水。37 ℃水浴条件下反应30 min,以蒸馏水为参比在波长510 nm处测定其吸光度值,记为Aj。
以维生素C(vitamin C,VC)作对照,进行相同的实验。按下式计算茶多酚对羟自由基的清除率:
式中:Ao为空白对照;Ai为样品组的吸光度值;Aj为样品本底的吸光度值。
(3)DPPH自由基清除率测定[12]
向试管加入0.4 mL不同质量浓度的茶多酚提取液,分别加入4 mL的0.1 mmol/L DPPH溶液,放到黑暗环境静置反应30 min,然后用乙醇作为参比,在波长517 nm条件下测定其吸光度值,记为Ax。按以上步骤把0.4 mL茶多酚提取液换成0.4 mL的乙醇溶液进行试验,作为空白对照,记为Ao。
考虑到色素本身的吸光度值,移取不同质量浓度的茶多酚提取液各0.4 mL至试管,分别加入4 mL的乙醇溶液,放到黑暗处静置30 min,以乙醇作为参比,测定其吸光度值,记为Ay。
以VC作对照,进行相同的实验。按下式计算茶多酚对DPPH自由基的清除率:
式中:Ao为空白对照;Ax为样品组的吸光度值;Ay为样品本底的吸光度值。
2 结果与分析
2.1 提取工艺优化单因素试验
2.1.1 乙醇体积分数对茶多酚提取量的影响
乙醇体积分数对茶多酚提取量的影响见图1。由图1可知,当乙醇体积分数在30%~80%范围内,茶多酚提取量先增大后降低;乙醇体积分数为60%时茶多酚的提取量为34.32 mg/g,达到最高值。当乙醇体积分数>60%时,茶多酚提取量呈现下降趋势。可能是因为较高的乙醇体积分数会引起茶酒糟中的茶多糖、蛋白质等物质沉淀,从而导致茶多酚沉淀,因此提取液中茶多酚含量降低[7]。所以,通过单因素试验,可以初步确定茶多酚提取的最佳乙醇体积分数为60%。
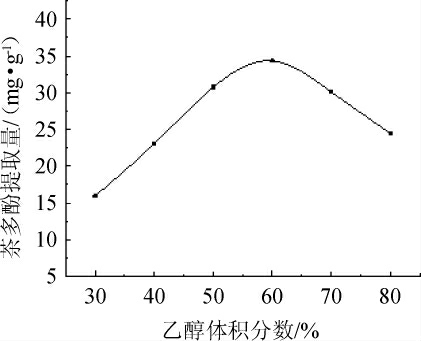
图1 乙醇体积分数对茶多酚提取量的影响
Fig.1 Effect of ethanol concentration on tea polyphenols extraction
2.1.2 提取时间对茶多酚提取量的影响
提取时间对茶多酚提取量的影响见图2。由图2可知,提取时间在2~10 min范围内时,茶多酚提取量随着振荡时间的延长而逐渐增大并达到最大值35.63 mg/g,说明提取时间的延长有利于茶多酚的提取,当提取时间超过10 min,茶多酚提取量下降,是因为随着反应时间延长,茶多酚中的多酚羟基容易被氧化,会致使其氧化分解,从而茶多酚提取量减少[13]。因此,可以确定最佳提取时间为10 min。
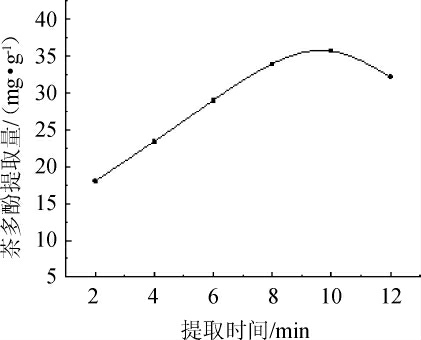
图2 提取时间对茶多酚提取量的影响
Fig.2 Effect of extraction time on tea polyphenols extraction
2.1.3 料液比对茶多酚提取量的影响
料液比对茶多酚提取量的影响见图3。由图3可知,料液比在1∶10~1∶25(g∶mL)范围内,茶多酚提取量随着料液比减小而逐渐升高,最大值为36.13 mg/g。当液料比<1∶25(g∶mL)时,提取量变化幅度小,这是因为细胞内外的茶多酚已充分的溶解出来[7]。因此,初步确定最佳料液比为1∶25(g∶mL)。
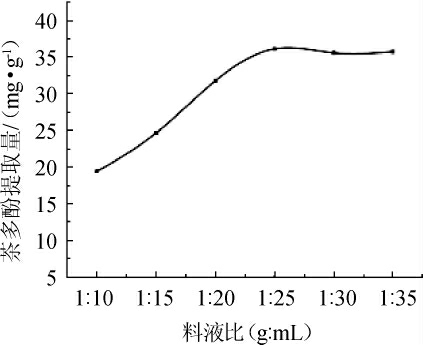
图3 料液比对茶多酚提取量的影响
Fig.3 Effect of liquid ratio on tea polyphenols extraction
2.1.4 提取温度对茶多酚提取量的影响
提取温度对茶多酚提取量的影响结果见图4。由图4可知,当提取温度范围在25~75 ℃时,随着提取温度升高,茶多酚的提取量呈现不断升高的趋势,在75 ℃条件下茶多酚的提取量达到38.73 mg/g。已知乙醇的沸点为78.4 ℃,因此提取温度不能>78.4℃,即初步确定提取茶多酚最佳提取温度为75 ℃。

图4 提取温度对茶多酚提取量的影响
Fig.4 Effect of extraction temperature on tea polyphenols extraction
2.2 提取工艺优化正交试验结果与分析
2.2.1 正交试验
以乙醇体积分数(A)、提取时间(B)、料液比(C)、提取温度(D)为评价指标,以茶多酚提取量为评价因素进行正交试验,试验因素与水平见表2,方差分析结果见表3。
表2 提取工艺优化正交试验结果与分析
Table 2 Results and analysis of orthogonal tests for extraction process optimization
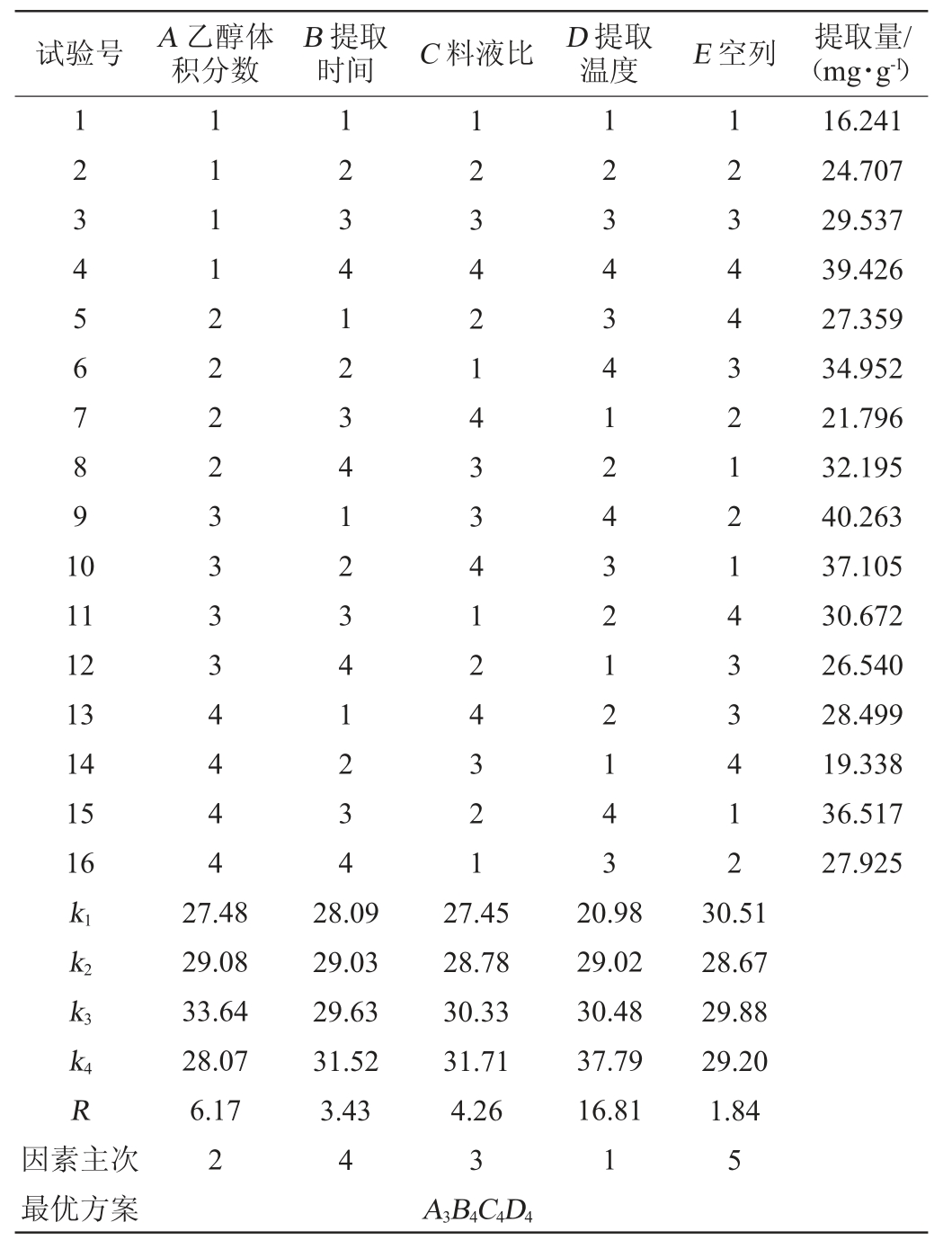
表3 正交试验结果方差分析
Table 3 Variance analysis of orthogonal tests results
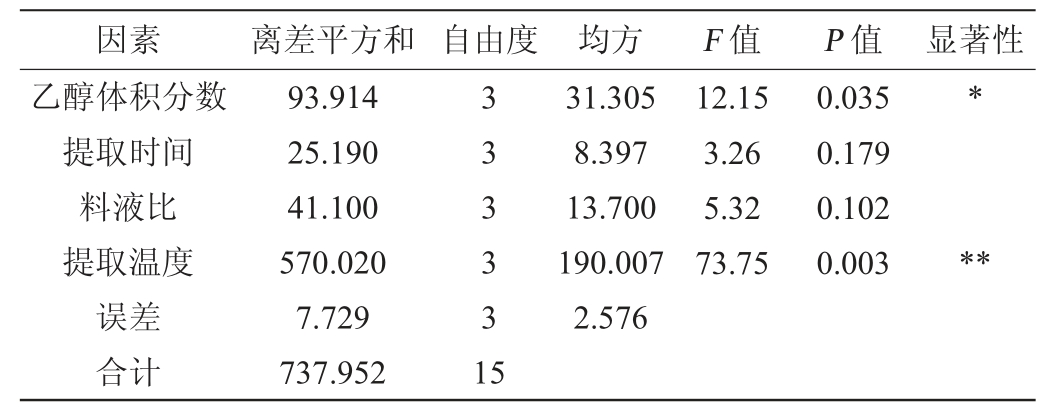
注:“**”表示对结果影响极显著(P<0.01),“*”表示对结果影响显著(P<0.05)。
由表2可知,4个因素对茶多酚提取量的影响次序依次为D(提取温度)>A(乙醇体积分数)>C(料液比)>B(提取时间),通过极差分析结果可知,茶多酚的最优乙醇提取工艺组合为A3B4C4D4,即乙醇体积分数为60%,提取时间为12 min,料液比为1∶30(g∶mL),提取温度为75 ℃。
由表3可知,提取温度对茶多酚提取效果有极显著影响(P<0.01),乙醇体积分数对提取效果影响显著(P<0.05),提取时间和料液比两个因素对茶多酚提取效果均不显著(P>0.05)。
2.2.2 验证试验
在最佳提取工艺条件下重复3次进行验证试验提取茶多酚,即乙醇体积分数为60%,提取时间12 min,料液比1∶30(g∶mL),提取温度75 ℃。得到茶多酚提取量分别为41.61 mg/g、42.00 mg/g、40.96 mg/g,平均值为41.52 mg/g,高于正交试验结果中的最大提取量40.26 mg/g,表明该方法准确,重复性好,适用于提取茶酒糟中的茶多酚。
2.3 红外光谱检测结果分析
红外光谱图(图5)可以看出,茶多酚样品在波数3432cm-1出现吸收峰,是O-H伸缩振动区,波数3 078 cm-1处有吸收峰为不饱和碳上的C-H伸缩振动区,在波数2 864 cm-1上的吸收峰为C-H伸缩振动区,波数1 695 cm-1是羰基的伸缩振动区,吸收峰1 424 cm-1、1 294 cm-1和1 187 cm-1为C-O伸缩振动区,波数939.4cm-1、711.7 cm-1是C-H面外弯曲振动区[20-22]。所以推断出此样品中含有羰基、羟基等官能团,和茶多酚的主要官能团基本符合。
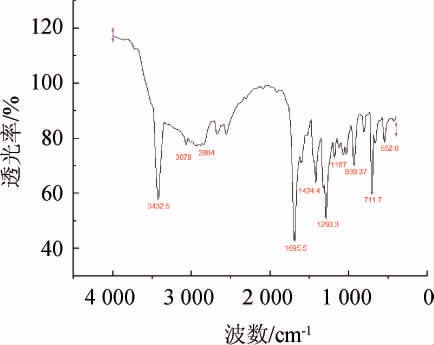
图5 茶多酚样品红外光谱图
Fig.5 Infrared spectrogram of tea polyphenols samples
2.4 抗氧化活性研究试验结果与分析
2.4.1 茶多酚对羟自由基的清除效果
茶多酚对羟自由基的清除效果见图6。由图6可知,茶多酚质量浓度在1~6 mg/mL范围内,随着茶多酚质量浓度的增大,其对羟自由基的清除率也逐渐升高,达到91.72%的清除率。当质量浓度>5 mg/mL时其清除率趋于平缓。与VC作对照,在0.2~6 mg/mL范围内,VC对羟自由基的清除率呈现一直上升的趋势[23],当VC质量浓度为0.8 mg/mL时,其对羟自由基清除率达到99.23%。
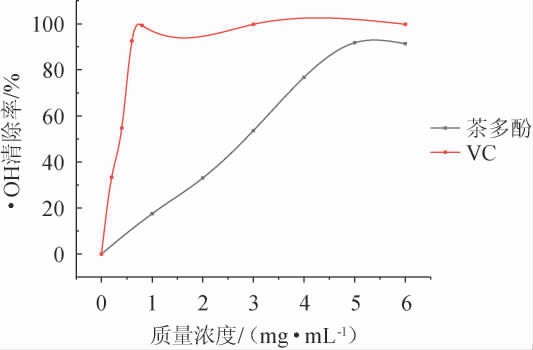
图6 茶多酚对羟自由基的清除效果
Fig.6 Scavenging effect of tea polyphenols on hydroxyl radical
通过计算得出茶多酚的半抑制浓度(half maximal inhibitory concentration,IC50)值为2.74 mg/mL,VC的IC50值为0.35 mg/mL。表明茶多酚对羟自由基的清除效果不如VC,但也表现出较强的抗氧化活性[24]。
2.4.2 茶多酚对DPPH自由基的清除效果
茶多酚对DPPH自由基的清除效果见图7。由图7可知,在50~300 μg/mL的质量浓度范围内,随着茶多酚质量浓度的升高,其对DPPH自由基的清除效果逐渐变好[25],当茶多酚质量浓度>300 μg/mL时,其清除率趋于稳定,达到93.7%。与VC作对照,在50~200 μg/mL范围内,VC对DPPH自由基的清除率呈现一直上升的趋势,VC质量浓度为180 μg/mL,其对羟自由基清除率达到95.8%。
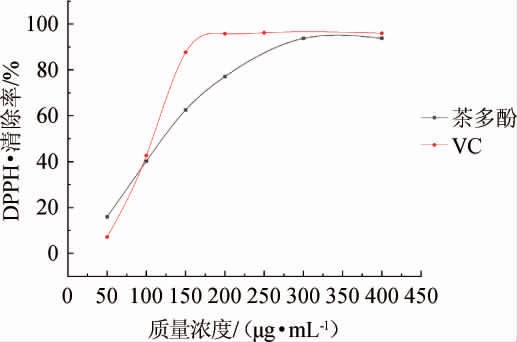
图7 茶多酚对DPPH自由基的清除效果
Fig.7 Scavenging effect of tea polyphenols on DPPH free radicals
计值算得出茶多酚和VC的IC50值分别为151.59 μg/mL、117.23 μg/mL,表明从茶酒糟中提取的茶多酚对DPPH自由基清除效果弱于VC,但茶多酚仍表现出较强的抗氧化性。
3 结论
该研究从茶酒糟提取茶多酚,通过单因素试验和正交试验优化,得到最佳提取工艺为乙醇体积分数60%,提取时间12 min,料液比1∶30(g∶mL),提取温度75 ℃。在此最佳提取工艺条件下,茶多酚的提取量为41.52 mg/g。实验结果显示,对茶酒糟进行水浴振荡乙醇提取茶多酚方法合理可行。对从茶酒糟中提取的茶多酚进行抗氧化性研究中,茶多酚对羟自由基和DPPH自由基均具有较强的清除效果,表明其是一种很好的天然抗氧化剂。对茶多酚样品进行红外光谱分析得出样品中含有茶多酚主要的官能团。
本研究对从茶酒糟中提取茶多酚及其抗氧化活性研究虽然取得了一定的成果,但仍存在一些不足之处,需要进一步研究。对提取得到的茶多酚进行纯化试验研究,得到纯度更高的茶多酚制品。本试验研究茶多酚提取液对自由基的清除效果,今后可研究提取液应用于果蔬、肉类的抗氧化。
[1]孟洋,陈莉,卢红梅.茶叶副产物中的有效成分、功效及综合利用研究进展[J].食品研究与开发,2020,41(5):207-212.
[2]林金科,涂良剑,王同,等.茶叶深加工学[M].北京:中国农业出版社,2012:173-174.
[3]宛晓春.茶叶生物化学[M].北京:中国农业出版社,2008:9.
[4]蔡静,叶润,贾凯,等.茶多酚的提取及抑菌活性研究综述[J].化学试剂,2020,42(2):105-114.
[5]左小博,孔俊豪,杨秀芳,等.茶多酚产业现状与发展展望[J].中国茶叶加工,2019(4):14-20.
[6]杨新,陈莉,卢红梅,等.茶多酚提取与纯化方法及其功能活性研究进展[J].食品工业科技,2019,40(5):322-328,332.
[7]袁珂.从绿茶叶中提取茶多酚的工艺方法[J].林产化学与工业,1997(1):58-62.
[8]徐如飞,金哲晨,许良,等.超声波提取安吉白茶茶多酚工艺的优化[J].贵州农业科学,2020,48(6):115-119.
[9]李志强,葛彦双,曾春菡,等.油茶叶茶多酚的提取及其抗氧化活性研究[J].四川大学学报(自然科学版),2014,51(5):1056-1062.
[10]易灵红.离子沉淀法提取绿茶中的茶多酚[J].化工技术与开发,2013,42(3):18-20.
[11]张效林,薛伟明,李平,等.树脂吸附法分离茶多酚及咖啡碱[J].化学工程,2001(3):15-19,1-2.
[12]张志旭,陈金发,张杨波,等.超临界萃取茶多酚工艺优化及萃取物茶多酚对化妆品的功效影响研究[J].茶叶通讯,2020,47(3):462-466.
[13]罗兰心,姜青,李翔,等.生物酶法提取铁观音茶梗中茶多酚工艺技术研究[J].食品研究与开发,2020,41(24):79-85.
[14]夏邦旗.天然食品抗氧化剂茶多酚及其在食品工业中的应用[J].西部粮油科技,1995(1):34-37.
[15]王文渊,黄光文,龙红萍,等.竹叶中茶多酚的提取及其抗氧化性研究[J].香料香精化妆品,2011(2):24-28.
[16]李栋林.超声耦合双水相茶多酚提取及抗氧化活性研究[D].南昌:南昌大学,2016.
[17]唐婷.脂溶性茶多酚微胶囊的制备及其特性研究[D].天津:天津科技大学,2015.
[18]国家市场监督管理总局,中国国家标准化管理委员会.GB/T 8313—2018茶叶中茶多酚和儿茶素类含量的检测方法[S].北京:中国标准出版社,2018.
[19]张秀芬,何文,谢君锋,等.辣木茶多酚的提取工艺优化及其抗氧化活性研究[J].化学与生物工程,2019,36(4):37-41.
[20]徐方祥,郑博文,苏袁宁,等.微波辅助双水相提取绿茶中茶多酚的研究[J].食品工业科技,2017,38(17):188-192,201.
[21]王红静.铁皮石斛多糖的分离纯化、结构鉴定及抗氧化活性的研究[D].武汉:华中科技大学,2017.
[22]崔珏,李超,王乃馨,等.大叶金花草总黄酮的抗氧化活性研究[J].中国食品添加剂,2011(4):117-120,129.
[23]冯丽琴.富硒茶中茶多酚和茶多糖的分离纯化及抗氧化性研究[D].西安:陕西科技大学,2017.
[24]胡燕,齐桂年.我国不同产地黑茶的FTIR指纹图谱分析[J].核农学报,2014,28(4):684-691.
[25]陈政旭,何香,何恒果,等.铁观音茶中茶多酚的提取研究[J].绿色科技,2018(12):170-172.