豌豆(Pisum sativum L.)属于豆科豌豆属植物,主要分布在我国中部,东北部。干豌豆含有蛋白质14%~31%、淀粉30%~50%,膳食纤维3%~27%和其他生物活性物质[1],可用于生产面粉、蛋白质、淀粉和纤维等以营养丰富为生产需求的高市场价值交易食品,但干豌豆作为面粉形式,因其令人不快的味道而受到高度限制[2]。将豌豆成分分离后加以利用可以尽可能地去除异味,有效提高其生产价值。豌豆淀粉提取简单易得,直链淀粉含量相对较高(35%~65%)[3]。高直链淀粉糊化时会出现吸水溶胀力弱,再生后凝胶脆度大等缺点[1],在食品加工领域受到严重限制。因此,为了扩大应用范围人们常常采用物理、化学、酶法[4]对豌豆淀粉进行改性。其中酶解法是一种提高慢消化淀粉含量的高效环保法。常用于该方法的酶主要是专一作用于淀粉中α-1,6糖苷键普鲁兰酶,一种重要脱支酶。淀粉分子经过脱支处理后,可使淀粉充分水解,产生更多的短链;脱支淀粉回生使得短链相互聚集,重新排列,形成抗性淀粉,提高淀粉原料利用率,具有良好的应用和研究价值。
抗性淀粉(resistant starch,RS)又名抗酶解淀粉,一种不能在小肠内消化,被大肠细菌发酵产生短链脂肪酸、乳酸和少量气体等人体有益物质的一种淀粉[5]。根据抗性淀粉来源和性质差异,RS被分成:物理包埋淀粉(RS1)、生淀粉颗粒(RS2)、老化回生淀粉(RS3)、化学改性淀粉(RS4)、直链淀粉-脂肪复合淀粉(RS5)5种类型[6]。RS具有促进肠道有益菌繁殖改变结肠微生物分布情况、预防结肠癌[7]、改善炎症[8]等潜在生理功能。此外,RS在调节糖脂代谢基因表达[9],改善人体胰岛素敏感性[10]等方面也发挥重要作用。目前,抗性淀粉制备方法主要有水热处理法、脱支处理法、机械辅助法[11],单一的方法产量较小、生产成本高、反应速率低、生产时间长等缺点,与之相比,两种方法协同得到抗性淀粉含量更高,溶解度、黏度、膨胀力等性质更好。本研究采用压热-普鲁兰酶酶解豌豆淀粉制备豌豆抗性淀粉,对其制备工艺进行优化,并分析检测最佳工艺条件下豌豆抗性淀粉的理化性质,为豌豆淀粉的利用以及抗性淀粉的开发提供技术支撑。
1 材料与方法
1.1 材料与试剂
豌豆:唐山德健生物科技有限公司;3,5-二硝基水杨酸(dinitrosalicylic acid,DNS)(分析纯):天津市光复精细化工研究所;胃蛋白酶(酶活1 000 U/g):河北格贝达生物科技有限公司;普鲁兰酶(酶活50 000 U/g):河南汇之全实业有限公司;葡萄糖淀粉酶(酶活100 000 U/g):河南糖柜食品有限公司;其他试剂均为分析纯;试验用水为超纯水。
1.2 仪器与设备
IS-RSD3台式恒温振荡器:苏州捷美电子有限公司;3H16RI台式高速冷冻离心机:湖南赫西仪器装备有限公司;D-7紫外可见分光光度计:南京菲勒仪器有限公司。
1.3 实验方法
1.3.1 葡萄糖标准曲线的制作
葡萄糖含量测定采用3,5-二硝基水杨酸(DNS)法[12]。取1 mL不同质量浓度0.1 mg/mL、0.2 mg/mL、0.3 mg/mL、0.4 mg/mL、0.5 mg/mL、0.6 mg/mL、0.7 mg/mL的葡萄糖,分别加入1 mL DNS显色试剂,沸水浴6 min,定容至10 mL,显色10 min,测定溶液吸光度值(A540nm),以葡萄糖含量(x)为横坐标,吸光度值(y)为纵坐标,绘制葡萄糖标准曲线,得标准曲线回归方程y=0.812 1x-0.008 1,相关系数R2=0.999 6。
1.3.2 豌豆淀粉制备
参照裴亚琼等[13]方法并进行部分修改提取豌豆淀粉。将豌豆去皮,烘干粉碎,按照1∶7(g∶mL)料液比加入0.4%氢氧化钠溶液,35 ℃、180 r/min摇床18 h,3 000 r/min离心10 min得沉淀,用约沉淀质量3倍的水洗涤2次,调pH至7.0,离心洗涤沉淀,50 ℃干燥24 h,粉碎过160目筛,得到豌豆淀粉。
1.3.3 豌豆抗性淀粉制备工艺优化单因素试验
称取7.5 g豌豆豆淀粉工艺优化并加入50 mL水于锥形瓶中,配制成质量分数为15%豌豆淀粉乳,分别调节豌豆淀粉溶液pH为4.0、4.5、5.0、5.5、6.0,添加酶活为50 000 U/g普鲁兰酶0.005 g、0.010 g、0.015 g、0.020 g、0.025 g,在温度40 ℃、45 ℃、50 ℃、55 ℃、60 ℃恒温振荡酶解24 h。121 ℃压热20 min,流水冷却至室温,4 ℃老化16 h、19 h、22 h、25 h、28 h。烘干老化淀粉(50 ℃,12 h),高速粉碎、过160目筛,即得豌豆抗性淀粉,于4 ℃保存。
1.3.4 豌豆抗性淀粉制备工艺优化响应面试验
根据单因素试验结果,以酶解pH(A)、酶添加量(B)、酶解温度(C)及老化时间(D)作为自变量,以抗性淀粉产率(Y)为响应值,设置低(-1)、中(0)、高(1)三个水平进行响应面试验。应用Box-Behnken试验设计,通过Design-Expert 8.0.6.1软件确定最佳制备工艺,Box-Behnken试验设计因素与水平见表1。
表1 Box-Behnken试验设计因素与水平
Table 1 Factors and levels of Box-Behnken experiments design

1.3.5 豌豆抗性淀粉含量及产率的测定
根据姜志杰等[14]的方法并进行适度修改。称取100 mg豌豆抗性淀粉;加入1 mol/L盐酸-氯化钾缓冲液10 mL(pH 1.5)、1 000 U/g胃蛋白酶溶液0.2 g;40 ℃、180 r/min摇床振荡60 min;加入0.2 mol/L磷酸氢二钠缓冲溶液9 mL(pH 6.2)、18 U/mL耐高温α-淀粉酶溶液1 mL;100 ℃振荡30 min;加入3 U/mL葡萄糖淀粉酶溶液4 mL;60 ℃、180 r/min在摇床振荡60 min;10 000 r/min离心10 min,得到沉淀;加入2 mol/L氢氧化钾溶液6 mL;25 ℃、180 r/min摇床振荡30 min;加入2 mol/L盐酸溶液5.5 mL、1.2 mol/L醋酸钠缓冲溶液3 mL(pH 3.8);调节pH至4.75;加入330 U/g葡萄糖淀粉酶液0.4 mL;60 ℃、180 r/min摇床振荡45 min;定容至50 mL,10 000 r/min离心15 min,收集上清液;测定样品溶液吸光度值(A540nm)。按照葡萄糖标准曲线回归方程计算豌豆抗性淀粉含量,豌豆抗性淀粉产率计算公式如下:
式中:YRS为抗性淀粉产率,%;GC为葡萄糖含量,mg/mL;50为测定溶液体积,mL;100为测定豌豆抗性淀粉质量,g;0.9为游离葡萄糖与脱水葡萄糖之间的换算系数。
1.3.6 豌豆抗性淀粉纯化
将未纯化豌豆抗性淀粉配制成10%的抗性淀粉乳液,用柠檬酸-磷酸氢二钠调至pH 6.5,加入90 ℃耐高温α-淀粉酶酶解2 h,100 ℃灭酶10 min,冷却至室温,加入体积分数为95%乙醇静置4 h,4 000 r/min离心15 min,并用体积分数为95%乙醇洗涤得沉淀,50 ℃烘干,粉碎,过160目筛,得到纯化的豌豆抗性淀粉。
1.3.7 豌豆抗性淀粉理化性质检测
(1)透明度
抗性淀粉的透明度以透光率值表示。称取0.1 g的抗性淀粉配制成质量分数1%的抗性淀粉乳,沸水浴30 min,水调整至10 mL。将样品储存在4 ℃中密封保存0、24 h、48 h、72 h、96 h、120 h、144 h,分别在波长620 nm处测定淀粉糊的透光率。
(2)冻融稳定性
1.5g抗性淀粉样品,加入蒸馏水25mL,95℃水浴30min,得到糊化物质,4 ℃冷藏24 h后-18 ℃冷冻12 h,加入蒸馏水溶解,4 000 r/min离心20 min,称取沉淀质量,析水率计算公式如下:
式中:m1为淀粉糊质量,g;m2为沉淀质量,g。
(3)溶解度与膨润度
取0.5 g抗性淀粉样品蒸馏水40 mL,水浴(50 ℃、60 ℃、70 ℃、80 ℃、90 ℃)加热30 min,4 000 r/min离心10 min,将上清液与沉淀分别于120 ℃干燥至恒质量后称质量,溶解度与膨润度计算公式如下:
式中:SA为溶解度;SP为膨润度;m3为上清液干燥后质量,g;m4为沉淀干燥后质量,g;0.5为测定样品质量,g。
(4)平均聚合度
抗性淀粉样品0.02 g、0.5 mL无水乙醇、2 mol/mL氢氧化钾溶液1 mL完全溶解样品。加水至50 mL,pH调至6.0~7.0得到溶液1号,取5 mL溶液1号、40 mL去离子水、1 mL I2-KI溶液(2 mg/mL I2、20 mg/mL KI),定容50 mL。在波长450~800 nm处扫描样品,找到吸光度峰的波长进行后续分析。
1.3.8 数据处理
实验每组重复3次,采用WPS Office 2019、SPSS 20.0、Design-Expert 8.0.6.1等软件进行数据分析。
2 结果与分析
2.1 豌豆抗性淀粉制备工艺优化单因素试验
酶添加量对RS产率的影响如图1a所示,随着酶添加量在5~20 U/mL范围内的增加,RS产率随之增大;酶添加量在20 U/mL时,RS产率最高,为25.994%;酶添加量>20 U/mL之后,RS产率随之下降。淀粉颗粒糊化后吸水膨胀使结晶区氢键断裂,小分子淀粉溶出,酶直接作用于支链淀粉α-1,6-糖苷键,水解形成更多的游离直链淀粉分子,促进老化过程中分子的重排,有利于RS的形成[15]。但添加量过多时,可能使得淀粉分子过分水解,分子链聚合度过低而不易形成抗性淀粉导致RS产率降低。因此,选用最适酶添加量为20 U/mL。
老化时间对RS产率的影响如图1b所示,抗性淀粉的结晶理论即直链淀粉分子重结晶形成致密晶体结构的过程[16]。淀粉分子晶核形成速度最快时间在12 h内,之后晶核的增长变得减缓[17]。当老化时间在16~22 h时,晶核逐渐增多抗性淀粉产率会不断增加;当老化时间在22 h时,RS产率最高,为25.024%,大多数淀粉分子会完全重结晶,剩下部分游离的豌豆支链淀粉;当老化时间>22 h之后,RS产率有所下降,可能是因为试验过程中没有防腐剂的加入,导致抗性淀粉出现轻微受损[18],造成含量降低。因此,最适老化时间为22 h。
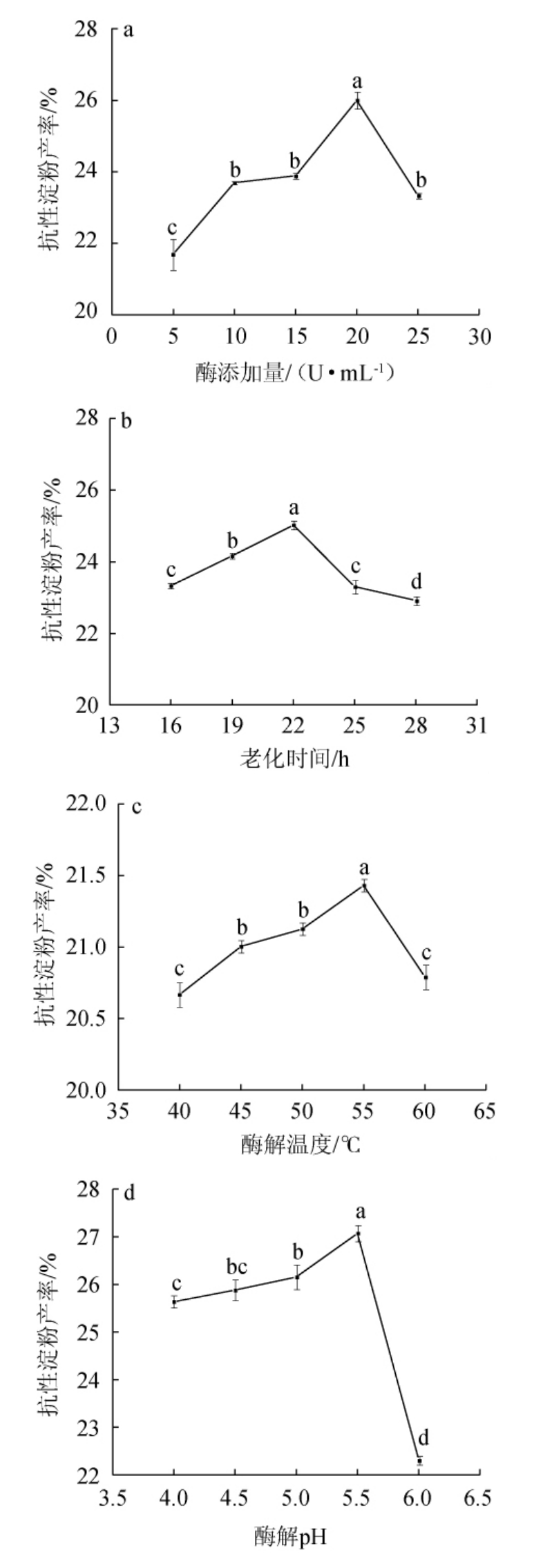
图1 酶添加量(a)、老化时间(b)、酶解温度(c)及酶解pH(d)对抗性淀粉产率的影响
Fig.1 Effects of enzyme addition (a),aging time (b),enzymatic temperature (c) and enzymatic pH (d) on yield of resistant starch
不同小写字母表示差异显著(P<0.05)。
温度主要通过改变酶活性基团的构象、酶与底物解离状态来影响整个酶促反应进程[19]。酶解温度对RS产率的影响如图1c所示,低酶解温度会减慢酶促反应速率,导致直链淀粉和豌豆抗性淀粉产量降低。当酶解温度在40~55 ℃范围内增加,RS产率随之增加;当酶解温度在55 ℃时,RS产率最高,为21.431%;当酶解温度高于55 ℃,酶活性会迅速下降甚至失活,导致RS产率迅速下降。因此,最适酶解温度为55 ℃。
pH对淀粉分子间的氢键以及酶活力有显著的影响。在偏酸或偏碱的环境下,直链淀粉分子被分解成运动剧烈过短链分子,分子难以互相接近形成重结晶的晶体结构,导致抗性淀粉生成困难[20]。合适的H+浓度可促进淀粉分子的结晶。在低H+浓度下,促进作用相对较低。在高酸度或强碱度的情况下,淀粉中的分子间氢键阻碍,这不利于反应的完成。酶解pH对RS产率的影响如图1d所示,当酶解pH在4.0~5.5范围内增加,RS产率随之增加;当酶解pH在5.5时,RS产率最高,为27.069%;当酶解pH>5.5之后,RS产率有所下降。因此,最适酶解pH值为5.5。
2.2 豌豆抗性淀粉制备工艺优化响应面试验
根据单因素试验结果,将影响因素酶解pH(A)、酶添加量(B)、酶解温度(C)及老化时间(D)作为自变量,以抗性淀粉产率(Y)为响应值,设置低(-1)、中(0)、高(1)三个水平进行响应面试验。Box-Behnken试验设计及结果见表2,方差分析见表3。
表2 Box-Behnken试验设计及结果
Table 2 Design and results of Box-Behnken experiments
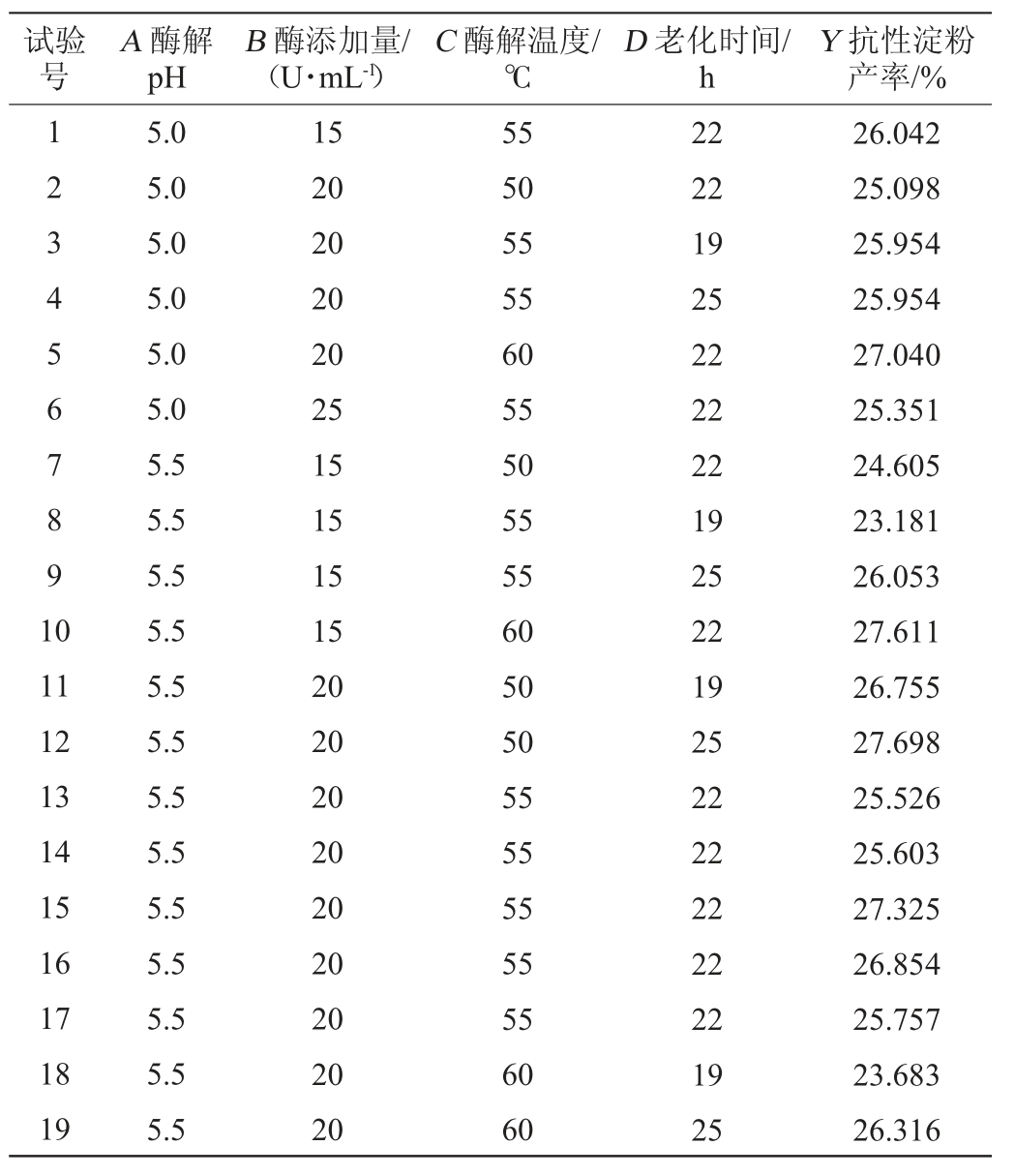
表3 回归模型方差分析
Table 3 Variance analysis of regression model
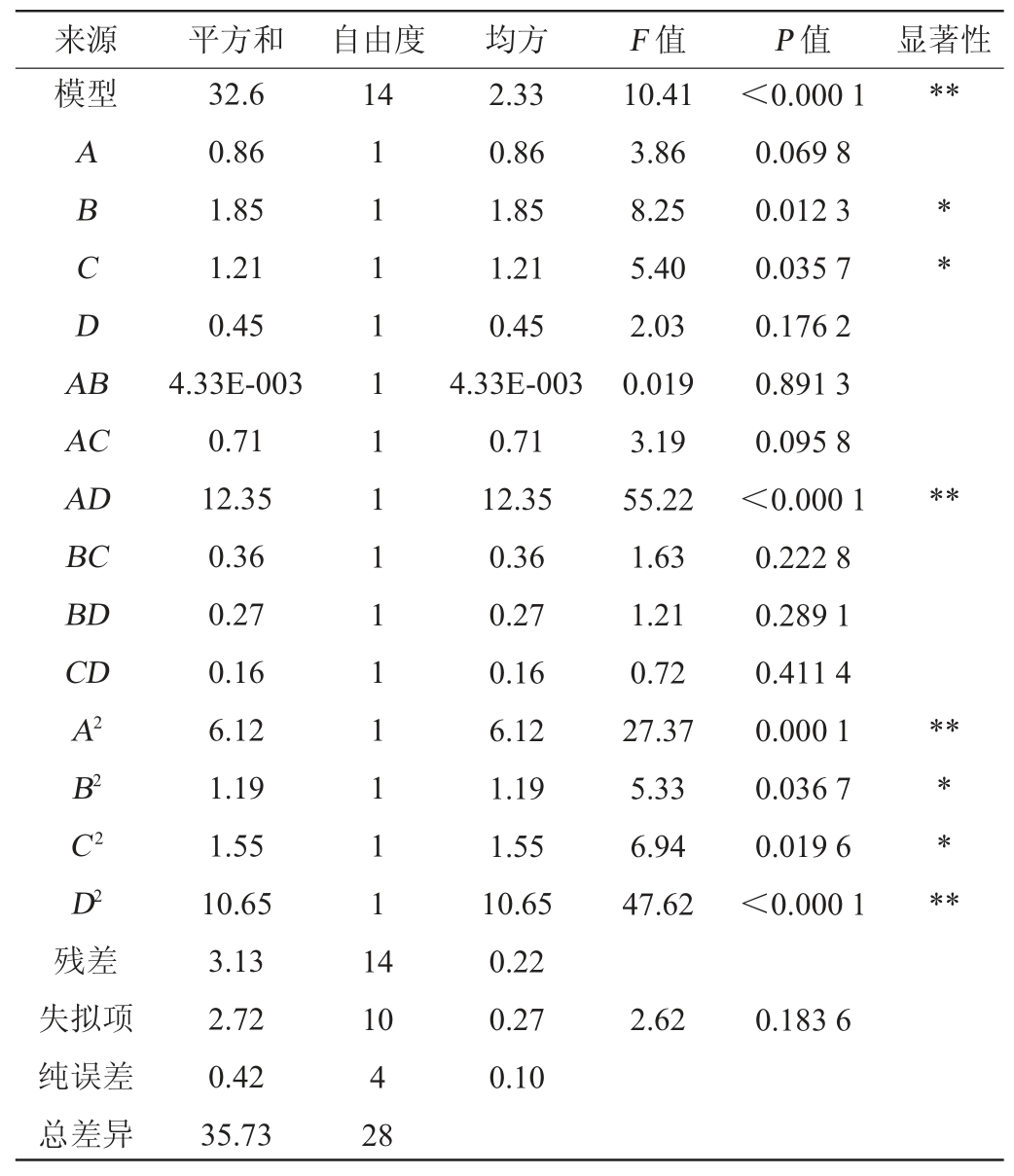
注:“*”表示对结果影响显著(P<0.05);“**”表示对结果影响极显著(P<0.01)。
续表
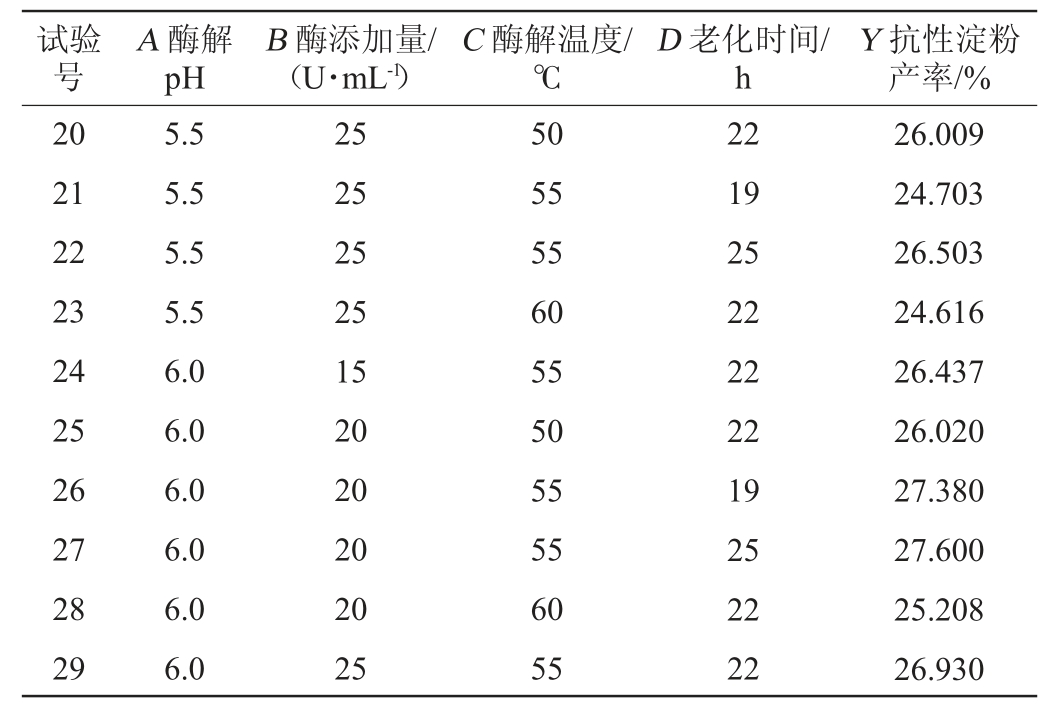
利用Design-Expert 8.0.6.1将表2数据进行回归拟合后,得到压热-酶解制备豌豆抗性淀粉条件的二次项回归方程如下:
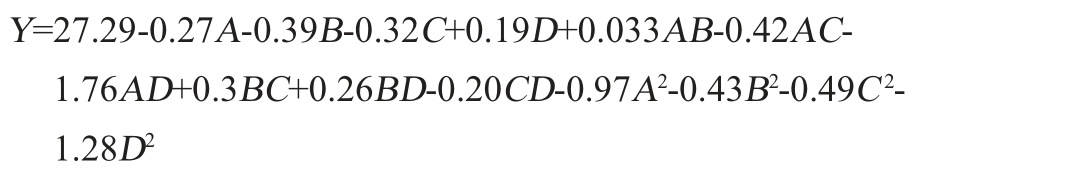
由表3可知,模型P值<0.000 1,表明模型极显著(P<0.01);失拟项P值=0.184>0.05,不显著,说明回归方程与实际结果拟合度较好;决定系数R2=0.912、调整决定系数R2adj=0.825,变异系数(coefficient of variation,CV)=1.82%,说明响应面预测值与试验值之间误差较小。一次项B、C,二次项B2、C2对结果影响显著(P<0.05),交互项AD,二次项A2、D2对结果影响极显著(P<0.01)。由F值可知,各因素对豌豆抗性淀粉制备的影响顺序为:酶添加量(B)>酶解温度(C)>酶解pH(A)>老化时间(D)。经软件Design-Expert 8.0.6.1分析得出的最佳制备工艺条件为酶解pH 5.36、酶添加量17.28 U/mL、酶解温度52.90 ℃、老化时间22.72 h,RS产率预测值为27.52%。结合实际生产情况,修正制备工艺条件为:酶解pH 5.4、酶添加量17.3 U/mL、酶解温度53 ℃、老化时间23 h。在此优化条件下,RS产率实际值为27.51%,与预测值差异不显著(P>0.05)。
2.3 豌豆抗性淀粉理化性质
淀粉透明度不仅反映了淀粉与水结合能力的强弱,还直接影响淀粉类食品外观。研究表明,淀粉样品透明度受淀粉颗粒膨胀度、分散程度、均匀与否、分子结构和链长等影响[21]。淀粉颗粒膨胀度越大、分散均匀、分子链越长、支链淀粉质量分数越高,淀粉的透明度就越高。由图2a可知,压热酶解后的豌豆抗性淀粉的透光率(1.994%)与原淀粉透光率(1.483%)相比有明显增加,可能是酶解后的抗性淀粉重结晶形成结晶体使得分子链长增加;纯化后抗性淀粉的样品成分单一分散更加均匀所以纯化后的透明度(2.305%)呈增大趋势。由图2b可知,不同样品储藏不同时间的透光率看出随着存储淀粉时间的增加透明度降低,可能是随着储存时间的延长,淀粉聚集分散程度降低从而样品稳定性降低。

图2 豌豆抗性淀粉理化性质测定结果
Fig.2 Determination results of physiochemical properties of pea resistant starch
a:透明度;b:稳定性;c:析水率;d:溶解度;e:膨润度;f:平均聚合度。
冻融稳定性是指样品经过冻结和融化交替处理后的稳定性,通过析水率反应的,与之成反比。由图2c可知,压热酶解纯化后的抗性淀粉的析水率(0.679)高于原豌豆淀粉(0.549),可能是淀粉处理之后分子间亲水力增强而氢键的强度减弱,从而降低了淀粉的冻融稳定性,与宋文天等[22]结果一致。
溶解度与膨润度是评价淀粉与水之间分子作用力的关键指标。由图2d可知,在50~90 ℃时,压热酶解纯化后的抗性淀粉的溶解度平均值(0.524)显著高于豌豆淀粉(0.064),因为豌豆抗性淀粉制备时原豌豆淀粉的结晶结构被破坏[23],脱去部分支链淀粉游离于水中增加溶解度。由图2e可知,与豌豆淀粉相比,纯化抗性淀粉膨胀度降低是因为纯化后样品中游离的可溶性糖和小分子物质被除去,结晶度增加的缘故,此处与宋昕祁[24]的研究结果相似。这样豌豆抗性淀粉可以在热处理食品中有较好的应用。
抗性淀粉的形成与直链淀粉含量、分子质量有关,聚合度太大、直链淀粉过长、分子间斥力大,难聚集形成抗性淀粉的结晶结构,所以适当的低平均聚合度有利于提高豌豆抗性淀粉的产率。由图2f可知,豌豆淀粉(612.0 nm)经过酶解处理后无论是纯化前、还是纯化后样品(583.5 nm)的吸光度峰波长均向低波长移动,聚合度降低,表明压热酶解后更易形成抗性淀粉,与朱哲等[25]研究结果相似。
3 结论
压热-普鲁兰酶酶解制备豌豆抗性淀粉最佳制备工艺条件为酶解pH5.4、酶添加量17.3 U/mL、酶解温度53 ℃、老化时间23 h。在此优化条件下,制备的豌豆抗性淀粉产率为27.51%。压热-酶解后纯化制备的豌豆抗性淀粉较豌豆淀粉贮藏稳定性和溶解度增大,冻融稳定性、膨润度以及平均聚合度降低,说明豌豆抗性淀粉品在适当的时间内储藏稳定性良好、分子间结合紧密、直链淀粉分子质量降低。本研究为抗性淀粉的应用提供广阔的发展前景。
[1]ZHOU D T,MA Z,YIN X X,et al.Structural characteristics and physicochemical properties of field pea starch modified by physical,enzymatic,and acid treatments[J].Food Hydrocoll,2019,93(2):386-394.
[2]VATANSEVER S,WHITNEY K,OHM J B,et al.Physicochemical and multiscale structural alterations of pea starch induced by supercritical carbon dioxide+ethanol extraction[J].Food Chem,2021,344:128699.
[3]张正茂,周颖.5种豆类淀粉凝胶特性的比较研究[J].中国粮油学报,2019,34(3):38-44.
[4]刘晓庆,刘松继,陈江平,等.不同改良剂对豌豆淀粉凝胶化及凝胶特性的影响[J].中国粮油学报,2020,35(1):143-148.
[5]白浩.强化抗性淀粉低蛋白主食对早期2型糖尿病肾病防治效果的研究[D].济南:山东大学,2018.
[6]刘树兴,候敏,徐晨,等.抗性淀粉对益生菌增殖作用的研究[J].食品科技,2019,44(1):14-20.
[7]朱哲,刘良忠,黄婷,等.直链淀粉含量及淀粉平均聚合度对抗性淀粉含量影响的研究[J].湖北农业科学,2017,56(2):320-324.
[8]梁单.马铃薯抗性淀粉调节肠道菌群及改善肥胖的作用机制[D].北京:中国农业科学院,2021.
[9]王琦.莲子抗性淀粉降血糖功效及其机理研究[D].福州:福建农林大学,2018.
[10]龙金利,张爱霞,生庆海.抗性淀粉制备及降糖作用研究进展[J].河北农业科学,2021,25(2):93-98.
[11]王宁,阮长青,张东杰,等.RS3型抗性淀粉制备方法研究进展[J].中国粮油学报,2021,36(12):185-193.
[12]张守花.微波辅助酶解法制备玉米抗性淀粉酶解条件研究[J].农业科技与信息,2020(3):43-46.
[13]裴亚琼,宋晓燕,杨念,等.豌豆淀粉的提取及其理化性质的研究[J].中国粮油学报,2014,29(9):24-28.
[14]姜志杰,潘飞燕,苏立杰,等.压热酸解法优化木薯抗性淀粉的制备工艺[J].农产品加工,2017(7):26-29.
[15]肖志刚,任海斌.挤压-酶解联用抗性淀粉工艺的优化[J].粮食加工,2016,41(2):27-33.
[16]VODOVOTZ Y,CHINACHOTI P.Glassy-rubbery transition and recrystallization during aging of wheat starch gels[J].J Agr Food Chem,1998,46(2):446-453.
[17]亢灵涛,宋莹,刘思含,等.压热法制备甘薯抗性淀粉的工艺优化[J].食品工业科技,2019,40(1):162-167,180.
[18]方桂红,陶宇,邓小宝,等.酶法制备菠萝蜜籽抗性淀粉的工艺优化及特性研究[J].粮食与油脂,2019,32(4):23-27.
[19]张伟,张焕新,张海涛,等.银杏抗性淀粉的微波-酶法制备及性质研究[J].食品工业,2018,39(10):5-10.
[20]阮思莲,马岁祥,吴枭锜,等.压热法制备紫山药抗性淀粉[J].安徽农业科学,2015,43(7):293-295.
[21]白婷,靳玉龙,朱明霞,等.超声波处理对青稞淀粉理化特性的影响[J].中国粮油学报,2021,36(9):60-66.
[22]宋文天,卢红妍,杨镜琦,等.交联法制备玉米抗性淀粉的工艺优化及理化性质分析[J].食品工业科技,2021,42(23):167-175.
[23]郑妍,曹珏,方泽栋,等.不同方法制备的马铃薯抗性淀粉物化特性研究[J].农产品加工,2020(14):10-12,18.
[24]宋昕祁.葛根抗性淀粉的制备、评价及调节血糖功能研究[D].南昌:江西中医药大学,2021.
[25]朱哲,刘良忠,黄婷,等.直链淀粉含量及淀粉平均聚合度对抗性淀粉含量影响的研究[J].湖北农业科学,2017,56(2):320-324.