白首乌(Cynanchum auriculatum)为萝藦科鹅绒藤属植物耳叶牛皮消,其含有多糖、黄酮、蛋白以及一些功效成分如告达庭-3-O-β-D-磁麻糖苷、C21甾醇、γ-氨基丁酸、二苯乙烯苷等[1-3],具有抗衰老、抗炎、抗氧化、护肝等功效[4]。酵素是以动物、植物、菌类等为原料,经微生物发酵制得的含有特定生物活性成分的一类产品[5]。由于是通过微生物发酵制成,酵素可以抑制有害微生物的生长,有报道表明,酵素可对病原菌和腐败细菌的生命活动,具有一定的环保应用价值[6-7]。目前,李凡等[8]通过优化乳酸菌和酵母菌单因素实验条件,得到乳酸菌、酵母菌活菌数较高的新型白首乌酵素。对白首乌功效的研究也多集中在抗氧化、解酒和乌须黑发等功效[9]。以白首乌作为原料,经发酵制成白首乌酵素的研究相对较少,关于白首乌酵素的其他功能研究也鲜有报道。
癫痫是一种慢性脑部疾病,表现为脑部神经元过度放电所致突然的、短暂的、反复的中枢神经系统失常,同时出现相应的认知、神经生物学、心理学以及社会学等方面的后果[10-11]。据流行病学调研发现,癫痫的患病率为4‰~7‰,且逐年增高,目前全球约有6 500万癫痫患者,80%的癫痫患者生活在发展中国家,由于经济、医疗技术等方面的问题,其中80%的患者得不到科学有效的诊治[12-13]。而且,部分癫痫患者存在着不同程度和内容的认知功能障碍,对个人、家庭和社会造成极大的危害和影响[14]。目前,抗癫痫药物有苯妥英钠、丙戊酸钠、托吡酯、奥卡西平、加巴喷丁等,均有一定的不良反应和药物间的不良作用,并且仍有30%~40%的患者发展为难治性癫痫[15-16]。吴隽松等[17]研究发现,白首乌酒通过调控p38-丝裂原活化蛋白激酶(mitogen activated protein kinases,p38-MAPK)蛋白表达来实现对癫痫大鼠神经元有保护作用[17]。赵健等[18]利用超高效液相色谱-质谱/质谱联用法测定白首乌中γ-氨基丁酸含量,γ-氨基丁酸是人体神经系统中重要的抑制性神经传达物质。但目前关于白首乌在神经方面的应用研究报道较少。
本研究以江苏滨海白首乌为原料制备酵素,测定其有效成分二苯乙烯苷(2,3,5,4'-四羟基二苯乙烯-2-O-β-D-葡萄糖苷(2,3,5,4'-tetrahydroxy stilbene-2-O-β-d-glucoside,THSG))的含量,研究其对癫痫引起认知损伤的缓解作用研究。以戊四氮诱导建立癫痫小鼠模型,对无特定病原体(specific pathogen free,SPF)小鼠灌胃白首乌酵素,通过进行Morris水迷宫实验、海马体病理学检测,血清和海马体组织的抗氧化水平以及海马体组织的炎症水平、核因子-κB(nuclear factor,NF-κB)P65及其抑制蛋白IκB表达水平的测定,研究白首乌酵素对癫痫小鼠认知损伤的缓解影响,以期为白首乌功能食品的开发提供理论依据和技术支持。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与菌株
白首乌(Cynanchum auriculatum):南京大华中药店;安琪酵母:安琪酵母股份有限公司;嗜酸乳杆菌(Lactobacillus acidophilus)CGMCC1.2919、植物乳杆菌(Lactobacillus plantarum)CGMCC 1.571:中国普通微生物菌种保藏管理公司。
30只无特定病原体(SPF)级雄性昆明小鼠(6~8周,体质量20~24 g),许可证号(SCXK[Jing]2015-0004):北京维通利华实验动物技术有限公司。
1.1.2 试剂
淀粉酶(酶活50U/mg)、葡萄糖淀粉酶(酶活100000U/g):上海源叶生物科技有限公司;乙腈(色谱纯)、戊四氮(分析纯):美国Sigma公司;二苯乙烯苷(色谱纯):上海源叶生物科技有限公司;二喹啉甲酸(bicinchoninic acid,BCA)试剂盒:南京建成生物工程研究所;苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)(分析纯):上海吉至生化科技有限公司;4%组织细胞固定液、高效无线电免疫沉淀反应试验(radio immunoprecipitation assay,RIPA)裂解液、脱脂奶粉:北京索莱宝科技有限公司;肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)试剂盒、白细胞介素-1β(interleukin-1β,IL-1β)试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malonic dialdehyde,MDA)酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒:北京盒子生工有限公司;聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜:迈博瑞生物膜技术有限公司;酵母浸出粉胨葡萄糖培养基、MRS培养基:北京索莱宝科技有限公司。
1.2 仪器与设备
S1-M81磨粉机:九阳股份有限公司;YP2001B电子天平:上海力辰仪器科技有限公司;安捷伦C18色谱柱(250 mm×4.6 mm,5 μm):美国安捷伦公司;LC-20AT型高效液相色谱仪:日本岛津公司;Gene&I Morris水迷宫:上海优耳仪器科技有限公司;DYCZ-24N垂直电泳仪:北京六一生物科技有限公司;Trans-Blot SD转膜系统:上海赛百奥科技有限公司;LHS-150恒温培养箱:上海重逢科学仪器有限公司;CX23显微镜:上海普赫光电科技有限公司;Odyssey红外激光成像系统:美国LI-COR公司。
1.3 实验方法
1.3.1 白首乌酵素加工工艺流程与操作要点[9]
白首乌洗净切块→粉碎过筛→溶解→蒸煮、冷却→接种两种酶→水解→糖化、液化→离心→接种→发酵及后熟→白首乌酵素
操作要点:白首乌洗净后切块、粉碎过50目筛,加入10倍体积水溶解,于100 ℃条件下煮30 min后,降温至50~60 ℃,接入1%淀粉酶和0.2%葡萄糖淀粉酶,60 ℃恒温水解60 min,进行糖化和液化。随后于6 000 r/min离心5 min后取上清液,在115 ℃灭菌30 min后,先接种0.2%的已活化酵母菌(酵母菌接种于酵母浸出粉胨葡萄糖培养基中于30 ℃活化培养12 h),30 ℃发酵24 h后,接种3%活化后(将菌株分别接种于MRS培养基中于37 ℃活化培养12 h)的混合乳酸菌(嗜酸乳杆菌(Lactobacillus acidophilus)和植物乳杆菌(Lactobacillus plantarum))按照1∶1的比例混合,37 ℃发酵36 h,于温度4~8 ℃发酵12 h后熟,即得白首乌酵素成品。
1.3.2 动物分组及癫痫模型的建立
30只无特定病原体(SPF)级雄性昆明小鼠置于通风良好的室内,保持室温为(22±2)℃,相对湿度(45±5)%,自由饮水摄食,维持12/12 h明暗交替光照,常规饲料喂养,适应性喂养一周后进行后续实验。实验符合江苏医药职业学院动物伦理委员会的要求。将动物随机分为3组:空白对照组、癫痫模型组、白首乌酵素组,每组10只,空白对照组灌胃1.2 mL/kg生理盐水和腹腔注射37 mg/kg生理盐水;癫痫模型组灌胃1.2 mL/kg生理盐水同时腹腔注射37 mg/kg戊四氮;白首乌给药组灌胃1.2 mL/(kg·d)白首乌酵素同时腹腔注射37 mg/kg戊四氮。灌胃每日一次,腹腔注射两日一次,实验共计28 d。按照癫痫发作Racine分级标准(0级为无惊厥;I级为面部阵挛;Ⅱ级为面部阵挛+节律性点头;Ⅲ级为面部阵挛+节律性点头+前肢阵挛;Ⅳ级为面部阵挛+节律性点头+前肢阵挛+后肢站立;Ⅴ级为面部阵挛+节律性点头+前肢阵挛+后肢站立+跌倒,依据Racine分级,Ⅲ级及其以上标准即可认为成功建立癫痫模型)[19-20],癫痫模型组与白首乌酵素组小鼠均达到Ⅳ级,癫痫模型建立成功。
1.3.3 白首乌酵素对癫痫小鼠认知功能的影响
采用Morris水迷宫实验研究白首乌酵素对癫痫小鼠的认知功能影响,经典的Morris水迷宫测试程序主要包括定位航行试验和空间探索试验两个部分,基于之前文献报道并进行适当调整[21],即最后一次注射戊四氮后24 h,采用定位航行实验、空间探索实验分别测定各组小鼠空间学习和空间记忆能力。
定位航行实验:将小鼠在四个象限面朝池壁轻放入水中,记录60 s内小鼠入睡后爬上水下平台的时间间隔即逃避潜伏期,如果60 s后小鼠未找到平台,记为60 s,实验为期5 d。每天训练4次,每次间隔15 min。
空间探索实验:上述实验结束后,撤走水下平台,将小鼠从水迷宫正中入水,记录60 s内小鼠跨越原平台的次数。
1.3.4 小鼠海马体组织病理学检测
实验结束后,将小鼠脑组织取出后,用4%多聚甲醛固定,经脱水、包埋等步骤后进行苏木精-伊红(hematoxylineosin,HE)染色,最后利用显微镜观察并拍照。
1.3.5 二苯乙烯苷的高效液相色谱检测
二苯乙烯苷标准品溶液的制备:准确称取二苯乙烯苷标准品350 μg,用10 mL甲醇溶解,配制成质量浓度为350 μg/mL的二苯乙烯苷标准溶液。
白首乌酵素二苯乙烯苷提取物的制备:参考文献[22]的方法并适当调整,利用大孔吸附树脂LSA-21对酵素中的二苯乙烯苷进行吸附,洗脱后得到二苯乙烯苷提取物,用0.22 μm的滤膜过滤备用。
高效液相色谱条件:C18色谱柱(250mm×4.6mm,5μm);流动相:乙腈-水(30∶70)(V/V);检测器:SPD-10Av检测器;检测波长:224 nm;进样量:10 μL;柱温:30 ℃;流速:1.0 mL/min。
定性与定量方法:以二苯乙烯苷标准品的保留时间为样品二苯乙烯苷的定性依据,采用外标法,以二苯乙烯苷标准品的质量浓度为横坐标(X),峰面积(Y)为纵坐标,得到线性回归方程为Y=38.94X+5.28,相关系数R2=0.999 5,按照回归方程对样品中的二苯乙烯苷定量分析。
1.3.6 ELISA检测小鼠血清和海马体组织的抗氧化水平和炎症因子水平
小鼠心脏取血后室温静置30 min,5 000 r/min离心10 min,取上清液按照试剂盒的步骤测定小鼠血清的SOD、MDA水平。将小鼠海马体组织用匀浆机破碎后,于4 ℃离心(14 000 r/min,15 min)后取上清液,按照ELISA试剂盒的步骤测定小鼠海马体组织的SOD、MDA及的TNF-α、IL-1β[23-25]。
1.3.7 Western blot检测NF-κB P65和IκB蛋白表达水平
将小鼠海马体组织取出后,加入含有3 μL苯甲基磺酰氟(PMSF)的300 μL RIPA组织裂解液,在液氮预冷的组织匀浆机匀浆。然后至于冰上裂解30 min。裂解30 min后,在4 ℃、12 000 r/min条件下离心5 min,取上清用BCA试剂盒测定组织蛋白含量。测定后分装,按1∶4的比例加入5×上样缓冲溶液,煮沸5 min,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)电泳然后,利用转膜仪将胶上蛋白转移至PVDF膜上,将膜在含5%脱脂奶粉的洗膜缓冲液(Tris buffered saline tween,TBST)中封闭1 h,一抗4 ℃过夜孵育,二抗孵育1 h,最后利用Odyssey红外激光成像系统成像。
1.3.8 统计学方法
数据以“平均值±标准差”的形式表示,数据分析采用SPSS 22.0软件,两组间数据比较采用t检验,多组数据比较使用单因素方差分析,P<0.05为统计学差异。作图软件采用Origin8.5,Western blot条带采用Image J V1.8.0软件。
2 结果与分析
2.1 白首乌酵素中二苯乙烯苷含量
通过高效液相色谱法测定白首乌酵素中二苯乙烯苷的含量,结果如图1所示,二苯乙烯苷标准品、样品的出峰时间分别为28.34 min、28.50 min,通过计算得出,白首乌酵素中二苯乙烯苷的质量浓度为78.18 μg/mL。
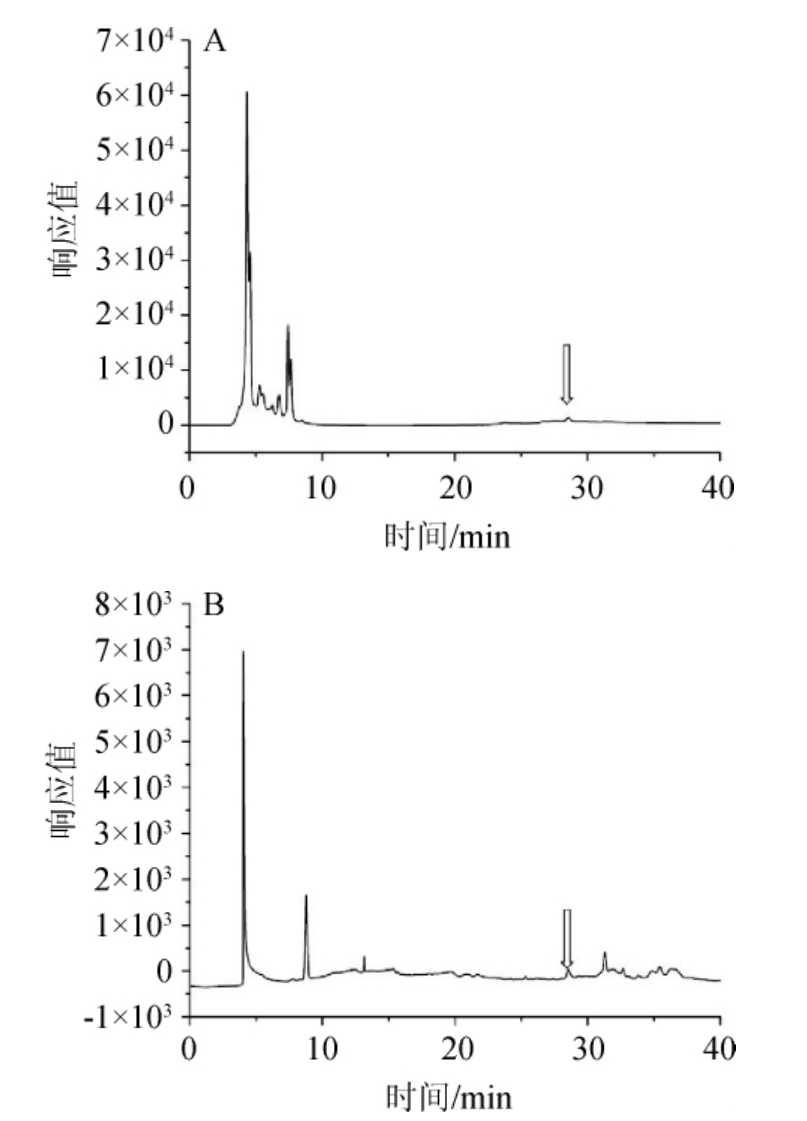
图1 二苯乙烯苷标准品(A)和样品(B)的HPLC图谱
Fig.1 HPLC chromatograms of stilbene glycoside standard (A) and the sample (B)
2.2 白首乌酵素对癫痫小鼠认知功能的影响
采用Morris水迷宫实验研究白首乌酵素对癫痫小鼠的认知功能影响,结果见表1。由表1可知,与空白对照组相比,癫痫模型组小鼠潜伏期显著延长、跨越平台次数显著减少(P<0.05),潜伏期由11.85 s延长至35.71 s(延长2.01倍),跨平台次数由12.99次减少至5.38次(减少58.6%),这与张高炼等[26]建立癫痫大鼠模型结果相一致;而白首乌酵素的摄入可显著减缓这种趋势,即与癫痫模型组相比,白首乌酵素组小鼠潜伏期显著缩短,跨越平台次数显著增加(P<0.05),潜伏期由35.71 s缩短至15.12 s(缩短57.7%),跨平台次数由5.38次增加至9.86次(增加83.3%)。表明白首乌酵素可有效改善癫痫小鼠的认知损伤功能。
表1 小鼠Morris水迷宫实验
Table 1 Morris water maze experiment of mice
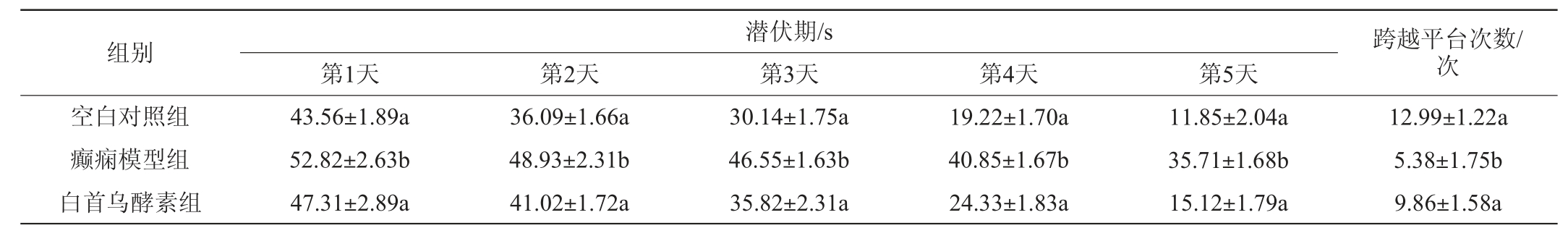
注:同列字母不同代表差异显著,P<0.05。下同。
2.3 白首乌酵素对癫痫小鼠脑组织海马体组织的影响
对各组小鼠脑组织海马体组织部分进行HE染色,结果见图2。由图2A可知,空白对照的小鼠海马区的锥体细胞分布均匀、排列整齐、细胞形态完整、轮廓清晰,且顶状树突明显;由图2B可知,癫痫模型组与空白对照差异较明显,即在戊四氮诱导的癫痫小鼠脑组织海马区的锥细胞分布杂乱、细胞肿胀变圆、轮廓不清晰,且顶状树突消失。由图2C可知,白首乌酵素组可明显的缓解这种损伤,呈现海马区锥细胞分布相对较整齐、大部分细胞形态完整,轮廓较清晰,顶状树突较明显。可能是由于白首乌酵素可以促进戊四氮代谢,减少其吸收,或者干扰其对海马体锥体细胞作用。
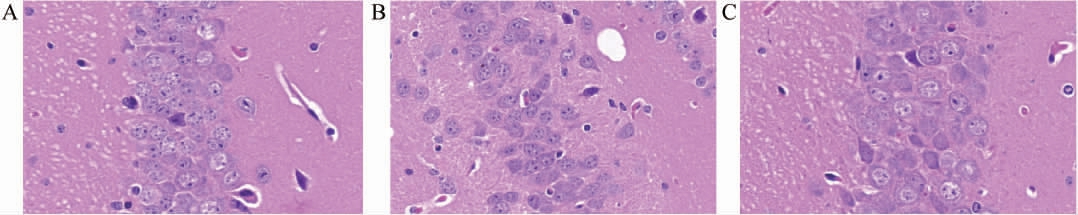
图2 白首乌酵素对空白对照组(A)、癫痫模型组(B)、白首乌酵素组(C)小鼠海马体组织的影响(400×)
Fig.2 Effect of Cynanchum auriculatum ferment on hippocampal tissue of mice in the blank control group (A),epilepsy model group (B),and Cynanchum auriculatum ferment group (C)(400×)
2.4 白首乌酵素对癫痫小鼠血清、海马体中SOD酶活和MDA含量的影响
利用ELISA试剂盒对各组小鼠血清、海马体中SOD、MDA水平进行测定,结果见表2。由表2可知,与空白对照组相比,癫痫模型组小鼠血清中SOD酶活显著降低(P<0.05)、MDA水平显著增加(P<0.05),SOD酶活由88.53 U/mL降低至67.59U/mL,MDA含量由9.26nmol/mL增加至13.84nmol/mL。与癫痫模型组相比,白首乌酵素可以增加癫痫小鼠血清中的SOD酶活,降低MDA水平,SOD酶活由67.59 U/mL增加至80.43 U/mL(增加19.9%),MDA含量由13.84 nmol/mL减少至11.62 nmol/mL(减少16.0%)。白首乌酵素组小鼠血清中SOD、MDA水平与空白组无显著差异(P>0.05),表明白首乌酵素可以显著提高癫痫小鼠血清的抗氧化水平。
表2 白首乌酵素对癫痫小鼠血清、海马体组织中SOD酶活和MDA含量的影响(n=10)
Table 2 Effect of Cynanchum auriculatum ferment on SOD enzyme activity and MDA content in serum and hippocampal tissue of epileptic mice(n=10)
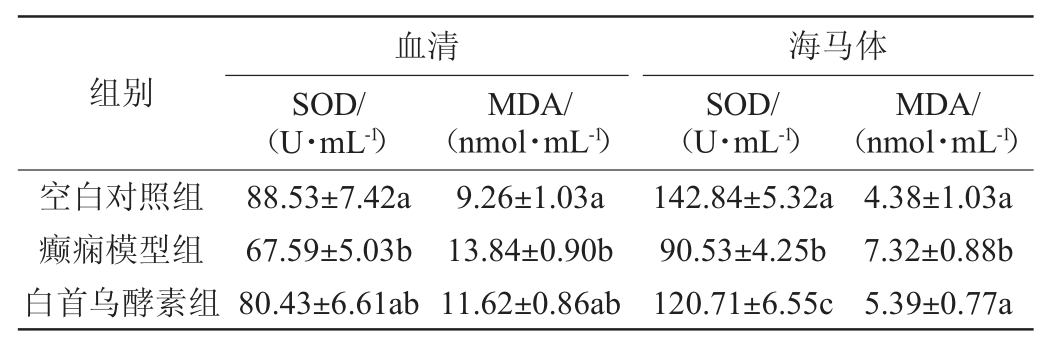
与空白对照组相比,癫痫模型小鼠的海马体SOD酶活由142.84 U/mL显著降低至90.53 U/mL,而MDA水平由4.38 nmol/mL显著增加至7.32 nmol/mL;而白首乌酵素可以显著增加癫痫小鼠海马体组织中的SOD酶活(P<0.05),显著降低MDA水平(P<0.05),即与癫痫模型组小鼠相比,白首乌酵素组小鼠海马体由SOD酶活由90.53 U/mL增加至120.71 U/mL(增加33.3%),MDA含量由7.32 nmol/mL减少至5.39 nmol/mL(降低26.4%)。此外,白首乌酵素组小鼠海马体组织中MDA水平与空白组无显著差异(P>0.05),表明白首乌酵素可以显著提高癫痫模型组小鼠海马体组织的抗氧化水平(P<0.05)。
2.5 白首乌酵素对癫痫小鼠海马体组织炎症因子水平影响
YAFFE K等[27]研究发现,炎症、代谢综合症对其认知功能有一定影响。本实验利用ELISA试剂盒对各组小鼠海马体组织的炎症因子TNF-α、IL-1β进行测定,结果见表3。
表3 滨海白首乌酵素对癫痫小鼠海马体组织TNF-α和IL-1β水平的影响
Table 3 Effect of Cynanchum auriculatum ferment on TNF-α and IL-1β levels in hippocampal tissue of epileptic mice
由表3可知,与空白对照组相比,癫痫模型组小鼠海马体组织中TNF-α、IL-1β水平显著升高(P<0.05),TNF-α含量由33.85 pg/mg增加至56.32 pg/mg,IL-1β含量由19.86 pg/mg增加至30.20pg/mg。与癫痫模型组相比,白首乌酵素组可显著降低TNF-α、IL-1β水平(P<0.05),TNF-α含量由56.32 pg/mg减少至40.66 pg/mg(减少27.8%),IL-1β含量由30.20减少至23.98 pg/mg(减少20.6%),表明白首乌酵素组具有减轻癫痫引起的海马体炎症作用。
2.6 NF-κB P65和IκB蛋白表达水平
NF-κB信号通路在机体的多种生理过程中起重要作用。NF-κB信号通路不仅参与机体免疫调节、炎症反应及肿瘤的生理病理过程,还参与感染、细胞感染、凋亡等[28]。本研究利用Western blot实验研究白首乌酵素对癫痫小鼠海马体组织NF-κB P65和IκB蛋白表达水平影响,结果如图3所示,与空白对照组相比,戊四氮诱导癫痫模型小鼠海马体组织中p-NF-κB P65和p-IκB蛋白表达水平显著升高(P<0.05),p-NF-κB P65和p-IκB蛋白表达水平分别升高至145.2%,158.3%,而白首乌酵素可显著缓解增加趋势,即与癫痫模型组相比,白首乌酵素组显著降低了p-NF-κB P65和p-IκB蛋白表达水平(P<0.05),p-NF-κB P65和p-IκB蛋白表达水平分别降低至121.6%,119.1%,表明白首乌酵素可以降低NF-κB信号通路中关键蛋白的表达水平。
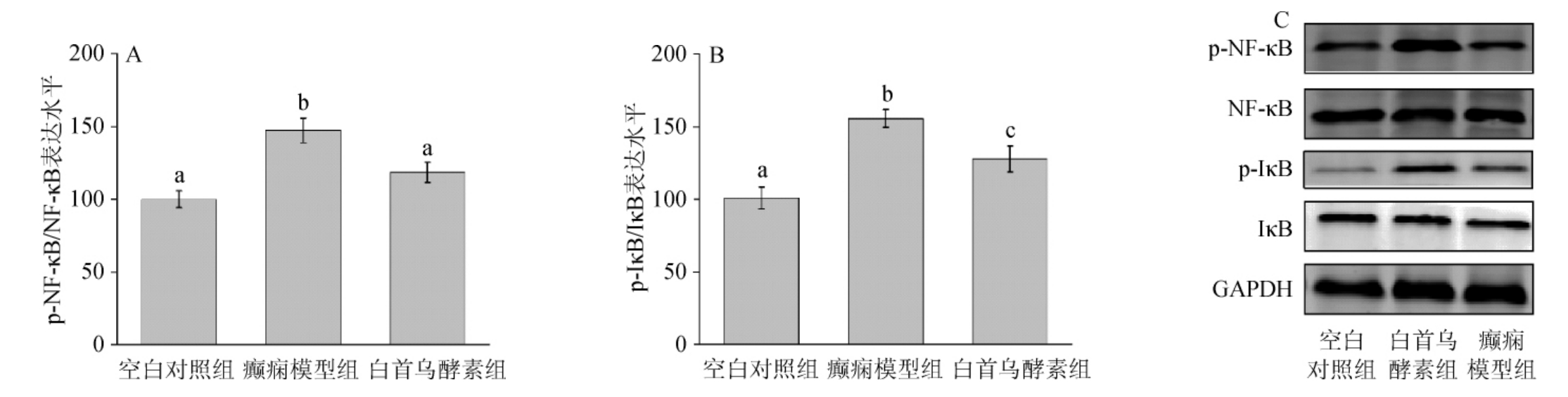
图3 白首乌酵素对癫痫小鼠海马体组织关键蛋白p-NF-κB/NF-κB、p-IκB/IκB表达水平的影响
Fig.3 Effect of Cynanchum auriculatum ferment on expression levels of key proteins P-NF-κB/NF-κB and P-I κB/IκB in hippocampal tissue of epileptic mice
3 结论
以新鲜滨海白首乌为原料经乳酸菌发酵制得白首乌酵素,经高效液相色谱法测定的二苯乙烯苷的质量浓度为78.18 μg/mL,由戊四氮构建癫痫小鼠模型,对SPF级小鼠连续灌胃滨海白首乌酵素。结果表明,白首乌酵素的摄入可提高癫痫小鼠的空间学习和记忆能力,缓解海马体组织损伤、提高癫痫小鼠血清和海马体组织的抗氧化能力以及降低海马体组织炎症因子水平,表明滨海白首乌酵素具有较好的缓解癫痫引起的认知损伤、抗氧化和抗炎效果,且其作用机制与调节NF-κB信号通路有关。
[1]宋俊梅,曲静然,丁霄霖.白首乌一般成分的研究[J].食品研究与开发,2002(1):52-54.
[2]施建丰,彭子萱,彭蕴茹,等.白首乌中抗肿瘤活性成分告达庭-3-O-β-D-磁麻糖苷在大鼠体内的代谢产物分析[J].南京中医药大学学报,2021,37(3):428-433.
[3]赵家文.泰山白首乌中C_(21)甾体化合物的分离鉴定及其抑制Hedgehog信号通路活性的研究[D].杭州:浙江省医学科学院,2017.
[4]史经略.首乌保健啤酒的研制[J].中国酿造,2010,29(7):176-179.
[5]姜峰,晏子玉,乐治平.发酵过程中青梅酵素的活性成分及其抗氧化性能[J].南昌大学学报(工科版),2021,43(3):227-233.
[6]白浩,文佳嘉,费爽雯,等.酵素的功能与综合应用研究进展[J].食品工业,2017,38(6):270-272.
[7]王海英.番木瓜酵素的研究与制备[D].天津:天津科技大学,2018.
[8]李凡,吕兵.白首乌酵素发酵工艺的优化[J].食品工业科技,2019,40(3):179-184.
[9]李凡.滨海白首乌酵素的制备及其功效性研究[D].无锡:江南大学,2019.
[10]邱文娟,胡小伟,张正春.癫痫发病机制及治疗的研究进展[J].中华临床医师杂志,2014,8(10):1920-1924.
[11]NGUGI A K,BOTTOMLEY C,FEGAN G,et al.Premature mortality in active convulsive epilepsy in rural Kenya:causes and associated factors[J].Neurology,2014,82(7):582-589.
[12]MOSHÉ S L,PERUCCA E,RYVLIN P,et al.Epilepsy:new advances[J].Lancet,2015,385(9971):884-898.
[13]秦兵,廖卫平,臼井直敬,等.癫痫:全球重点防治的神经精神疾病[J].实用医学杂志,2012,28(13):2109-2111.
[14]洪震,黄茂盛.癫痫患者的认知功能状况分析[J].临床神经电生理学杂志,2002,11(2):88-90.
[15]丁松青.托吡酯、丙戊酸钠、卡马西平治疗脑炎后癫痫的有效性和安全性比较[J].现代实用医学,2013,25(1):71-72.
[16]KWAN P,BRODIE M J.Early identification of refractory epilepsy[J].N Engl J Med,2000,342(5):314-319.
[17]吴隽松,滕飞翔,杨留才.白首乌酒对癫痫大鼠神经元保护作用及其机制研究[J].中国酿造,2020,39(11):143-146.
[18]赵健,李凤华,杨丽,等.超高效液相色谱-质谱/质谱联用法测定泰山白首乌中γ-氨基丁酸含量及其相关药效分析[J].世界科学技术(中医药现代化),2012,14(5):2029-2035.
[19]RACINE R J.Modification of seizure activity by electrical stimulation.Ⅱ.Motor seizure[J].Electroencephalogr Clin Neurophysiol,1972,32(3):281-294.
[20]曾春梅,雷丹青,孙兰凤,等.致痫大鼠海马谷氨酸及γ-氨基丁酸在痫性发作后含量变化规律[J].南京医科大学学报(自然科学版),2019,39(11):1571-1574,1588.
[21]谢瑞,徐敏,吴凡,等.α-倒捻子素对癫痫小鼠学习记忆及海马神经元的保护作用[J].中药材,2019,42(10):2401-2405.
[22]曹骋,贾薇,王术玲,等.LSA-21型大孔吸附树脂富集何首乌中二苯乙烯的工艺研究[J].中国实验方剂学杂志,2011,17(10):50-53.
[23]DU P,ZHOU J H,ZHANG L,et al.GC×GC-MS analysis and hypolipidemic effects of polyphenol extracts from Shanxi-aged vinegar in rats under a high fat diet[J].Food Funct,2020,11(9):7468-7480.
[24]DU P,SONG J,Qiu H R,et al.Polyphenols extracted from Shanxi-aged vinegar inhibit inflammation in LPS-induced RAW264.7 macrophages and ICR mice via the suppression of MAPK/NF-κB pathway activation[J].Molecules,2021,26(9):2745.
[25]DU L,LI J K,ZHANG X T,et al.Pomegranate peel polyphenols inhibits inflammation in LPS-induced RAW264.7 macrophages via the suppression of MAPKs activation[J].J Funct Foods,2018,43:62-69.
[26]张高炼,郭建辉,曾敬,等.基于PI3K/AKT信号通路研究草果知母汤对锂-匹罗卡品诱导的癫痫大鼠的神经保护作用[J].中药药理与临床,2021,37(3):16-20.
[27]YAFFE K,KANAYA A,LINDQUIST K,et al.The metabolic syndrome,inflammation,and risk of cognitive decline[J].JAMA,2004,292(18):2237-2242.
[28]王晓晨,吉爱国.NF-κB信号通路与炎症反应[J].生理科学进展,2014,45(1):68-71.