肥胖症是全球最普遍的健康问题之一,是导致死亡的主要风险因素[1]。肥胖与肠道菌群的结构及功能变化有关,越来越多的证据表明,肠道菌群在肥胖、肥胖相关炎症和胰岛素抵抗的发展中发挥着重要作用[2-3],肠道菌群失调可导致肥胖及其并发症的发生[4]。益生菌发酵的功能食品可以通过改善肠道菌群紊乱进而改善健康[5],鼠李糖乳杆菌(Lactobacillus rhamnosus Gorbach-Goldin,LGG)是人类研究最广泛的一种益生菌,具有平衡肠道菌群、改善肠道健康、增强肠粘膜屏障、预防和治疗腹泻、预防与促进过敏恢复、预防龋齿等功效[6-7]。
大果山楂(Malus domeri(Bois)Chev.)是一种有着悠久历史的药食两用水果,在世界各地均有种植[8]。研究表明,大果山楂提取物可以有效预防或治疗Ⅱ型糖尿病[9],能够通过诱导腺苷酸激活蛋白激酶(adenosine 5'-monophosphate(AMP)-activated protein kinase,AMPK)磷酸化来降低葡萄糖的产生和甘油三酯的合成[10],可以作为抗糖尿病和抗高脂血症植物营养素因子的候选来源[11]。大果山楂中的多酚类化合物含量丰富,具有抗氧化、抑制自由基和降低高脂血症的效果[12-13]。山楂果胶多酚能显著降低高脂小鼠的肝脏质量、血清总胆固醇、肝脏甘油三酯、低密度脂蛋白和总脂质水平[14-15],可以作为膳食补充剂用于预防脂肪肝和氧化损伤,在开发功能性食品方面具有很大潜力[16-17]。越来越多的研究表明,天然产物发酵制品可以通过调节肠道菌群改善肥胖及相关的代谢综合症[18-19],但大果山楂发酵制品对肠道菌群的影响尚未见报道。大果山楂味道酸涩,不宜直接食用,益生菌发酵可有效改善大果山楂的涩味[20]。因此,本研究采用鼠李糖乳杆菌(LGG)发酵新鲜大果山楂所得的大果山楂发酵液来饲喂高脂小鼠,旨在探讨其对高脂饮食小鼠肥胖指标及肠道菌群的影响。
1 材料与方法
1.1 材料与试剂
大果山楂:采自广东省连山县某大果山楂种植基地。
小鼠:6周龄雄性C57BL/6小鼠体质量(20±2 g),饲料由广东省医学实验动物中心提供。小鼠被置于控温和光照条件下(25 ℃,光照-暗循环12 h)饲养,自由获取食物和水。
没食子酸、儿茶素等标准品(纯度均≥98%):美国Sigma公司;表儿茶素、原花青素、咖啡酸、金丝桃苷、异槲皮苷、肉桂酸、绿原酸、根皮苷、熊果酸、齐墩果酸、山楂酸、科罗索酸等标准品(纯度均≥98%):上海纯晶生化科技有限公司;戊巴比妥钠(批号:F20190816)、抗凝剂EDTA-K2:国药集团上海化学试剂有限公司;总胆固醇(total cholesterol,TC)、高密度脂蛋白(high-density lipoprotein,HDL)、低密度脂蛋白(low-density lipoprotein,LDL)和肝甘油三酯(triglyceride,TG)酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)试剂盒(批号:20190718):南京建成生物工程研究所;粪便脱氧核糖核酸(deoxyribonucleic acid,DNA)分离试剂盒:广州IGE生物技术有限公司;MRS培养基、鼠李糖乳杆菌(LGG)CBS98073:广东环凯微生物科技有限公司。
发酵培养基:大果山楂20%、葡萄糖5%、蛋白胨2%、酵母膏1%,自然pH值,115 ℃灭菌20 min。
1.2 仪器与设备
DS-1高速组织捣碎机:上海精密科学仪器有限公司;LDZF-50L-III高压灭菌锅:上海申安有限公司;ZY-800发酵罐:上海紫裕生物科技有限公司;TGL-20M离心机:湖南湘仪实验室仪器开发有限公司;Waters1525高效液相色谱仪、二级阵列管检测器、Waters2707自动进样器、反相色谱柱(4.6 mm×250 mm,5 μm):美国Waters公司;Illumina Miseq测序仪PE2500:美国Illumina公司。
1.3 方法
1.3.1 大果山楂发酵液制备的工艺流程及操作要点
大果山楂→洗净→去核→打浆→调配→灭菌→接种→发酵→离心→灭菌→大果山楂发酵液
操作要点:将鼠李糖乳杆菌(LGG)CBS98073接入装有MRS培养基的摇瓶中,于28 ℃培养7 d,然后按5×106CFU/mL接种至装有发酵培养基的发酵罐中进行发酵,28 ℃、120 r/min发酵21 d。发酵结束后离心收集上清液于115 ℃灭菌20 min即得大果山楂发酵液,4 ℃贮存备用。
1.3.2 大果山楂发酵液中主要活性成分含量测定
参考温玲蓉[21]的方法进行测定,采用反相高效液相色谱(reversed-phase high performance liquid chromatography,RP-HPLC)法鉴定大果山楂发酵液中的主要活性成分,根据保留时间确定化合物种类,并对其主要化合物进行定量分析[22]。色谱条件如下:反相色谱柱(4.6 mm×250 mm,5 μm);流动相为0.1%三氟乙酸(A),甲醇(B);流速1.00 mL/min;检测波长280 nm、340 nm、217 nm;柱温35 ℃;进样量10 μL。实验结果表示为大果山楂发酵液中所含的化合物含量(mg/L)。
1.3.3 动物试验
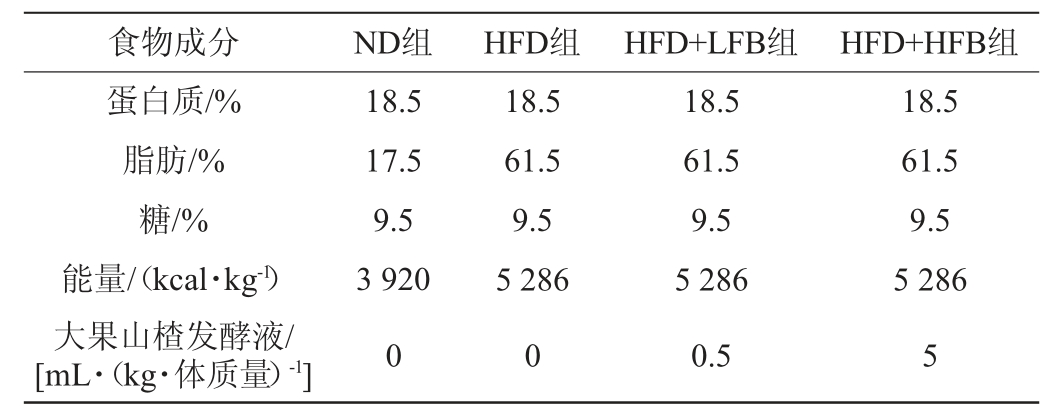
32只6周龄雄性小鼠被随机分为4组(对照组(ND)、高脂饮食组(HFD)、低浓度大果山楂发酵液组(HFD+LFB)、高浓度大果山楂发酵液组(HFD+HFB)),每组8只。对照组(ND)和高脂饮食组(HFD)分别允许自由进食正常饮食和高脂饲料,灌胃生理盐水;低浓度大果山楂发酵液组(HFD+LFB)自由进食高脂饲料,灌胃低浓度大果山楂发酵液;高浓度大果山楂发酵液组(HFD+HFB)自由进食高脂饲料,灌胃高浓度大果山楂发酵液。处理12周后所有小鼠经历12 h禁食后测定体质量,采用1%戊巴比妥钠(50 mg/(kg·体质量))对小鼠进行深度麻醉后处死。动物实验经广州医科大学实验动物伦理委员会批准(2019-083)。小鼠饮食成分见表1。
表1 小鼠饮食成分
Table 1 Dietary components of mice
1.3.4 肝脏指数和内脏脂肪指数测定[23]
处死小鼠后,分离肝脏和内脏脂肪并分别称质量,按下式计算肝脏指数与内脏脂肪指数:

1.3.5 组织学分析
解剖小鼠后,取出肝脏浸于-80 ℃液氮中保存,在低温条件下送往武汉塞维尔生物科技有限公司进行油红O(切片)染色。
1.3.6 生化分析
解剖小鼠后,经腹主动脉取出全血,置于含抗凝剂EDTA-K2的小试管中。血样于4 ℃、4 000 r/min离心10 min后取上清液,采用ELISA试剂盒测定血浆总胆固醇(TC)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)和肝甘油三酯(TG)。
1.3.7 肠道菌群分析
小鼠饲养12周后,采集粪便标本进行16S rRNA基因测序。首先利用粪便DNA分离试剂盒提取粪便DNA,然后用特异性引物对16S rRNA基因的V4区进行聚合酶链式反应(polymerase chain reaction,PCR)扩增,纯化PCR产物至相同的DNA浓度,使用Illumina Miseq测序仪PE2500进行测序,基于相似度99%对所有样品的全部non_chimeras序列聚类(聚类软件为Qiime调用Uclust),将序列聚类成为操作分类单元(operational taxonomic units,OTUs),去除所有样本中只出现一次的OTUs。利用GreenGene数据库通过核糖体数据库项目(ribosomal database project,RDP)Classifier(Version 2.2)对每个OTU进行物种注释confidence cutoff 0.8,同时基于各个样本在不同分类水平上的物种组成及丰度信息进行统计汇总。
1.3.8 统计分析
采用GraphPad Prism 7.0版软件对数据进行统计分析,数据以“平均值±标准差”表示,多组间差异比较采用单因素方差分析(analysis of variance,ANOVA),两两比较采用SNK-q检验。
2 结果与分析
2.1 大果山楂发酵液中的主要活性成分
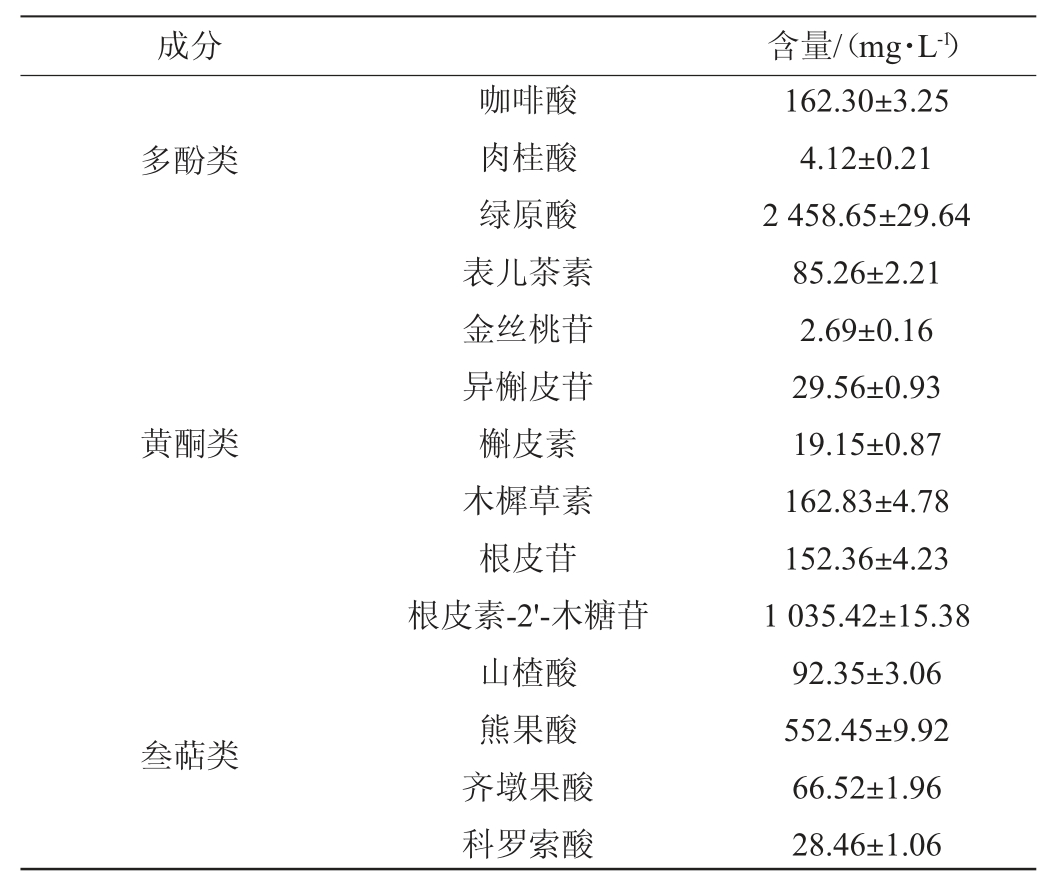
大果山楂发酵液中的主要活性成分含量见表2。由表2可知,大果山楂发酵液中主要含有多酚类(咖啡酸、肉桂酸、绿原酸)、黄酮类(表儿茶素、金丝桃苷、异槲皮苷、槲皮素、木樨草素、根皮苷和根皮素-2'-木糖苷)和叁萜类(山楂酸、熊果酸、齐墩果酸和科罗索酸)化合物,其中多酚类和黄酮类物质与肠道菌群调节、改善肥胖及其并发症密切相关[24]。
表2 山楂发酵液中的主要活性成分含量
Table 2 Content of main active components in fermented hawthorn broth
2.2 大果山楂发酵液对高脂饮食小鼠体质量和脂肪积累量的影响
由图1(A)可知,与ND组相比,HFD组小鼠体质量增加极显著(P<0.01),说明高脂饮食导致了小鼠肥胖;与HFD组相比,HFD+LFB组和HFD+HFB组小鼠体质量均出现下降,但HFD+LFB组小鼠体质量下降不显著(P>0.05),HFD+HFB组小鼠体质量下降显著(P<0.05),说明大果山楂发酵液可以抑制由高脂饮食导致的肥胖,且这种抑制作用与大果山楂发酵液的摄入量有关。
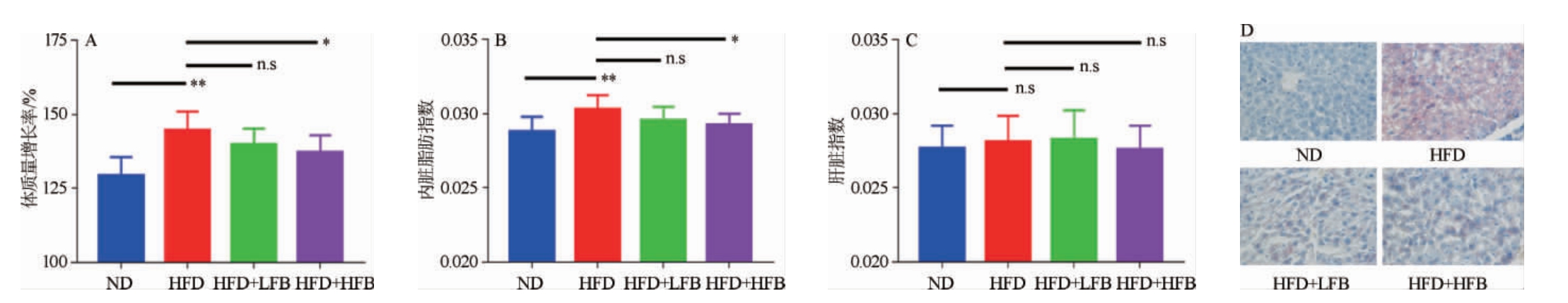
图1 山楂发酵液对高脂饮食小鼠体质量和脂肪积累量的影响
Fig.1 Effects of fermented hawthorn broth on body mass and fat accumulation of high-fat diet mice
“n.s”表示两组数据之间没有显著性差异(P>0.05),“*”表示两组数据之间有显著性差异(P<0.05),“**”表示两组数据之间有极显著性差异(P<0.01)。下同。
内脏脂肪指数是反映动物肥胖程度的重要指标[25],由图1(B)可知,与ND组相比,HFD组小鼠内脏脂肪指数增加极显著(P<0.01),说明高脂饮食会促进脂肪在小鼠体内堆积;与HFD组相比,HFD+LFB组和HFD+HFB组小鼠内脏脂肪指数均出现下降,但HFD+LFB组小鼠内脏脂肪指数下降不显著(P>0.05),HFD+HFB组小鼠内脏脂肪指数显著下降(P<0.05),说明大果山楂发酵液能抑制小鼠体内脂肪的积累。
肝脏指数是反映动物肝脏质量随体质量变化的常用指标[26],由图1(C)可知,各组小鼠的肝脏指数差异均不显著(P>0.05),说明高脂饲料和大果山楂发酵液的摄入并未明显促进小鼠肝脏指数的改变,这与相关报道不一致[27]。
由图1(D)可知,各组小鼠的肝细胞形态基本正常,与ND组相比,HFD组小鼠肝脏组织油红O染色面积明显增大,说明高脂饮食会导致小鼠肝脏脂肪数目增多;与HFD组比较,HFD+LFB组和HFD+HFB组小鼠肝脏组织油红O染色面积明显减小,较为稀疏,说明大果山楂发酵液的摄入减缓了小鼠肝细胞中脂肪的堆积。
2.3 大果山楂发酵液对高脂饮食小鼠血脂含量的影响
由图2可知,与ND组相比,HFD组小鼠出现高血脂症状,高密度脂蛋白(HDL)浓度显著下降(P<0.05)(图2C),总胆固醇(TC)(图2A)、肝甘油三酯(TG)(图2B)和低密度脂蛋白(LDL)(图2D)浓度均有不同程度的上升,其中TG浓度上升极显著(P<0.01),TC浓度上升显著(P<0.05),LDL浓度上升但不显著(P>0.05),说明高脂饮食小鼠肥胖模型比较成功。经过大果山楂发酵液干预后,各组小鼠的高血脂症状均有不同程度的减轻,与HFD组相比,HDL浓度上升,TG、TC和LDL浓度均有不同程度的下降,由图2(B)可以看出,HFD+HFB组的TG浓度相对HFD组显著降低(P<0.05),说明大果山楂发酵液可改善由高脂饮食造成的血脂升高现象。
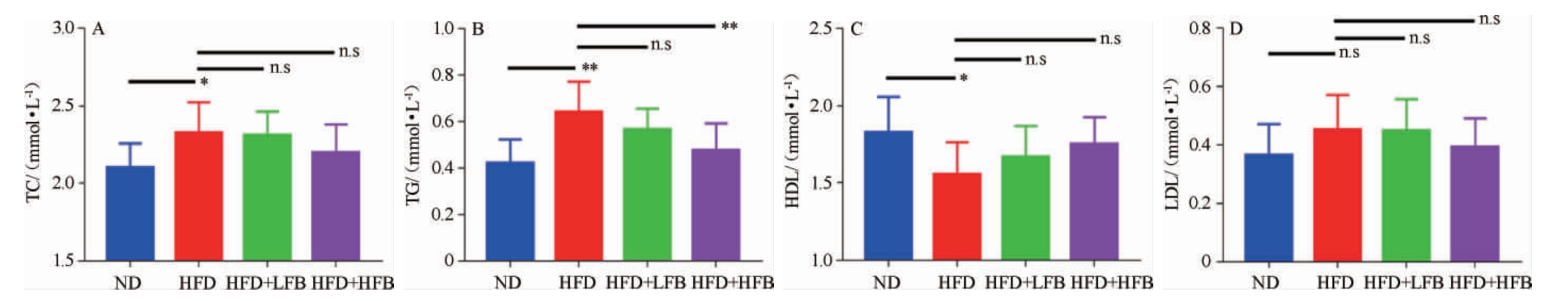
图2 山楂发酵液对高脂饮食小鼠血脂含量的影响
Fig.2 Effect of fermented hawthorn broth on blood lipid content in high-fat diet mice
2.4 大果山楂发酵液对高脂饮食小鼠肠道菌群丰度和多样性的影响
从各分类层级获得注释OTUs数量统计结果(图3A)可以看出,与ND组比较,HFD组小鼠肠道菌群丰度明显降低,差异极显著(P<0.01),说明高脂饮食会显著降低小鼠肠道菌群的丰富度,这与相关报道结果一致[28];与HFD组比较,HFD+LFB组和HFD+HFB组小鼠肠道菌群丰度均有不同程度的上升,但HFD+LFB组上升不显著(P>0.05),HFD+HFB组上升极显著(P<0.01),说明大果山楂发酵液的干预可以逆转由高脂饮食导致的小鼠肠道菌群丰度降低,且这种效应与大果山楂发酵液的摄入量呈正相关。Alpha多样性分析可用于分析样品内群落的丰富度和均匀度,Chao1指数是Alpha多样性分析中最常用的指标之一,Chao1指数越大,说明样品中的物种越丰富[29],物种丰富度相同的情况下,菌落中各物种均匀度越大,菌落多样性越大[30]。从图3B可知,与ND组比较,HFD组的Chao1指数出现下降;与HFD组比较,HFD+LFB组和HFD+HFB组的Chao1指数出现回升,而且HFD+HFB组与HFD组有显著性差异(P<0.05),说明高脂饮食会降低小鼠肠道菌群的丰富度和均匀度,大果山楂发酵液可逆转这种现象,而且这种逆转能力与大果山楂发酵液摄入量正相关。从各样品对应的物种注释结果在门水平上的相对丰度柱形图(图3C)可以看出,变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)是小鼠肠道中的优势菌群,这与相关报道结果一致[31]。高脂饮食和大果山楂发酵液的干预改变了小鼠肠道菌群的结构,与ND组比较,HFD组小鼠肠道Bacteroidetes(B)的相对丰度下降,Firmicutes(F)的相对丰度上升,F/B值上升;与HFD组比较,HFD+LFB组和HFD+HFB组小鼠肠道Bacteroidetes的相对丰度上升,Firmicutes的相对丰度下降,F/B值降低,说明高脂饮食导致了小鼠肠道菌群失调,大果山楂发酵液可以调节高脂饮食导致的肥胖小鼠肠道菌群在门水平上的组成,且这种调节能力与大果山楂发酵液的摄入量正相关。
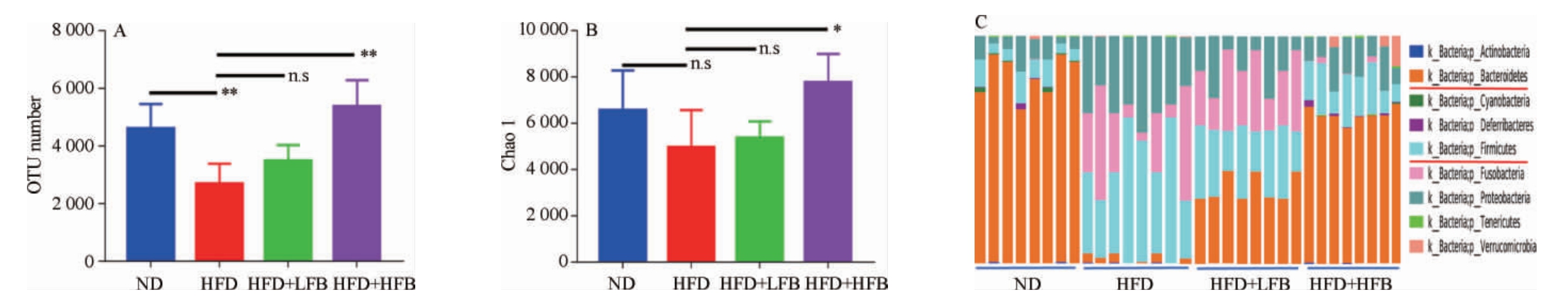
图3 山楂发酵液对高脂饮食小鼠肠道菌群丰度和多样性的影响
Fig.3 Effects of fermented hawthorn broth on the abundance and diversity of intestinal flora in high-fat diet mice
2.5 大果山楂发酵液对高脂饮食小鼠肠道特定菌群的影响
进一步分析了各组小鼠肠道菌群在属和种水平上的差异菌,在属水平上各组小鼠肠道菌群能够注释到的物种主要包括萨特菌(Sutterella)、Flexispira、普雷沃氏菌(Prevotella)、副拟杆菌(Parabacteroides)等,在种水平上各组小鼠肠道菌群能够注释到的物种主要包括隐藏梭菌(Clostridium celatum)、类腐败梭菌(Clostridium paraputrificum)、高山姬鼠螺杆菌(Helicobacter apodemus)和产酸拟杆菌(Bacteroides acidifaciens)等。由图4可知,与ND组相比,HFD组小鼠肠道的Sutterella、Flexispira、Clostridiumcelatum、Clostridium paraputrificum和Helicobacter apodemus相对丰度升高,Prevotella、Parabacteroides和Bacteroides acidifaciens的相对丰度降低;与HFD组比较,HFD+LFB组和HFD+HFB组小鼠肠道的Sutterella、Flexispira、Clostridium celatum、Clostridium paraputrificum和Helicobacter apodemus相对丰度降低,Prevotella、Parabacteroides和Bacteroides acidifaciens的相对丰度升高。高脂饮食改变了小鼠肠道菌群的结构,大果山楂发酵液干预增加了高脂饮食小鼠肠道菌群的丰度和多样性,特别是与肥胖及免疫调节相关的菌群,其中Sutterella是短链脂肪酸的主要生产微生物,短链脂肪酸是结肠上皮细胞营养的主要来源,具有抗炎和调节肠道免疫等作用[32],Parabacteroides具有改善炎症性肠病(inflammatory bowel disease,IBD)、非酒精性脂肪肝和肥胖的作用[33],Prevotella可以通过影响肠道通透性来调节宿主机体免疫力[34],肠道内Bacteroides相对丰度升高可能通过介导炎症效应参与胰岛素抵抗、肥胖等疾病的发生[35],Bacteroides acidifaciens可能具有治疗糖尿病和肥胖症等代谢性疾病的潜力[36]。结合大果山楂发酵液中主要活性成分检测结果和肥胖指标检测结果,推测大果山楂发酵液中的黄酮类、多酚类等化合物可能通过调节小鼠肠道中的上述菌群丰度抑制由高脂饮食导致的脂肪堆积,进而改善血脂异常。
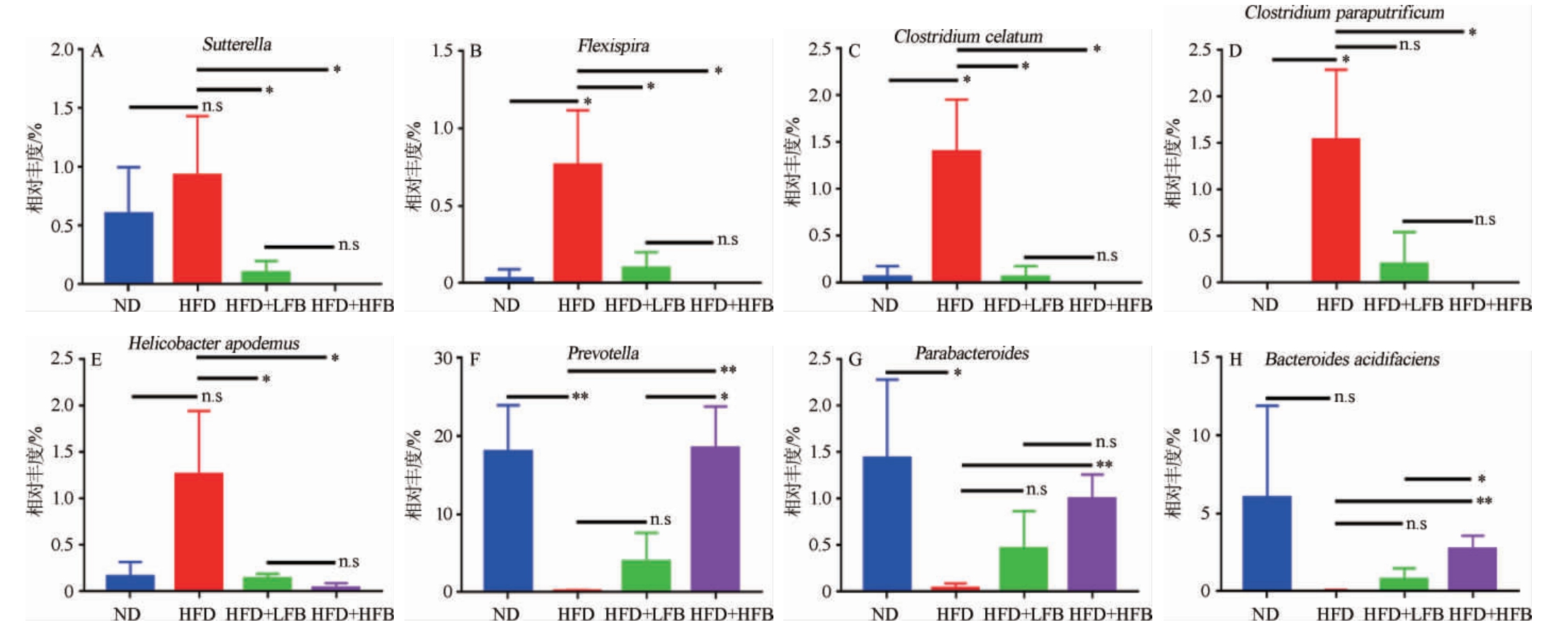
图4 山楂发酵液对高脂饮食小鼠肠道特定菌群的影响
Fig.4 Effects of fermented hawthorn broth on specific intestinal flora of high-fat diet mice
3 结论
通过研究大果山楂发酵液对高脂饮食诱导小鼠肥胖指标及肠道菌群的调节作用,结果表明,摄入大果山楂发酵液可以抑制小鼠体质量的增加,促进肥胖小鼠的脂肪积累量和血脂水平向正常化恢复,从而降低肥胖的风险;大果山楂发酵液还可以显著提升高脂小鼠肠道菌群的丰度和多样性,在门水平上提升高脂小鼠肠道拟杆菌门(Bacteroidetes)的相对丰度,降低厚壁菌门(Firmicutes)的相对丰度,从而降低F/B值,改善高脂小鼠肠道菌群失调;在属和种水平上通过调节特定菌群(如Sutterella、Flexispira、Prevotella、Parabacteroides、Clostridium celatum、Clostridium paraputrificum、Helicobacter apodemus和Bacteroides acidifaciens等)的相对丰度使高脂小鼠的肠道菌群向正常化转变,调节肠道屏障,改善肥胖引起的代谢紊乱。因此,大果山楂发酵液在肠道菌群的调节中呈现良好的益生作用,可作为功能性食品成分预防肠道微生态失调,通过调节肠道菌群的结构实现减脂的目的。
[1]SINGER-ENGLAR T,BARLOW G,MATHUR R.Obesity,diabetes,and the gut microbiome:an updated review[J].Expert Rev Gastroenterol Hepatol,2019,13(1):3-15.
[2]BARATHIKANNAN K,CHELLIAH R,RUBAB M,et al.Gut microbiome modulation based on probiotic application for anti-obesity:A review on efficacy and validation[J].Microorganisms,2019,7(10):456.
[3]CÂNDIDO F G,VALENTE F X,GRZES′KOWIAK Ł M,et al.Impact of dietary fat on gut microbiota and low-grade systemic inflammation:mechanisms and clinical implications on obesity[J].Int J Food Sci Nutr,2018,69(2):125-143.
[4]GENTILE C L,WEIR T L.The gut microbiota at the intersection of diet and human health[J].Science,2018,362(6416):776-780.
[5]QIAN L M,GAO R Y,HUANG J M,et al.Supplementation of triple viable probiotics combined with dietary intervention is associated with gut microbial improvement in humans on a high-fat diet[J].Exp Ther Med,2019,18(3):2262-2270.
[6]CAPURSO L.Thirty years of Lactobacillus rhamnosus GG:A review[J].J Clin Gastroenterol,2019,53(Suppl 1):S1-S41.
[7]SEGERS M E,LEBEER S.Towards a better understanding of Lactobacillus rhamnosus GG-host interactions[J].Microb Cell Fact,2014,13(Suppl 1):S7.
[8]潘莹,张林丽.大果山楂的研究进展[J].时珍国医国药,2007,18(12):2972-2973.
[9]AIERKEN A,BUCHHOLZ T,CHEN C,et al.Hypoglycemic effect of hawthorn in type II diabetes mellitus rat model[J].J Sci Food Agric,2017,97(13):4557-4561.
[10]LI T P,LI S H,DONG Y P,et al.Antioxidant activity of penta oligogalacturonide,isolated from haw pectin,suppresses triglyceride synthesis in mice fed with a high-fat diet[J].Food Chem,2014,145:335-341.
[11]HU C Q,ZHANG Y,LIU G R,et al.Untargeted metabolite profiling of adipose tissue in hyperlipidemia rats exposed to hawthorn ethanol extracts[J].J Food Sci,2019,84(4):717-725.
[12]郭兵兵,叶志青,黄欣欣,等.大果山楂多酚氧化酶的酶特性研究[J].保鲜与加工,2017,17(4):20-24.
[13]黄欣欣.大果山楂黄酮类物质的提取及其抗氧化性和降血脂功能研究[D].南宁:广西大学,2015.
[14]ZHU R G,SUN Y D,Li T P,et al.Comparative effects of hawthorn(Crataegus pinnatifida Bunge) pectin and pectin hydrolyzates on the cholesterol homeostasis of hamsters fed high-cholesterol diets[J].Chem Biol Interact,2015,238:42-47.
[15]HU H J,LUO X G,DONG Q Q,et al.Ethanol extract of Zhongtian hawthorn lowers serum cholesterol in mice by inhibiting transcription of 3-hydroxy-3-methylglutaryl-CoA reductase via nuclear factor-kappa B signal pathway[J].Exp Biol Med,2016,241(6):667-674.
[16]ZHU R G,LI T P,DONG Y P,et al.Pectin penta saccharide from hawthorn(Crataegus pinnatifida Bunge.Var.major)ameliorates disorders of cholesterol metabolism in high-fat diet fed mice[J].Food Res Int,2013,54(1):262-268.
[17]LI T P,ZHU R G,DONG Y P.Effects of pectin penta oligosaccharide from Hawthorn(Crataegus pinnatifida Bunge.var.Major)on the activity and mRNA levels of enzymes involved in fatty acid oxidation in the liver of mice fed a high-fat diet[J].J Agric Food Chem,2013,61(31):7599-7605.
[18]SHIH C C,LIN C H,LIN Y J,et al.Validation of the antidiabetic and hypolipidemic effects of Hawthorn by assessment of gluconeogenesis and lipogenesis related genes and AMP-Activated protein kinase phosphorylation[J].Evide Based Complement Alternat Med,2013,2013:597067.
[19]XIE W H,SUN C,LIU S M.Effect of hawthorn flavanone on blood-fat and expression of lipogenesis and lipolysis genes of hyperlipidemia model mouse[J].Zhong guo Zhong Yao Za Zhi,2009,34(2):224-229.
[20]张巧,柯博芳,唐小闲,等.不同发酵菌种对大果山楂酵素品质的影响[J].食品工业,2020,41(6):162-166.
[21]温玲蓉.北山楂和大果山楂的活性成分及其抗氧化与抗增殖活性研究[D].广州:华南理工大学,2016.
[22]ZHAO H D,HU X,CHEN X Q,et al.Analysis and improved characterization of minor antioxidants from leaves of Malus doumeri using a combination of major constituents'knockout with high-performance liquid chromatography-diode array detector-quadrupole time-of-flight tandem mass spectrometry[J].J Chromatogr A,2015,1398:57-65.
[23]LIU J P,ZOU W L,CHEN S J,et al.Effects of different diets on intestinal microbiota and nonalcoholic fatty liver disease development [J].World J Gastroenterol,2016,22(32):7353-7364.
[24]程天德,陈清乐,李雪平.液体深层发酵提高粤北大果山楂发酵液中主要活性成分含量及其抗氧化能力[J].现代食品科技,2020,36(12):111-117,68.
[25]GODWIN M.Obesity:Epidemiology,pathophysiology,and prevention[J].JAMA,2008,299(17):2092-2093.
[26]王丽媛,秦文,霍军生,等.黄酒对高脂饮食小鼠的肥胖指标及肠道菌群的影响[J].中国酿造,2019,38(12):53-57.
[27]WANG Y,YU M,SHI Y W,et al.Effects of a fermented beverage of Changbai mountain fruit and vegetables on the composition of gut microbiota in mice[J].Plant Foods Hum Nutr,2019,74(4):468-473.
[28]王方杰,吴祖芳,翁佩芳,等.胡柚黄酮对高脂饮食诱导的肥胖小鼠模型肠道菌群的调节作用[J].食品科学,2020,41(21):140-146.
[29]SCHLOSS P D,WESTCOTT S L,RYABIN T,et al.Introducing mother:Open-source,platform-independent,community-supported software for describing and comparing microbial communities[J].Appl Environ Microbiol,2009,75(23):7537-7541.
[30]高洁,孙静,黄建,等.开菲尔对高脂金黄地鼠肠道菌群的调节作用研究[J].中国酿造,2017,36(4):15-19.
[31]TURNBAUGH P J,LEY R E,MAHOWALD M A,et al.An obesity associated gut microbiome with increased capacity for energy harvest[J].Nature,2006,444(7122):1027-1131.
[32]VINOLO M A,RODRIGUES H G,NACHBAR R T,et a1.Regulation of inflammation by short chain fatty acids[J].Nutrients,2011,3(10):858-876.
[33]CEKANAVICIUTE E,YOO B B,RUNIA T F,et al.Gut bacteria from multiple sclerosis patients modulate human T cells and exacerbate symptoms in mouse models[J].Proc Natl Acad Sci U S A,2017,114(40):10713-10718.
[34]MARIETTA E V,MURRAY J A,LUCKEY D H,et a1.Suppression of inflammatory arthritis by human gut-derived Prevotella histicola in humanized mice[J].Arthritis Rheumatol,2016,68(12):2878-2888.
[35]GRASSET E,PUEL A,CHARPENTIER J,et al.A specific gut microbiota dysbiosis of type 2 diabetic mice induces GLP-1 resistance through an enteric NO-dependent and gut-brain axismechanism[J].Cell Metab,2017,25(5):1075-1090.
[36]YANG J Y,LEE Y S,KIM Y,et al.Gut commensal Bacteroides acidifaciens prevents obesity and improves insulin sensitivity in mice[J].Mucosal immunol,2017,10(1):104-116.