精酿啤酒(craft beer)也称为工坊啤酒,指由生产规模较小的商业化企业或作坊生产且酿造工艺、原料、酵母种类独特的啤酒产品[1]。目前,果味啤酒是新型工坊啤酒开发的热点,如比利时和林德曼啤酒[2]。为增加啤酒中的果香味,酿造工艺中常添加果汁、酒花和产香酵母以提升风味[3-4],其中产香酵母菌起到关键作用[5]。
产香酵母主要包括汉逊酵母(Hanseniaspora sp.)、球拟酵母(Torulopsis sp.)、克勒克酵母(Kloeckera sp.)、假丝酵母(Candida sp.)和毕赤酵母(Pichia sp.)等[6-8],其在发酵过程产生的酯类、高级醇和低级脂肪酸等能够赋予啤酒浓郁的醇、酯香味[9-12]。产香酵母在发酵过程中能生成大量风味物质前体物,何松等[13]采用非酿酒酵母发酵水蜜桃,发现果酒中产生了大量的芳香类物质,改善了果酒的发酵风味。目前,精酿果啤生产所使用的酵母多为工业用啤酒酵母,使用单一啤酒酵母发酵会造成产品风味单调、口味平淡[14-15],非酿酒酵母和商业化啤酒酵母混合使用在保证了精酿啤酒基础风味的前提下可增加酯香风味物质[16-18]。因此,产香酵母菌种的优化、培育、筛选对啤酒品质具有重要的意义[19]。目前,已发现的生香酵母大多从固态酒、调味品酿造中分离而来[20],而从谷物中筛选出产香酵母并应用到啤酒酿造中的研究鲜见报道。
因此,本研究利用嗅闻技术和气相色谱-质谱联用(gas chromatography-mass spectrography,GC-MS)法检测技术,从传统谷物大米发酵液中筛选具有浓郁果香风味的酵母,通过形态观察、生理生化试验和分子生物学技术对其进行鉴定,并对其耐受性进行分析,以期为果香味精酿啤酒提供优良的酵母菌株。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
大米发酵液:哈尔滨某工厂;大麦芽:哈尔滨广汇生活超市。
1.1.2 试剂
ExTaq酶RR001:南京建成生物工程研究所;脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)Mix、10×ExTaq Buffer:日本TaKaRa公司;引物:上海生物工程有限公司;DL2000脱氧核糖核酸(deoxyribonucleic acid,DNA)Marker:北京博迈德生物技术有限公司;真菌基因组DNA提取试剂盒:杭州爱思进生物技术有限公司。
1.1.3 培养基
孟加拉红固体培养基[4]:蛋白胨5 g/L、葡萄糖10 g/L、磷酸二氢钾1 g/L、硫酸镁0.5 g/L、孟加拉红0.03 g/L、氯霉素0.1 g/L、琼脂20 g/L、蒸馏水1 L,121 ℃高压蒸汽灭菌15 min。
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基[9]:蛋白胨20g/L、酵母浸粉10g/L、葡萄糖20g/L、蒸馏水1 L,固体培养基中添加2%的琼脂。121 ℃高压蒸汽灭菌15 min。
麦芽汁糖化液[21]:将原料大麦芽粉碎调浆(料水比为1∶2(g∶mL))后,搅拌均匀,升温至65 ℃糖化30 min,滤去纤维渣后煮沸15 min至糖度达12°Bx左右。
1.2 仪器与设备
YXQ-70A型立式压力蒸汽灭菌器:上海博讯实业有限公司;H1650型医用离心机:湖南湘仪离心机仪器有限公司;JEI002型电子天平:上海浦春计量仪器有限公司;DHP-9162型电热恒温培养箱、DHG-9203A型电热鼓风干燥箱:上海一恒科技有限公司;UV-2450紫外可见分光光度计:上海元析仪器有限公司;HDL型超净工作台:北京市东联哈尔仪器制造厂;聚合酶链式反应(polymerase chain reaction,PCR)仪:杭州郎基科学仪器有限公司;HH-S4型恒温水浴锅:巩义市予华仪器有限责任公司;3730XL型测序仪:美国ABI公司;HP6890/5975C气相色谱-质谱联用仪:美国Agilent公司。
1.3 试验方法
1.3.1 酵母菌的分离纯化
在无菌条件下,取100 μL大米发酵液,采用无菌水按10倍梯度稀释至10-6,分别取发酵稀释液100 μL涂布于孟加拉红固体培养基上,于28 ℃条件下培养24 h。待菌落长出后,挑取肉眼可见不同形态的单个菌落划线接种于YPD固体培养基中,反复纯化得到纯菌落。
1.3.2 产果香酵母菌的筛选
将已纯化的菌株分别接种于YPD固体培养基,28 ℃条件下培养48 h。由经过专业训练的嗅觉灵敏的试验人员与国家一级品酒师组成感官评价小组,采用嗅香技术对不同发酵培养基中的风味物质进行评价,以期筛选产香菌株[22]。
1.3.3 酵母菌产香发酵试验
将产香菌株接种于YPD液体培养基,28 ℃、120 r/min条件下培养24 h后。按照2%(V/V)的接种量将活菌数为2.32×108 CFU/mL的产香菌液接种于麦芽汁糖化液中,在25 L发酵罐中混合均匀,于10 ℃条件下静置发酵6 d,命名为样品A,以未接菌的麦芽汁糖化液为空白组,命名为样品a。
1.3.4 挥发性香气物质的测定
采用GC-MS对样品A、a的挥发性风味物质进行测定[23]。
样品前处理:称取适量样品置于顶空瓶中,加3 mL饱和NaCl溶液密封,于80 ℃条件下平衡30 min,用固相微萃取针萃取30 min。待萃取结束后,萃取针在进样口解吸5 min,萃取结束后采用分液漏斗分液,收集下层溶液并浓缩至5 mL,使用气相色谱-质谱联用仪测定挥发性风味物质。
色谱条件:TG-5MS非极性毛细管色谱柱(30 m×0.25 mm×0.25 μm);升温程序为起始温度45 ℃保持4 min,以6 ℃/min的速率升至130 ℃保持5 min,再以10 ℃/min的速率升至240 ℃保持8 min;进样口温度240 ℃;载气为氦气(He)(纯度99.99%),流速1.0 mL/min;进样量1 μL;不分流进样。
质谱条件:离子源温度230 ℃;四级杆温度180 ℃;电子电离(electronic ionization,EI)源;电子能量70 eV;扫描方式为全扫描;质谱扫描范围为40~600 amu。
定性定量分析:采集到的质谱图利用美国国家标准与技术研究院(national institute of standards and technology,NIST)谱库进行检索,鉴定样品中的挥发性成分,并利用峰面积归一化法分析各成分的相对含量。
1.3.5 产果香酵母菌的鉴定
(1)形态学观察
根据《酵母菌的特征与鉴定手册》[24],观察并记录产香酵母菌株的菌落颜色、形状、大小、湿润度、透明度、边缘是否整齐、菌落质地等特征,记录菌体形态、大小、出芽情况等,对产香菌株进行初步判断。
(2)生理生化鉴定
参照《酵母菌的特征与鉴定手册》[24]和《真菌鉴定手册》[25]对产香酵母菌株进行生理生化试验。
(3)分子生物学鉴定
采用真菌基因组DNA提取试剂盒提取产香酵母菌株的DNA,以其为模板,采用引物ITS1(5'-TCCGTAGGTGAACCTGCGG-3')、ITS4R(5'-TCCTCCGCTTATTGATATGC-3')对其ITS rDNA基因序列进行PCR扩增。PCR扩增体系:10×ExTaq Buffer 5.0 μL,2.5 mmol/L dNTP Mix 4.0 μL,引物ITS1(10 μmol/L)2.0μL,引物ITS4R(10 μmol/L)个2.0 μL,DNA聚合酶0.5 μL,菌液2 μL,双蒸水(ddH2O)34.5 μL。PCR扩增条件:94 ℃预变性3 min;94 ℃变性30 s,54 ℃退火30 s,72 ℃延伸1 min 30 s,共25个循环;72 ℃再延伸10 min。将PCR扩增产物经1%的琼脂糖凝胶电泳检测合格后,委托上海美吉生物医药科技有限公司进行测序。将测序得到的基因序列提交至美国国立生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库中,采用基本局部比对搜索工具(basic local alignment search tool,BLAST)进行同源性搜索比对,选取同源性较高的模式菌株的ITS rDNA基因序列,采用MAGE-x软件中的邻接(neighbor-joining,NJ)法构建系统发育树,并采用Bootstrapin法评估其准确性。
1.3.6 产果香酵母菌生长曲线的测定
将产香菌株接种于YPD液体培养基,28 ℃、120 r/min条件下培养24 h作为种子液(菌体浓度2×107 CFU/mL),备用。
按2%(V/V)的接种量将种子液接种于YPD培养基,28 ℃、120 r/min条件下培养24 h,每2 h取样测定OD600nm值,以发酵时间(x)为横坐标,OD600nm值(y)为纵坐标绘制生长曲线。
1.3.7 产果香酵母菌株的耐受性试验
葡萄糖耐受性:按2%(V/V)的接种量,将产果香酵母菌的种子液分别接种于葡萄糖含量分别为10%、20%、30%、40%、50%、60%的YPD培养基中,28 ℃、120 r/min条件下培养24 h,测定OD600nm值。
酸耐受性:按2%(V/V)的接种量,采用乳酸调节YPD培养基pH值,将产果香酵母菌的种子液接种于pH分别为3.5、4.0、4.5、5.5、6.0的YPD培养基中,28 ℃、120 r/min条件下培养24 h,测定OD600nm值。
乙醇耐受性:按2%(V/V)的接种量,将产果香酵母菌的种子液接种于乙醇体积分数分别为0、2%、4%、6%、8%、10%的YPD培养基中,28 ℃、120 r/min条件下培养24 h,测定OD600nm值。
温度耐受性:按2%(V/V)的接种量,将产果香酵母菌的种子液接种于YPD培养基中,分别于温度为15 ℃、18 ℃、21 ℃、24 ℃、27 ℃、30 ℃条件下,120 r/min培养24 h,测定OD600nm值。
1.3.8 数据处理
所有数据均平行测定3次,结果用“平均值±标准差”表示;利用SPSS26.0软件进行数据处理;利用Origin 9.0软件绘制图形。
2 结果与分析
2.1 产果香酵母菌的分离筛选
通过平板涂布、划线分离和嗅闻技术[26],从大米发酵液样品中分离筛选出一株产浓郁果香风味的酵母菌,命名为QL-2。
2.2 产果香酵母菌QL-2发酵液的香气成分分析
采用GC-MS联用法检测样品A和a的挥发性香气成分,GC-MS分析总离子流色谱图见图1,分析结果见表1。
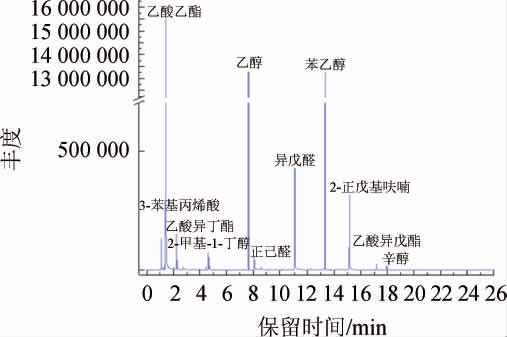
图1 产果香酵母菌QL-2发酵液中挥发性风味成分的GC-MS分析总离子流色谱图
Fig.1 Total ion flow chromatographic of volatile flavor components in fermentation broth of fruity-producing yeast QL-2 analyzed by GC-MS
表1 产果香酵母菌QL-2发酵液中挥发性风味成分的GC-MS分析结果
Table 1 GC-MS analysis results of volatile flavor components in fermentation broth of fruity-producing yeast QL-2
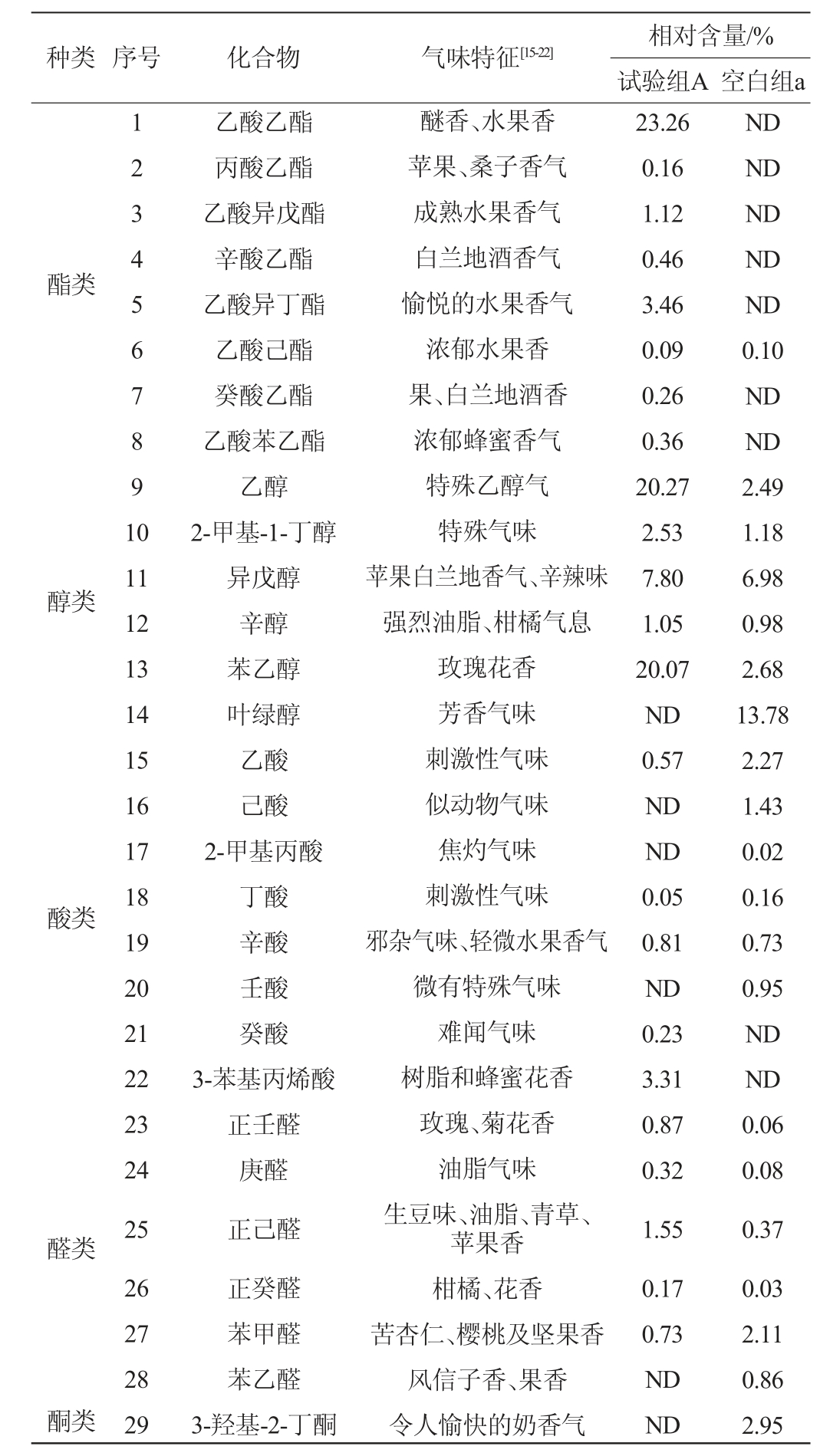
续表

注:ND表示未检出。
由图1及表2可知,样品中共检测出36种挥发性风味成分。试验组A中共检出26种挥发性风味物质,包括酯类8种、醇类5种、酸类5种、醛类5种、酚类2种、呋喃类1种,相对含量分别为29.17%、51.72%、4.97%、3.64%、1.17%、5.51%。其中相对含量较高的是乙酸乙酯(23.26%)、乙醇(20.27%)、苯乙醇(20.07%)、异戊醇(7.80%)、2-正戊基呋喃(5.51%)、乙酸异丁酯(3.46%)、3-苯基丙烯酸(3.31%),推测浓郁梨清香和香甜味可能与乙酸乙酯和苯乙醇有关;空白组a中共检测出25种挥发性风味物质,包括酯类1种、醇类6种、酸类6种、醛类6种、酮类1种、酚类4种和呋喃类1种,相对含量分别为0.10%、28.09%、5.56%、3.51%、2.95%、49.14%、0.29%,其中相对含量较高的风味物质是2,5-二叔丁基酚(25.32%)、4-乙烯基-2-甲氧基苯酚(18.10%),这两种物质可能是麦芽汁的主要特征风味物质。通过对比发现,空白组的酚类相对含量较多,酯类含量较少,而发酵后的酯类和醇类生成相对较多,说明发酵前后酚类物质在发酵过程中发生了一系列反应生成具有特征风味物质的酯类,形成独特的风味体系[26],并且酵母菌在发酵过程中产生了大量的醇,导致发酵后醇类物质增多。由此可见,接入酵母菌株QL-2在麦芽汁糖化液中能增加果香风味物质,具有调节啤酒风味的作用。
2.3 产果香酵母菌的鉴定
2.3.1 形态学鉴定
产果香酵母菌QL-2在YPD培养基上的菌落形态和细胞形态见图2。由图2可知,菌株QL-2的菌落中央凸起、边缘整齐、表面光滑、湿润易挑起、呈现奶油状;细胞呈椭球状,单边出芽。
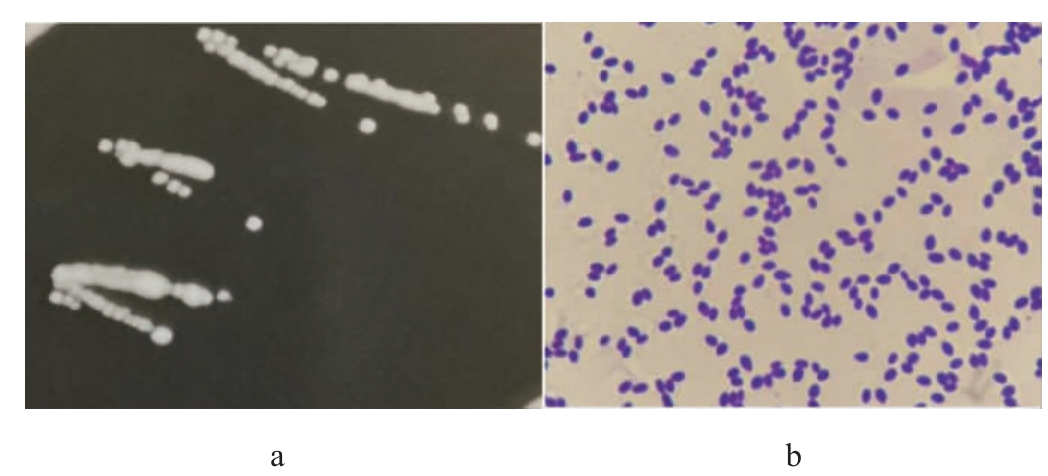
图2 菌株QL-2的菌落(a)及细胞(b)形态特征
Fig.2 Colony (a) and cell (b) morphological characteristics of strain QL-2
2.3.2 生理生化试验
产果香酵母菌QL-2的生理生化试验结果见表2。由表2可知,在碳源同化试验中,菌株QL-2能利用葡萄糖、蔗糖、半乳糖、可溶性淀粉、麦芽糖、棉子糖、海藻糖、乙醇,不能利用纤维二糖、乳糖、鼠李糖、山梨糖、甘露醇、山梨醇进行生长;在氮源同化试验中,菌株QL-2能利用尿素、硝酸铵、硫酸铵,而不能利用亚硝酸钾进行生长;除了吲哚试验和尿素试验结果呈现阳性外,重氮基兰B试验、脲酶试验、甲基红试验、明胶水解试验和硫化氢试验结果皆为阴性,参照《酵母菌的特征与鉴定手册》[24]可初步判定该菌株为酿酒酵母(Saccharomyces cerevisiae),但仅通过生理生化还不能精确判断到具体菌种,因此还需要进行分子生物学鉴定。
表2 菌株QL-2的生理生化试验结果
Table 2 Physiological and biochemical tests results of strain QL-2
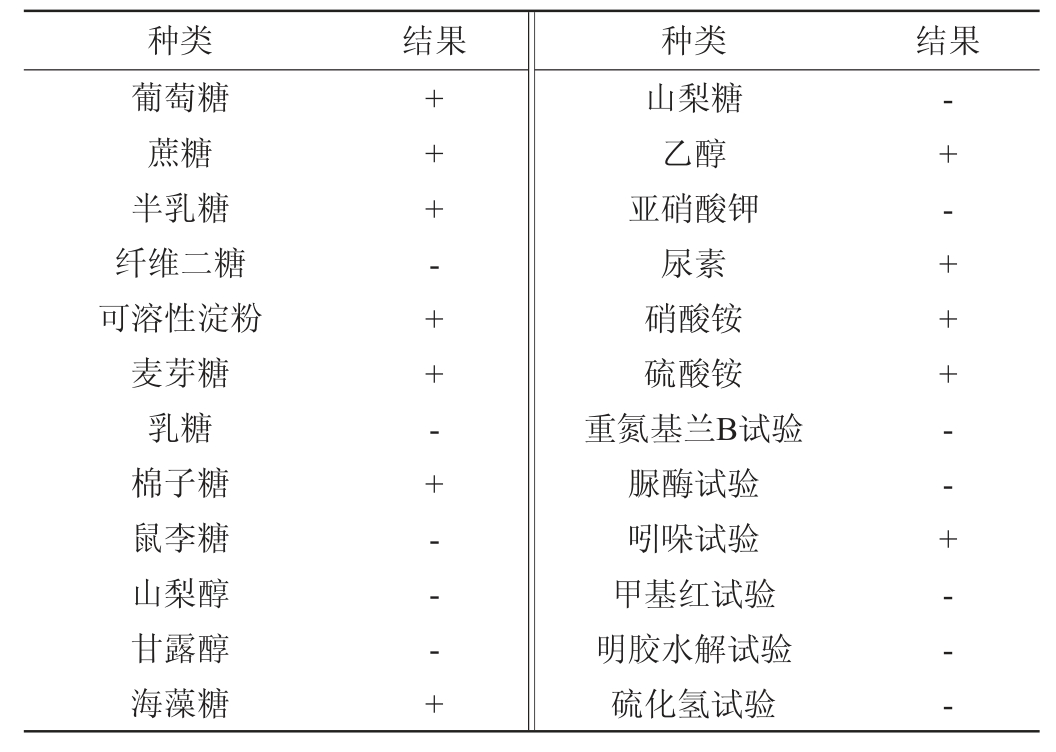
注:“+”表示结果呈阳性,“-”表示结果呈阴性。
2.3.3 分子生物学鉴定
基于ITS rDNA基因序列产果香酵母菌QL-2的系统发育树见图3。

图3 基于ITS rDNA基因序列菌株QL-2的系统发育树
Fig.3 Phylogenetic tree of strain QL-2 based on ITS rDNA gene sequences
由图3可知,菌株QL-2与属于酿酒酵母(Saccharomyces cerevisiae)(KC544499.1)等聚于一个分支,亲缘关系最近,同时结合测序结果与NCBI数据库中blast序列进行对比,发现菌株QL-2与菌株S.cerevisiae(KC544499.1)具有100%的相似度,并结合形态观察、生理生化试验,最终鉴定菌株QL-2为酿酒酵母(Saccharomyces cerevisiae)。
2.4 产果香酿酒酵母QL-2的生长特性
2.4.1 生长曲线
产果香酿酒酵母QL-2的生长曲线见图4。由图4可知,菌株QL-2在0~8 h处于延迟期,8~16 h为对数生长期,16 h后处于稳定期。
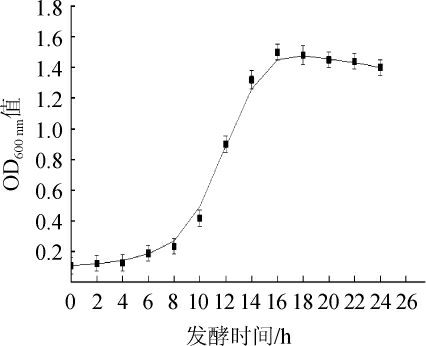
图4 酿酒酵母QL-2的生长曲线
Fig.4 Growth curve of Saccharomyces cerevisiae QL-2
2.4.2 耐受性分析
(1)葡萄糖耐受性试验
在麦芽汁发酵过程中,添加葡萄糖有利于酵母菌的生长,有利于在啤酒发酵后期酒精度和风味物质的增加,因此,葡萄糖耐受较好的酵母菌对于发酵至关重要。有研究表明,葡萄糖耐受较好的酵母菌能够快速生长繁殖,延滞期更短,有利于工业化的生产[27]。酿酒酵母QL-2对葡萄糖的耐受性见图5。由图5可知,随葡萄糖含量的增加,酿酒酵母QL-2的OD600nm值不断降低,二者呈负相关。但在葡萄糖含量为60%时,酿酒酵母QL-2仍可生长,说明该菌种葡萄糖耐受性较好,具有良好的环境适应性,可用于工业生产发酵。
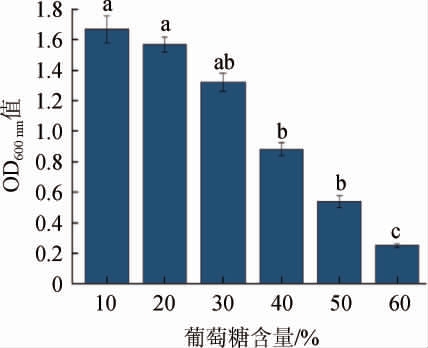
图5 酿酒酵母QL-2的葡萄糖耐受性
Fig.5 Glucose tolerance of Saccharomyces cerevisiae QL-2
不同字母表示差异显著(P<0.05)。下同。
(2)酸耐受性试验
李棒等[28]研究发现,酿酒酵母具有一定的酸耐受性有利于提升酵母的发酵速率,因此,酵母是否具有耐酸性对酿造啤酒品质具有至关重要的作用。酿酒酵母QL-2对酸的耐受性见图6。由图6可知,酿酒酵母QL-2可在pH为3.5~6.0的条件下生长,随着环境pH不断升高,菌株QL-2的OD600nm值呈现先升高后降低的趋势,在pH为5.5时菌株的生长状况最佳,pH为6.0时菌株的生长相对下降,说明该菌株可能更适合在稍酸的环境中生长且具有一定的耐酸性,可耐受pH 3.5。
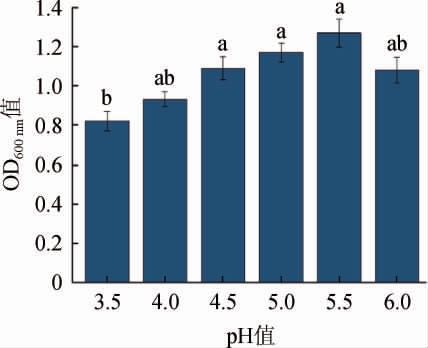
图6 酿酒酵母QL-2的酸耐受性
Fig.6 Acid tolerance of Saccharomyces cerevisiae QL-2
(3)乙醇耐受性试验
耐乙醇能力强的酵母能够促使发酵更加完全、彻底[29]。酿酒酵母QL-2对乙醇的耐受性见图7。由图7可知,酿酒酵母QL-2在乙醇体积分数为0~10%的范围内均能生长,且在乙醇体积分数为6%时生长情况最佳,在乙醇体积分数为10%时生长相对下降但仍具有生长力,说明酿酒酵母QL-2具有一定乙醇耐受性。
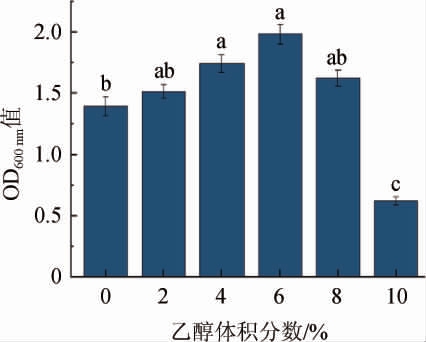
图7 酿酒酵母QL-2的乙醇耐受性
Fig.7 Alcohol tolerance of Saccharomyces cerevisiae QL-2
(4)温度耐受性试验
有研究表明,温度会直接影响酵母的生长繁殖,如果温度较高,酵母生长较快容易加速衰亡,风味物质也会相应减少;相反,一定的低温条件有利于促进产香酵母产风味物质[30-31]。酿酒酵母QL-2对低温的耐受性见图8。由图8可知,酿酒酵母QL-2在15~30 ℃范围内均能生长,且在24 ℃条件生长情况最好,说明酿酒酵母QL-2具有一定的低温耐受性,可耐受低温15 ℃,通过对低温发酵试验结果进行嗅闻发现,该菌株在低温条件下发酵确实能产生较怡人的风味物质,与之前嗅闻结果符合,可应用于麦芽汁低温发酵丰富风味物质。
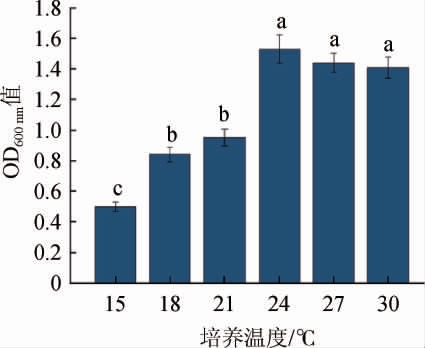
图8 酿酒酵母QL-2的温度耐受性
Fig.8 Temperature tolerance of Saccharomyces cerevisiae QL-2
3 结论
通过嗅闻技术和GC-MS检测技术从大米发酵液中筛选获得1株产果香的酵母菌,编号为QL-2,利用该菌株发酵麦芽汁糖化液后发现呈果香风味物质的种类及含量增加,其中乙酸乙酯相对含量最高(23.26%)。通过形态观察、生理生化试验及分子生物学技术鉴定菌株QL-2为酿酒酵母菌(Saccharomyces cerevisiae),其对生长环境具有一定的耐受性,可在pH 3.5、乙醇体积分数10%、葡萄糖含量60%、温度为15 ℃条件下正常生长,可作为理想的精酿啤酒产果香风味的酵母并应用到工业化生产。
[1]尹花.工坊啤酒的发展现状及趋势[J].中外酒业·啤酒科技,2020(7):12-15.
[2]马德秀,白羽嘉,冯作山,等.香梨全果果浆与果汁发酵工艺及果酒香气成分分析[J].现代食品科技,2021,37(5):237-249,295.
[3]张璐,梁锦,天姿,等.单一及混合益生菌发酵猕猴桃果汁的香气成分分析[J].食品科学,2021,42(24):213-220.
[4]张荣,殷娜,王浩臣,等.石榴精酿啤酒酿造工艺优化的研究[J].食品科技,2020,45(4):74-79.
[5]廖世荣.桂花香型精酿啤酒糖化工艺研究[J].福建师大福清分校学报,2018(5):71-76.
[6]梅丛笑,方元超,王福荣.啤酒酵母的改良途径[J].食品工业科技,2000(3):70-72.
[7]李居宁,易庆平.青岛啤酒酵母和高浓酵母原生质体融合选育高浓酿造菌株[J].食品科学,2014,35(3):173-177.
[8]王伟,俞志敏,侯英敏,等.产香酵母Pichia myanmarensis LX15的分离纯化及对精酿啤酒风味物质形成的影响[J].微生物学杂志,2018,38(4):34-40.
[9]王希彬.纯种发酵酸啤酒的研究[D].天津:天津科技大学,2018.
[10]MANZANNO M,IACUMIN L,VENDRAMES M,et al.Craft beer microflora identification before and after a cleaning process[J].J I Brewing,2012,117(3):343-351.
[11]ESTELA ESCALANTE W D,ROSALES MENDOZA S,MOSCOSA SANTILLAN M,et al.Evaluation of the fermentative potential of Candida zemplinina yeasts for craft beer fermentation[J].J I Brewing,2016,122(3):530-535.
[12]陈嘉,邢晓莹,冯志宏,等.山西老陈醋酿造过程中产酯酵母的筛选及产香特性分析[J].食品科学,2019,40(16):144-151.
[13]何松,任建军,牛东泽,等.阳山水蜜桃非酿酒酵母的筛选、发酵特性及产香气性能的研究[J].食品科技,2021,46(1):1-7.
[14]王刚,邢家溧,印伯星,等.泡菜、豆酱中产香酵母菌的筛选及其在面包制作中的应用[J].食品科学,2014,35(23):155-160.
[15]李泽洋,伍时华,龙秀锋,等.米酒生香酵母的分离筛选鉴定及其性能研究[J].食品与发酵工业,2021,47(7):43-50.
[16]富志磊,范光森,马超,等.老白干酒曲中一株高产β-苯乙醇酵母菌的分离、鉴定及其产香特性研究[J].中国食品学报,2019,19(1):207-215.
[17]罗小叶,邱树毅,陆安谋,等.酱香大曲产香酵母的分离及鉴定[J].食品与发业,2016,42(12):26-31.
[18]孟凡冰,王中伟,李云成,等.酱曲中耐盐产香酵母的分离及其发酵特性[J].食品科学,2020,41(24):31-38.
[19]范光森,许岱,富志磊,等.古井贡酒曲中酵母的分离及其产香挥发性风味物质分析[J].中国食品学报,2018,18(7):220-229.
[20]申光辉,黎梅,王玥,等.发酵低醇西瓜果酒产香酵母的分离筛选及香气成分分析[J].食品与发酵工业,2016,42(8):103-108.
[21]王丽娟,许婷婷,何冰芳,等.双酶法制备玉米粉水解糖液的工艺优化[J].粮食与饲料工业,2008(6):25-27.
[22]贾丽艳,田宇敏,荆旭,等.清香风味导向的酿酒酵母Y2的分离鉴定及生物学特性研究[J].中国食品学报,2020,20(1):230-236.
[23]范光森,刘朋肖,吴秋华,等.一株有氧条件下高产乙醇酵母的筛选、鉴定及其生物学特性研究[J].食品工业科技,2019,40(14):138-143.
[24]巴尼特,佩恩亚罗,胡瑞卿(译),等.酵母菌的特征与鉴定手册[M].青岛:青岛海洋大学出版社,1991:68-171.
[25]魏景超.真菌鉴定手册[M].上海:上海科学技术出版社,1979:21-36.
[26]刘朋肖,刘玉春,李晨语,等.酿酒酵母Y3401产乙醇条件优化及其产香特性[J].中国食品学报,2021,21(4):168-178.
[27]黄琳,葛秀琪,张元夫,等.精酿啤酒专用麦芽的研究进展[J].中国酿造,2020,39(2):7-12.
[28]李棒,邓梦菲,陈延儒,等.高酸度水果果酒酿造产酯酵母的鉴定及发酵特性研究[J].中国酿造,2020,39(4):103-108.
[29]于洋,粟春燕,陈晶瑜.3株葡萄酒非酿酒酵母的生长与发酵特性[J].食品科学,2015,36(19):106-111.
[30]刘灿珍,董书甲,姜凯凯,等.5株非酿酒酵母的耐受性及发酵特性研究[J].中国酿造,2017,36(10):42-46.
[31]张莉,张兰,张玉,等.酿酒酵母菌株的筛选与发酵特性分析[J].河南农业科学,2018,47(6):144-148.