中国白酒的发酵是传统的固态发酵工艺[1-2],白酒生产是利用自然界微生物的过程,多种因素会影响浓香型白酒的质量风格,在工艺上,曲、窖、糟是影响酒质的三大要素,而有益微生物的区系形成及其功能的发挥又是其关键所在[3]。中国白酒的制曲工艺和酒窖发酵分别是开放式和半开放式,与窖外环境的关系十分紧密,空气、土壤、水质、气候等因素都会影响到酿酒微生物区系的形成,从而对酒质和风格产生影响[4]。目前对于浓香型白酒的研究侧重于微生物的种类、形成机制、酒体香味物质和口感等品质特征[5-6],对于白酒酿造环境的研究重点则放在车间内外空气[7-8]和使用器具上[9]。白酒生产车间中空气微生物菌群主要来自于曲粉、发酵糟和窖泥、细菌细胞、细菌芽孢和真菌孢子均以气溶胶形式飘浮于空气中,并随着空气四处流动[10]。空气中的细菌和真菌的孢子飘落到适宜的介质上即快速萌发生长,浓香型白酒酿造车间内与外环境呈半开放状态,车间内外的微生物经由空气流动相互交换,从而影响空气中微生物群落结构[7],然而,空气中的微生物主要来源于自然界的土壤、水体、动植物和人类[11-13]。对于微生物种类和稳定性而言,土壤是微生物的大本营,每克土壤包含数千个微生物类群且优势微生物种群相对较稳定[14],而空气微生物群落结构和物种组成及其浓度极不稳定,会随着各种环境气象因素及污染因子的变化而使空气中微生物的种类、数量均发生较大的变化[15]。无论是空气中还是土壤中的微生物,都不是单独存在的,总是通过各种信号转递、对空间和营养的相互竞争和依赖等作用而形成微生物群落。它们与环境的相互作用,促进了微生物群落的进化和演替,从而达到调控和优化微生物群落的作用。
众所周知,名酒的酿造离不开当地独特的地理环境、气候、水源等条件,环境微生物也是其中的重要部分,现有对于酿酒外环境的研究主要集中在生产区内外空气中的微生物,而对与白酒生产区土壤微生物的研究及其影响因素却较少。杨代永等[16]研究发现,习酒镇的环境中存在着大量的酿酒微生物,其可培养的微生物菌群结构比较稳定。土壤中常见的可培养细菌主要有12种,常见的可培养霉菌有11种,常见的可培养酵母菌有4种,但该研究结果缺乏对酿酒环境中土壤微生物群落结构与具体组成的研究,对其季节性变化趋势及影响因素是否与现有土壤研究一致还不得而知,并且使用的是传统的微生物平板分离技术,获得培养的生物量远远要小于实际微生物的数量。
本研究以四川省遂宁市沱牌舍得生态酿酒产业园区生产车间外周土壤为研究对象,采用Illumina MiSeq高通量测序技术对土壤中微生物群落结构的季节变化趋势、影响因子及土壤中是否具有酿酒微生物的存在进行初步研究,旨在探究浓香型白酒酿酒生产区外周的土壤微生物与环境因子的内在联系,以期为更深层次探讨浓香型白酒酒体特征形成的原因做好酿酒外环境的研究基础,并为研究稳定酿酒微生态环境的技术措施提供数据。
1 材料与方法
1.1 材料与试剂
氢氧化钠、碳酸氢钠、硼酸、硝酸钠、四苯硼钠(均为分析纯):上海阿拉丁生化科技股份有限公司;重铬酸钾、高锰酸钾、硫酸、盐酸(均为分析纯):成都市科隆化学品有限公司。其他试剂均为国产分析纯。
1.2 仪器与设备
AT-710自动电位滴定仪:日本京都电子公司;UV-5100B紫外可见分光光度计:上海元析仪器有限公司;K1100全自动凯式定氮仪、SH220F石墨消解仪:济南海能仪器股份有限公司;BSD-YZ2200立式智能精密摇床:上海博迅实业有限公司医疗设备厂;VeritiFAST梯度聚合酶链式反应(polymerase chain reaction,PCR)仪:美国ABI公司。
1.3 方法
1.3.1 样品采集
围绕白酒生产车间外周,选取10个(20 m×20 m)样地,每个样地设置5个(2 m×2 m)样方。于2020年的7月份(夏季(Sum),工厂停产期)和1月份(冬季(Win),工厂繁忙期)中旬采样,按照“五点取样法”在每个样方中随机采集5个(0~40 cm)混合土样,并立即混合成单个土壤样品,共获得100个土样。土样过2 mm筛后分成两份,一部分自然风干,用于土壤物理和化学性质的测定;另一部分每一个样地混合成1个样,两个季节共得20个土样,用于微生物测序。
1.3.2 土壤理化性质测定
土样采用LU R K[17]描述的标准土壤试验方法进行分析。使用烘箱105℃烘干24h后测定含水量(moisturecontent,MC)和容重;pH采用离子交换法测定;有机质(organic matter,OM)和有机碳(organic carbon,OC)采用重铬酸钾氧化-外加热法测定;全氮(total nitrogen,TN)采用微量凯氏定氮法测定;速效磷(available phosphorus,AP)采用钼蓝比色法测定;速效钾(available kalium,AK)采用比浊法测定。
1.3.3 数据处理与统计分析
细菌选择16S rRNA V3-V4区进行PCR扩增,正向引物为V4 515F(5'-GTGCCAGCMGCCGCGGTAA-3'),反向引物为806R(5'-GGACTACHVGGGTWTCTAAT-3'),真菌选择ITS1区进行扩增,正向引物为ITS1-F(5'-CTTGGTCATTTAGAGGAAGTAA-3'),反向引物为(5'-GCTGCGTTCTTCATCGATGC-3'),利用Illumina公司的PE300平台进行Miseq测序,比对Silva 16S rRNA数据库(v138)和UNITE数据库,使用RDP classifier[18]对每条序列进行物种分类注释。
根据样本序列物种分类注释结果,统计各个样本的物种在门、纲、目、科、属和种各分类单元上的数量。运用上海美吉生物医药科技有限公司的云平台多样性分析流程(Qiime2流程),将测得序列数进行抽平后,计算各季节样本微生物群落的α多样性指数,以表征物种的丰富度(Chao1指数)和多样性(Shannon指数)。
采用R语言Stat包[19](http://gffiy 7bd9881e65bf47e3hq unf09xkwkb06nk x.fffb.sus e.c w keji.cn:999/),根据群落相对丰度数据,利用组间差异检验方法,得到物种丰度差异的显著性水平。采用CANOCO5.0软件对环境因子与微生物群落结构进行冗余分析(redundancyanalysis,RDA),同时应用主轴邻距法(principal coordinates of neighbor matrices,PCNM)计算得出不同环境因子对土壤微生物群落变量构建的贡献率。采用SPSS 20.0对理化指标进行差异显著性分析。
2 结果与分析
2.1 不同季节土壤理化指标
对生产车间夏、冬季的土壤理化因子进行分析,结果见表1。由表1可知,土样呈中碱性(pH在7~9)。土壤含水量、容重、有机质、速效磷的含量从夏季到冬季呈上升趋势,而pH、总氮、有机碳和速效钾的含量则呈现相反的变化趋势。进一步对理化因子进行Wilcox显著性检验表明,除土壤总氮含量在夏季和冬季无显著性差异外(P>0.05),其余因子均有显著性差异(P<0.05)。
表1 生产车间夏季和冬季土壤理化特征
Table 1 Physical and chemical characteristics of soil in production workshop in summer and winter

注:表中数值为“平均值±标准差”;同列字母不同表示不同季节样本间各指标差异显著(P<0.05)。下同。
2.2 不同季节土壤微生物多样性季节变化特征
基于observed ASV(sobs指数)构建的稀释曲线,结果见图1。由图1可知,细菌和真菌稀释曲线趋于平缓,说明测序数据能够覆盖土壤微生物绝大部分物种,能够满足分析需要。
图1 夏季和冬季土壤细菌(a)和真菌(b)微生物稀释曲线
Fig.1 Rarefaction curve of bacteria (a) and fungi (b) in the soil of summer and winter
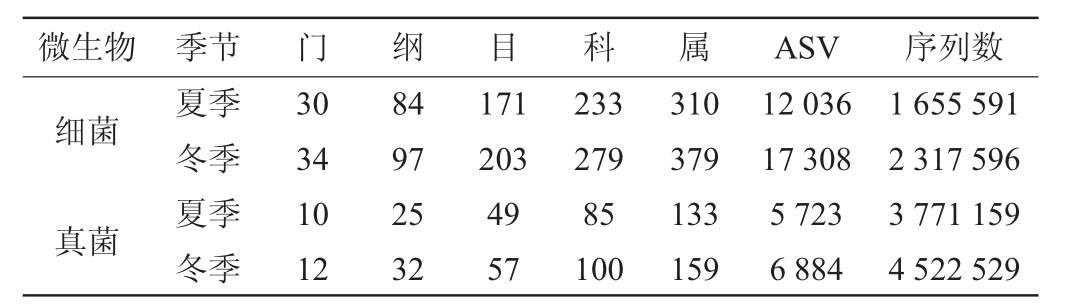
对不同季节土壤微生物物种丰度进行分析,结果见表2。由表2可知,无论是细菌还是真菌,冬季微生物群落各分类单元门、纲、目、科、属、种、扩增子序列变异体(amplicon sequence variants,ASV)和序列(sequence)的数量皆高于夏季。
表2 夏季和冬季土壤微生物群落各分类单元的物种丰富度特征
Table 2 Species richness characteristics of each taxonomic unit in soil microbial community in summer and winter
将测序数据进行抽平后,对夏季(Sum)和冬季(Win)土壤微生物群落进行多样性指数分析,结果见图2。
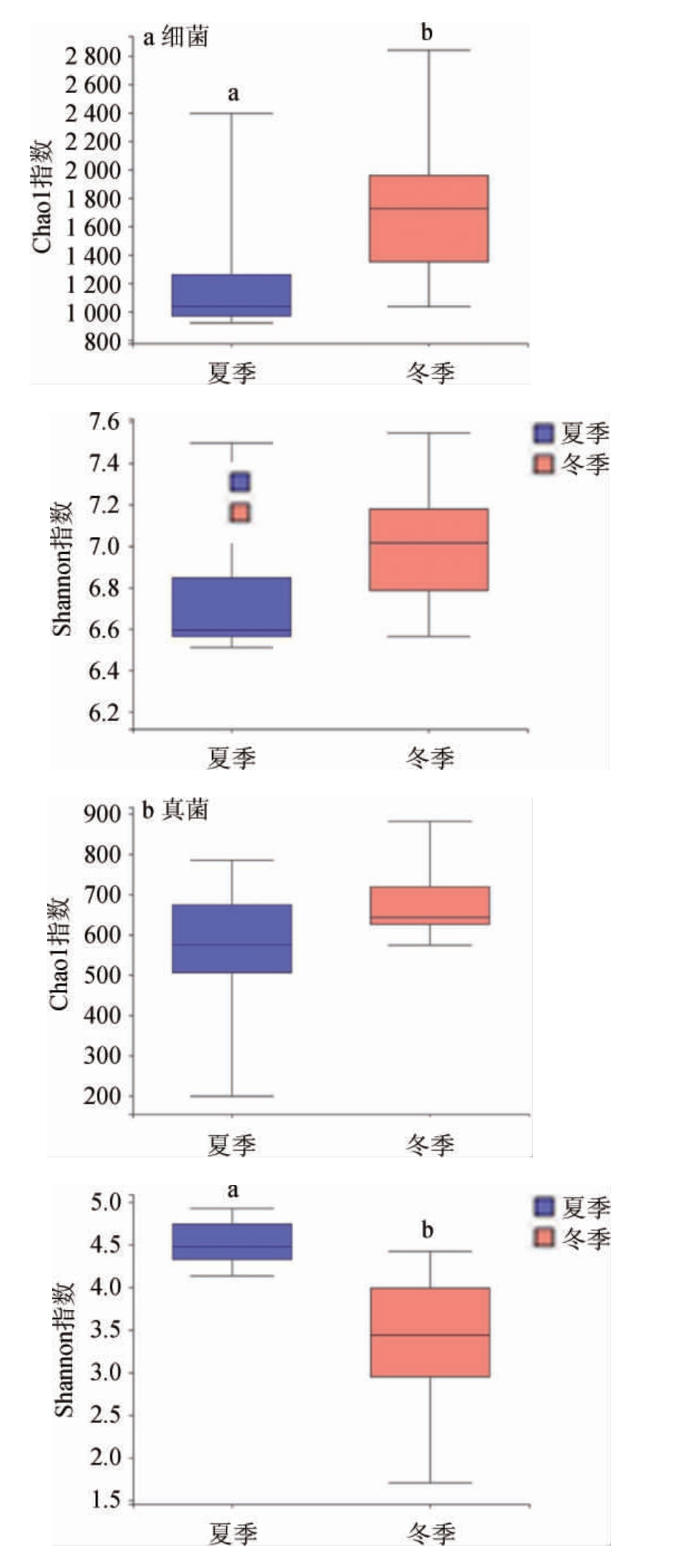
图2 夏季和冬季土壤细菌(a)和真菌(b)群落多样性指数分析结果
Fig.2 Diversity indexes analysis results of bacterial(a) and fungal(b)communities in the soil of summer and winter
不同字母表示差异显著(P<0.05)。
由图2a可知,冬季的细菌Chao1指数和Shannon指数皆高于夏季,其中冬季Chao1指数显著高于夏季(P<0.05),表明冬季细菌微生物群落多样性和丰富度高于夏季。由图2b可知,真菌冬季Chao1指数高于夏季,但Shannon指数却相反,夏季Shannon指数显著高于冬季(P<0.05),表明冬季真菌微生物群落丰富度高于夏季,而夏季真菌微生物群落多样性却高于冬季。
无论是细菌还是真菌,冬季微生物数量都高于夏季。一方面是秋季植被凋落物的大量输入为冬季微生物的生长提供了足够的碳源和营养,从而使冬季土壤微生物数量增加,对川西高原和温带土壤研究发现[20-21],40%~60%凋落物通常在冬季被分解,植被凋落物的分解腐化降低了微生物生物量氮的含量,增加了细菌微生物的数量。另一方面是温度,川南地区土壤温度会随着季节性温度的变化而改变,因此土壤温度呈现出夏季高、冬季低的特征,不同种类微生物生长的最适温度不同,土壤温度的变化导致土壤微生物群落结构和活性发生改变。如LIPSON D A等[22]分别取回夏季和冬季的土壤,在22 ℃和0 ℃分别测试其呼吸强度发现,冬季土壤明显高于夏季土壤。但也有研究发现,土壤呼吸与土壤温度呈正比,微生物群体组成随温度升高而改变[23],某些微生物群落能在较高温度代谢那些在低温时不能被利用的基质。对于秦岭两种林型[24]和东莞市城市森林[25]土壤微生物季节性研究发现,土壤微生物群落多样性在夏、秋季显著高于冬、春季,对土壤微生物季节变化过程的研究结果并没有统一的定性规律,这说明土壤微生物群落不仅受到植被凋谢和环境因子影响,还会受当地气候类型和生态系统影响。
2.3 不同季节土壤微生物群落组成的季节变化特征
基于Bray-Curtis距离对不同季节生产车间土壤微生物群落组成在ASV水平进行非度量多维尺度分析(non-metric multidimensional scaling analysis,NMDS),结果见图3。
由图3a可知,细菌夏季组与冬季组中的样本显著分开,组间差异明显,表明夏季的土壤微生物组成与冬季组存在显著差异(P<0.001);由图3b可知,真菌夏季组与冬季组中样本位置距离相近,表明真菌夏季的土壤微生物组成与冬季组存在一定的相似性。结果表明,季节变化能够显著影响土壤微生物群落的结构和多样性,季节变化对细菌的影响大于真菌。
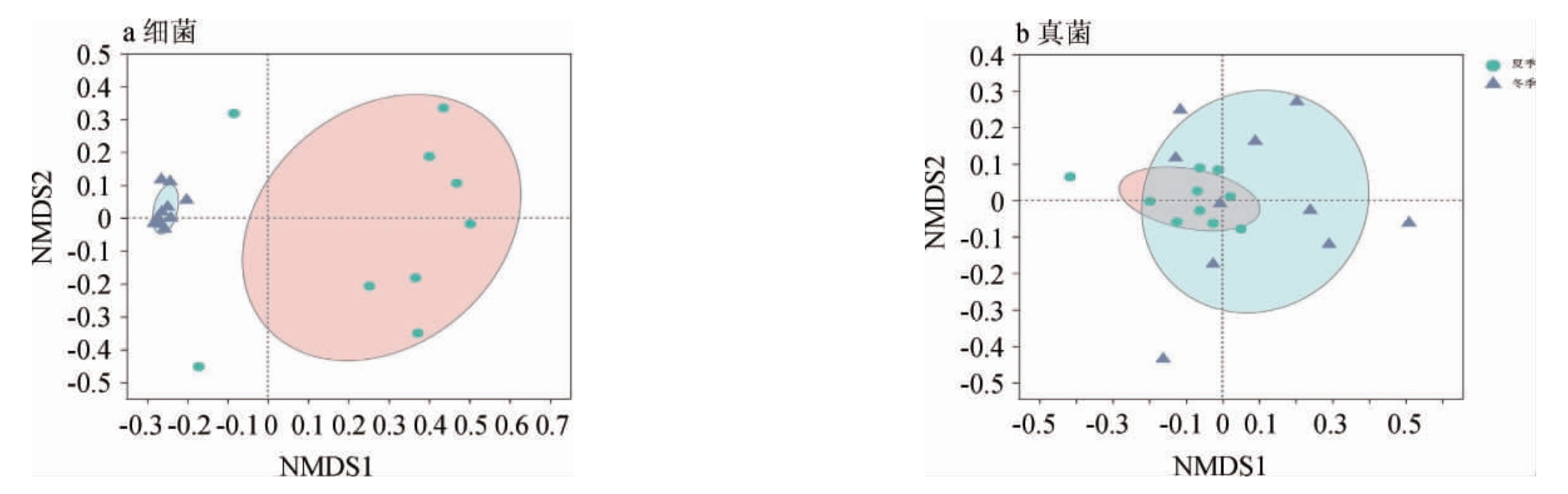
图3 夏季和冬季土壤微生物非度量多维尺度分析结果
Fig.3 Non-metric multidimensional scaling analysis results of soil microorganisms in summer and winter
对生产车间夏季(Sum)和冬季(Win)土壤在门和属水平TOP15的微生物类群进行物种差异分析,结果分别见图4和图5。
由图4a可知,两个季节细菌优势菌门为酸杆菌门(Acidobacteriota)和变形杆菌门(Proteobacteria)。不同季节样本间,Planctomycetota菌门和Methylomirabilota菌门相对丰度呈极显著差异(P<0.01),NB1-j菌门呈显著性差异(P<0.05),但优势菌门无显著性差异(P>0.05)。由图5a可知,两个季节细菌优势菌属为MND1菌属、RB41菌属,不同季节样本间,夏季土壤小梨形菌属(Pirellula)和Subgroup_10菌属相对丰度显著高于冬季(P<0.01,P<0.05),而冬季土壤组中MND1菌属、Haliangium菌属、ADurb.Bin063-1菌属相对丰度显著高于夏季(P<0.05)。
对于土壤微生物细菌群落组成研究发现,酸杆菌门(Acidobacteriota)普遍存在于土壤中,被认为是土壤主要的细菌门之一[26],湖北省神农架山阔叶林土壤微生物结构和组成研究[27]表明,在门分类水平上,酸杆菌门(Acidobacteriota)和变形杆菌门(Proteobacteria)是各样地土壤优势菌群。本研究同样发现,两个季节土壤中酸杆菌门(Acidobacteriota)和变形杆菌门(Proteobacteria)为主要优势菌门,相对丰度占比较高,且夏季相对丰度高于冬季,但两个季节并没有显著性差异。
由图4b可知,子囊菌门(Ascomycota)和Mortierellomycota菌门为两个季节绝对优势菌。不同季节样本间,子囊菌门(Ascomycota)呈极显著性差异(P<0.01),担子菌门(Basidiomycota)呈显著性差异(P<0.05)。由图5b可知,两个季节真菌优势菌属均为被孢霉属(Mortierella)、枝穗霉属(Clonostachys),不同季节样本间,夏季土壤组的新赤壳属(Neocosmospora)、木霉属(Trichoderma)、腐质霉属(Humicola)相对丰度显著高于冬季(P<0.05),而冬季土壤组中枝穗霉属(Clonostachys)、马利亚霉属(Mariannaea)相对丰度显著高于夏季(P<0.01,P<0.05)。
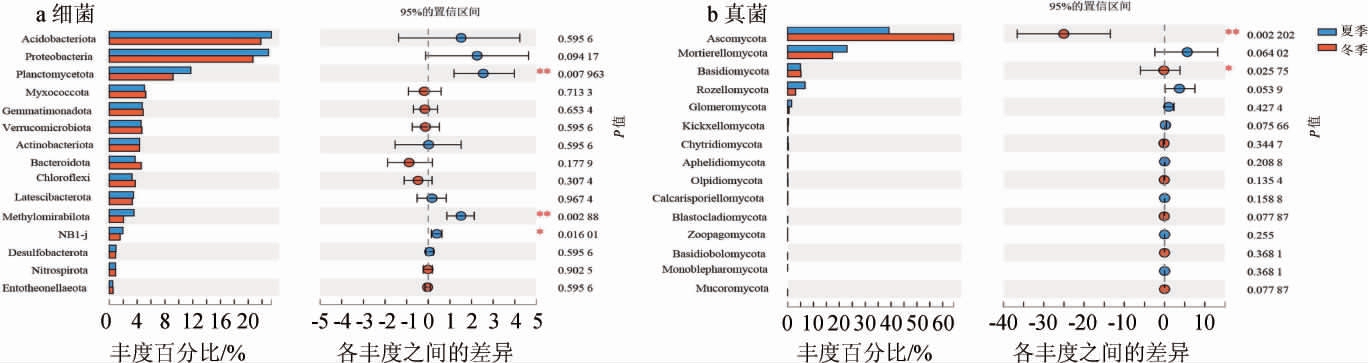
图4 春夏季土壤细菌(a)和真菌(b)物种在门水平相对丰度差异
Fig.4 Difference in relative abundance of soil bacterial (a) and fungal (b) species in spring and summer at phylum level
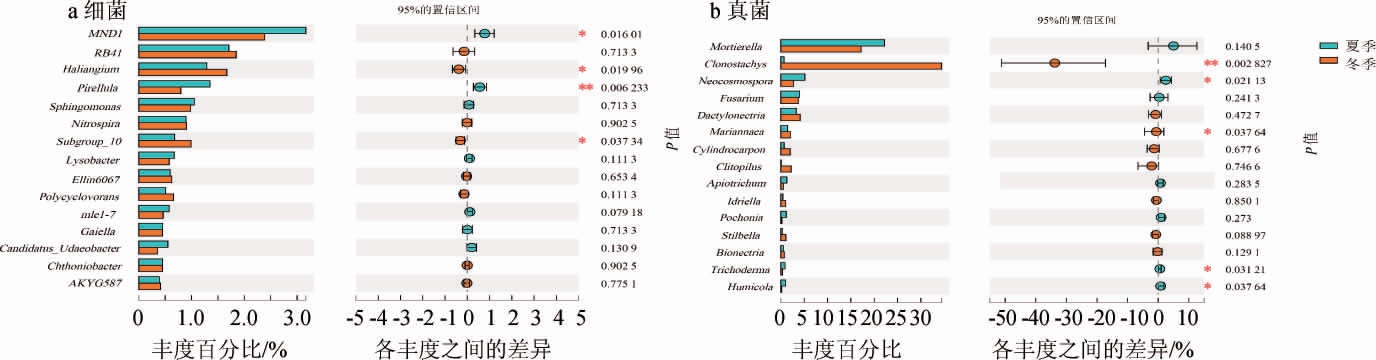
图5 春夏季土壤细菌(a)和真菌(b)物种在属水平相对丰度差异
Fig.5 Difference in relative abundance of soil bacterial (a) and fungal (b) species in spring and summer at genus level
子囊菌门(Ascomycota)为全球范围内土样的主要优势菌门,其次是担子菌门(Basidiomycota)[28]。在本研究中,子囊菌门(Ascomycota)为两个不同季节样本间主要优势菌群,子囊菌门和担子菌门都为腐生菌,是土壤有机质、木质素和其他底物的重要分解者,冬季土壤温度低,水分含量高,为两种菌生长提供能量和物质条件[29-30]。本研究也验证了这一结论,冬季子囊菌门(Ascomycota)和担子菌门(Basidiomycota)相对丰度显著高于夏季。
2.4 环境因子对土壤微生物群落的影响
为探究影响微生物群落的主导因子,将土壤环境因子与样本微生物群落进行冗余分析(RDA),结果见图6。由图6a可知,细菌RDA两轴的方差贡献率分别为17.66%和24.16%,土壤环境因子共同解释了41.82%的细菌群落组成变化。将土壤8个环境因子进行Variation partitioning[31]分析,从而得到各因子独立影响细菌群落的强度。理化因子对土壤细菌群落影响的单独解释率见表3。
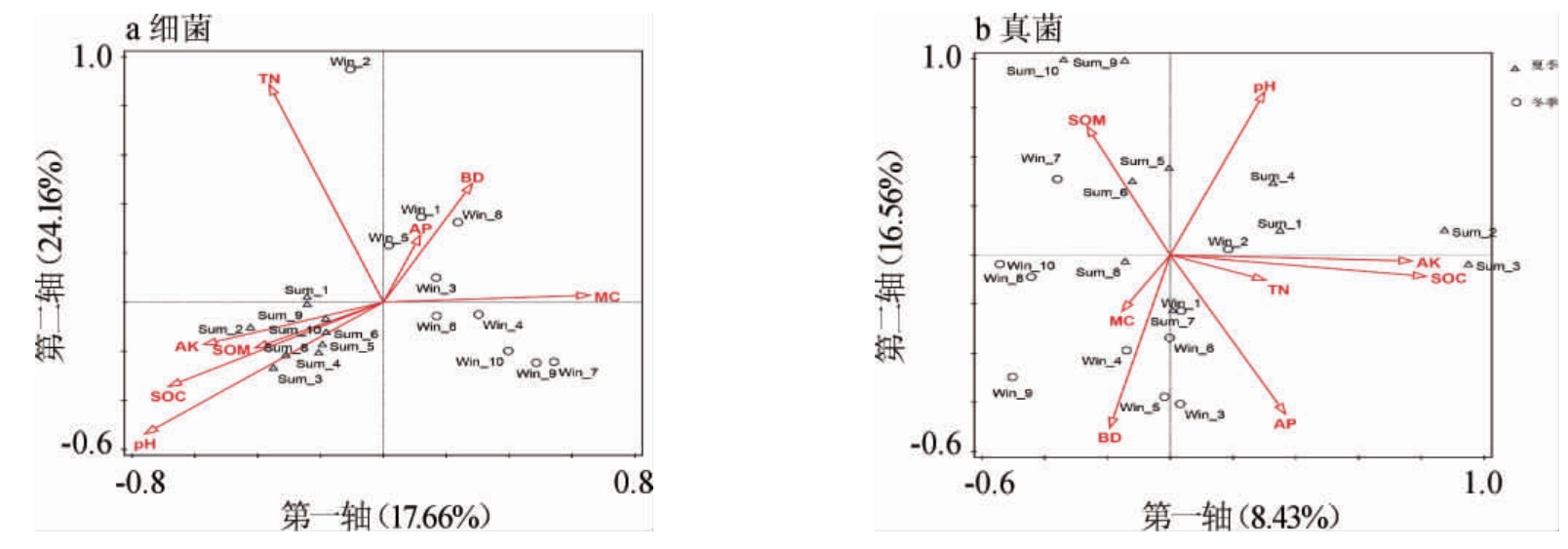
图6 土壤细菌(a)和真菌(b)群落与土壤环境因子冗余分析结果
Fig.6 Redundancy analysis results of soil bacterial (a) and fungal (b) communities with soil environmental factors
由表3可知,pH是影响细菌群落组成变化的主要因素,解释率为12.7%(P=0.004),其次是有机碳(P=0.016)和水分含量(P=0.018)解释率分别为10.7%和10.4%,土壤环境因子对土壤细菌群落的影响顺序为pH>OC>MC>AK>TN>BD>OM>AP。
由图6b可知,真菌RDA两轴的贡献率分别为8.43%和16.56%,土壤环境因子共同解释了24.99%的真菌群落组成变化。将土壤8个环境因子进行Variation partitioning[31]分析,从而得到各理化因子独立影响真菌群落的强度。理化因子对土壤真菌群落影响的单独解释率见表3。
表3 环境因子对微生物群落组成贡献率
Table 3 Contribution rate of environmental factors to microbial community composition

由表3可知,土壤OC是影响真菌群落结构变化的主要因素,解释率为7.6%(P=0.01),其次是pH(P=0.006)解释率为7.5%,土壤环境因子对土壤真菌群落的影响顺序为OC>pH>AK>AP>BD>TN>OM>MC。
土壤物理和化学性质、养分有效性、区域气候、土地利用方式、植被类型等众多环境因素会对土壤微生物群落结构和组成产生影响[32]。土壤pH值是细菌群落组成的最佳预测因子,营养状况是真菌群落组成的最佳预测因子[33]。在全球尺度上,pH是影响土壤细菌群落组成和多样性的关键因素[34-36],且对于细菌的影响强于真菌[37],这与本研究结果相同,理化因子对细菌群落变化解释率的分析结果表明(表3),pH对土壤细菌群落组成变化的贡献率最高,而对于真菌而言,pH是贡献率第二的环境因子,原因是细菌最佳生长的pH范围较窄,而真菌却相反具有广泛的生长范围(5~9)[38-39],所以与细菌相比,真菌与pH值的直接关系明显较弱。
水分是微生物原生质的重要组成部分,约占90%左右,微生物的生命活动离不开水,通过对奇瓦瓦沙漠草原土壤微生物对7年季节性降水变化的响应表明,季节性降水变化会影响土壤真菌群落丰度,从而改变微生物群落功能动态[40]。在本研究中,水分含量是影响土壤微生物群落变化的主要因素。通过对加拿大西部七个地理气候区和加州农田研究发现,土壤水分和有机质含量与微生物群落特征关系最为密切,是影响微生物群落组成的重要因素[32,41],这与本研究结果一致,理化因子对细菌群落变化解释率的分析结果表明(表3),有机碳和水分含量对细菌群落的影响仅次于pH,土壤含水量会通过对氧浓度和养分有效性对微生物群落造成直接或者间接的影响[42]。本研究结果表明(表3),有机碳对真菌群落变化的解释率最高为7.6%,碳的有效性是土壤中微生物生长最常见的限制因素[43],土壤微生物以土壤有机碳为主要碳源进行物质代谢并通过分泌酶参与土壤有机碳的解吸附、解聚、溶解[44]。
2.5 土壤中酿酒微生物类群探究
一直以来,微生物群落结构组成和多样性,一直是生态学和传统发酵食品等领域研究的重点,浓香型白酒的生产,窖泥是基础,大曲是动力,大曲样品微生物群落受区域环境影响较大,表现出明显的地域性[45],酿造环境中的微生物可能通过大曲制曲、贮存富集网络、堆积发酵迁徙进入到酿造过程,为白酒酿造提供微生物来源[46],在不同的环境中,各种微生物以群落的形式共同生活在特定的区域,它们之间会相互作用、相互影响[16]。
2.5.1 酿酒细菌微生物与土样细菌微生物类群比对结果分析
通过查阅文献可知[45,47],四川省境内浓香型白酒大曲中的主要细菌微生物类群有芽胞杆菌属(Bacillus)、片球菌属(Pedicoccus)、乳杆菌属(Lactobacillus)、魏斯氏菌属(Weissella)、明串珠菌属(Leuconostoc)、高温放线菌属(Thermoactinomyces)和醋杆菌属(Acetobacter)。窖泥的好坏直接决定着浓香型白酒酒质的优劣,甲烷杆菌属(Methanobacterium)、甲烷袋状菌(Methanoculleuss)、甲烷粒菌属(Methanocorpusculum)、甲烷短杆菌属(Methanobrevibacter)、瘤胃球菌属(Ruminococcus)、梭菌属(Clostridium)、紫单胞菌属(Petrimonas)、互养单胞菌属(Syntrophomonas)、八叠球菌属(Sporobacter)、红蝽杆菌属(Coriobacterium)、纤维素单胞菌属(Cellulomonas)、Sediminibacter、氨基杆菌属(Aminobacter)、棒杆菌属(Corynebacterium)、Sporosarcina是窖泥中的主要细菌菌群,共计22个细菌属。将上述酿酒细菌微生物与土样中细菌微生物类群测得的结果进行比对,结果见表4。由表4可知,夏季出现了7个菌属,冬季出现了10个菌属,两个季节共出现了11个菌属,其中有8个菌属ASV数量是冬季高于夏季,瘤胃球菌属(Ruminococcus)、芽胞杆菌属(Bacillus)为两个季节绝对优势微生物。比对结果表明,冬季土壤中酿酒微生物细菌类群数量和ASV数量都显著高于夏季。为找出可能影响土壤中酿酒微生物细菌群落组成的因子,将比对结果中ASV数量大于1 000的细菌酿酒微生物与环境因子进行相关性矩阵分析,由图7a可知,芽孢杆菌属(Bacillus)和瘤胃球菌属(Ruminococcus)都与MC呈显著正相关,与TN呈显著负相关关系。
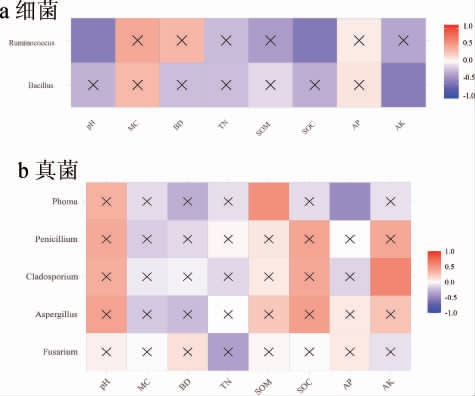
图7 土壤中优势酿酒微生物菌属与理化因子相关性热图
Fig.7 Heat map of correlation between dominant liquor-making microorganisms genera in soil and physicochemical properties of soil
ASV数量>1 000的为优势微生物菌属。
表4 生产车间外围土壤中夏季和冬季土壤中酿酒微生物扩增子序列变异体数量
Table 4 Number of amplicon sequence variants of soil brewing microorganisms in production workshops in summer and winter
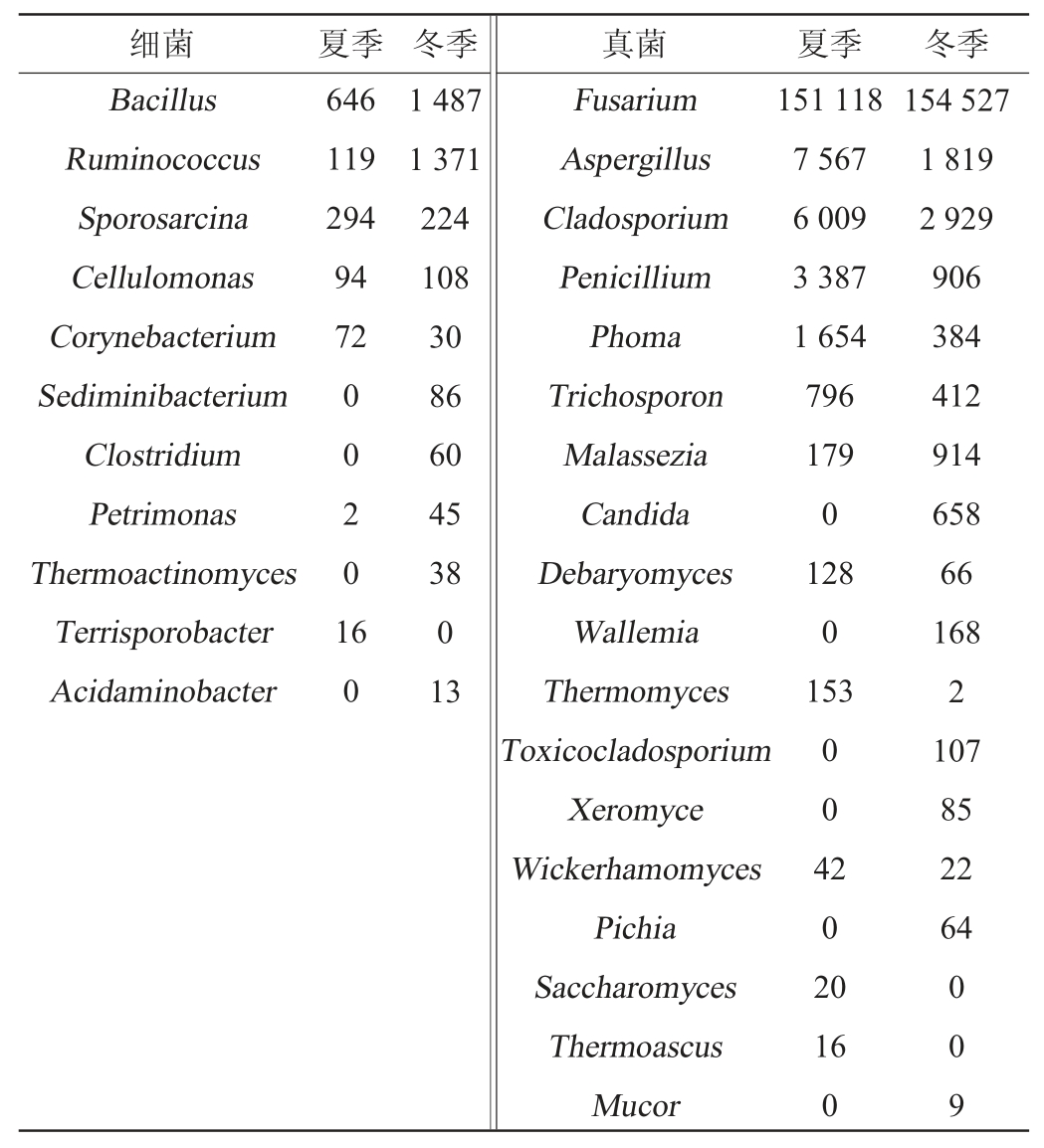
2.5.2 酿酒真菌微生物与土样真菌微生物类群比对结果分析
通过查阅文献可知[48-49],四川省境内浓香型白酒大曲和窖泥中的主要真菌微生物类群有根霉属(Rhizopus)、曲霉属(Aspergillus)、茎点霉属(Phoma)、毛孢子菌属(Tri chosporon)、念珠菌属(Candida)、热孢菌属(Thermoascus)、柳条霉属(Wickerhamomyces)、青霉属(Penicillium)、嗜热丝孢菌属(Thermomyces)、德巴利酵母属(Debaryomyces)、酵母属(Saccharomyces)、马拉色菌属(Malassezia)、毛霉属(Mucor)、Davidiella、Wallemia、毒枝孢菌属(Toxicocla dosporium)、镰刀菌属(Fusarium)、毕赤酵母属(Pichia)、枝孢菌属(Cladosporium)、Xeromyces共计20个真菌属。将上述酿酒真菌微生物与土样中真菌微生物类群测得的结果进行比对,结果见表4,由表4可知,夏季出现了14个真菌属,冬季出现了18个菌属,有10个菌属夏季ASV数量高于冬季,镰刀菌属(Fusarium)、曲霉属(Aspergillus)、枝孢菌属(Cladosporium)为两个季节的绝对优势菌群,冬季镰刀菌属(Fusarium)的ASV数量相比夏季来说稍有上升,而曲霉属(Aspergillus)和枝孢菌属(Cladosporium)却呈现相反的趋势,表现为夏季ASV数量显著高于冬季。比对结果表明,冬季土壤中酿酒微生物真菌类群数量高于夏季,但夏季有10个菌属的ASV数量高于冬季,冬季酿酒真菌微生物的多样性高于夏季,但是微生物的丰富度却是夏季优于冬季。为找出可能影响土壤中酿酒微生物真菌群落组成的因子,将比对结果中ASV数量>1 000的真菌酿酒微生物与环境因子进行相关性矩阵分析,结果见图7。由图7b可知,镰刀菌属(Fusarium)与pH、BD、OM、AP呈显著正相关,与MC、TN、OC、AK呈显著负相关,曲霉属(Aspergillus)、枝孢菌属(Cladosporium)、青霉属(Penicillium)、茎点霉属(Phoma)和镰刀菌属(Fusarium)都与pH呈显著性正相关关系,与MC、BD、TN呈显著性负相关关系,说明土壤pH、MC、BD、TN含量含量是土壤中酿酒真菌微生物的主要共同影响因子。
2.5.3 分析讨论
关于酿酒微生物,从微生物类群多样性和丰富度来讲,冬季细菌微生物多样性和丰富度都高于夏季,这与生产车间外围总的土壤微生物变化趋势是一致的(见表2,图2),然而真菌酿酒微生物却出现相反的趋势,冬季酿酒真菌微生物的多样性高于夏季,但是微生物的丰富度却是夏季优于冬季。一方面含水量过高会使土壤含氧量降低,从而选择兼性和专性厌氧微生物,而土壤含水量过低,土壤干燥会使微生物的活性降低,从而选择真菌和孢子[42],另一个原因可能是冬季是生产的繁忙期,生产车间空气中酿酒相关微生物浓度较高,通过生产车间内外空气流动而在土壤中富集。从微生物相对丰度来讲,绝大多数细菌酿酒微生物冬季都高于夏季,优势微生物也呈相同趋势,这与生产园区土壤微生物的整体趋势是一致的,但是真菌却出现相反的趋势,除了优势菌群镰刀菌属(Fusarium)在冬季相对丰度稍高之外,其余绝大数菌群相对丰度都是冬季要低于夏季。在寒冷地区,从夏季到冬季,微生物的丰度可能会减少[50-52],温度降低可能通过限制土壤水分和养分的有效性直接或间接杀死微生物[53-54],此外,土壤中微生物之间存在着互生、共生、寄生、拮抗等关系,而存活下来的微生物适应性物种增加了其优势[53]。酿酒外环境一方面受当地环境因子的影响,同时与生产也具有一定的关联性,微生物的最适性指微生物所具有的各种最适形态和功能,是在长期进化过程中自然选择的结果。环境中酿造微生物会随着时间和生态环境的变化从而发生突变和选择,可能对酿酒等环境变化有更好的调节作用的方式[55],从而在白酒生产过程中逐渐形成了一个靠自然给予、异常复杂并与环境相适应的微生物区系[16]。
3 结论
本研究通过Illumina平台的Miseq高通量测序技术对四川省遂宁市沱牌舍得生态酿酒产业园区内生产车间外围夏季和冬季土壤对比分析,结果表明,土壤细菌和真菌微生物群落结构和多样性有显著的季节性变化,冬季土壤微生物总数量显著高于夏季,季节变化对细菌的影响大于真菌,pH是影响细菌群落结构变化的主要环境因子,有机碳则是影响真菌群落结构的主要环境因子。在土壤中发现有酿酒相关微生物的存在,细菌有11个属,真菌有18个属,其中细菌相对丰度较高的是瘤胃球菌属(Ruminococcus)、芽孢杆菌属(Bacillus),真菌相对丰度较高是镰刀菌属(Fusarium)、曲霉属(Aspergillus)、枝孢菌属(Cladosporium),酿酒车间外围的微生物群落结构和组成可能受到季节和生产周期变化的影响。
[1]WANG H Y,ZHANG X J,ZHAO L P,et al.Analysis and comparison of the bacterial community in fermented grains during the fermentation for two different styles of Chinese liquor[J].J Ind Microbiol Biot,2008,35(6):603-609.
[2]LI X R,MA E B,YAN L Z,et al.Bacterial and fungal diversity in the traditional Chinese liquor fermentation process[J].Int J Food Microbiol,2011,146(1):31-37.
[3]周恒刚.白酒生产与环境[J].酿酒科技,2004(3):119-119.
[4]吴衍庸.白酒工业生态中的微生物生态学[J].酿酒科技,2001(5):32-33.
[5]程伟,吴丽华,徐亚磊,等.浓香型白酒酿造微生物研究进展[J].中国酿造,2014,33(3):1-4.
[6]罗晶,祝水兰,王丽,等.浓香型白酒酿造微生物与风味物质组成的研究进展[J].中国酿造,2020,39(4):1-6.
[7]张宿义,李宗珍,张良,等.泸州老窖国窖酿造环境空气真菌四季分布研究[J].酿酒科技,2011(2):36-39.
[8]杨开梅,胡峰,胡建锋,等.浓香型习酒酿造环境中细菌多样性的研究[J].酿酒科技,2015(10):51-54.
[9]WANG X,DU H,ZHANG Y,et al.Environmental microbiota drives microbial succession and metabolic profiles during Chinese liquor fermentation[J].Appl Environ Microbiol,2018,84(4):e02369-17.
[10]张宿义,张良,刘光烨,等.酿酒古作坊空气细菌的分析与鉴定[C].经济发展方式转变与自主创新——第十二届中国科学技术协会年会(第三卷)2010.
[11]BOVALLIUS A,BUCHT B,ROFFEY R,et al.Three-year investigation of the natural airborne bacterial flora at four localities in Sweden[J].Appl Environ Microbiol,1978,35(5):847-852.
[12]LINDEMANN J,CONSTANTINIDOU H A,BARCHET W R,et al.Plants as sources of airborne bacteria,including ice nucleation-active bacteria[J].Appl Environ Microbiol,1982,44(5):1059-1063.
[13]MANCINELLI R L,SHULLS W A.Airborne bacteria in an urban environment[J].Appl Environ Microbiol,1978,35(6):1095-1101.
[14]FIERER N.Embracing the unknown:disentangling the complexities of the soil microbiome[J].Nat Rev Microbiol,2017,15(10):579-590.
[15]凌琪.空气微生物学研究现状与展望[J].安徽建筑大学学报(自然科学版),2009,17(1):75-79.
[16]杨代永,王和玉,刘华,等.习酒镇特殊生态环境及酿造微生物多样性的研究与展望[J].酿酒科技,2013(7):49-51.
[17]LU R K.Methods for soil agrochemistry analysis[J].China Agr Sci Technol,2000:106-310.
[18]WANG Q.Naive Bayesian classifier for rapid assignment of rRNA sequences into the new bacterial taxonomy[J].Appl Environ Microbiol,2007,73(16):5261-5267.
[19]TEAM R.R:A language and environment for statistical computing.R foundation for statistical computing:Vienna,Austria[J].Computing,2009,14:12-21.
[20]SCHMIDT S K,LIPSON D A.Microbial growth under the snow:Implications for nutrient and allelochemical availability in temperate soils[J].Plant and Soil,2004,259(1):1-7.
[21]胡霞,吴宁,尹鹏,等.川西高原季节性雪被覆盖下凋落物输入对土壤微生物数量及生物量的影响[J].生态科学,2013,32(3):359-364.
[22]LIPSON D A,SCHADT C W,SCHMIDT S K.Changes in soil microbial community structure and function in an alpine dry meadow following spring snow melt[J].Microbial Ecol,2002,43(3):307-314.
[23]肖辉林,郑习健.土壤变暖对土壤微生物活性的影响[J].土壤与环境,2001,10(2):138-142.
[24]杜璨,耿增超.秦岭2种林分土壤性质的季节性变化对细菌群落多样性和组成的影响[J].西北林学院学报,2021,36(1):54-61.
[25]谭雪莲,阚蕾,张璐,等.城市森林土壤微生物群落结构的季节变化[J].生态学杂志,2019,38(11):3306-3312.
[26]CONRADIE T A,JACOBS K.Distribution patterns of Acidobacteriota in different Fynbos soils[J].Plos One,2021,16(3):e0248913.
[27]ZHANG Y,CONG J,LU H,et al.An integrated study to analyze soil microbial community structure and metabolic potential in two forest types[J].Plos One,2014,9(4):e93773.
[28]EGIDI E,DELGADO-BAQUERIZO M,PLETT J M,et al.A few Ascomycota taxa dominate soil fungal communities worldwide[J].Nat Commun,2019,10(1):2369.
[29]KERFAHI D,TRIPATHI B M,LEE J,et al.The impact of selectivelogging and forest clearance for oil palm on fungal communities in Borneo[J].Plos One,2014,9(11):e111525.
[30]张玲豫,齐雅柯,焦健,等.河西走廊沙地芦苇(Phragmites australis)根际土壤微生物群落多样性[J].中国沙漠,2021,41(6):1-9.
[31]BORCARD D,LEGENDRE P,DRAPEAU P.Partialling out the spatial component of ecological variation[J].Ecology,1992,73(3):1045-1055.
[32]BROCKETT B F T,PRESCOTT C E,GRAYSTON S J.Soil moisture is the major factor influencing microbial community structure and enzyme activities across seven biogeoclimatic zones in western Canada[J].Soil Biol Biochem,2012,44(1):9-20.
[33]LAUBER C,STRICKLAND M,BRADFORD M,et al.The influence of soil properties on the structure of bacterial and fungal communities across land-use types[J].Soil Biol Biochem,2008,40(9):2407-2415.
[34]FIERER N,JACKSON R B.The diversity and biogeography of soil bacterial communities[J].P Natl Acad Sci USA,2006,103(3):626-631.
[35]HAMADY M,WALKER J J,HARRIS J K,et al.Error-correcting barcoded primers for pyrosequencing hundreds of samples in multiplex[J].Nat Methods,2008,5(3):235-237.
[36]HÖGBERG M,HÖGBERG P,MYROLD D.Is microbial community composition in boreal forest soils determined by pH,C-to-N ratio,the trees,or all three?[J].Oecologia,2007,150(4):590-601.
[37]BEALES N.Adaptation of microorganisms to cold temperatures,weak acid preservatives,low pH,and osmotic stress:A review[J].Compr Rev Food Sci Food Safety,2004,3(1):1-20.
[38]ROUSK J,BÅÅTH E,BROOKES P C,et al.Soil bacterial and fungal communities across a pH gradient in an arable soil[J].ISME J,2010,4(10):1340-1351.
[39]WHEELER K A,HURDMAN B F,PITT J I.Influence of pH on the growth of some toxigenic species of Aspergillus,Penicillium and Fusarium[J].Int J Food Microbiol,1991,12(2-3):141-149.
[40]BELL C W,TISSUE D T,LOIK M E,et al.Soil microbial and nutrient responses to 7 years of seasonally altered precipitation in a Chihuahuan Desert grassland[J].Glob Chang Biol,2014,20(5):1657-1673.
[41]DRENOVSKY R E,VO D,GRAHAM K J,et al.Soil water content and organic carbon availability are major determinants of soil microbial community composition[J].Microbial Ecol,2004,48(3):424-430.
[42]WAGNER G.Principles and applications of soil microbiology[J].Prin Appl Soil Microbiol,2005.
[43]ALDÉN L,DEMOLING F,BÅÅTH E.Rapid method of determining factors limiting bacterial growth in soil[J].Appl Environ Microbiol,2001,67(4):1830-1838.
[44]CONANT R,RYAN M,?GREN G I,et al.Temperature and soil organic matter decomposition rates-synthesis of current knowledge and a way forward[J].Glob Chang Biol,2011,17(11):3392-3404.
[45]翟磊,于学健,冯慧军,等.宜宾产区浓香型白酒酿造生境中细菌的群落结构[J].食品与发酵工业,2020,46(2):18-24.
[46]王琳,胡小霞,黄永光.茅台镇酱香型白酒不同生产轮次酿造环境的细菌菌群结构特征[J].食品科学,2021,42(22):185-192.
[47]唐贤华.高通量测序技术初步解析浓香型白酒窖泥细菌群落结构[J].中国酿造,2020,39(1):160-164.
[48]LIU M,TANG Y,ZHAO K,et al.Determination of the fungal community of pit mud in fermentation cellars for Chinese strong-flavor liquor,using DGGE and Illumina MiSeq sequencing[J].Food Res Int,2017,91:80-87.
[49]谭崇尧,徐军.高通量测序法对不同地域浓香型大曲微生物结构的分析[J].酿酒科技,2018(9):118-122.
[50]SULKAVA P,HUHTA V.Effect of hard frost and freeze-thaw cycles on decomposer communities and N mineralisation in boreal forest soil [J].Appl Soil Ecol,2003,22(3):225-239.
[51]EDWARDS A,SCALENGHE R,FREPPAZ M,et al.Changes in the seasonal snow cover of alpine regions and its effect on soil processes:A review[J].Quatern Int,2007,162:172-181.
[52]AUGUET J C,NOMOKONOVA N,CAMARERO L,et al.Seasonal changes of freshwater ammonia-oxidizing archaeal assemblages and nitrogen species in oligotrophic alpine lakes[J].Appl Environ Microbiol,2011,77(6):1937-1945.
[53]WALKER V K,PALMER G R,VOORDOUW G.Freeze-thaw tolerance and clues to the winter survival of a soil community[J].Appl Environ Microbiol,2006,72(3):1784-1792.
[54]JEFFERIES R,WALKER N,EDWARDS K,et al.Is the decline of soil microbial biomass in late winter coupled to changes in the physical state of cold soils?[J].Soil Biol Biochem,2010,42(2):129-135.
[55]蒋红军.茅台酒生态环境中酿造微生物多样性的研究及展望[J].酿酒,2003,30(4):22-24.