酱香型白酒具有“酱香突出、酒体醇厚、空杯留香持久”等特点,在我国白酒行业中占主导地位,深受广大消费者的喜爱。大曲是中国酱香型白酒发酵生产过程中的重要发酵剂和专用原料,环境中的各类微生物在适合的条件下,能在其表面和内部形成有益的酿酒微生物群系,成为原料中大分子物质水解和代谢的必要条件,其产物能直接或间接地构成酒中不同香型的独特风味物质,对中国白酒的品质至关重要[1]。
大曲中的微生物主要集中在酵母菌、霉菌、细菌,其中细菌在高温大曲中占有90%以上,耐高温细菌不仅能产生水解淀粉及蛋白质的酶类,还能为白酒生成香味物质提供重要前体物质,是白酒酿造过程中重要的产香功能微生物[2]。传统分离培养法是直接对微生物进行分离和纯化。该方法简单易行,已广泛应用于白酒中微生物的分离。任爱容等[3]采用传统可培养技术从酱香白酒大曲和环境中分离得到1 370株细菌,并归属于5个门、28个属,其中大曲和环境分别有18个属、24个属,芽孢杆菌属(Bacillus)、赖氨酸芽孢杆菌属(Lysinibacillus)、葡萄球菌属(Staphylococcus)和微球菌属(Micrococcus)为大曲中的核心可培养细菌。然而,由于自然环境中仅有1%~10%的微生物能够被培养,导致无法全面准确地揭示微生物的群落结构。随着分子生物学的发展,基于聚合酶链式反应(polymerase chain reaction,PCR)和高通量测序等一系列免培养技术相继出现,该技术最大特点是无需培养,直接对样品中所有种类的微生物的脱氧核糖核酸(deoxyribonucleic acid,DNA)多样性进行研究,从而揭示微生物群落组成[4]。酱香型白酒大曲微生物群落组成及演替规律的研究技术主要包括聚合酶链式反应-变性梯度凝胶电泳(polymerase chain reaction-denaturing gradient gel electrophoresis,PCR-DGGE)技术、荧光原位杂交技术(fluorescence in situ hybridization,FISH)、高通量测序技术等。谭映月等[5]利用PCR-DGGE技术从酱香型酒曲中共检测出10个细菌属,发现了白酒中不曾报道过的如丙酸杆菌属(Propionibacterium)、棒状杆菌属(Corynebacterium)、鞘氨醇单胞菌属(Sphingomonas)中的鞘氨醇单胞菌(Sphingomonas yabuuchiae)等细菌类群,并检测到了3株不可培养细菌。与PCR-DGGE技术相比,高通量测序技术不仅能检测出丰度高的微生物群落,而且丰度极低的微生物群落也能检测出,具有简单、通量高、准确度高和速度快等优点,能够更好地研究复杂的白酒微生物群落结构及微生物多样性。沈毅等[6]利用高通量测序技术对酱香型郎酒大曲、酒醅和窖泥的细菌菌群进行了比较分析,结果显示郎酒窖泥中细菌菌群丰富度和多样性最高,而大曲中细菌菌群的多样性远远高于酒醅;母应春等[7]运用高通量测序技术分析不同地区酒曲中微生物的组成及多样性在属和门水平上的差异性,结果表明,不同地区的酒曲微生物群落构成及多样性存在明显差异。
目前,仅有少数研究采用传统培养法揭示了曲皮、曲心之间的微生物种类及数量的差异[8],关于酱香大曲不同部位的微生物组成差异的研究鲜见报道。本研究采用Illumina Hiseq高通量测序技术对贵州地区酱香型白酒大曲的细菌群落进行研究,分析酱香型白酒大曲不同部位的细菌群落结构特点,初步了解其菌群组成的差异性,以期更好地揭示酱香型白酒大曲微生物发酵机理。
1 材料与方法
1.1 材料与试剂
1.1.1 样品采集
高温大曲样品:取自贵州省茅台镇某酒厂同批次大曲,在不同颜色的大曲曲块表面厚度约为1 cm处分别取三块平行样,粉碎后充分混匀作为曲皮(QP)样品;在曲块中心,取三块长、宽、厚均为5 cm的正方体,粉碎后充分混匀作为曲心(QX)样品。
1.1.2 试剂
Hiseq Rapid SBS Kit v2测序试剂盒:美国Illumina公司;胶回收试剂盒:德国QIAGEN公司;DNA Marker:北京擎科生物科技有限公司;引物:由上海生物工程股份有限公司合成;Gengreen染料:上海赛百盛有限公司;TruSeq DNA PCR-Free Sample Prep Kit:美国Illumina公司;KOD-Plus-Neo酶:日本TOYOBO公司;QIA quick Gel Extraction Kit:德国QIAGEN公司。
1.2 仪器与设备
ABIGeneAmpR9700型PCR仪:美国ABI公司;Qubit2.0荧光定量仪:美国Thermo Fisher公司;Thermo Scientific X3R型冷冻离心机:美国Thermo Fisher Scientific公司;CP114电子分析天平:上海奥豪斯仪器有限公司;DYY-8C电泳仪:北京六一仪器厂;JS-680C凝胶成像仪:上海培清科技有限公司。
1.3 实验方法
1.3.1 大曲样品基因组总DNA的提取
将粉碎好的大曲样品使用DNA提取试剂盒进行基因组DNA提取后,使用0.8%琼脂糖凝胶电泳检测DNA。
1.3.2 PCR扩增
以提取的基因组总DNA为模板,使用带有Barcode的特异引物515F(5'-GTGCCAGCMGCCGCGGTAA-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3')PCR扩增16SrDNA V4区域基因序列。PCR扩增体系(50 μL)为:1×PCR buffer 5 μL,MgCl2(1.5 mmol/L)3 μL,脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTPs)(0.4 μmol/L)5 μL,正向和反向引物(1.0 μmol/L)各1 μL,KOD-Plus-Neo酶1 μL,模板10 ng,双蒸水(ddH2O)31 μL。PCR扩增程序:94 ℃预变性1 min;94 ℃变性20 s,54 ℃退火30 s,72 ℃延伸30 s,30个循环;72 ℃再延伸5 min。使用2%琼脂糖凝胶电泳检测,利用QIA quick Gel Extraction Kit进行纯化,PCR纯化产物用Qubit 2.0荧光定量仪进行检测定量。
1.3.3 Illumina Hiseq高通量测序
使用TruSeq DNA PCR-Free Sample Prep Kit建库,构建好的文库经过定量和文库检测合格后,使用Hiseq 2500平台PE250模式进行高通量测序。
1.3.4 数据处理与分析
使用Flash 8.0软件进行序列拼接,使用Trimmomatic进行质控,过滤得到高质量目标序列后,利用Usearch序列分析软件分组成具有97%相似度的操作分类单元(operational taxonomic units,OTU),挑选出现频率最高的序列作为每个OTUs的代表性序列,使用SILVA数据库对其进行物种信息分类,采用随机抽样的方式对OTU特征表进行抽平处理后,再利用QIIME等软件对样本进行Alpha多样性分析,采用Origin 9.0软件作图。
2 结果与分析
2.1 大曲样品中细菌菌群OTU的统计结果
OTU可以反映样品物种的丰富程度[9],利用Usearch序列分析软件在97%相似度下对所有序列进行OTU的划分。经分析,QP和QX样品基于97%相似度的OTU数量分别为73和74,说明QP与QX样品的细菌种类差异不大。在水平方向,曲线的宽度反映样本中物种的丰度,曲线在横轴上的范围越大,物种的丰度越高;曲线的平滑程度反映样本中物种的均匀度,曲线越平缓,物种分布越均匀[10]。由图1可知,两个样品的Rank-Abundance曲线不是很平缓,物种分布并不是很均匀,相比QX样品,QP样品的Rank-Abundance曲线较为平缓。尽管QP和QX样品只有1个OTU数的差异,但根据OTU统计结果,大曲不同部位的细菌丰度分布存在一定的差异,可能是因为曲皮样品与外界环境能够直接接触,曲皮的水分及空气含量要低于曲心,导致大曲不同部位的物种存在较大差异[11]。
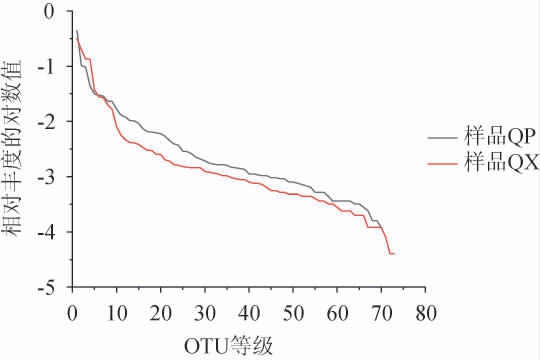
图1 酱香型白酒大曲曲皮和曲心样品中细菌菌群的Rank-Abundance曲线
Fig.1 Rank-abundance curves of bacterial community in Qupi and Quxin samples of high-temperature Daqu
2.2 大曲样品中细菌菌群多样性的分析结果
2.2.1 稀释曲线
稀释曲线可以用来比较测序数据量不同的样本中物种的丰富度,也可以用来说明样本的测序数据量是否合理[12]。经过Illumina Hiseq高通量测序和序列质量控制,QP和QX样品中细菌菌群中所得有效序列分别为29 871条和34 636条,其平均碱基长度分别为290 bp和288 bp。由图2可知,测序深度>10 000条时,稀释曲线趋于平缓,说明本次测序结果能代表样本的真实情况,能较好地反映该区域细菌菌群的种类和结构。

图2 酱香型白酒大曲曲皮和曲心样品中细菌群落的稀释曲线
Fig.2 Dilution curve of bacterial community in Qupi and Quxin samples of high-temperature Daqu
2.2.2 Alpha多样性分析
Alpha多样性是指一个特定区域或者生态系统内的多样性和群落的物种丰富度,常用辛普森(Simpson)指数、香农(Shannon)指数、超1(Chao 1)指数、系统发育多样性(phylogenetic diversity,PD)指数等进行评价数据结果[13]。QP和QX样品中细菌菌群的Alpha多样性分析结果见表1。由表1可知,QP样品的Shannon指数(2.34)高于QX样品(2.20),QP样品的Simpson指数(0.77)低于QX样品(0.82),表明QP样品中细菌群落多样性高于QX样品。QX样品细菌群落Chao 1指数(76.50)、PD指数(6.65)均高于QP样品(74.33、6.63),表明QX样品中细菌群落物种的丰富度高于QP样品。这一研究结果与李登勇等[14]研究发现的高温大曲细菌群落分布规律不同,可能是因为取样时间的不同造成了差异性[15]。
表1 酱香型白酒大曲曲皮和曲心样品中细菌菌群的Alpha多样性分析结果
Table 1 Alpha diversity analysis results of bacterial community in Qupi and Quxin samples of high-temperature Daqu

2.3 大曲样品细菌群落结构分析结果
将每个OTU与数据库进行比对,选取置信度阈值,即相似度在97%以上的序列进行物种分类,得到每个OTU的分类水平,结果发现,两个大曲样品中细菌菌群主要归属于7个门、13个纲、19个目、29个科和55个属。
2.3.1 基于门水平细菌菌群结构分析结果
由图3可知,从QP、QX样品中共检测到7个细菌菌门,分别为厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)、变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、埃普西隆杆菌门(Epsilonbacteraeota)、螺旋体门(Spirochaetes)、Kiritimatiellaeota。在QP样品中,优势细菌门(平均相对丰度≥1.00%)为厚壁菌门(Firmicutes)(90.92%)、放线菌门(Actinobacteria)(6.92%)、变形菌门(Proteobacteria)(1.93%)。任爱容等[16]从茅台镇主酿区大曲样本中检测出21个门,其中Firmicutes、Proteobacteria、Actinobacteria、拟杆菌门(Bacteroidetes)为优势菌门;郭敏[17]对酱香大曲微生态多样性研究也发现了同样的结果。张双燕等[9,18-19]通过高通量测序分析发现,清香型大曲、芝麻香型高温大曲以及浓香型大曲的主要细菌种群为Firmicutes及Proteobacteria。在不同香型的白酒中均能发现这些细菌,说明Firmicutes和Proteobacteria是中国白酒大曲中的重要微生物。而在QX样品中,优势细菌门只有Firmicutes(81.65%)、Actinobacteria(17.40%)。LI H等[20]研究发现,酱香大曲中的优势细菌门为Firmicutes和Actinobacteria。酱香大曲中耐高温细菌的种类共通性和丰度差异性,造成差异性的原因可能与原料来源、母曲中微生物组成及制曲工艺等因素有关[21]。在QX样品中Proteobacteria没有成为优势细菌门,原因在于曲心的制曲温度高(达到65 ℃)和水分含量低,导致不耐热的Proteobacteria无法存活;而在QP样品中因跟外界环境直接接触,水分和温度的适宜促使Proteobacteria成为优势细菌门[22]。这一结果说明在曲块的不同部位所含的细菌菌群尽管种类没有差异,但其相对丰度有所差异。

图3 基于门水平酱香型大曲曲皮和曲心中细菌群落结构的分析结果
Fig.3 Analysis results of bacterial community structure in Qupi and Quxin samples of high-temperature Daqu at the phylum level
2.3.2 基于属水平细菌菌群结构分析结果
由图4可知,在QP和QX样品中均检测到55个属。QP和QX样品中的优势细菌属(相对丰度≥1.00%)分别为8个、7个,共有优势细菌属有5个,分别为枝芽孢杆菌属(Virgibacillus)(46.36%,19.87%)、芽孢杆菌属(Bacillus)(12.78%,32.41%)、芽孢链菌属(Desmospora)(10.26%,13.55%)、乳杆菌属(Lactobacillus)(14.79%,6.47%)、糖多孢菌属(Saccharopolyspora)(2.87%,13.37%),其中Virgibacillus、Bacillus、Desmospora、Lactobacillus都属于芽孢杆菌纲,因此表明芽孢杆菌是高温大曲中的主要微生物菌群,该结果与戴奕杰等[23-24]的研究结果一致。有研究表明,Virgibacillus对酱香型白酒风味品质的形成有重要贡献[25];Lactobacillus在酿造过程中产生的乳酸能为白酒形成风味物质合成提供前体,具有维护与保持酿酒微生态环境等作用[26]。属于放线菌纲的Saccharopolyspora为酱香型白酒第1轮次酒醅堆积发酵中的优势细菌属[27],对白酒风味物质的形成有重要作用。在芝麻香型白酒中也发现了Saccharopolyspora为优势菌群[28]。有研究表明,Desmospora与克罗彭施泰特氏菌属(Kroppenstedtia)的基因序列相似度达到94.3%[29],Kroppenstedtia主要与丁酸乙酯、己酸乙酯、庚酸乙酯、辛酸乙酯等酯类、β-苯基乙醇、2-甲氧基-4-乙烯基苯酚乙基愈创木酚的产量呈正相关,Kroppenstedtia在白酒酿造中发现的时间较短,目前对其功能特性了解有限[30]。
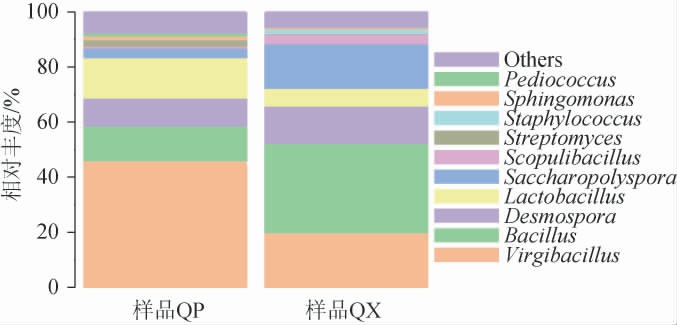
图4 基于属水平酱香型大曲曲皮和曲心中细菌群落结构的分析结果
Fig.4 Analysis results of bacterial community structure in Qupi and Quxin samples of high-temperature Daqu at the genus level
Others表示相对丰度<1%的其他菌属。
QP样品中特有的优势细菌属为链霉菌属(Streptomyces)(2.30%)、鞘氨醇单胞菌属(Sphingomonas)(1.30%)、片球菌属(Pediococcus)(1.02%)。其中,Streptomyces可能来源于白酒酿造环境中的空气,其作为一种需氧菌,具有酯化脂肪酶、分泌酯酶、碱性磷酸酶与水解磷酸盐酶的能力,可能在酱香型白酒风味物质或风味前体的形成中起重要作用[31];Sphingomonas可以降解芳香类化合物和产生多糖类物质,同时具有较强的产辅酶Q能力[32]。Pediococcus可以利用碳水化合物产生乳酸不产气,无法分解蛋白,但能够促进发酵食品产生特有的风味物质,因此在白酒发酵过程中起着重要的作用[33]。这些菌属仅在QP中成为优势菌属可能是因为它们是需氧菌,因QX样品中没有氧气所以无法大量生存。
QX样品中特有的优势细菌属为Scopulibacillus(3.71%)、葡萄球菌属(Staphylococcus)(1.66%)。其中,Scopulibacillus是兼性厌氧嗜热菌,在芝麻香型白酒高温大曲也有发现[34],但目前对Scopulibacillus在白酒中的功能还尚未清楚。
大曲曲块不同部位的微生物群落的差异会导致水分、酸度、温度等理化指标也不同。同样,大曲不同部位的水分和酸度值也是导致微生物群落分布不同的环境因素[35]。因此,尽管在QP和QX中的细菌种类差别不大,但由于其含量不同,共同在后期发酵过程中相互作用,可以对后期合成的风味物质造成一定的影响。
3 结论
本研究采用Illumina HiSeq高通量测序技术,分析比较了酱香型白酒大曲曲皮和曲心的细菌菌群多样性及群落结构的差异性。结果表明,曲皮样品中的细菌群落多样性高于曲心样品,但其丰度低于曲心样品。在曲皮和曲心样品中共检测到7个门、13个纲、19个目、29个科和55个属,曲皮、曲心样品中检测到的细菌种类没有差异,但同一细菌的相对丰度存在一定的差异性。曲皮样品中的优势细菌门为Firmicutes、Actinobacteria、Proteobacteria,曲心样品中的优势细菌门没有Proteobacteria。曲皮和曲心样品共有的优势细菌属为Virgibacillus、Bacillus、Desmospora、Lactobacillus、Saccharopolyspora,除Desmospora属外,其他优势细菌属在曲皮和曲心样品中的含量差异较大。曲皮样品的特有优势细菌属为Streptomyces、Sphingomonas、Pediococcus;曲心样品的特有优势细菌属为Scopulibacillus、Staphylococcus。这些细菌在茅台酒的风味生产和发酵中均起着重要作用,有助于形成茅台酒独特的酒体组成和独特的风格。本研究在一定程度上丰富了对贵州地区高温大曲微生物群落多样性的认识,证实了在大曲的不同部位,细菌群落结构是有差异的,对后续研究微生物对大曲的理化指标及其风味物质的影响奠定了基础。
[1]王彩虹.基于克隆文库法研究不同香型大曲微生物群落结构[D].自贡:四川理工学院,2014.
[2]吴徐建.酱香型白酒固态发酵过程中酵母与细菌群落结构变化规律的研究[D].无锡:江南大学,2013.
[3]任爱容,黄永光,涂华彬.茅台镇酱香型白酒酿造大曲及环境中可培养细菌多样性及功能分析[J].食品科学,2020,41(14):195-202.
[4]王小平,黄永光,周文美.酱香型白酒大曲细菌菌群结构及功能研究进展[J].中国酿造,2020,39(2):19-25.
[5]谭映月,胡萍,谢和.应用PCR-DGGE技术分析酱香型白酒酒曲细菌多样性[J].酿酒科技,2012(10):107-111.
[6]沈毅,陈波,王西,等.酱香型郎酒高温大曲、酒醅和窖泥中细菌群落结构分析[J].中国酿造,2020,39(2):89-93.
[7]母应春,姜丽,苏伟.应用Illumina高通量测序技术分析3种酒曲中微生物多样性[J].食品科学,2019,40(14):115-122.
[8]赵金松,陈泽军,吴重德,等.浓香型大曲曲块部位间微生物群落结构与风味组分差异的研究[J].酿酒科技,2013(12):9-12.
[9]张双燕,廖永红,纪南,等.基于高通量测序技术分析北京清香型大曲微生物多样性[J].中国酿造,2016,35(11):49-53.
[10]姜明慧,许玲,于文娟,等.高通量测序技术分析酱香型白酒下沙轮次堆积过程的微生物多样性[J].酿酒,2020,47(4):51-59.
[11]邓长阳,黎婷玉,刘文汇,等.襄阳地区中高温大曲曲皮和曲心真菌多样性解析[J].中国酿造,2021,40(6):65-69.
[12]黄蕴利,黄永光,胡建峰,等.酱香型白酒第二轮次酒发酵过程微生物多样性研究[J].中国酿造,2017,36(9):30-35.
[13]安飞宇,武俊瑞,解梦汐,等.酱块发酵过程中真菌和细菌群落的演替[J].现代食品科技,2018,34(7):61-67.
[14]李登勇,黄钧,晓菲,等.酱香大曲间微生物群落结构时空特征的表征[J].食品工业科技,2018,39(23):139-145.
[15]黎瑶依,胡小霞,黄永光.茅台镇酱香型白酒酿造环境中真菌菌群多样性分析[J].食品科学,2021,42(18):164-170.
[16]任爱容,黄永光.茅台镇不同主酿区域酱香型白酒酿造大曲中细菌菌群结构分析[J].食品科学,2021,42(4):167-174.
[17]郭敏.基于高通量测序对酱香大曲制曲微生态多样性的研究[D].贵阳:贵州大学,2018.
[18]姚粟.芝麻香型白酒高温大曲细菌群落多样性研究[D].北京:北京林业大学,2013.
[19]吴树坤,谢军,卫春会,等.四川不同地区浓香型大曲微生物群落结构比较[J].食品科学,2019,40(14):144-152.
[20]LI H,LIAN B,DING Y H,et al.Bacterial diversity in the central black component of Maotai Daqu and its flavor analysis[J].Ann Microbiol,2014,64(4):1659-1669.
[21]周晓龙.北派酱香大曲的细菌群落分析及增香芽孢杆菌的筛选及应用[D].济南:齐鲁工业大学,2020.
[22]王琳,胡小霞,黄永光.茅台镇酱香型白酒不同生产轮次酿造环境的细菌菌群结构特征[J].食品科学,2021,42(22):185-192.
[23]戴奕杰,李宗军,田志强.酱香型白酒大曲和糟醅的细菌多样性分析[J].食品科学,2019,40(4):152-159.
[24]LI X R,MA E B,YAN L Z,et al.Bacterial and fungal diversity in the starter production process of Fen liquor,a traditional Chinese liquor[J].J Microbiol,2013,51(4):430-438.
[25]王光路,张帆,杨旭,等.贾湖原香型白酒高温堆积过程原核微生物的消长规律研究[J].中国酿造,2020,39(11):30-35.
[26]胡小霞,黄永光,涂华彬,等.酱香型白酒1轮次酿造细菌的菌群结构[J].食品科学,2020,41(14):175-182.
[27]LIU S P,MAO J,LIU Y Y,et al.Bacterial succession and the dynamics of volatile compounds during the fermentation of Chinese rice wine from Shaoxing region[J].World J Microbiol Biotech,2015,31(12):1907-1921.
[28]申孟林,张超,王玉霞.白酒大曲微生物酶系研究进展[J].中国酿造,2016,35(5):1-5.
[29]CHAKRABORTYA S,KHOPADEA A J,BIAO R,et al.Characterization and stability studies on surfactant,detergent and oxidant stable-amylase from marine haloalkaliphilic Saccharopolyspora sp.A9[J].J Mole Cat B:Enzy,2011,68(1):52-58.
[30]WANG W H,FAN G S,LI X T,et al.Application of Wickerhamomyces anomalus in simulated solid-state fermentation for Baijiu production:Changes of microbial community structure and flavor metabolism[J].Front Microbiol,2020,11(11):1-20.
[31]FRIKHA-DAMMAK D,FARDEAU M L,CAYOL J L,et al.Paludifilum halophilum gen.nov.,sp.nov.,a thermoactinomycete isolated from superficial sediment of a solar saltern[J].Int J Syst Evol Micr,2016,66(12):5371-5378.
[32]王欢,席德州,黄永光,等.酱香型白酒机械化酿造不同轮次堆积发酵细菌菌群结构多样性分析[J].食品科学,2020,41(2):188-195.
[33]向凡舒,刘雪婷,代程洋,等.基于Miseq高通量测序技术宣恩地区米酒微生物多样性解析[J].食品工业科技,2020,41(21):128-132,138.
[34]YAO S,ZHAI L,XIN C H,et al.Scopulibacillus daqui sp.nov.,a thermophilic bacterium isolated from high temperature Daqu[J].Int J Syst Evol Micr,2016,66(11):4723-4728.
[35]CHEN Y R,LI K M,LIU T,et al.Analysis of difference in microbial community and physicochemical indices between surface and central parts of Chinese special-flavor Baijiu Daqu[J].Front Microbiol,2021,11:1-11.