内蒙古通辽地区的牧民长期以来沿用传统的自然发酵方法制作具有民族特色的传统发酵乳制品,主要有奶豆腐、酸马奶、酸性奶油(乌日莫)、奶皮子等,这些传统乳制品工艺独特、品种繁多、味道极美、营养丰富,并较好地保存了当地自然环境中的乳酸菌,曾经是皇帝王室的贡品,至今还是蒙族地区最重要的主食,该地区独特的气候、环境和食品的特色加工方法使得传统发酵乳制品中乳酸菌资源十分丰富[1-2]。有研究表明,新疆、青海、西藏地区传统发酵乳制品中的优势菌群分别为瑞士乳杆菌(Lactobacillus helveticus)、植物乳杆菌(Lactobacillus plantarum)和德氏乳杆菌(Lactobacillus delbrueckii)[3],内蒙古西部地区传统发酵乳制品中的优势菌群为干酪乳杆菌(Lactobacillus casei)、瑞士乳杆菌、植物乳杆菌和乳酸乳球菌乳酸亚种(Lactococcus lactis subsp lactis)[4-5]。这些乳酸菌对肠道内病原菌生长和定殖有抑制作用,对维持肠道健康有着重要作用[6-7],被公认为安全性(generally regarded as safe,GRAS)菌株[8]。因此,内蒙古东部地区传统发酵乳制品中丰富的乳酸菌资源尚待进一步开发利用。
近年来,随着抗生素的广泛使用,细菌耐药性问题越来越严重,已由多重耐药性发展为普遍耐药性[9]。有研究表明,乳酸菌对万古霉素、庆大霉素、链霉素、四环素、环丙沙星等药物具有较强的耐药性,且部分菌株具有多重耐药性[10],但乳酸菌对各种抗生素的耐药性因样品来源、生存环境等差异显著[11-14]。因此,研究传统发酵乳制品中乳酸菌的耐药性具有重要的意义。
本研究以内蒙古通辽地区自制的奶豆腐和酸性奶油(乌日莫)两种传统发酵乳制品为材料,采用稀释涂布法从中分离纯化乳酸菌,借助保守序列16S rRNA鉴定乳酸菌种属关系,并采用8种常见抗生素药敏性实验深入分析乳酸菌的耐药率和多重耐药性,为传统发酵乳制品中乳酸菌安全性评价提供重要参考,为乳酸菌耐药分子机制和优良乳酸菌资源开发奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
奶豆腐(NDF)和乌日莫(WRM)两种自制传统发酵乳制品均采集自内蒙古通辽地区的牧民家庭。
1.1.2 培养基
MRS固体培养基[7]:蛋白胨10 g,牛肉膏10 g,酵母提取物5 g,K2HPO4 2 g,柠檬酸二铵2 g,乙酸钠5 g,葡萄糖20 g,吐温80 1 mL,MgSO4·7H2O 0.58 g,MnSO4·H2O 0.25 g,琼脂粉18 g,蒸馏水1 000 mL,pH 6.2~6.4。121 ℃灭菌20 min。MRS液体培养基中不添加琼脂。
1.1.3 药敏纸片及主要试剂
氯霉素(chloramphenicol,C)、万古霉素(vancomycin,VA)、四环素(tetracycline,T)、链霉素(streptomycin,SM)、环丙沙星(ciprofloxacin,CIP)、利福平(rifampicin,RD)、萘啶酸(nalidixic acid,NA)、红霉素(erythromycin,EM)抗生素药敏试纸:杭州滨和微生物试剂有限公司;无水乙醇(分析纯):天津市致远化学试剂厂;琼脂糖(分析纯):北京索莱宝科技有限公司;聚合酶链式反应(polymerase chain reaction,PCR)引物:生工生物工程(上海)股份有限公司;磷酸氢二铵(分析纯):国药集团化学试剂有限公司;硫酸锰(分析纯):天津市天力化学试剂有限公司;无水乙酸钠(分析纯):天津市德恩化学试剂有限公司;酵母浸粉(生化试剂):北京奥博星生物技术有限责任公司;2×Master Mix:北京擎科新业科技有限公司。
1.2 仪器与设备
3K-15型台式高速离心机:德国Sigma公司;Mastercycler nexus PCR扩增仪:德国Eppendorf公司;DYY-6C电泳仪:北京六一电子仪器厂;ProteinSimple凝胶成像系统HP:美国ProteinSimple公司;DZF-6051型生化培养箱:宁波市东南仪器有限公司;BS-1E型振荡培养箱:苏州威尔实验用品有限公司;LS-35HD型立式压力蒸汽灭菌器:江阴滨江医疗设备有限公司;V8型漩涡混合器:美国Essenscien公司。
1.3 方法
1.3.1 乳酸菌菌株的分离与纯化
将奶豆腐样品置于无菌研钵中捣碎后待用,准确称取奶豆腐、乌日莫样品10.0 g于90 mL无菌生理盐水(含量为0.9%)中,充分振荡5 min,使样品与生理盐水混合均匀[15]。采用10倍系列梯度稀释法将样品稀释至10-3,取稀释度为10-1、10-2、10-3的样品分别涂布于MRS固体培养基上,每个梯度做3次平行[16],37 ℃静置培养48 h后,根据乳酸菌菌落特征,挑取单菌落并纯化2次,将纯化菌株保存于20%甘油中,-80 ℃冷冻保存备用。
1.3.2 分子生物学鉴定
采用异硫氰酸胍(guanidine thiocyanate,GUTC)法提取乳酸菌的基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)[17]。以其为模板,27F(5'-AGAGTTTGATCCTGGCTCAG-3')和1492R(5'-GGTTACCTTGTTACGACTT-3')为引物,对其16SrRNA基因序列进行PCR扩增。PCR扩增体系:2×Mix(含Loading)23.00 μL、引物27F和1492R各1.00 μL、DNA模板2.00 μL,以双蒸水(ddH2O)补至50.00 μL。PCR扩增条件:95 ℃预变性5 min;94 ℃变性1 min,55 ℃退火1 min,72 ℃延伸1 min,共循环30次;72 ℃再延伸10 min。取PCR扩增产物3.00 μL,采用1.0%琼脂糖凝胶电泳检测。将单一条带的样品送至生工生物工程(上海)股份有限公司进行测序,将测序结果提交到美国国立生物技术信息中心(nationalcenterforbiotechnologyinformation,NCBI)的GenBank数据库中采用基本局部比对搜索工具(basic local alignment searchtool,BLAST)进行同源性比对,鉴定菌株的种属关系。
1.3.3 抗生素耐药性敏感试验
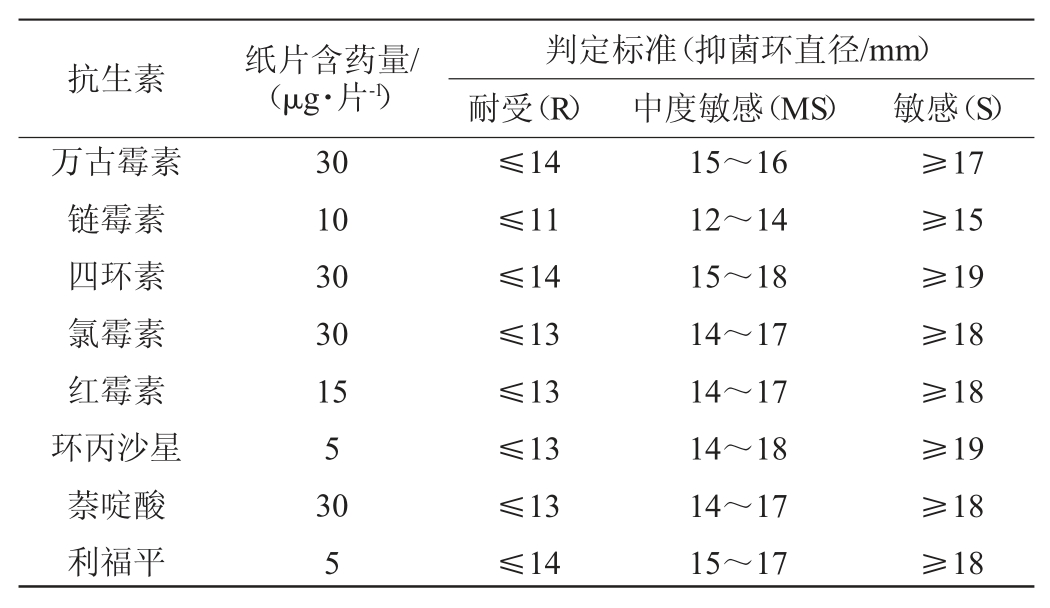
首先将乳酸菌菌株活化,挑取单菌落于MRS液体培养基中,37 ℃静置培养48 h,将菌液用无菌水调整至OD600nm值为1.0的菌悬液。然后将15 mL MRS固体培养基倒入培养皿中,待培养基凝固后,取200 μL菌悬液加入4 mL 0.6%琼脂,45 ℃混匀,均匀涂布于MRS固体培养基上,于室温放置15 min。最后在无菌条件下取出药敏纸片,置于固体培养基上(每皿3个相同药敏纸片),37 ℃培养48 h后,测量并记录抑菌圈直径。根据临床实验室标准化协会(clinical and laboratory standards institute,CLSI)(2018)和《抗微生物药物敏感性试验执行标准》第十七版信息增刊提供的纸片法标准,制定评价乳酸菌对抗生素的耐药性标准,具体判定标准见表1。
表1 药敏纸片种类、含药量及判定标准
Table 1 Types,drug contents and determination standards of drug sensitive paper
1.3.4 耐药率的计算
菌株的耐药率[18]计算公式如下:
2 结果与分析
2.1 乳酸菌的分离
采用稀释涂布法从内蒙古通辽地区自制的奶豆腐和乌日莫中共分离得到80株乳酸菌,部分典型菌株的菌落形态及革兰氏染色镜检观察结果见图1。

图1 部分分离菌株的菌落形态(a)及革兰氏染色结果(b)
Fig.1 Colony morphology (a) and Gram staining results (b) of some isolated strains
由图1可知,乳酸菌菌落在MRS固体培养基上多呈圆形,凸起,微白色,湿润,边缘整齐;所有菌株镜检结果均呈革兰氏阳性,细胞形态多样。
2.2 乳酸菌的分子生物学鉴定
分离乳酸菌的分子生物学鉴定结果见表2。由表2可知,经16S rRNA基因测序与鉴定,80株乳酸菌归属于13个种,分别为短乳杆菌(7株)、粪肠球菌(5株)、乳酸片球菌(2株)、乳酸乳球菌(12株)、瑞士乳杆菌(4株)、屎肠球菌(13株)、戊糖片球菌(5株)、副干酪乳杆菌(7株)、食二酸乳杆菌(4株)、奥塔基乳杆菌(5株)、耐久肠球菌(4株)、植物乳杆菌(6株)、开菲尔乳杆菌(6株),表明内蒙古东部地区传统发酵乳制品中乳酸菌生物多样性较高。
表2 分离乳酸菌的分子生物学鉴定结果
Table 2 Molecular biological identification results of isolated lactic acid bacteria

2.3 乳酸菌耐药性结果与分析
2.3.1 乳酸菌药敏纸片结果
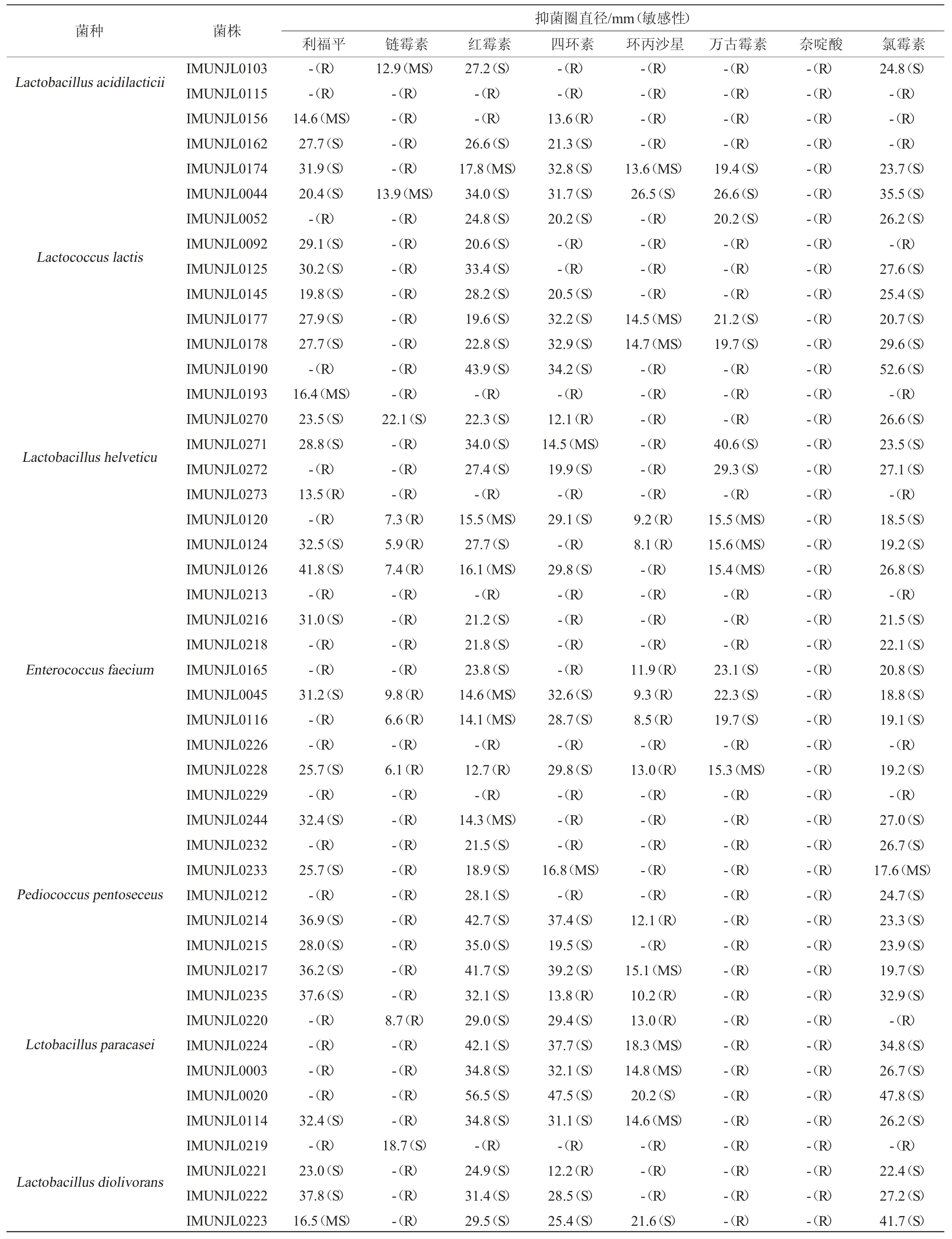
分离得到的80株乳酸菌对8种抗生素的耐药性见表3。
由表3可知,利福平、链霉素、红霉素、四环素、环丙沙星、万古霉素、奈啶酸、氯霉素抗性培养基上无抑菌圈(耐药(R))的乳酸菌分别是36株、59株、13株、26株、49株、53株、80株、16株,这些乳酸菌对相应抗生素表现出强耐药性;抑菌圈直径较大(敏感(S)型)的菌株数分别为39株、4株、59株、43株、11株、22株、0株、61株,这些菌株对相应抗生素表现出强敏感性。另外,有7株乳酸菌(L.brevis IMUNJL0111、E.faecalis IMUNJL0096、E.faecalis IMUNJL0039、L.acidilacticii IMUNJL0115、E.faecium IMUNJL0213、E.faecium IMUNJL0226、E.faecium IMUNJL0229)对所有8种抗生素均无抑菌圈(强耐药性)。由此可见,从内蒙古通辽地区传统发酵乳制品中分离得到的80株乳酸菌对8种抗生素的耐药性差异显著,部分菌株表现出强耐药性,部分菌株表现出强敏感性,这可能与菌株自身的固有性耐药以及外部环境的影响有关[19]。
表3 80株乳酸菌对8种抗生素的耐药性结果
Table 3 Drug resistance results of 80 strains of lactic acid bacteria to 8 antibiotics

续表
续表

注:“-”表示无抑菌圈产生。
2.3.2 乳酸菌对不同抗生素的耐药率分析
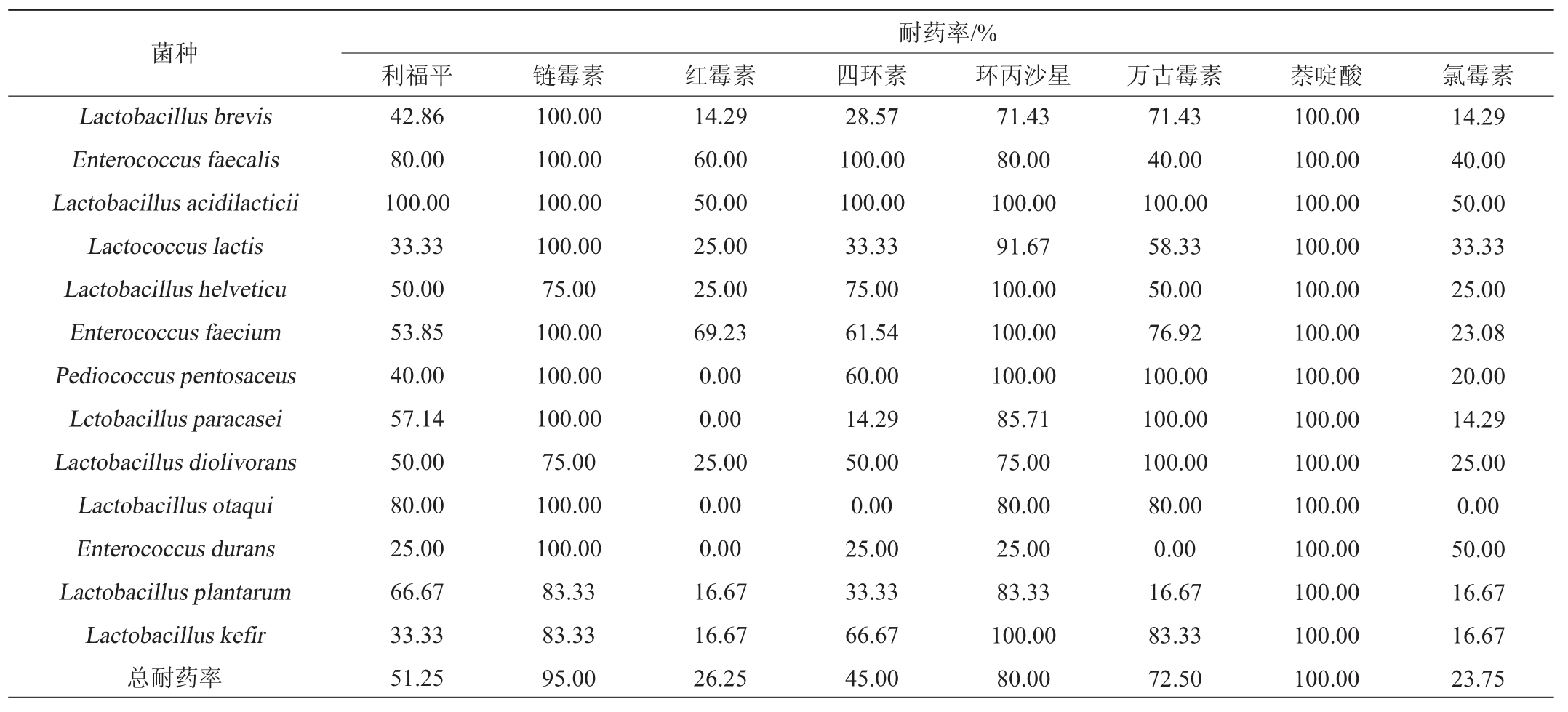
13个乳酸菌菌种对8种抗生素的耐药率见表4。
表4 乳酸菌对8种抗生素的耐药率
Table 4 Drug resistance rates of lactic acid bacteria to 8 antibiotics
注:总耐药率为对某一种抗生素有耐药性的菌株数量占总数(80株乳酸菌)的比率。
由表4可知,80株乳酸菌对抗生素的耐药率由高到低依次为萘啶酸(100%)、链霉素(95.00%)、环丙沙星(80.00%)、万古霉素(72.50%)、利福平(51.25%)、四环素(45.00%)、红霉素(26.25%)、氯霉素(23.75%)。13种乳酸菌对8种抗生素的耐药率差异明显。乳酸片球菌对萘啶酸、利福平、链霉素、四环素、环丙沙星、万古霉素的耐药率均为100%;戊糖片球菌对链霉素、环丙沙星、万古霉素、萘啶酸的耐药率均为100%;副干酪乳杆菌对链霉素、万古霉素、萘啶酸的耐药率均为100%。然而,植物乳杆菌对红霉素、万古霉素、氯霉素的耐药率均为16.67%,耐药率较低;奥塔基乳杆菌(对红霉素、四环素、氯霉素的耐药率为0)、耐久肠球菌(对红霉素和万古霉素的耐药率为0)、戊糖片球菌和副干酪乳杆菌(对红霉素耐药率为0)对不同抗生素表现出高度的敏感性。
上述结果与新疆北部[16]、西藏[20-21]、内蒙地区[22]发酵乳制品中分离出的乳酸菌耐药性高度一致,均发现植物乳杆菌、副干酪乳杆菌对链霉素耐药,对四环素、红霉素敏感,这表明传统发酵乳制品中的乳酸菌在遗传分化过程中具备一定的固有耐药能力,这与乳酸菌基因组上的大环内酯-林肯酰胺类ML(ermA,ermB,msrA/B,lnuA)及四环素类(tetM,tetK)、氨基糖苷类(aac(6')-aph(2″),aph(3')-III,strA,strB)、β-内酰胺类(blaZ)、氯霉素(cat)和万古霉素(vanX)等耐药基因有关[23-24]。然而,河南新乡市售酸奶中分离出的乳酸菌对四环素(61.3%)的耐药率更高,并检测到乳酸菌具有四环素耐药基因tetM[25];广州市售酸奶中的乳酸菌对环丙沙星和万古霉素耐药率只有54.17%~35.42%,对四环素、青霉素、氯霉素、红霉素和利福平的耐药率均较低或完全敏感[19]。因此,乳酸菌抗生素耐药性可能与地理位置、样品来源、污染程度等均有关,也可能与其耐药基因沉默或表达不充分有关[26-27],有待于更深入研究。
2.3.3 乳酸菌多重耐药性分析
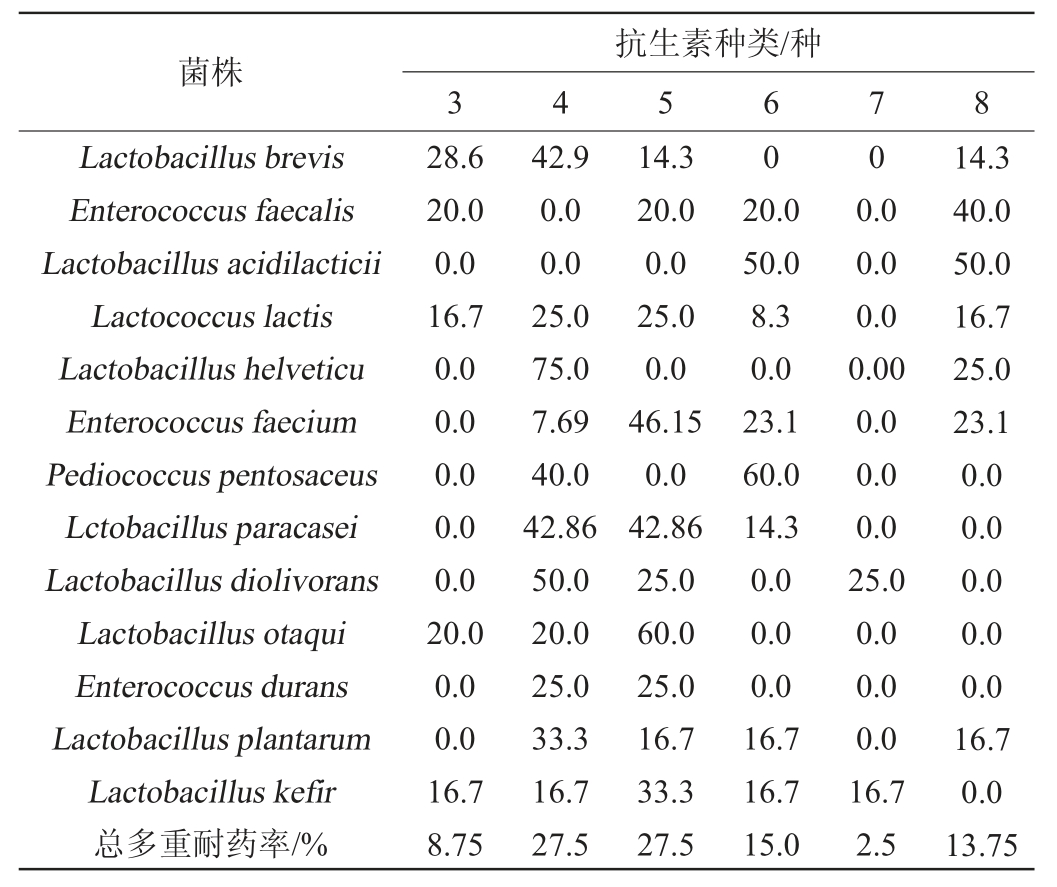
13个乳酸菌菌种的多重耐药性分析结果见表5。
表5 乳酸菌的多重耐药率
Table 5 Multiple drug resistance rates of lactic acid bacteria
注:总多重耐药率为对多种抗生素(≥3种)有耐药性的菌株数量占总数(80株乳酸菌)的比率。
由表5可知,76株(95%)乳酸菌具有多重耐药性,其中短乳杆菌、粪肠球菌、乳酸片球菌、瑞士乳杆菌、屎肠球菌、戊糖片球菌、副干酪乳杆菌、食二酸乳杆菌、奥塔基乳杆菌、开菲尔乳杆菌均表现为抗3种及以上抗生素,表明这10个种的乳酸菌具有较强的耐药性,比前期研究结果中具有多重耐药性的乳酸菌所占比例(90.3%和70.33%)更高[28-29],可能是由于具有多重耐药性的乳酸菌对自然环境的适应能力更强[30]。此外,有11株(13.75%)乳酸菌(短乳杆菌1株、粪肠球菌2株、乳酸片球菌1株、乳酸乳球菌2株、瑞士乳杆菌1株、屎肠球菌3株、植物乳杆菌1株)具有8重抗生素耐药性,表明该地区传统发酵乳制品中的乳酸菌资源多重耐药性现象十分普遍。这可能与农牧区饲养动物长期接触抗菌药物有关,致使传统发酵乳制品中抗生素残留量较高,耐药型菌株大量繁殖,以及抗性基因或R质粒[31-32]在菌株间横向转移使乳酸菌由单重耐药演化为多重耐药[33]。
3 结论
采用稀释涂布法从内蒙古通辽地区自制的奶豆腐和乌日莫中共分离纯化出80株乳酸菌,经16S rRNA序列分析,归属于13个种,分别为短乳杆菌(Lactobacillus brevis)、粪肠球菌(Enterococcus faecalis)、乳酸片球菌(Lactobacillus acidilacticii)、乳酸乳球菌(Lactococcus lactis)、瑞士乳杆菌(Lactobacillushelveticus)、屎肠球菌(Enterococcusfaecium)、戊糖片球菌(Pediococcus pentosaceus)、副干酪乳杆菌(Lactobacillus paracasei)、食二酸乳杆菌(Lactobacillus digitalis)、奥塔基乳杆菌(Lactobacillusottaki)、耐久肠球菌(Enterococcus durans)、植物乳杆菌(Lactobacillus plantarum)、开菲尔乳杆菌(Lactobacillus kefir),说明内蒙古通辽地区传统自然发酵乳制品中具有非常高的生物多样性。80株乳酸菌对萘啶酸的耐药率为100%,对链霉素、环丙沙星、万古霉素、红霉素、氯霉素的耐药率分别为95.00%、80.00%、72.50%、26.25%、23.75%。此外,76株(95%)乳酸菌具有多重耐药性(≥3种抗生素培养基上判断为耐药或中敏),这表明内蒙古传统发酵乳制品中的乳酸菌抗生素耐药性问题非常突出。因此,抗生素的使用频率和剂量将致使传统发酵乳制品中乳酸菌耐药性改变,今后应加强对传统发酵乳制品的耐药监测和溯源,制定严格的卫生标准。
[1]张和平.自然发酵乳制品中乳酸菌的生物多样性[J].生命科学,2015,27(7):837-846.
[2]额尔登孟克,潘琳,阿木尔图布兴,等.传统发酵乳制品酸马奶的研究进展[J].内蒙古农业大学学报(自然科学版),2016,37(2):134-140.
[3]蒋厚阳,陈芝兰,赵国华,等.PCR-DGGE法分析西藏传统发酵乳制品中乳酸菌的多样性[J].食品科学,2014,35(1):167-173.
[4]SUN Z H,LIU W J,ZHANG J C,et al.Identification and characterization of the dominant Lactobacilli isolated from koumiss in China[J].J Gen Appl Microbiol,2010,56(3):257-265.
[5]LIU W J,BAO Q H,JIRIMUTU,et al.Isolation and identification of lactic acid bacteria from Tarag in Eastern Inner Mongolia of China by 16S rRNA sequences and DGGE analysis[J].Microbiol Res,2012,167(2):110-115.
[6]TSAI Y T,CHENG P O,PAN T M.The immunomodulatory effects of lactic acid bacteria for improving immune functions and benefits[J].Appl Microbiol Biot,2012,96(4):853-862.
[7]王磊.酸乳用乳酸菌的筛选与应用研究[D].扬州:扬州大学,2021.
[8]DAVIS E C,WANG M,DONOVAN S M.The role of early life nutrition in the establishment of gastrointestinal microbial composition and function[J].Gut Microbes,2017,8(2):143-171.
[9]PELEG A Y,SEIFERT H,PATERSON D L. Acinetobacter baumannii:emergence of a successful pathogen[J].Clin Microbiol Rev,2008,21(3):538-582.
[10]LI S Y,LI Z,WEI W,et al.Association of mutation patterns in GyrA and ParC genes with quinolone resistance levels in lactic acid bacteria[J].J Antibiot,2015,68(2):81-87.
[11]SANDERS M E,AKKERMANS L M A,HALLER D,et al.Safety assessment of probiotics for human use[J].Gut Microbes,2010,1(3):164-185.
[12]HYACINTA M,HANA K S,ANDREA B,et al.Bile tolerance and its effect on antibiotic susceptibility of probiotic Lactobacillus candidates[J].Folia Microbiol,2015,60(3):253-257.
[13]RIAZ RAJOKA M S,SHI J L,ZHU J,et al.Capacity of lactic acid bacteria in immunity enhancement and cancer prevention[J].Appl Microbiol Biot,2017,101(1):35-45.
[14]JOMEHZADEH N,JAVAHERIZADEH H,AMIN M,et al.Isolation and identification of potential probiotic Lactobacillus species from feces of infants in southwest Iran[J].Int J Infect Dis,2020,96:524-530.
[15]聂睿,于洋,倪永清.新疆乳品中乳酸菌的多样性及耐药性分析[J].中国酿造,2016,35(1):47-50.
[16]刘璐,迪娜热尔·迪力达西,吴禹澈,等.新疆发酵乳品中乳酸菌的分离鉴定及其耐药性[J].中国微生态学杂志,2017,29(7):745-749,753.
[17]陈强,张小平,李登煜,等.从豆科植物的根瘤中直接提取根瘤DNA的方法[J].微生物学通报,2002(6):63-67.
[18]石磊,李艳莉,梁暖意,等.广州市售酸奶中乳酸菌的耐药性评估[J].现代食品科技,2014,30(10):245-250.
[19]张刚,冯婕.细菌固有耐药的研究进展[J].遗传,2016,38(10):872-880.
[20]郭慧玲,陈霞,邵玉宇,等.乳酸杆菌属对抗生素的耐药性[J].乳业科学与技术,2014,37(6):6-10.
[21]杨吉霞,陈芝兰,贺稚非,等.牦牛奶酪中乳酸菌对抗生素的药敏性[J].食品科学,2014,35(17):176-180.
[22]吕耀龙,李少英,包丹丹,等.内蒙古达茂旗牧区牛乳中乳酸菌的鉴定与耐药性分析[J].食品工业科技,2016,37(12):178-182.
[23]LIU C,ZHANG Z Y,DONG K,et al.Antibiotic resistance of probiotic strains of lactic acid bacteria isolated from marketed foods and drugs[J].Biomed Environ Sci,2009,22(5):401-412.
[24]高婧,姚景慧,赵秋华,等.奶酪中抗生素抗性基因检测及奶酪分离乳酸菌耐药性分析[J].南昌大学学报(理科版),2020,44(1):63-69,75.
[25]于涛,姜晓冰,李磊,等.市售酸奶中乳酸菌耐药性及耐药基因的检测[J].食品科学,2016,37(11):131-136.
[26]LU P,HU X,WANG X.Assessment of antibiotic resistance of lactic acid bacteria in Chinese fermented foods[J].Food Control,2011,22(8):1316-1321.
[27]张一爽.副干酪乳杆菌抗生素耐药性分析及蛋白酶活性评价[D].哈尔滨:哈尔滨工业大学,2020.
[28]陈燃,段会会,陈慧来,等.绍兴市售酸奶中乳酸菌的分离鉴定及耐药性分析[J].安徽农业科学,2013,41(21):9070-9071.
[29]杨国兴,靳增军,丁国涛,等.市售酸奶中乳酸菌的分离鉴定及耐药性分析[J].医学动物防制,2019,35(12):1142-1145.
[30]张玫.北疆部分地区食源性大肠杆菌耐药性及生长特性的研究[D].石河子:石河子大学,2015.
[31]邱美珍,杜丽飞,王红兵,等.由R质粒介导的大肠杆菌耐药性及消除[J].激光生物学报,2015,24(6):500-505.
[32]马驰.不同中药对3种细菌耐药质粒的消除作用研究[D].雅安:四川农业大学,2011.
[33]张蓓.藏族传统曲拉制作过程中乳酸菌群变化及曲拉中益生性乳杆菌的筛选和功能性评价[D].郑州:郑州大学,2017.