食醋在我国有着3 000多年的发展历史,其作为调味品可以提升食物的风味和口感。大红浙醋是一种属于广东特色的中国传统食醋,由于复杂的微生物发酵体系,使其呈现清香的风味和透亮的玫瑰色。大红浙醋主要由糖化阶段、酒精发酵阶段以及醋酸发酵阶段发酵而成[1]。
醋酸菌作为醋酸发酵阶段中的重要微生物,其属于革兰氏阴性的需氧菌,能够快速并不完全氧化大量的碳水化合物和醇,产生有机酸作为最终产物[2]。有机酸决定了食醋的品质,为食醋清香而酸甜的风味作出了重要贡献。有趣的是,醋酸菌包含很多新属和种,每个菌株都有独特的生长需求。醋酸菌可以利用广泛的化合物作为氮的来源,如从简单的无机化合物到复杂的有机化合物,甚至铵离子都可以作为唯一的氮源提供醋酸菌生长代谢。因此,研究不同种类醋酸菌生长的具体营养源浓度和类型是解除其生长限制的重要前提[3-4]。有研究通过单一营养缺乏实验,确定了天冬氨酸、谷氨酸、脯氨酸和色氨酸是巴氏醋酸杆菌(Acetobacter pasteurianus)CICIM B7003的关键营养氨基酸[5]。还有研究报道,天冬氨酸和谷氨酸能对巴氏醋酸杆菌(Acetobacter pasteurianus)的代谢和抗酸胁迫产生有益影响[6]。此外,有研究发现氨基酸是通过平衡极端环境条件下的氧化还原电势[7],提升糖利用率以及保护特定微生物免受竞争的侵害,以此对微生物的代谢产生影响[8-11]。
为了研究大红浙醋发酵中特定醋酸菌的营养需求,本研究首先采用钙透明圈法从大红浙醋中分离筛选醋酸菌,并通过分子生物学技术对其进行菌种鉴定;然后研究10种氮源对巴氏醋酸杆菌产酸量的影响,并对10种氮源组成进行定性和定量分析,得出产酸代谢的关键氨基酸;最后挑出10种关键氨基酸进行验证,不仅可以了解醋酸菌对氨基酸的需求,还可以通过使用干预手段直接投入关键氨基酸以降低食醋生产成本和提升食醋发酵效率。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
大红浙醋样品:采用无菌方式从广州致美斋食品有限公司获取发酵不同天数的大红浙醋样品。
1.1.2 试剂
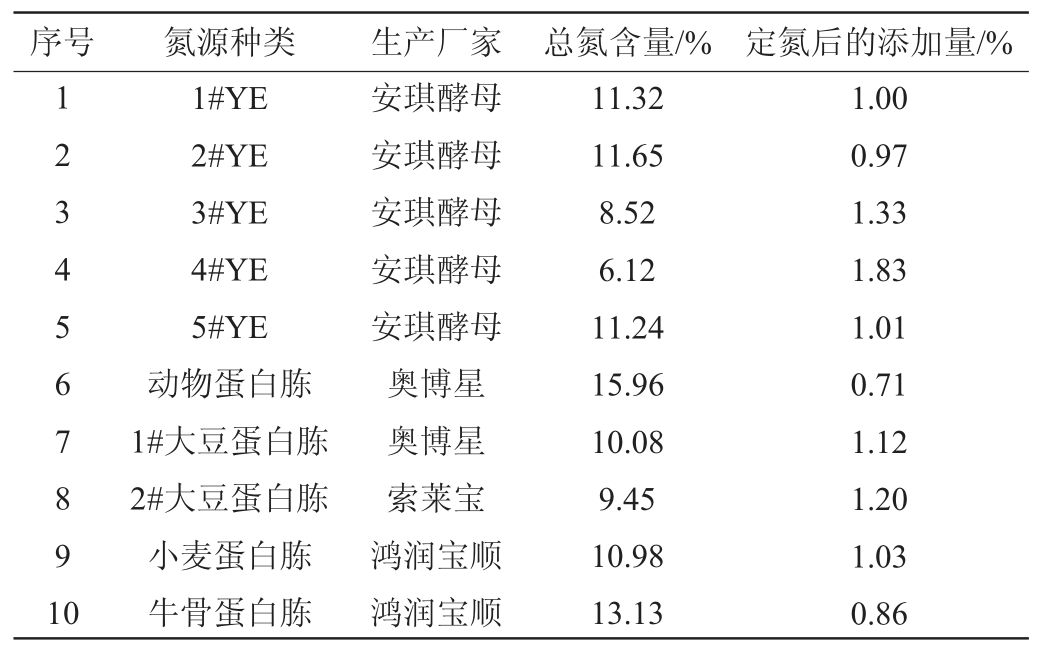
5种酵母抽提物(yeast extract,YE)1#YE、2#YE、3#YE、4#YE、5#YE:安琪酵母股份有限公司;动物蛋白胨、小麦蛋白胨(均为生化试剂):北京奥博星生物技术有限公司;1#大豆蛋白胨、2#大豆蛋白胨(均为生化试剂):北京鸿润宝顺科技有限公司;氢氧化钠(分析纯):天津风船化学试剂有限公司;无水乙醇(分析纯):天津市江天化工股份有限公司;普通凝胶脱氧核糖核酸(deoxyribonucleic acid,DNA)回收试剂盒:北京天根生化试剂公司;牛骨蛋白胨(生化试剂)、革兰氏染色试剂盒、脯氨酸、甘氨酸、丙氨酸、天冬氨酸、谷氨酸、色氨酸、精氨酸、赖氨酸、丝氨酸、缬氨酸(均为分析纯):北京索莱宝科技有限公司。
1.1.3 培养基
分离纯化培养基[12]:1%1#YE,1%葡萄糖,2%琼脂粉,2%CaCO3,0.01%硫酸镁,自然pH,121 ℃灭菌20 min,使用前加入4%(V/V)无水乙醇。
液体发酵培养基[12]:1%不同种类氮源,1%葡萄糖,0.01%硫酸镁,自然pH,121 ℃灭菌20 min,使用前加入4%(V/V)无水乙醇。
斜面保藏培养基[12]:1%1#YE,1%葡萄糖,2%琼脂粉,2%CaCO3,自然pH,121 ℃灭菌20 min。
1.2 仪器与设备
DY04-13-44-00高压蒸汽灭菌锅:上海东亚压力容器有限公司;MTZ18H009离心机:美国贝克曼库尔特有限公司;ZHJH-C1115C超净工作台:上海智城仪器有限公司;FE28-Standard pH计:梅特勒-托利多有限公司;ZWY-100H恒温培养箱:上海智城仪器有限公司;UV-1800紫外分光光度计:上海美谱达仪器有限公司;T100聚合酶链式反应(polymerase chain reaction,PCR)仪、Y-600电泳仪:美国Bio-Rad Laboratories公司;1260 infinityⅡ高效液相色谱(high performance liquid chromatography,HPLC)仪:美国安捷伦公司;Kjeltec 8400全自动凯氏定氮仪:丹麦FOSS公司。
1.3 方法
1.3.1 醋酸菌的分离与筛选
在无菌环境下称取25 mL大红浙醋样品加入225.0 mL无菌生理盐水中,常温下振荡混匀,梯度稀释,吸取不同稀释度的样品100 μL涂布于分离纯化培养基上,在30 ℃培养箱中培养2 d。挑取培养基内的单个菌落进行三区划线,纯化至无杂菌时采用斜面保藏培养基保藏备用[13]。挑取纯化好的菌落在载玻片上革兰氏染色,进行光学显微镜观察[14]。
从固体培养基内挑选透明圈较大的菌株接种于液体发酵培养基(氮源为1#YE),30 ℃、180 r/min条件下培养24 h。取5 mL菌液,4 ℃、8 000 r/min条件下离心,取上清,用1.0 mol/L NaOH调节上清液pH为7.0,滴加几滴5%FeCl3摇匀,随后在酒精灯火焰上将试管加热至沸腾,观察试管内是否生成红褐色沉淀,如产生红褐色沉淀即为产醋酸菌株[12]。
1.3.2 分子生物学鉴定
采用DNA提取试剂盒提取醋酸菌基因组DNA,以其为模板,采用引物27F(5'-AGAGTTTGATCCTGGCTCAG-3')和1492R(5'-GGTTACCTTGTTACGACTT-3')对分离菌株的16S rDNA基因序列进行PCR扩增。PCR扩增条件:94 ℃预变性2 min;94 ℃变性45 s、55 ℃复性50 s、72 ℃延伸2 min,30个循环,72 ℃修复延伸10 min,于4 ℃终止反应。PCR扩增体系:引物27F、1492R各2 μL,模板2 μL,反应混合物20 μL,重蒸水(ddH2O)14 μL。PCR扩增产物经0.5%琼脂糖凝胶电泳检测,检测合格后委托金唯智生物科技公司进行测序。将测序结果提交至美国国立生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库中,采用基本局部比对搜索工具(basic local alignment search tool,BLAST)与已知序列进行同源比对,利用MEGA 6软件中的邻接(neighbor-joining,NJ)法构建系统发育树[15-16]。
1.3.3 最佳氮源浓度的确定
在液体发酵培养基中加入0.5%、1.0%、1.5%、2.0%、5.0%的1#YE作为氮源,按3%(V/V)的接种量接入分离菌株,检测不同发酵时间的生物量(OD600nm值)和产酸量[17]。
1.3.4 不同氮源总氮含量和组成成分分析
采用凯氏定氮法测定10种氮源的总氮含量[18]。采用高效液相色谱法对氮源游离氨基酸和非游离氨基酸进行定性和定量测定[19-20]。
1.3.5 不同氮源对分离菌株生物量和产酸量的影响
为了保持不同氮源总氮量恒定,液体发酵培养基内按1%1#YE的总氮量分别添加其他9种氮源,按3%(V/V)的接种量接入分离菌株,检测不同发酵时间的生物量(OD600nm值)和产酸量[17]。
1.3.6 氨基酸缺失实验
通过单氨基酸缺失实验,确定醋酸菌在酒精醋酸化过程中的必需营养氨基酸。具体步骤如下:设置包含10种氨基酸的培养基为空白组,再将10种氨基酸分别减少1种(包含9种氨基酸)的培养基作为实验组,比较空白组和实验组的产酸量[2]。
1.3.7 数理统计方法
在实验过程中每组实验平行做3次平行后取平均值,最终结果以“平均值±标准偏差”表示,所有实验数据结果采用Origin 2021软件绘图。
2 结果与分析
2.1 醋酸菌的分离与筛选
采用分离纯化培养基从大红浙醋中分离得到20株有钙透明圈的菌株,其中菌株SHQ-A发酵液产生红褐色沉淀,初步判定其为产醋酸菌株[17,21],该菌株在分离纯化培养基上的菌落及细胞形态见图1。
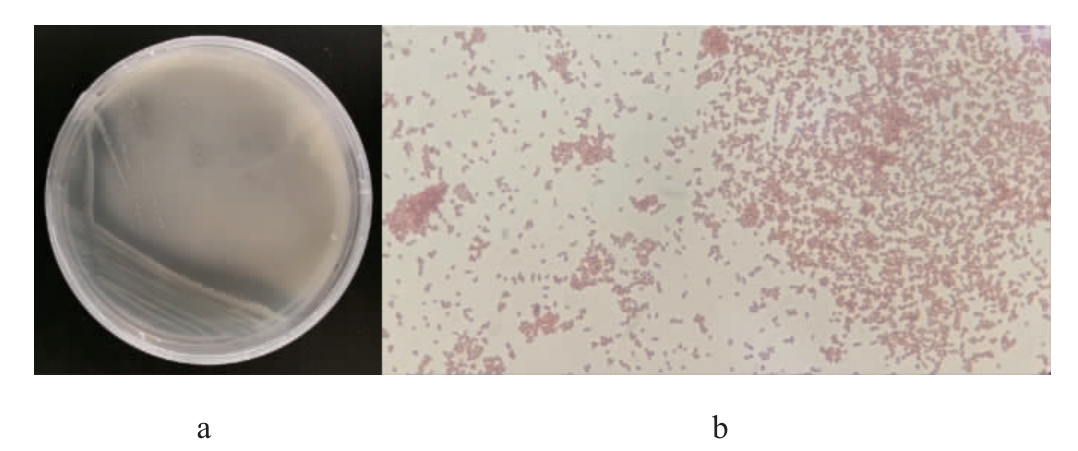
图1 菌株SHQ-A的菌落(a)及细胞(b)形态
Fig.1 Colony (a) and cell (b) morphology of strain SHQ-A
由图1可知,菌株SHQ-A的菌落呈圆形,表面呈光滑油脂状,边缘整齐且具有透明圈;菌株SHQ-A革兰氏染色后呈红色短杆状,为革兰氏阴性菌,符合醋酸菌的产酸和革兰氏阴性特性[22-23]。
2.2 菌株SHQ-A的分子生物学鉴定
基于16S rDNA基因序列,采用MEGA 6软件构建菌株SHQ-A的系统发育树,结果见图2。
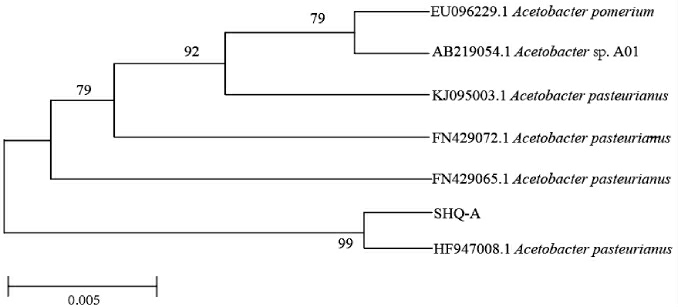
图2 基于16S rDNA基因序列菌株SHQ-A的系统发育树
Fig.2 Phylogenetic tree of strain SHQ-A based on 16S rDNA gene sequences
由图2可知,菌株SHQ-A与Acetobacter pasteurianus(HF947008.1)聚于一支,亲缘关系最近,结合形态观察,鉴定该菌株为巴氏醋酸杆菌(Acetobacter pasteurium)。
2.3 提升醋酸菌SHQ-A发酵产酸性能的研究
2.3.1 总氮添加量的确定
氮源提供必要氨基酸使醋酸菌生长并进行产酸代谢,当总氮含量过高引起氨基酸浓度过高时不但不会促进醋酸菌生长,更可能抑制它的代谢活动。因此,选择适宜的总氮添加量是提升巴氏醋酸杆菌产酸的基础[24]。1#YE添加量对巴氏醋酸杆菌SHQ-A生长和产酸量的影响见图3。
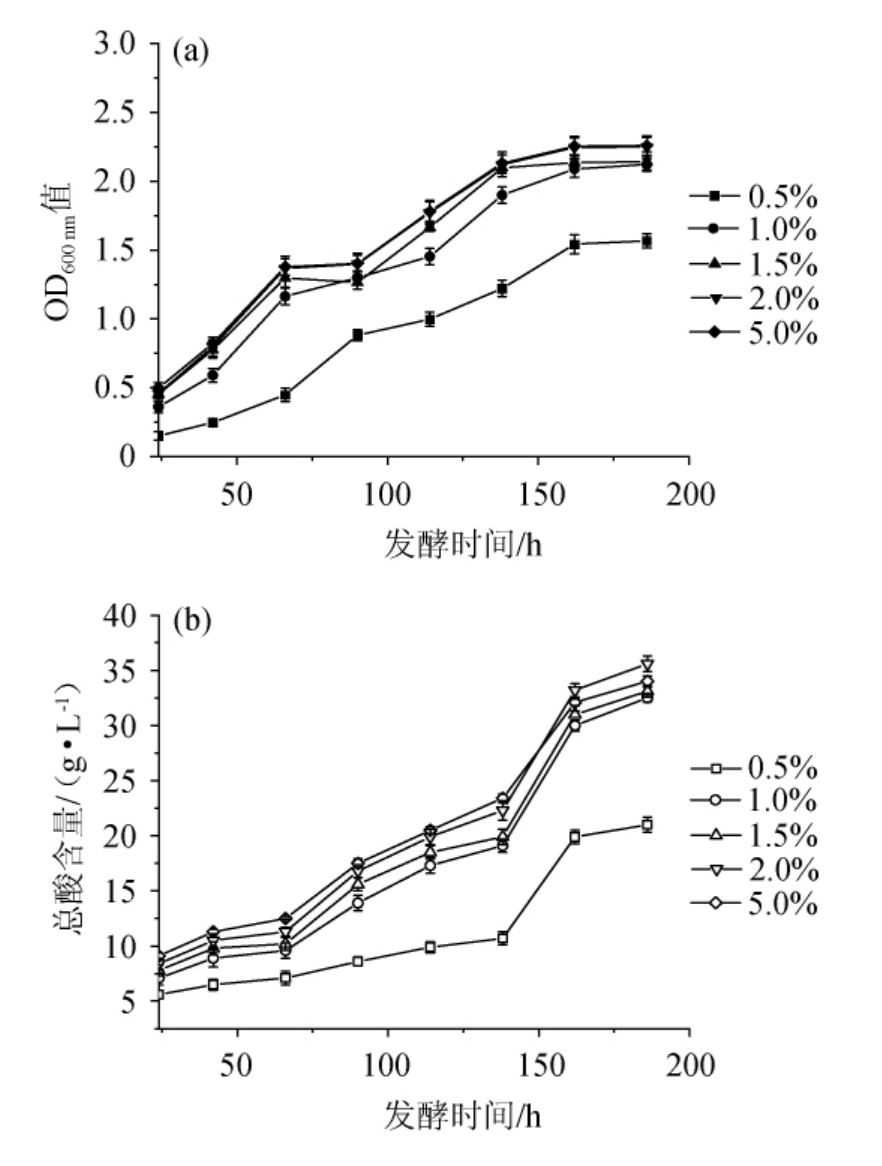
图3 不同1#YE添加量对巴氏醋酸杆菌SHQ-A生长(a)和产酸量(b)的影响
Fig.3 Effects of different 1#YE addition on the growth (a) and acid production (b) of Acetobacter pasteurianus SHQ-A
由图3可知,当1#YE含量<1.0%时,巴氏醋酸杆菌SHQ-A的生长和产酸量极低。但当1#YE含量>1.0%之后,巴氏醋酸杆菌SHQ-A的生长和产酸量也并无优势。基于高效原则,确定1#YE的最优添加量为1.0%。为了确保不同氮源的可比性,根据表1所测定的不同氮源的总氮含量,将1%1#YE定义为参考培养基,因此,每种培养基总氮添加量都应保持为0.11%后添加不同种类氮源。
表1 添加不同氮源对总氮含量的影响
Table 1 Effect of different nitrogen sources addition on total nitrogen content
2.3.2 不同氮源对菌株SHQ-A生长及总酸含量的影响
不同氮源对巴氏醋酸杆菌SHQ-A生长及产酸代谢的影响见图4。
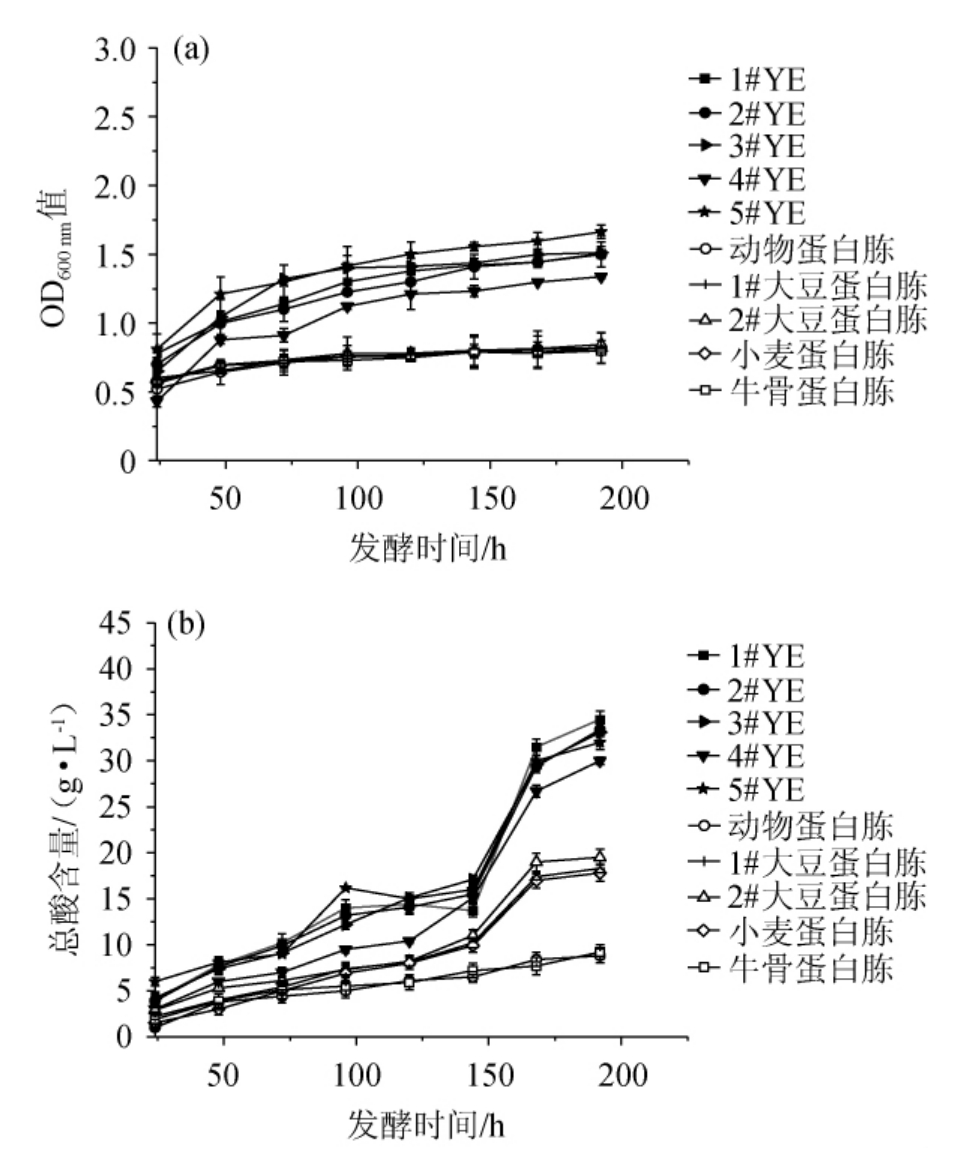
图4 不同氮源对巴氏醋酸杆菌SHQ-A生物量(a)和产酸量(b)的影响
Fig.4 Effects of different nitrogen sources on biomass (a) and acid production (b) of Acetobacter pasteurianus SHQ-A
由图4可知,相比于蛋白胨,YE明显对巴氏醋酸杆菌SHQ-A的生长和产酸代谢更具优势。在发酵终点,以5#YE为氮源时,巴氏醋酸杆菌SHQ-A的OD600nm值最高,为1.7;小麦蛋白胨和牛骨蛋白胨为氮源时,OD600nm值相同且为最低,为0.8。以1#YE为氮源时,巴氏醋酸杆菌SHQ-A的产酸量最高,为34.5 g/L;动物蛋白胨为氮源时,产酸量最低,为8.8 g/L。
2.3.3 不同氮源组成成分分析
为分析不同氮源导致巴氏醋酸杆菌SHQ-A生物量及产酸量差异的原因,进一步对不同氮源的组成成分进行分析,结果见图5。
由图5可知,整体来看YE组中的游离氨基酸的数量高于蛋白胨组。游离氨基酸和小肽比大肽和蛋白质更容易转运到细胞中[25-26]。此外,氨基酸可增强醋酸菌三磷酸合成和氨基酸脱氨,最终提高细胞内氨浓度以维持细胞内pH的稳定性和DNA的修复,促进不饱和脂肪酸的合成和脂质转运,从而提高细胞膜硬度、稳定性和完整性[6]。
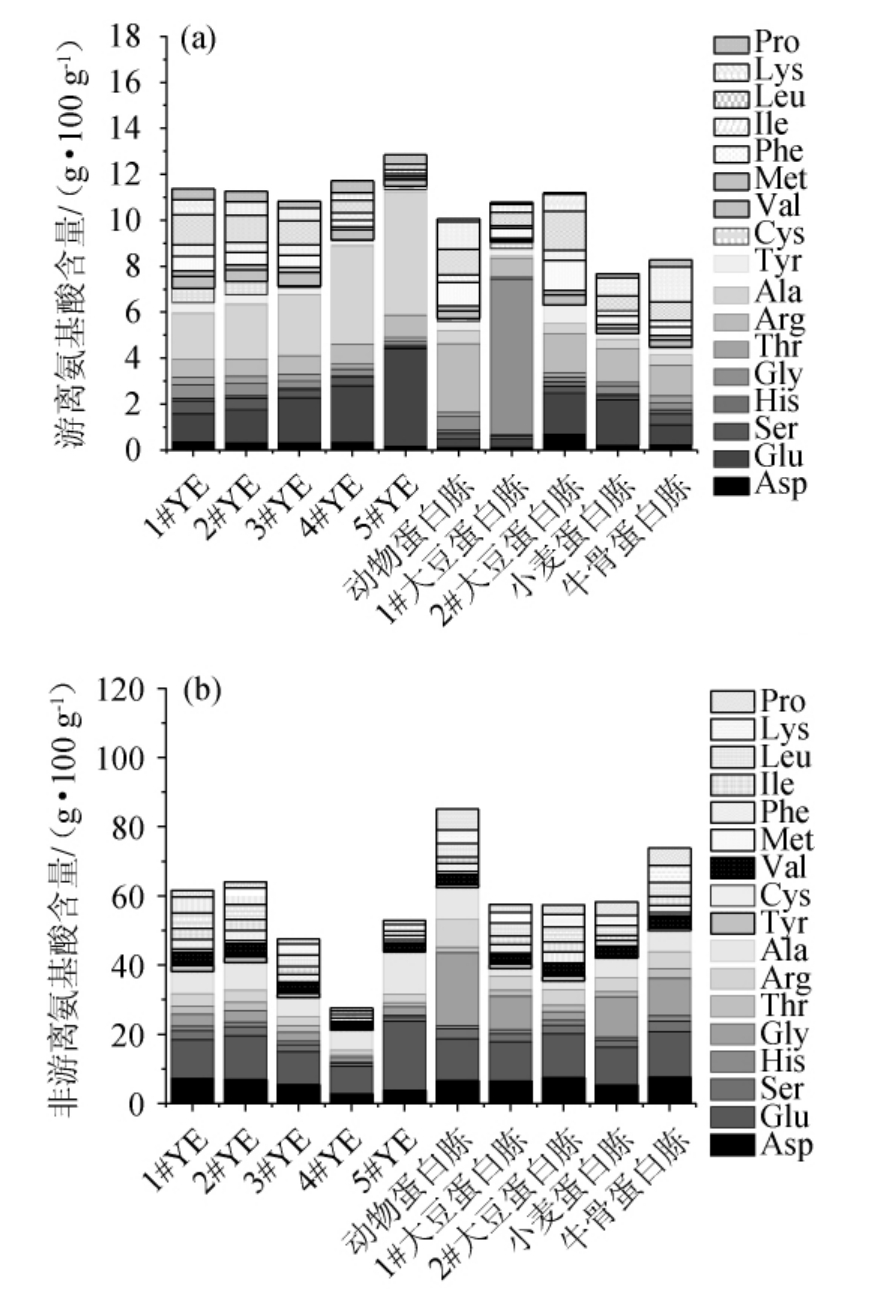
图5 不同氮源游离氨基酸(a)和非游离氨基酸(b)含量分析结果
Fig.5 Analysis results of free amino acid (a) and non-free amino acid (b) contents of different nitrogen sources
Pro:脯氨酸;Lys:赖氨酸;Leu:亮氨酸;Ile:异亮氨酸;Phe:苯丙氨酸;Met:蛋氨酸;Val:缬氨酸;Cys:半胱氨酸;Tyr:酪氨酸;Ala:丙氨酸;Arg:精氨酸;Thr:苏氨酸;Gly:甘氨酸;His:组氨酸;Ser:丝氨酸;Glu:谷氨酸;Asp:天冬氨酸。下同。
由图5亦可知,1#大豆蛋白胨、2#大豆蛋白胨游离氨基酸总量与YE相似,但其对巴氏醋酸杆菌SHQ-A的生长和产酸量较YE低,推测可能是游离氨基酸和非游离氨基酸组分的差异导致。YE与蛋白胨组成最大的区别在于前者含有较高浓度的丙氨酸和游离脯氨酸,后者则含有更多的精氨酸。其中,5#YE中的游离丙氨酸含量最高为5.38 g/100 g,1#大豆蛋白胨中的游离丙氨酸含量最低为0.12 g/100 g。4#YE中的游离脯氨酸含量最高为0.53 g/100 g,2#大豆蛋白胨中的游离脯氨酸含量最低为0.07 g/100 g。动物蛋白胨中的游离精氨酸含量最高为2.98 g/100 g,2#YE中的游离精氨酸含量最低为0.76 g/100 g。1#大豆蛋白胨中含6.78 g/100 g的游离甘氨酸,是5#YE的40.65倍。因此,丙氨酸和脯氨酸很可能是促进产酸代谢的关键积极氨基酸;而甘氨酸和精氨酸可能是抑制产酸代谢的关键消极氨基酸。研究报道,谷氨酰胺、丙氨酸和色氨酸在草莓醋发酵中呈显著下降趋势,可能是因为它们被醋酸细菌消耗,是醋酸细菌和酵母等微生物的良好氮来源。相反,精氨酸和脯氨酸,在发酵过程中显著增加。精氨酸显著增加的可能原因是该氨基酸在亚硝基条件下储存在微生物液泡中,自溶解后留在培养基中[3]。
2.3.4 氨基酸缺失实验
为了阐明巴氏醋酸杆菌SHQ-A的具体营养需求,根据上述推测结果和巴氏醋酸杆菌中心氨基酸代谢网络[5](图6)找出10种关键氨基酸以作具体研究,结果见图7。
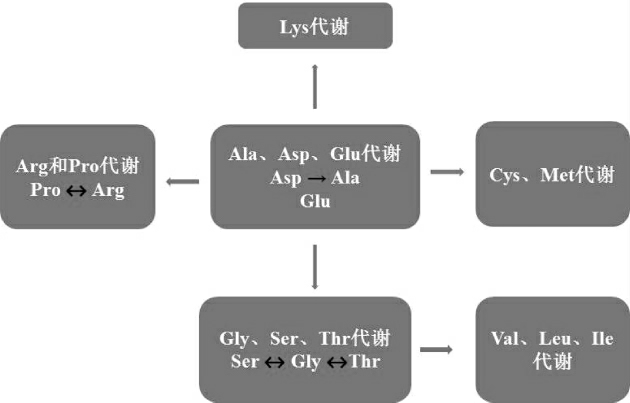
图6 巴氏醋酸杆菌SHQ-A的中心氨基酸代谢网络图
Fig.6 Central amino acid metabolic network of Acetobacter pasteurianus SHQ-A
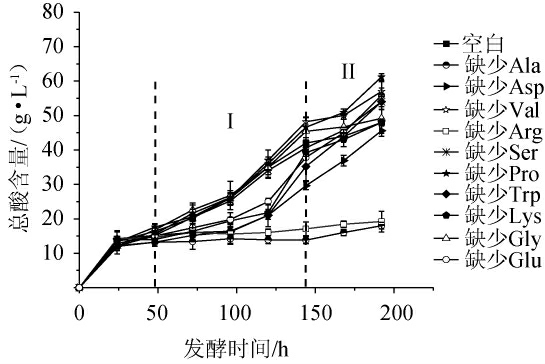
图7 缺少单一氨基酸时巴氏醋酸杆菌SHQ-A的产酸量
Fig.7 Acid production of Acetobacter pasteurianus SHQ-A without single amino acid
由图7可知,在发酵终点时,空白组中总酸含量为48.0 g/L。当缺少丙氨酸和精氨酸时总酸含量显著降低,分别为18.0 g/L和19.2 g/L,比空白组低62.5%和60%。因此,可以确定丙氨酸和精氨酸是巴氏醋酸杆菌SHQ-A代谢产酸的关键积极氨基酸。可能是因为巴氏醋酸杆菌SHQ-A的产酸只需要少量的精氨酸,所以蛋白胨中精氨酸高于YE中精氨酸的含量没有产生实际作用。在氨基酸脱羧逆向转运蛋白反应中,氨基酸被转运到细胞内并被相关酶脱羧,然后脱羧基通过反向转运蛋白从细胞中输出,同时消耗一个质子[27]。精氨酸去氨酸酶途径,通过碱性物质增加了细胞内的pH,可能有助于修复由酸应激引起的损伤或其他应激引起的脱氧核糖核酸(DNA)的损伤[27-28]。因此,当营养源中缺乏精氨酸便会直接导致产酸受到限制。有趣的是,当发酵体系中缺乏脯氨酸时,不但不会抑制巴氏醋酸杆菌SHQ-A产酸代谢,产酸量反而比空白组高27.1%,推测脯氨酸可能是产酸代谢的关键消极氨基酸。但是在植物学研究中,脯氨酸可以稳定生物大分子结构,降低细胞酸度,调节细胞膜氧化还原电位[5]。
为了更好的表明空白组与实验组产酸量的差异分布,分为I和II发酵阶段。由图7亦可知,在Ⅰ区内,谷氨酸、赖氨酸、天冬氨酸和色氨酸缺失后产酸量相较于空白组低,但随着时间延长(Ⅱ区)其限制影响消失。氨基酸主要在指数生长阶段被使用,因此Ⅰ区内一些氨基酸缺乏导致了产酸代谢受到限制。但是考虑到氨基酸之间可以相互转化,所以某些氨基酸的单一缺乏在发酵后期可能不足以导致产酸量降低。如在巴氏醋酸杆菌的中心氨基酸代谢中天冬氨酸可转化为谷氨酸和丙氨酸,由此可以降低谷氨酸和丙氨酸缺失时产生的不良影响[5]。根据其他研究报道,在苹果酒中加入谷氨酸或天冬氨酸可明显促进菌生长,这可能是由于三羧酸循环(tricarboxylic acid cycle,TCA)周期的增强,但最终酸度较低。色氨酸有利于在发酵过程中稳定乙醇脱氢酶(alcohol dehydrogenase,ADH)和乙醛脱氢酶(aldehyde dehydrogenase,ALDH)的活性,这可能会导致最终的酸度增加。根据京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)数据库可知,色氨酸参与了泛素的合成,这是醋酸细菌中酒精呼吸链中唯一的一个自由电子转运体,色氨酸可能会加强酒精呼吸链中的电子转运,从而增强腺嘌呤核苷三磷酸(adenosinetriphosphate,ATP)的合成,促进酒精酰化过程中乙酸的细胞应激性[29]。但在本研究中,缺乏色氨酸时并未对巴氏醋酸杆菌SHQ-A产酸代谢产生影响。
3 结论
本研究首先采用钙透明圈法从大红浙醋中分离筛选得到一株产酸菌株,编号为SHQ-A,经形态观察和分子生物学鉴定为巴氏醋酸杆菌(Acetobacter pasteurianus)。该菌株利用10种氮源发酵的产酸量在8.8~34.5 g/L范围内,且以酵母抽提物为氮源的产酸量明显高于蛋白胨。当缺少缬氨酸、组氨酸、色氨酸、甘氨酸、天冬氨酸、赖氨酸、谷氨酸时,产酸量与空白组无明显差异。然而,当缺少丙氨酸和精氨酸时,产酸量仅为18.0 g/L和19.2 g/L,分别低于空白组62.5%和60%,表明丙氨酸和精氨酸是产酸代谢的关键积极氨基酸;当缺少脯氨酸时,产酸量为61.2 g/L,高于空白组27.1%,表明脯氨酸是产酸代谢的关键消极氨基酸。
[1]罗瑞山,陈春香.大红浙醋的生产探讨[J].中国调味品,2003(8):29-30.
[2]SAINZ F,MAS A,TORIJA M J.Effect of ammonium and amino acids on the growth of selected strains of Gluconobacter and Acetobacter[J].Int J Food Microbiol,2017,242:45-52.
[3]ORDONEZ J L,SAINZ F,CALLEJON R M,et al.Impact of gluconic fermentation of strawberry using acetic acid bacteria on amino acids and biogenic amines profile[J].Food Chem,2015,178:221-228.
[4]SAN-VALERO P,ABUBACKAR H N,VEIGA M C,et al.Effect of pH,yeast extract and inorganic carbon on chain elongation for hexanoic acid production[J].Bioresour Technol,2020,300:122659.
[5]QI Z,DONG D,YANG H,et al.Improving fermented quality of cider vinegar via rational nutrient feeding strategy[J].Food Chem,2017,224:312-319.
[6]YIN H,ZHANG R,XIA M,et al.Efect of aspartic acid and glutamate on metabolism and acid stress resistance of Acetobacter pasteurianus[J].Microb Cell Fact,2017,16(1):109.
[7]MAESTRE O,SANTOS-DUEÑAS I M,PEINADO R,et al.Changes in amino acid composition during wine vinegar production in a fully automatic pilot acetator[J].Process Biochem,2008,43(8):803-807.
[8]CHUA J Y,TAN S J,LIU S Q.Understanding the interaction of isoleucine paired with other amino acids in soy whey alcohol fermentation using Torulaspora delbrueckii[J].Int J Food Microbiol,2020,333:108802.
[9]CHUA J Y,TAN S J,LIU S Q.The impact of mixed amino acids supplementation on Torulaspora delbrueckii growth and volatile compound modulation in soy whey alcohol fermentation[J].Food Res Int,2021,140:109901.
[10]ALVAREZ L,ALIASHKEVICH A,DE PEDRO M A,et al.Bacterial secretion of D-arginine controls environmental microbial biodiversity[J].ISME J,2018,12(2):438-450.
[11]SASABE J,MIYOSHI Y,RAKOFF-NAHOUM S,et al.Interplay between microbial D-amino acids and host D-amino acid oxidase modifies murine mucosal defence and gut microbiota[J].Nat Microbiol,2016,1(10):16125.
[12]王超宇.山西老陈醋源优良醋酸菌的分离筛选及在山楂苦荞醋中的应用[D].晋中:山西农业大学,2019.
[13]李阳.生料醋醅中优势醋酸菌的筛选及产酸特性[D].太原:山西大学,2020.
[14]孙峰宇.乳酸菌的分离鉴定及在食醋酿造中的应用[D].天津:天津科技大学,2013.
[15]谢锦明,赵秀芳,袁江兰.陕西民间醋醅中高产酸醋酸菌的筛选和发酵特性[J].食品与发酵工业,2020,46(10):173-8.
[16]邱婷.产乙偶姻微生物群落的合成及其在传统食醋酿造过程的应用[D].无锡:江南大学,2019.
[17]易九龙.传统广式米醋中醋酸菌的分离、鉴定及分批补料发酵法制备米醋工艺研究[D].广州:暨南大学,2013.
[18]PENG M,LIU J,LIU Z,et al.Effect of citrus peel on phenolic compounds,organic acids and antioxidant activity of soy sauce[J].LWTFood Sci Technol,2018,90:627-635.
[19]CALLEJON R M,TRONCOSO A M,MORALES M L.Determination of amino acids in grape-derived products:a review[J].Talanta,2010,81(4-5):1143-1152.
[20]杨菁,孙黎光,白秀珍.异硫氰酸苯酯柱前衍生化反相高效液相色谱法同时测定18种氨基酸[J].色谱,2002(4):369-371.
[21]梁丛颖,周偏,张琳.诺丽自然发酵汁中醋酸菌的分离鉴定及发酵特性[J].食品科学,2019,40(12):131-136.
[22]查婧.福建传统红曲醋中功能微生物的分离鉴定及生产性能研究[D].合肥:安徽农业大学,2014.
[23]赵会芳.耐酸醋酸菌的选育及高酸度发酵果醋的研究[D].西安:陕西科技大学,2012.
[24]李欣,黄芳,常旭.醋酸菌的营养特性分析及研究进展[J].食品研究与开发,2018,39(15):219-24.
[25]KLOTZ S,KUENZ A,PRÜßE U.Nutritional requirements and the impact of yeast extract on the d-lactic acid production by Sporolactobacillus inulinus[J].Green Chem,2017,19(19):4633-41.
[26]HIGGINS C F,HILIES I D,WHALEY K,et al.Nucleotide binding by membrane components of bacterial periplasmic binding protein-dependent transport systems[J].Embo J,1985,4(4):1033-1040.
[27]WANG B,SHAO Y,CHEN F.Overview on mechanisms of acetic acid resistance in acetic acid bacteria[J].World J Microbiol Biotechnol,2015,31(2):255-263.
[28]YANG H,YU Y,FU C,et al.Bacterial acid resistance toward organic weak acid revealed by RNA-Seq transcriptomic analysis in Acetobacter pasteurianus[J].Front Microbiol,2019,10:1616.
[29]QI Z,YANG H,XIA X,et al.High strength vinegar fermentation by Acetobacter pasteurianus via enhancing alcohol respiratory chain[J].Biotechnol Bioproce E,2014,19(2):289-297.