桔青霉素(citrinin,CIT)是引起肾脏毒性的真菌毒素之一[1],在红曲产品、发霉水果、霉变粮食及其相关食品中检出率极高[2]。已有的研究表明,红曲霉、青霉和曲霉等霉菌是引起食品中桔青霉素残留的主要原因,其中紫色红曲霉(Monascus purpureus)、红色红曲霉(Monascus ruber)、橙色红曲霉(Monascus aurantiacus)、丛毛红曲霉(Monascus pilosus)、血红红曲霉(Monascus sanguineus)、安卡红曲霉(Monascus anka)等红曲霉,纠缠青霉(Penicillium implicatum)、瘿青霉(Penicillium fellutanum)、黄绿青霉(Penicilli-um citreoviridin)、点青霉(Penicillium notatum)、扩展青霉(Penicillium expansum)、詹森青霉(Penicillium jensenii)等青霉以及土曲霉和白曲霉等曲霉已被报道为桔青霉素产毒菌[1,3-5]。
葡萄酒是以酿酒葡萄为原料,经过长时间酿造而成的酒精饮料,由于酿酒葡萄在生长期、采摘期、存储期和酿造过程中易被各种霉菌污染,其中灰霉菌、青霉和曲霉是在葡萄中常被分离到的霉菌[6-11],而这些从酿酒葡萄中分离鉴定的霉菌有一些菌与桔青霉素产毒菌一致,因此,从保障消费者饮用葡萄酒的安全性考虑,有必要对国内葡萄酒产品中的桔青霉素残留状况进行检测和风险评估。
目前,我国国标GB 5009.222—2016《食品安全国家标准食品中桔青霉素的测定》中规定桔青霉素的检测方法为免疫亲和柱净化-高效液相色谱(high performance liquid chromatography,HPLC)法和C18固相萃取小柱净化-高效液相色谱法[12],这两种方法在批量样品检测时需要大量的免疫亲和柱或C18固相萃取小柱用于样品前处理,不仅耗时而且检测成本也很高,不利于大批量样品的筛查。为此,本研究利用桔青霉素不同基团制备全抗原,经免疫小鼠后筛选最佳配对的抗血清和包被抗原,构建适合葡萄酒直接上样检测桔青霉素的高效间接竞争酶联免疫吸附测定(indirect competitive enzyme-linked immunosorbent assay,IC-ELISA)方法,该方法可免除桔青霉素的提取、净化过程,而且可以利用96孔板从批量样品中快速筛选阳性样品,为葡萄酒中桔青霉素安全性评估提供了高效率的检测工具。
1 材料与方法
1.1 材料与试剂
葡萄酒:市售;桔青霉素标准品(纯度>98%)、展青霉素(纯度>99%)、黄曲霉毒素B1(纯度>98%)、沙丁胺醇(纯度>98%)、1,4-丁二醇二缩水甘油醚(纯度>93%)、牛血清白蛋白(bovine serum albumin,BSA)(纯度98%)、卵清蛋白(ovalbumin,OVA)(纯度98%)、血蓝蛋白(keyhole limpet hemocyanin,KLH)(纯度85%)、N-羟基丁二酰亚胺(N-hydroxysuccinimide,NHS)(纯度98%)、N,N'-二环己基碳二亚胺(N,N'-dicyclohexylcarbodiimide,DCC)(纯度99%)、二甲基甲酰胺(dimethylformamide,DMF)(纯度99%)、弗氏完全佐剂(纯度99%)、弗氏不完全佐剂(纯度98%)、Tween-20(纯度99%):美国Sigma公司;BALB/c小鼠:齐齐哈尔医学院实验动物部;其他试剂均为国产分析纯。
1.2 仪器与设备
桔青霉素免疫亲和柱:北京华安麦科生物科技有限公司;UV-2450紫外可见分光光度计:日本岛津公司;HF4500酶标仪:北京华安麦科生物技术有限公司;3K15低温高速离心机:美国Sigma公司;MS204精密分析天平:瑞士Metter公司。
1.3 方法
1.3.1 抗原偶联
(1)基于桔青霉素羟基的蛋白偶联
基于桔青霉素羟基的蛋白偶联见图1。
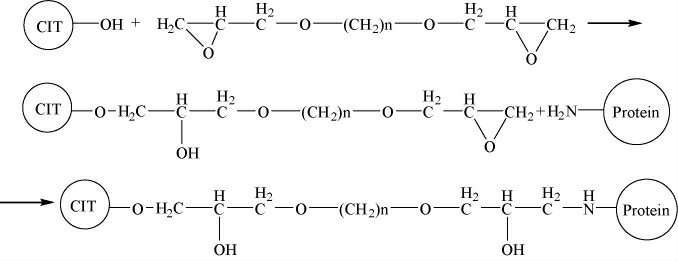
图1 基于桔青霉素羟基的蛋白偶联
Fig.1 Protein conjugation based on citrulin hydroxyl
具体方法:准确称取桔青霉素2.5 mg溶于1 mL NaOH(0.6 mol/L)溶液中,加入2.5 mL NaBH4(2 mg/mL)和2.5 mL 1,4-丁二醇二缩水甘油醚,室温反应4 h。取0.5 mL溶于碳酸盐缓冲溶液的偶联用蛋白(5 mg/mL)添加到活化的桔青霉素溶液中,37 ℃孵育24 h,分别制备CIT-BSA(OH)、CIT-OVA(OH)和CIT-KLH(OH)偶联物。CIT-BSA(OH)、CIT-OVA(OH)和CIT-KLH(OH)偶联物用0.01 mol/L的磷酸盐缓冲液(phosphate buffer saline,PBS)在4 ℃透析48 h,冻干保存在冰箱中待用。
(2)基于桔青霉素羧基的蛋白偶联
基于桔青霉素羧基的蛋白偶联见图2。
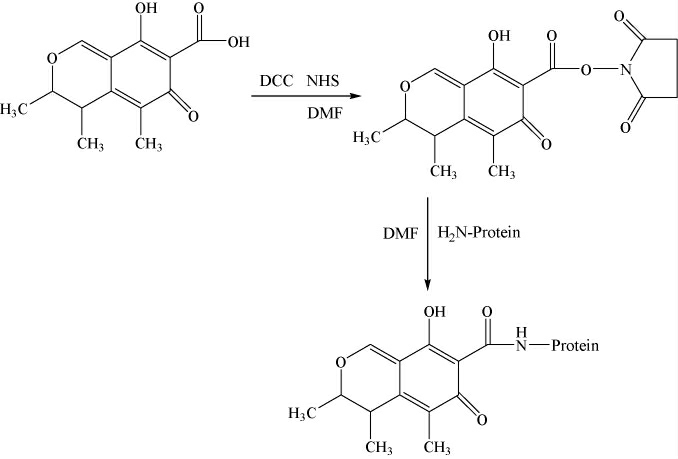
图2 基于桔青霉素羧基的蛋白偶联
Fig.2 Protein conjugation based on citrulin carboxyl
具体方法:准确称取桔青霉素1 mg溶于0.3 mL DMF溶液中,加入2 mg NHS和3 mg DCC室温孵育过夜。取2 mL溶于碳酸盐缓冲溶液的偶联用蛋白(2.5 mg/mL)滴加到活化的桔青霉素溶液中,冷藏孵育24 h,分别制备的CIT-BSA(COOH)、CIT-OVA(COOH)和CIT-KLH(COOH)偶联物。CIT-BSA(COOH)、CIT-OVA(COOH)和CIT-KLH(COOH)偶联物用0.01 mol/L的PBS在4 ℃透析48 h,冻干保存在冰箱中待用。
(3)基于桔青霉素活泼氢的蛋白偶联
基于桔青霉素活泼氢的蛋白偶联见图3。具体方法:准确称取桔青霉素1 mg溶于0.2 mL甲醇溶液中,取0.8 mL溶于乙酸钠(pH 4.2)缓冲溶液的偶联用蛋白(6 mg/mL)添加到活化的桔青霉素溶液中,加入37%的甲醛溶液混匀,37 ℃反应24 h,分别制备的CIT-BSA(H)、CIT-OVA(H)和CIT-KLH(H)偶联物。CIT-BSA(H)、CIT-OVA(H)和CIT-KLH(H)偶联物用0.01 mol/L的PBS在4 ℃透析3 d,冻干保存在冰箱中待用。
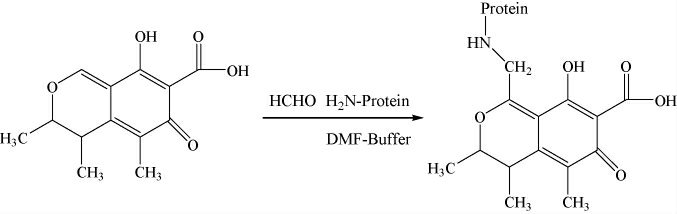
图3 基于桔青霉素活泼氢的蛋白偶联
Fig.3 Protein conjugation based on citrulin active hydrogen
1.3.2 免疫小鼠
27只BALB/c小鼠分为9组,将基于羟基偶联、羧基偶联和活泼氢偶联的CIT-BSA(OH)、CIT-OH-OVA(OH)、CIT-KLH(OH)、CIT-BSA(COOH)、CIT-OVA(COOH)、CITKLH(COOH)、CIT-BSA(H)、CIT-OVA(H)、CIT-KLH(H)全抗原分别溶解于0.01 mol/L的无菌PBS中,与等体积的弗氏完全佐剂乳化后每隔2周免疫一次,每组小鼠分别皮下和腹腔注射全抗原10~20 μg/只,共免疫3次。3次免疫后10 d从尾部采血,采用间接ELISA法测定抗体效价,血清效价超过1∶3 200的小鼠用等体积不完全弗氏完全佐剂乳化全抗原后进行增强免疫。
1.3.3 最佳配对抗血清和包被抗原的筛选
采用间接竞争ELISA法筛选最佳配对抗血清和包被抗原。以溶解于0.2 mol/L碳酸钠缓冲溶液(pH 9.6)的1 μg/mL偶联物按100 μL/每孔添加到96孔板孵育过夜。用含1.5%吐温20的PBS洗涤4次,每孔加入200 μL含5%脱脂奶粉的PBS,37 ℃孵育45 min。用含1.5%吐温20的PBS洗涤4次,每孔分别加入含5%脱脂奶粉的PBS倍比稀释的小鼠抗血清50 μL和竞争抗原(桔青霉素质量浓度1 μg/L)的PBS溶液50 μL,以添加PBS 50 μL为对照,37 ℃孵育1 h。用含1.5%吐温20的PBS洗涤4次,按100 μL/每孔加入1∶5 000稀释的辣根过氧化物酶(horse radish peroxidase,HRP)标记的山羊抗小鼠抗体,37 ℃孵育1 h后,每孔加入100 μL 3,3',5,5'-四甲基联苯胺(3,3',5,5'-tetramethylbenzidine,TMB),37 ℃反应15 min,加入50 μL 2 mol/L H2SO4终止反应,用酶标仪在波长450 nm处测定吸光度值。
1.3.4 标准曲线及交叉反应性[13-14]
选用最佳的包被抗原和抗血清稀释倍数,将此抗血清分别和质量浓度分别为0.01 μg/L、0.100 μg/L、1.00 μg/L、10.00 μg/L、100.00 μg/L、1 000 μg/mL的桔青霉素标准溶液等体积混合后,按照100 μL/孔添加到包被全抗原的96孔板,以相同质量浓度的展青霉素、黄曲霉毒素B1、沙丁胺醇和莱克多巴胺标准溶液为对照,进行间接竞争ELISA。将质量浓度为0.01 μg/L的化合物的OD450nm值用B0表示,各稀释倍数的化合物质量浓度的OD450nm值用B表示,以化合物质量浓度为横坐标(x),B/B0(%)为纵坐标(y),建立桔青霉素及其他化合物检测间接竞争ELISA标准曲线,然后利用Origin 8.1软件包分别求出CIT和其他化合物对抗血清的半数抑制浓度(half maximal inhibitory concentration,IC50)值。最后计算制备的抗血清与其他化合物的交叉反应率(cross reaction rate,CR),其计算公式如下:
1.3.5 葡萄酒中桔青霉素的测定效果分析
选用最优全抗原和抗血清构建间接竞争ELISA检测桔青霉素体系,为了评估葡萄酒中的酒精含量对构建的桔青霉素IC-ELISA检测体系的影响,在葡萄汁样品中添加乙醇体积分数为14%,以添加14%水的葡萄汁为对照,在样品中分别添加质量浓度为1 μg/L、10 μg/L、50 μg/L的桔青霉素标准溶液进行间接竞争ELISA测定,计算加标回收率,其计算公式如下:
并分析乙醇体积分数对检测方法的影响,通过加标回收试验分析葡萄酒直接上样检测的效果。
1.3.6 统计分析
数据采用Origin 8.1软件包进行统计分析。
2 结果与分析
2.1 最佳配对抗血清和包被抗原的确定
有研究表明[15-19],利用桔青霉素偶联蛋白的全抗原具有良好的免疫原性和免疫反应性。本研究在9种包被抗原和9种抗血清配对组合构建的81对IC-ELISA体系中,有25对有效组合中的抗血清的效价>1∶3 200,在检测桔青霉素标品质量浓度0 μg/L和1 μg/L之间的OD450nm值可以相差1.2以上,阴性结果与阳性结果的比值(P/N)可以大于5,结果见图4。
由图4可知,利用桔青霉素的羟基、羧基和活泼氢与不同蛋白质偶联均可筛选出具有良好免疫效价的组合,但是基于同一个基团偶联不同蛋白质组合的配对包被抗原与抗血清之间构建的竞争性ELISA效果优于不同基团偶联蛋白质的组合,基于桔青霉素活泼氢的偶联物免疫效果优于其他基团的偶联物,其中基于桔青霉素活泼氢偶联的CIT-KLH(H)免疫小鼠所形成的抗血清在稀释倍数3 200倍时检测0 μg/L桔青霉素(阴性)的OD450nm值达到2.4,与检测1 μg/L桔青霉素(阳性)的OD450nm值相差最大,为2.1,P/N值为7,其对应的包被抗原为基于活泼氢偶联的CIT-BSA(H)。因此,确定基于桔青霉素活泼氢偶联的免疫原和包被抗原为最佳,经过96孔酶标板棋盘滴定法确定的最佳全抗原包被质量浓度为2 μg/mL,竞争结合抗血清稀释倍数为1∶5 000。

图4 最佳配对抗血清和包被抗原的确定
Fig.4 Determination of optimal paired antiserum and coating antigen
2.2 标准曲线及交叉反应性
建立的桔青霉素及其他化合物的间接竞争ELISA的标准曲线见图5。由图5可知,CIT的抗血清的半数抑制浓度(IC50)值为9.8 μg/L,检测范围在0.1~100 μg/L之间的线性相关系数R2为0.969 88,因此,确定检测限为0.1 μg/L。而抗血清与其他物质的B/B0值均>50%,说明其他化合物没有与抗血清发生竞争性结合,进而说明该抗体只特异性结合桔青霉素,与其他化合物无交叉反应性。抗血清的这一特异性保障了该IC-ELISA方法可以对葡萄酒中的桔青霉素进行精准的检测而不受其他成分的影响。
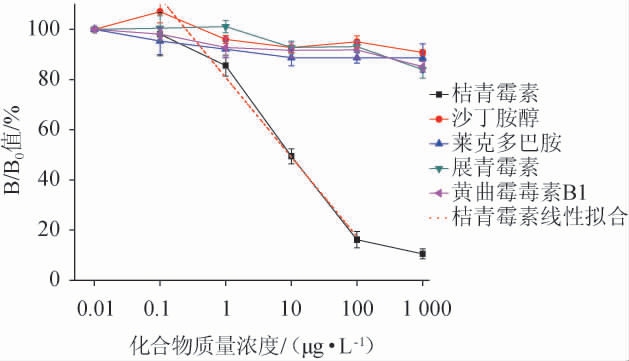
图5 桔青霉素标准曲线及其他化合物的交叉反应性
Fig.5 Citrinin standard curve and cross reactivity of other compounds
2.3 IC-ELISA法加标回收率试验
IC-ELISA法测定葡萄酒中桔青霉素的加标回收率试验结果见表1。
表1 间接竞争ELISA法检测桔青霉素的加标回收率试验结果
Table 1 Results of standard recovery rate test for the detection of citrinin by indirect competitive ELISA
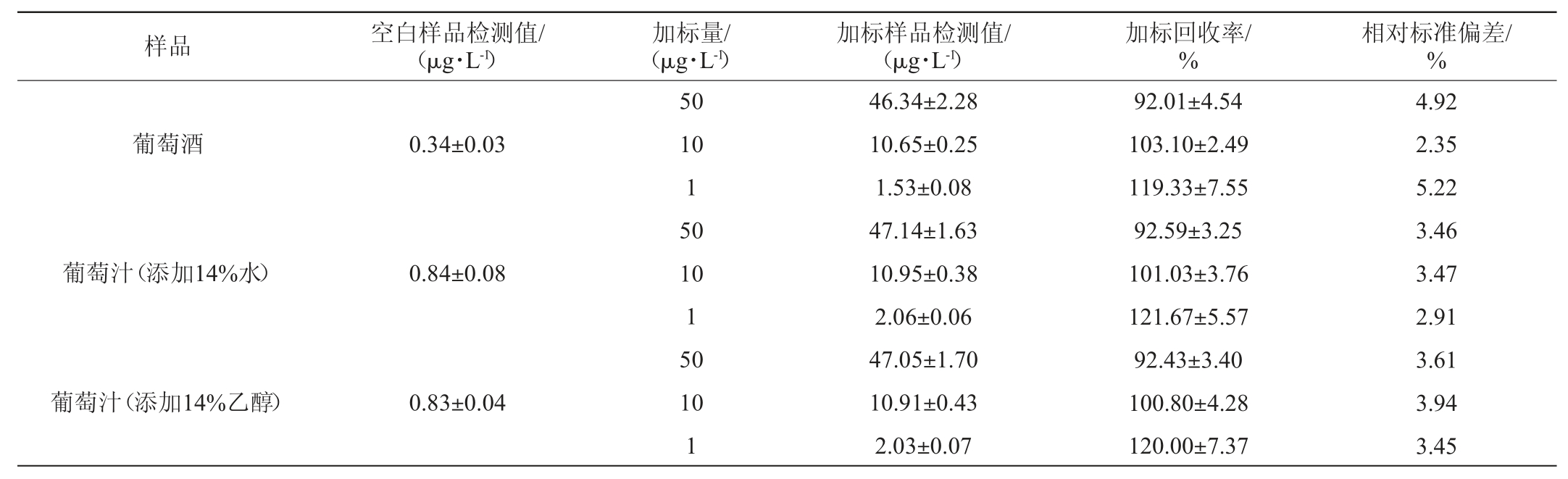
由表1可知,葡萄酒中添加桔青霉素1~50 μg/L,间接竞争ELISA检测的回收率在92.01%~119.33%之间,加标回收率试验的相对标准偏差(relative standard deviation,RSD)为2.35%~5.22%,由此可认为利用本试验制备的抗血清构建的桔青霉素间接竞争ELISA分析体系在对一定桔青霉素污染度范围的葡萄酒进行测定的方法是可行的,该体系在桔青霉素质量浓度10~50 μg/L范围内精确度较高,但对于污染度接近1 μg/L的葡萄酒,在测定过程中可能会存在一定的误差,但考虑到免疫亲和柱净化-高效液相色谱法的检测限为8 μg/kg和国际上桔青霉素残留限量标准一般为200 μg/kg或2 000 μg/kg的现状[20-22],本试验制备的抗血清以及间接竞争ELISA检测方法完全可以用于大量葡萄酒样品中超标阳性样品的初期筛查研究,因此,结合我国国标方法对大量样品进行检测时可以有效提高检测工作效率。
由表1亦可知,添加体积分数14%乙醇的葡萄汁样品和添加等量水的葡萄汁样品检测结果无显著性差异(P>0.05),表明低含量的酒精对IC-ELISA检测结果无显著性影响,因此针对葡萄酒进行直接上样检测是可行性的,而且该方法免除了葡萄酒前处理过程,可以有效提高检测效率。
另外,在对葡萄汁和葡萄酒空白样品的检测过程中发现,国内采集的葡萄汁和葡萄酒样品中含有0.34~0.84 μg/L的桔青霉素污染,虽然相对于国外报道的桔青霉素污染度较低[23-24],但是由于国内对葡萄酒中桔青霉素污染程度的调查分析资料有限[25],还无法进行有效的对比分析来证明国内葡萄及葡萄酒的桔青霉素安全性高于国外,这也提示我们未来需要对我国葡萄及其相关产品开展广泛的桔青霉素污染度调查及膳食摄入风险的评估研究。
3 结论
本研究利用桔青霉素结构中的羧基、活泼氢和羟基分别与BSA、OVA、KLH进行偶联制备了全抗原,经小鼠免疫,采用间接竞争ELISA法筛选出具有最佳竞争性反应的配对抗血清和包被抗原,其中最佳抗血清为基于桔青霉素活泼氢偶联的CIT-KLH(H),与其对应的包被原为基于桔青霉素活泼氢偶联的CIT-BSA(H),基于此建立的葡萄酒中检测桔青霉素间接竞争IC-ELISA法的检测线性范围为0.1~100 μg/L(相关系数R2为0.969 88),检测限为0.1 μg/L,桔青霉素抗血清半数抑制浓度(IC50)值为9.8 μg/L,抗血清对沙丁胺醇、莱克多巴胺、展青霉素和黄曲霉毒素B1均没有交叉反应性,该方法在葡萄酒中检测CIT的加标回收率为92.01%~119.33%,加标回收率试验的RSD为2.35%~5.22%,体积分数14%的乙醇对IC-ELISA检测结果无显著性影响(P>0.05),可直接上样快速检测葡萄酒中残留的桔青霉素。
[1]刘仁荣,许扬.桔青霉素简介及其免疫学检测方法研究进展[J].卫生研究,2004,31(1):124-127.
[2] ZHANG H,AHIMA J,YANG Q,et al.A review on citrinin:Its occurrence,risk implications,analytical techniques,biosynthesis,physiochemical properties and control[J].Food Res Int,2021,141:110075.
[3] BLANC P J,LAUSSAC J P,LE BARS J,et al.Characterization of monascidin A from Monascus as citrinin[J]. Int J Food Microbiol,1995,27(2):201-213.
[4] LI H T,DUAN R T,LIU T,et al.Penctrimertone,a bioactive citrinin dimer from the endophytic fungus Penicillium sp.T2-11[J].Fitoterapia,2020,146:104711.
[5] WANG Y Z,JU X L,ZHOU Y G.The variability of citrinin production in Monascus type cultures[J].Food Microbiol,2005,22(1):145-148.
[6]ABRAMSON D,LOMBAERT G,CLEAR R M,et al.Production of patulin and citrinin by Penicillium expansum from British Columbia (Canada)apples[J].Mycotoxin Res,2009,25(2):85-88.
[7]ATAPATTU SANKA N,POOLE COLIN F.Recent advances in analytical methods for the determination of citrinin in food matrices[J]. J Chromatogr A,2020,1627:461399.
[8] OSTRY V,MALIR F,CUMOVA M,et al.Investigation of patulin and citrinin in grape must and wine from grapes naturally contaminated by strains of Penicillium expansum[J].Food Chem Toxicol,2018,118:805-811.
[9]李玮,陈国品,谢蜀豫,等.广西南宁巨峰葡萄果实溢糖性霉斑病病原菌鉴定[J].南方农业学报,2018,49(3):495-500.
[10]李慧芳,赵利娜,郑香峰,等.1株产桔青霉素扩展青霉的鉴定及其产毒条件优化[J].食品科学,2018,39(24):162-167.
[11]王守一,贠建民,韩建平,等.甘肃河西走廊产区酿酒葡萄附生微生物区系分析[J].甘肃农业大学学报,2015,50(2):77-83.
[12]国家食品药品监督管理总局,国家卫生和计划生育委员会.GB 5009.222—2016 食品安全国家标准食品中桔青霉素的测定[S].北京:中国标准出版社,2016.
[13]孙亚宁,李青梅,杨苏珍,等.脱氧雪腐镰刀菌烯醇单克隆抗体的制备及间接竞争ELISA方法建立[J].中国兽医学报,2021,41(4):689-696.
[14]张园园,裴世春,才琳,等.抗黄曲霉毒素M1单克隆抗体的制备及定量ELISA方法的建立[J].中国预防兽医学报,2008(10):800-804.
[15]刘仁荣,余宙,何庆华,等.抗桔青霉素单克隆抗体的研制与鉴定[J].卫生研究,2007(2):190-193.
[16]李娇,钟理,田世民,等.桔青霉素人工抗原合成及偶联比测定[J].安徽农业科学,2010,38(36):20737-20739.
[17]陈尔净,徐影,马骉,等.胶体金免疫层析法快速检测桔青霉素的研究[J].中国计量大学学报,2019,30(4):490-498.
[18]KONONENKO G P,BURKIN A A.Immunoenzyme method for the determination of citrinin[J].J Anal Chem,2007,62(7):691-696.
[19]ABRAMSON D,USLEBER E,MÄRTLBAUER E.An indirect enzyme immunoassay for the mycotoxin citrinin[J]. Appl Environ Microbiol,1995,61(5):2007-2009.
[20]翟晨,穆蕾,杨悠悠.中国及欧盟粮油食品真菌毒素限量及减控措施对比[J].现代食品科技,2020,36(3):302-309.
[21]AKIYAMA H.Regulation of food additives in Japan[J].ACS Symposium,2014,1162:11-25.
[22] BOHM J,SAEGER S D,EDLERE L,et al.Scientific opinion on the risk for public and animal health related to the presence of sterigmatocystin in food and feed[J].Eur Food Safety Author J,2012,10(3):1-82.
[23] WELKE J E.Fungal and mycotoxin problems in grape juice and wine industries[J].Curr Opin Food Sci,2019,29:7-13.
[24]OSTRY V,MALIR F,CUMOVA M,et al.Investigation of patulin and citrinin in grape must and wine from grapes naturally contaminated by strains of Penicillium expansum[J].Food Chem Toxicol,2018,118:805-811.
[25]陈霞.基于QuEChERS的快速UHPLC-MS/MS法测定葡萄酒及其原料中20种真菌毒素方法的研究[D].兰州:甘肃农业大学,2017.