壳聚糖因其具有多种生物活性和用途而受到许多研究者的关注[1-3],但壳聚糖在中性pH条件下的溶解性很差,这可能限制其应用。壳寡糖是壳聚糖水解后的产物,平均分子质量<3 900 Da,聚合度<20[4]。与壳聚糖不同,壳寡糖在水中具有很大的溶解度。此外,壳寡糖还具有抗糖尿病[5-6]、抗氧化[4,7-8]、抗炎[4,9]、抗癌[9]、抗肿瘤[10]、抗菌等生物活性[11-12]。壳聚糖是一种由β-1,4连接的D-氨基葡萄糖和不同数量(低于50%)的N-乙酰-D-氨基葡萄糖组成的聚合物[13]。在很多细菌、蓝细菌、真菌和植物中都可以观察到壳聚糖酶的活性[14],它们以胞外或者胞内的形式存在。除了一类接合菌的真菌(例如犁头霉菌(Absidia orchidis)[15]、鲁氏毛霉(Mucor rouxii)[16]、卷枝毛霉(Mucor circinelloides))[17]外,大多数细菌和真菌所产壳聚糖酶属于胞外壳聚糖酶。另外还有一些胞内壳聚糖酶在植物中被发现。壳聚糖酶的特性取决于酶的来源。壳聚糖酶的分子质量在10~75 kDa,但是,Aspergillus fumigatus KH-94的壳聚糖酶分子质量可达到108 kDa[14]。壳聚糖酶的最适pH为4~8,温度为30~60 ℃,且与产酶的菌株生长条件密切相关。已经有一些研究报道了壳聚糖酶的热稳定性[18-20]。
由壳聚糖化学转化得到的壳寡糖产率低、链短、分离成本高、环境污染严重。酶法转化壳聚糖具有环境友好、成本低、重现性好、条件温和、可操作性强等优点。壳聚糖酶生产的重要来源主要是细菌,例如芽孢杆菌(Bacillus)[21-25]和链霉菌(Streptomyces)[26]。壳聚糖降解酶在近年来备受关注,并且在医学[27-29]、生物技术[30-31]、农业[32]和食品领域[33-35]有多种应用。然而,酶的生产成本高限制了它的大规模应用。因此,需要一种廉价高效的生产壳聚糖酶和将壳聚糖转化为生物活性壳寡糖的方法。
本研究以经过常压室温等离子体(atmospheric and room temperature plasma,ARTP)诱变的蜡状芽孢杆菌(Bacillus cereus)菌株作为研究对象,对其发酵培养基的组分进行优化。首先通过单因素试验确定酵母浸粉、葡萄糖、Tween-80、K2HPO4、MgSO4·7H2O、KH2PO4和NaCl的最佳添加量,然后通过Plackett-Burman(PB)试验设计和Design-Expert 10.0.4软件分析显著性因素,然后再进行最陡爬坡试验、Box-Behnken(BB)试验分析显著因素的最佳浓度,获得发酵培养基成分的最佳配比,旨在提高聚糖酶酶活,为工业化生产壳聚糖酶奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
本研究所用的突变菌株为经过ARTP诱变的蜡状芽孢杆菌TCCC 150072R,该突变菌株保藏在天津科技大学生物工程实验室。
1.1.2 试剂
酵母浸粉(生化试剂):国药集团化学试剂有限公司;葡萄糖、NaCl、K2HPO4(均为分析纯):天津市风船化学试剂科技有限公司;KH2PO4、MgSO4(均为分析纯):天津市化学试剂一厂;Tween-80(分析纯):天津市大茂化学试剂厂。
1.1.3 培养基
发酵培养基:酵母浸粉16 g/L、葡萄糖11.5 g/L、NaCl 5 g/L、K2HPO4 1.4 g/L、KH2PO4 0.6 g/L、Tween-80 1.2 g/L和MgSO4·7H2O 1.2 g/L,pH为6.5,121 ℃灭菌20 min。
活化培养基:蛋白胨10g/L,酵母浸粉5g/L,氯化钠5 g/L,葡萄糖10 g/L,琼脂20 g/L,pH 为6.5,121 ℃灭菌20 min。
种子液培养基:蛋白胨10 g/L,酵母浸粉5 g/L,氯化钠5 g/L,葡萄糖10 g/L,pH 为6.5,121 ℃灭菌20 min。
1.2 仪器与设备
LDZX-50KBS高压蒸汽灭菌锅:上海申安医疗器械厂;LRH-150-HS恒温恒湿培养箱:广东省医疗器械厂;ELX800酶标仪:基因有限公司;ZWYR-D2401恒温摇床:上海智能分析仪器制造有限公司;TG16 台式高速离心机:上海卢湘仪离心机仪器有限公司。
1.3 方法
1.3.1 种子液的制备
将保藏的突变菌种先在活化培养基中进行活化培养,然后挑选生长茁壮的菌株接种到种子培养基中制成种子液。
1.3.2 壳聚糖酶发酵液的制备
在250 mL摇瓶中装100 mL的发酵培养基,灭菌后按照2%(V/V)接种量接种种子液进行壳聚糖酶的生产,发酵条件为30 ℃、160 r/min的旋转摇床中培养30 h。发酵结束后,在10 000×g条件下离心20 min,将上清液作为粗制壳聚糖酶进行酶活测定。
1.3.3 壳聚糖酶酶活的测定
根据壳聚糖酶酶活定义[36]来进行壳聚糖酶活测定,其测定方法参考文献[37]。
1.3.4 发酵培养基优化单因素试验
分别考察发酵培养基配方中的成分:酵母浸粉(4 g/L、8 g/L、12 g/L、16 g/L和20 g/L)、葡萄糖(7.0 g/L、11.5 g/L、16.0 g/L、20.5 g/L和25.0 g/L)、NaCl(2 g/L、5 g/L、8 g/L、11 g/L和14 g/L)、K2HPO4(0.2 g/L、0.8 g/L、1.4 g/L、2.0 g/L和2.6 g/L)、KH2PO4(0.2 g/L、0.6 g/L、1.0 g/L、1.4 g/L和1.8 g/L)、Tween-80(0.4 g/L、1.2 g/L、2.0 g/L、2.8 g/L和3.6 g/L)和MgSO4·7H2O(0.4 g/L、1.2 g/L、2.0 g/L、2.8 g/L和3.6 g/L)对蜡状芽孢杆菌突变菌株产壳聚糖酶酶活的影响。
1.3.5 发酵培养基优化响应面试验
(1)P-B试验设计
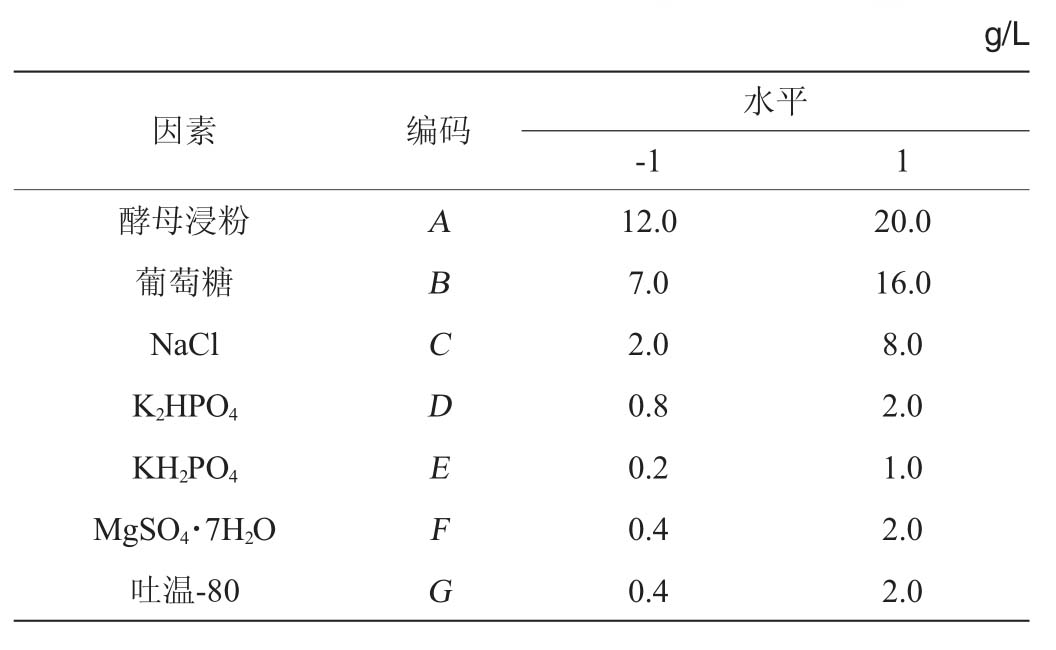
壳聚糖酶发酵培养基的七个变量分别为:酵母浸粉(A)、葡萄糖(B)、NaCl(C)、K2HPO4(D)、KH2PO4(E)、Tween-80(F)和MgSO4·7H2O(G),使用Design-Expert 10.0.4软件从这七个变量中筛选出对壳聚糖酶产量具有较大影响的因素,每个因素测试两个水平,表示为1和-1,PB试验设计因素与水平见表1。
表1 PB试验设计因素与水平
Table 1 Factors and levels of PB experimental design
(2)最陡爬坡试验
根据上述PB试验设计筛选出对壳聚糖酶显著影响的因素,然后使用最陡爬坡试验的上升试验,进一步分析和优化具有显著影响的因素对壳聚糖酶酶活力的影响,通过此试验确定各显著影响因素的合适范围。
(3)响应面法优化培养基
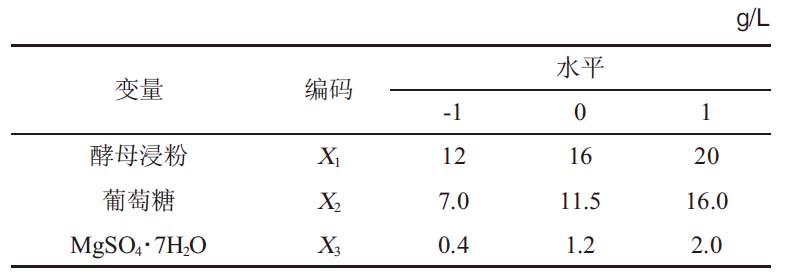
根据最陡爬坡试验初步得到酵母浸粉(X1)、葡萄糖(X2)和MgSO4·7H2O(X3)合适浓度范围,然后利用Box-Behnken进行3因素3水平试验优化培养基配方,BB试验因素与水平见表2。
表2 Box-Behnken试验设计因素与水平
Table 2 Factors and levels of Box-Behnken experimental design
2 结果与分析
2.1 单因素试验
2.1.1 酵母浸粉添加量对诱变菌株产壳聚糖酶酶活的影响
不同酵母浸粉添加量对诱变菌株产壳聚糖酶酶活的影响结果见图1。由图1可知,诱变菌株壳聚糖酶酶活随着酵母浸粉的添加量在4~16 g/L范围内的不断增加逐渐上升;当酵母浸粉添加量达到16 g/L,诱变菌株壳聚糖酶酶活最高,为9.455 4 U/mL;随着酵母浸粉添加量在16~20 g/L范围内的继续增加,壳聚糖酶酶活不升反降。推测可能是因为酵母浸粉添加量过大,导致过度发酵,致使渗透压变得过大,影响菌株生长。因此,选择酵母浸粉最适添加量为16 g/L。
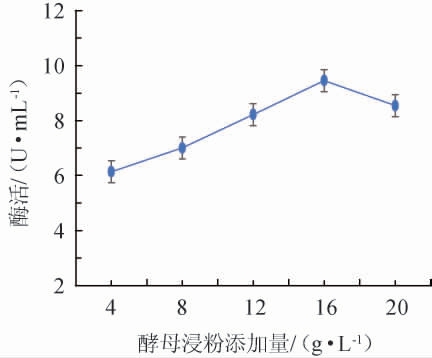
图1 酵母浸粉添加量对诱变菌株酶活的影响
Fig.1 Effect of yeast extract powder addition on the enzyme activity of mutant strains
2.1.2 葡萄糖添加量对诱变菌株产壳聚糖酶酶活的影响
不同葡萄糖添加量对诱变菌株产壳聚糖酶酶活的影响结果见图2。由图2可知,诱变菌株壳聚糖酶酶活随着葡萄糖添加量在7.0~11.5 g/L范围内的不断增加逐渐上升;当葡萄糖添加量达到11.5 g/L,菌株壳聚糖酶酶活最高,为9.374 6 U/mL;随着葡萄糖添加量在11.5~25.0 g/L范围的继续增加,壳聚糖酶酶活不升反降,推测可能是因为葡萄糖添加量过大,导致细胞失水发生质壁分离,从而抑制了菌株的生长。因此,选择葡萄糖最适添加量为11.5 g/L。
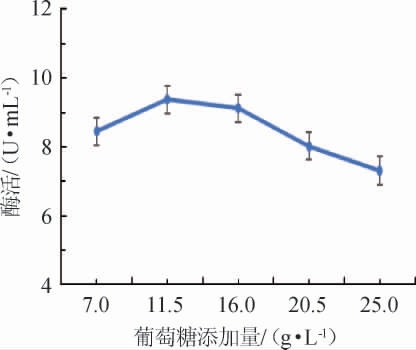
图2 葡萄糖添加量对诱变菌株酶活的影响
Fig.2 Effect of glucose addition on the enzyme activity of mutant strains
2.1.3 NaCl添加量对诱变菌株产壳聚糖酶酶活的影响
不同NaCl添加量对诱变菌株产壳聚糖酶酶活的影响结果见图3。由图3可知,诱变菌株壳聚糖酶酶活随着NaCl添加量在2~5 g/L范围内的不断增加逐渐上升;当NaCl添加量达到5 g/L,菌株壳聚糖酶酶活最高,为9.459 3 U/mL;随着NaCl添加量在5~14 g/L范围内的继续增加,壳聚糖酶酶活不升反降,推测可能是因为NaCl添加量过大,导致渗透压过大,从而抑制了菌株生长。因此,选择NaCl最适添加量为5 g/L。
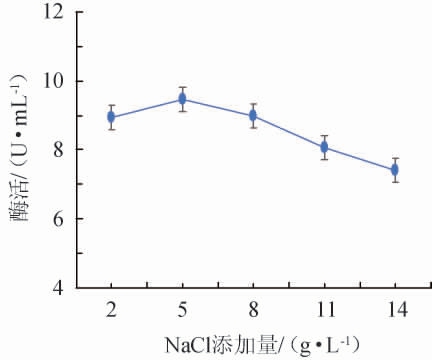
图3 NaCl添加量对诱变菌株酶活的影响
Fig.3 Effect of NaCl addition on the enzyme activity of mutant strains
2.1.4 K2HPO4添加量对诱变菌株产壳聚糖酶酶活的影响
不同K2HPO4添加量对诱变菌株产壳聚糖酶酶活的影响结果见图4。由图4可知,诱变菌株壳聚糖酶酶活随着K2HPO4添加量在0.2~1.4 g/L范围内不断增加逐渐上升;当K2HPO4添加量达到1.4 g/L,菌株壳聚糖酶酶活最高,为9.461 0 U/mL,随着K2HPO4添加量在1.4~2.6 g/L范围内继续增加,壳聚糖酶酶活不升反降,推测可能是因为K2HPO4添加量过大,导致培养基pH过大,从而影响菌株生长。因此,选择K2HPO4最适添加量为1.4 g/L。
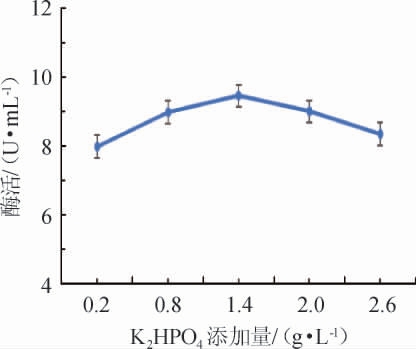
图4 K2HPO4添加量对诱变菌株酶活的影响
Fig.4 Effect of K2HPO4 addition on the enzyme activity of mutant strains
2.1.5 KH2PO4添加量对诱变菌株产壳聚糖酶酶活的影响
不同KH2PO4添加量对诱变菌株产壳聚糖酶酶活的影响结果见图5。由图5可知,诱变菌株壳聚糖酶酶活随着KH2PO4添加量在0.2~0.6 g/L范围内不断增加逐渐上升;当KH2PO4添加量达到0.6 g/L,菌株壳聚糖酶酶活最高,为9.459 8 U/mL;随着KH2PO4添加量在0.6~1.8 g/L范围内继续增加,壳聚糖酶酶活不升反降,推测可能是因为KH2PO4添加量过大,导致培养基pH过低,影响菌株生长。因此,选择KH2PO4最适添加量为0.6 g/L。
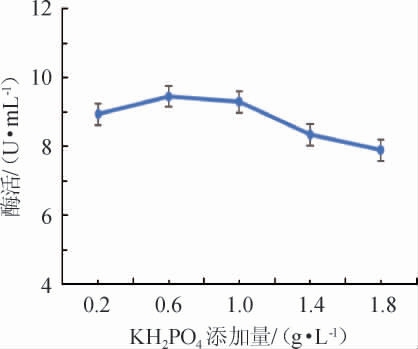
图5 KH2PO4添加量对诱变菌株酶活的影响
Fig.5 Effect of KH2PO4 addition on the enzyme activity of mutant strains
2.1.6 Tween-80添加量对诱变菌株产壳聚糖酶酶活的影响
不同Tween-80添加量对诱变菌株产壳聚糖酶酶活的影响结果见图6。由图6可知,诱变菌株壳聚糖酶酶活随着Tween-80添加量在0.4~1.2 g/L范围内的不断增加逐渐上升;当Tween-80添加量达到1.2 g/L,菌株壳聚糖酶酶活达到最高9.462 1 U/mL;随着Tween-80添加量在1.2~2.8 g/L范围内的继续增加,壳聚糖酶酶活不升反降,少量Tween-80是刺激因子,含量过多会抑制菌株生长。因此,选择Tween-80最适添加量为1.2 g/L。
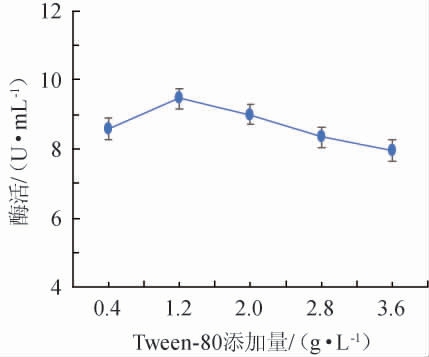
图6 Tween-80添加量对诱变菌株酶活的影响
Fig.6 Effect of Tween-80 addition on enzyme activity of mutant strains
2.1.7 MgSO4·7H2O添加量对诱变菌株产壳聚糖酶酶活的影响
不同MgSO4·7H2O添加量对诱变菌株产壳聚糖酶酶活的影响结果见图7。由图7可知,诱变菌株壳聚糖酶酶活随着MgSO4·7H2O添加量在0.4~1.2 g/L范围内的不断增加逐渐上升;当MgSO4·7H2O添加量达到1.2 g/L,菌株壳聚糖酶酶活达到最高9.460 7 U/mL;随着MgSO4·7H2O添加量在1.2~3.6 g/L范围内的继续增加,壳聚糖酶酶活不升反降,推测可能是因为MgSO4·7H2O添加量过大,导致细胞渗透压增大,可能导致部分菌株死亡。因此,选择MgSO4·7H2O最适添加量为1.2 g/L。
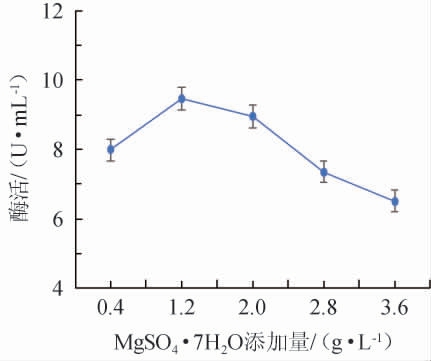
图7 MgSO4·7H2O添加量对诱变菌株酶活的影响
Fig.7 Effect of MgSO4·7H2O addition on the enzyme activity of mutant strains
2.2 响应面试验
2.2.1 PB试验
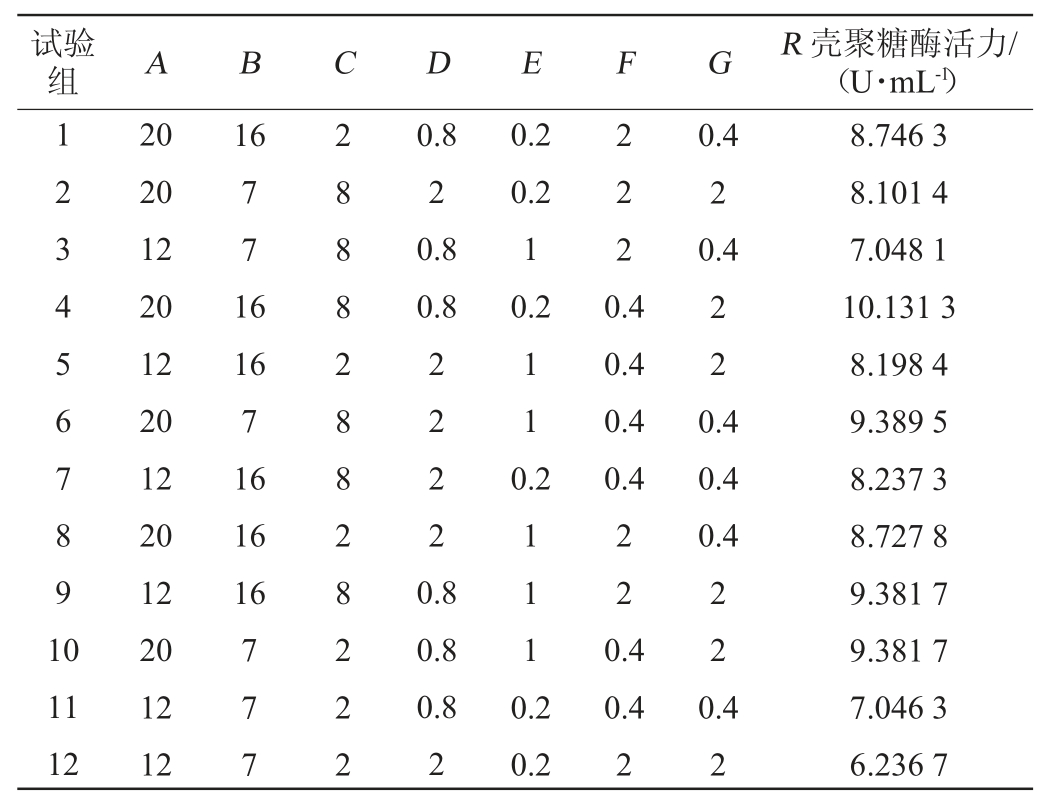
使用Design-Expert10.0.4软件列出了12组PB试验设计方案,每组试验设计进行3个平行试验,将每组试验壳聚糖酶活力的平均值(R)作为响应值,如表3所示,壳聚糖酶活力在6.236 7~10.131 3 U/mL。PB试验的回归分析结果见表4。
表3 PB试验设计与结果
Table 3 Design and results of PB experiments
由表4可知,该模型的P值为0.016 7,模型显著(P<0.05),该模型拟合较好。在这七个变量中,对壳聚糖酶活力影响显著性从大到小为:酵母浸粉(A)>葡萄糖(B)>MgSO4·7H2O(F)>NaCl(C)>KH2PO4(E)>K2HPO4(D)>吐温-80(G)。其中,酵母浸粉(A)对壳聚糖酶的酶活力有极其显著性影响(P<0.01),葡萄糖(B)和MgSO4·7H2O(F)对壳聚糖酶酶活力有显著性影响(P<0.05),其他4个因素对壳聚糖酶酶活没有显著性影响(P>0.05)。所以选择这3个具有显著性影响的因素进行最陡爬坡试验。
表4 PB试验回归分析结果
Table 4 Regression analysis results of PB experiments
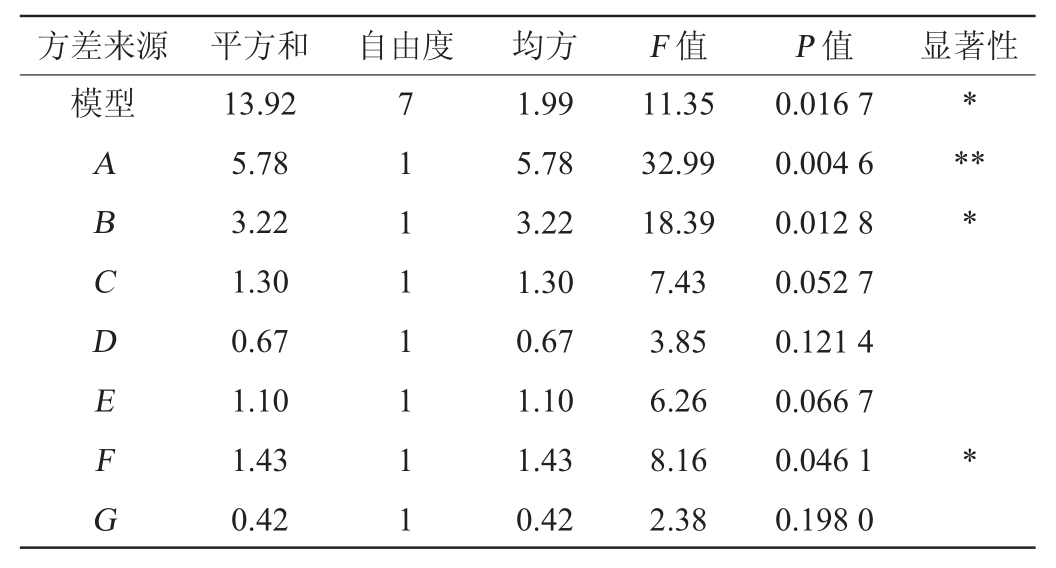
注:“*”表示对结果影响显著(P<0.05);“**”表示对结果影响极显著(P<0.01)。下同。
2.2.2 最陡爬坡试验
根据上述回归分析选择的3个影响显著的因素,通过梯度增加酵母浸粉、葡萄糖和MgSO4·7H2O的添加量,采用最陡爬坡试验的上升试验确定3个因素的最佳水平范围,最陡爬坡试验设计及结果见表5。
表5 最陡爬坡试验设计及结果
Table 5 Design and results of the steepest climbing experiments
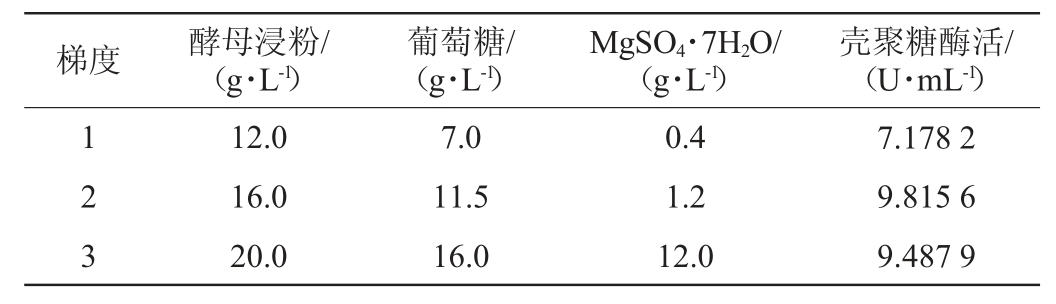
由表5可知,当固定MgSO4·7H2O的添加量为1.2 g/L时,得出酵母浸粉的添加量为16~17 g/L以及葡萄糖的添加量为10~11 g/L。当固定葡萄糖添加量为11.5 g/L时,得出酵母浸粉的添加量为16~17 g/L以及MgSO4·7H2O的添加量为1.2~1.6 g/L。当固定酵母浸粉添加量为16 g/L时,得出葡萄糖的添加量为10~11 g/L以及MgSO4·7H2O的添加量为1.2~1.6 g/L。最终得出酵母浸粉的添加量为16~17 g/L、葡萄糖的添加量为10~11 g/L以及MgSO4·7H2O的添加量为1.2~1.6 g/L。
2.2.3 响应面法优化培养基条件
在上述的最陡爬坡试验的基础上,利用Design-Expert 10.0.4软件,酵母浸粉(X1)、葡萄糖(X2)和MgSO4·7H2O(X3)对壳聚糖酶活力(Y)的影响进行响应面试验,并对结果进行方差分析,BB试验设计与结果见表6,方差分析见表7。
表6 Box-Behnken试验设计与结果
Table 6 Design and results of Box-Behnken experiments
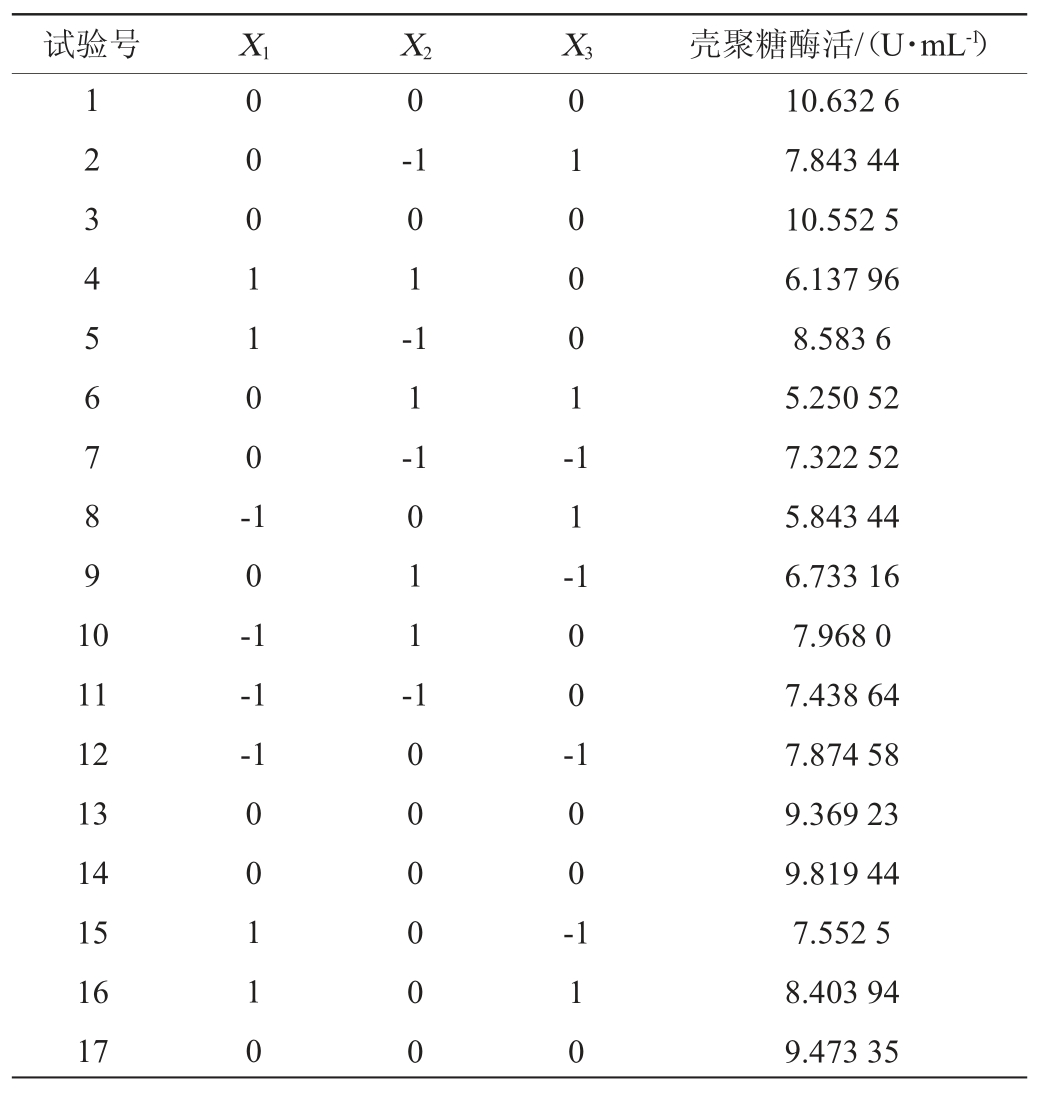
表7 回归方程方差分析
Table 7 Variance analysis of regression equation
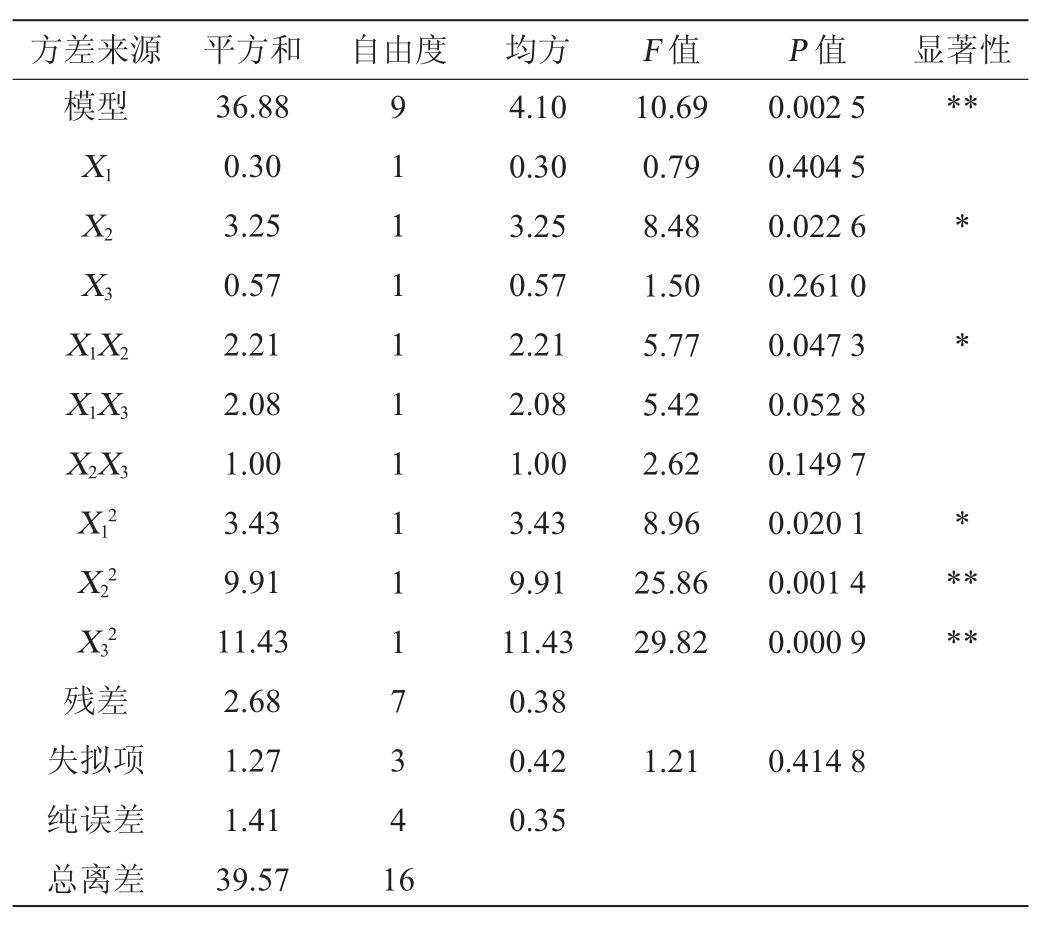
通过Design Expert 10.0.4软件对表6数据进行多元线性回归分析,得到拟合试验因素的回归方程:Y=-22.153 0+2.059 6X1+2.429 1X2+3.841 2X3-0.041 3X1X2+0.225 2X1X3-0.139 1X2X3-0.056 4X12-0.075 8X22-2.574 6X32
由表7可知,该模型的P值为0.002 5,模型极显著(P<0.01),失拟项影响不显著(P=0.414 8>0.05),表明该模型拟合较好。模型的决定系数R2为0.932 2,校正决定系数R2为0.845 0,变异系数(coefficient of variation,CV)为7.690%,表示该模型有7.690%的变异不能由该模型解释,信噪比为9.66 2,说明试验操作和模型均可信。该模型显著性由大到小为:X32>X22>X12>X2>X1X2>X1X3>X2X3>X3>X1。在该模型中,二次项X22和X32对壳聚糖酶活力影响极显著(P<0.01),一次项X2、交互项X1X2和二次项X12对壳聚糖酶活力影响显著(P<0.05),一次项X1、X3、交互项X1X3和X2X3对壳聚糖酶活力影响不显著(P>0.05)。
2.2.4 响应面分析
根据上述的试验结果与分析表示,该模型可以用于解释和预测试验的结果,根据回归分析和回归方程的拟合,利用Design-Expert10.0.4软件得到各因素相互作用的响应面见图8。
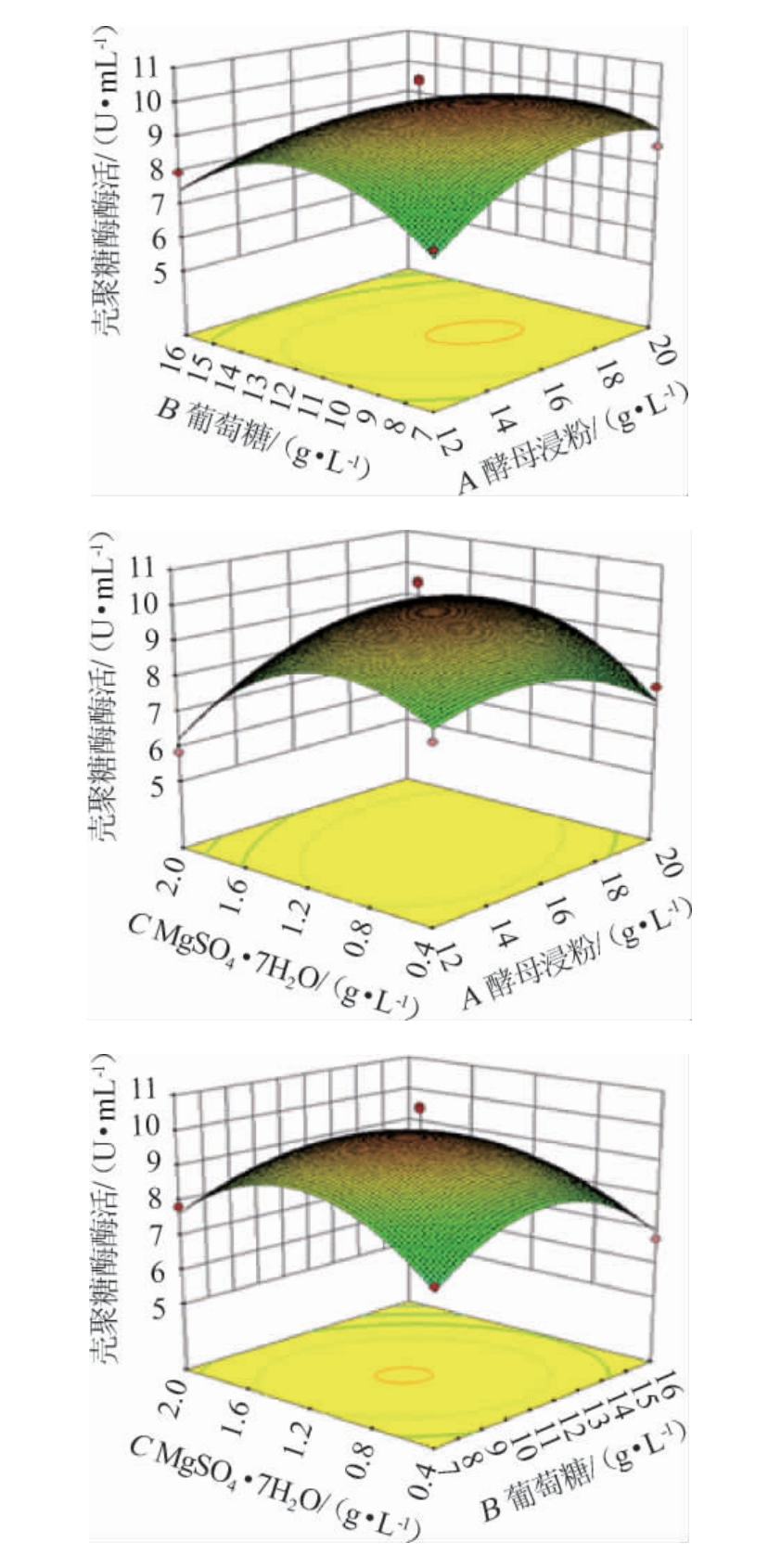
图8 各因素交互作用对壳聚糖酶活性影响的响应面及等高线
Fig.8 Response surface plots and contour lines of effects of interaction between each factor on chitosanase activity
由图8可知,各因素交互作用对壳聚糖酶活影响的响应面曲线呈现抛物线状,说明所拟合的回归模型有极大值点。酵母浸粉添加量与葡萄糖添加量的交互作用对壳聚糖酶活影响显著(P<0.05),而其余两两因素间的交互作用较小,与方差分析结果一致。
通过Design-Expert10.0.4软件所预测得最佳试验条件:酵母浸粉添加量为16.872 g/L,葡萄糖添加量为10.324 g/L和MgSO4·7H2O添加量为1.205 g/L时,在此条件下发酵液壳聚糖酶活性理论值为10.104 U/mL。
为了验证Design-Expert10.0.4软件所预测的最佳试验条件,在所提供的最佳发酵条件下,并考虑到现实操作条件,调整发酵培养基的成分为:酵母浸粉16.9 g/L、葡萄糖10.3 g/L、NaCl 5 g/L、K2HPO4 1.4 g/L、KH2PO4 0.6 g/L、MgSO4·7H2O 1.2 g/L和Tween-80 1.2 g/L。在此条件下进行3次平行试验,壳聚糖酶活性实际值为10.574 U/mL,比未优化酶活提高了11.769%。
3 结论
不同聚合度的壳寡糖具有不同的生物活性,利用壳聚糖酶水解壳聚糖是绿色、安全、高效生产壳寡糖的主要工艺。本研究在单因素试验的基础上,以响应面法优化生产壳聚糖酶诱变菌株的发酵培养基配方。在进行单因素试验后,先用PB试验设计筛选出了三个显著因素。然后进行最陡爬坡试验,得出显著因素的合理浓度范围。最后进行响应面法试验,得到最佳的培养基为:酵母浸粉16.9 g/L、葡萄糖10.3 g/L、NaCl 5 g/L、K2HPO4 1.4 g/L、KH2PO4 0.6 g/L、MgSO4·7H2O 1.2 g/L和Tween-80 1.2 g/L。在此最佳培养基下,壳聚糖酶活性为10.574 U/mL,比未优化培养基酶活提高了11.769%。在食品和制药等行业生产壳聚糖酶具有潜在的应用价值。
[1] JOSEPH S M,KRISHNAMOORTHY S,PARANTHAMAN R,et al.A review on source-specific chemistry,functionality,and applications of chitin and chitosan[J].Carbohydr Polym Technol Appl,2021,2(4):100036.
[2] WANG S L,LIANG T W.Microbial reclamation of squid pens and shrimp shells[J].Res Chem Intermed,2017,43(6):3445-3462.
[3]ELIEH-ALI-KOMI D,HAMBLIN M R.Chitin and chitosan:production and application of versatile biomedical nanomaterials[J].Int J Adv Res,2016,4(3):411-427.
[4] LIANG T W,CHEN W T,LIN Z H,et al.An amphiprotic novel chitosanase from Bacillus mycoides and its application in the production of chitooligomers with their antioxidant and anti-inflammatory evaluation[J].Int J Mol Sci,2016,17(8):1302.
[5]JO S H,HA K S,MOON K S,et al.Molecular weight dependent glucose lowering effect of low molecular weight chitosan oligosaccharide(GO2KA1)on postprandial blood glucose level in SD Rats model[J]. IJMS,2013,14(7):14214-14224.
[6]LEE H W,PARK Y S,CHOI J W,et al.Antidiabetic effects of chitosan oligosaccharides in neonatal streptozotocin-induced noninsulin-dependent diabetes mellitus in rats[J].Biol Pharmaceut Bull,2003,26(8):1100-1103.
[7]TRAN T N,DOAN C T,NGUYEN V B,et al.The isolation of chitinase from Streptomyces thermocarboxydus and its application in the preparation of chitin oligomers[J]. Res Chem Intermed,2019,45(2):DOI:10.1007/s11164-018-3639-y.
[8] DOAN C T,TRAN T N,NGUYEN V B,et al.Reclamation of marine chitinous materials for chitosanase production via microbial conversion by Paenibacillus macerans[J].Marine Drug,2018,16(11):429.
[9]AZUMA K,OSAKI T,MINAMI S,et al.Anticancer and anti-inflammatory properties of chitin and chitosan oligosaccharides[J]. J Funct Biomat,2015,6(1):33-49.
[10]LIANG T W,CHEN Y J,YEN Y H,et al.The antitumor activity of the hydrolysates of chitinous materials hydrolyzed by crude enzyme from Bacillus amyloliquefaciens V656[J].Process Biochem,2006,42(4):527-534.
[11]NO H K,PARK N Y,LEE S H,et al.Antibacterial activity of chitosans and chitosan oligomers with different molecular weights[J].Int J Food Microbiol,2002,74(1):65-72.
[12]SUN T,QIN Y Y,XUH L,et al.Antibacterial activities and preservative effect of chitosan oligosaccharide Maillard reaction products on Penaeus vannamei[J].Int J Biol Macromol,2017,105(Pt 1):764-768.
[13]赵玉巧,徐娜,杜云建.一株产壳聚糖酶菌株的培养条件优化[J].安徽农业科学,2017,45(8):7-9.
[14]THADATHIL N,VELAPPAN S P.Recent developments in chitosanase research and its biotechnological applications:A review[J].Food Chem,2014,150(1):392-399.
[15] MALGORZATA M.J.Kinetics of enzymatic deacetylation of chitosan[J].Cellulose,2012,19(2):363-369.
[16]CARLOS A,JES S M M,FUENSANTA R.Purification and properties of two endochitosanases from Mucor rouxii implicated in its cell wall degradation[J].FEMS Microbiol Lett,1992,95(2-3):187-194.
[17] KATARZYNA S,MIROSLAWA S A,WALCZAK M,et al.Isolation and purification of Mucor circinelloides intracellular chitosanolytic enzymes[J].Carbohydr Polym,2009,78(1):16-24.
[18] CHEN X,CHAO Z,KANG L,et al.High-level expression and characterization of a highly thermostable chitosanase from Aspergillus fumigatus in Pichia pastoris[J].Biotechnol Lett,2012,34(4):689-694.
[19] ZITOUNI M,FORTIN M,SCHEERLE R K,et al.Biochemical and molecular characterization of a thermostable chitosanase produced by the strain Paenibacillus sp.1794 newly isolated from compost[J].Appl Microbiol Biotechnol,2013,97(13):5801-5813.
[20]DOAN C T,THI N T,VAN BN,et al.Production of a thermostable chitosanase from shrimp heads via Paenibacillus mucilaginosus TKU032 conversion and its application in the preparation of bioactive chitosan oligosaccharides[J].Marine Drug,2019,17(4):217-217.
[21] WANG S L,YU H T,TSAI M H,et al.Conversion of squid pens to chitosanases and dye adsorbents via Bacillus cereus[J].Res Chem Intermed,2018,44(8):4903-4911.
[22] WANG C L,SU J W,LIANG T W,et al.Production,purification and characterisation of a chitosanase from Bacillus cereus[J].Res Chem Intermed,2014,40(6):2237-2248.
[23]LIANG T W,CHEN Y Y,PAN P S,et al.Purification of chitinase/chitosanase from Bacillus cereus and discovery of an enzyme inhibitor[J].Int J Biol Macromol,2014,63(63):8-14.
[24]LIANG T W,HSIEH J L,WANG S L.Production and purification of a protease,a chitosanase,and chitin oligosaccharides by Bacillus cereus TKU022 fermentation[J].Carbohyd Res,2012,362(15):38-46.
[25] WANG S L,CHEN T R,LIANG T W,et al.Conversion and degradation of shellfish wastes by Bacillus cereus TKU018 fermentation for the production of chitosanases and bioactive materials[J]. Biochem Eng J,2009,48(1):111-117.
[26]BOUCHER I,DUPUY A,VIDAL P,et al.Purification and characterization of a chitosanase from Streptomyces N174[J].Appl Microbiol Biotechnol,1992,38(2):188-193.
[27]原旭冰,刘洪涛,杜昱光.壳寡糖的制备及其在医学和农业生产中的应用[J].生物技术进展,2018,8(6):461-468,553.
[28]KHAN F,LEE J W,PHAM D T N,KIM YM.Chitooligosaccharides as antibacterial,antibiofilm,antihemolytic and anti-virulence agent against Staphylococcus aureus[J].Curr Pharmaceut Biotechnol,2019,20(14):1223-1233.
[29]杨焕蝶,张翔,亚历山大·苏沃洛夫,等.壳聚糖与壳寡糖抑菌保鲜研究进展[J].山东农业科学,2020,52(2):167-172.
[30]韩玉娟,王华,路新枝.壳聚糖酶的研究进展[J].中国海洋药物,2018,37(2):88-96.
[31]王贤泽,肖定福.壳寡糖保健作用研究进展[J].饲料博览,2018(9):9-11,15.
[32]黄大野,向朝晖,周世位,等.壳寡糖防治茶赤星病研究[J].湖北农业科学,2017,56(24):4791-4792,4798.
[33]厉佳怡,严燕儿.壳聚糖在食品行业中的应用[J].食品安全导刊,2020,290(31):63-65.
[34]詹心瑜,马艺超,高彦祥.壳聚糖在食品领域的应用研究进展[J].中国食品添加剂,2018,178(12):209-215.
[35]宋晓晨,祖国仁,陈莉,等.微生物壳聚糖酶的研究及其降解产物壳寡糖在食品领域的应用[J].河北农业科学,2009,13(7):48-50,128.
[36]张华峰.关于酶活力单位定义[J].科技术语研究,2005,7(1):38-38.
[37]张朝正,李意,赵华.ARTP诱变法提高蜡状芽孢杆菌中壳聚糖酶的产量[J].食品工业科技,2022,43(1):141-146.