甘蔗渣是制糖工业的主要副产物,是一种可再生生物质资源[1]。中国是仅次于巴西和印度的第三大甘蔗种植国。据统计,2018年我国华南地区甘蔗年产量达1.05亿t,而甘蔗渣的产量约为2 940万t,数目十分庞大[2]。甘蔗渣的成分主要以纤维素、半纤维素等多糖以及木质素为主,其中多糖经处理转化为单糖后可被再利用[3]。甘蔗渣等木质纤维素有望替代传统的粮食作物,作为原料用于燃料乙醇的制备,此技术被认为是一种先进的清洁能源技术[4]。近年来,木质纤维素燃料乙醇以其经济、环保、实用等优势,受到世界各国专家学者的广泛关注,其产业化有望成为缓解日益紧缺的化石能源问题的一种有效途径[5-6]。
目前,甘蔗渣等木质纤维素燃料乙醇的生产工艺主要分为三个技术环节,即预处理、酶解和微生物发酵[7]。碱法被普遍认为是有效且具开发潜力的一种木质纤维素预处理方法,如氨处理、石灰预处理、碳酸钠预处理等,其中氢氧化钠预处理备受关注,已在工业生产中得到广泛应用[8]。然而,酶解成本较高仍是当下限制甘蔗渣等木质纤维素燃料乙醇规模化生产的主要因素。据报道,在木质纤维素燃料乙醇的生产中,水解酶成本占总生产成本的50%~60%[9]。国内外研究者已针对此问题进行了广泛探索,但高酶成本仍是木质纤维素燃料乙醇规模化生产的主要障碍[10]。此外,高浓度可发酵糖的获得是实现目标产物发酵或转化的重要前提,也是实现甘蔗渣等木质纤维素燃料产业化发展的重要基础[11-12]。为了实现甘蔗渣等木质纤维素燃料乙醇的规模化生产,有效降低酶的使用成本以及提高可发酵糖产量仍任重道远,而通过优化酶解条件来提高酶的利用效率,获得较高可发酵糖产量以及减少相关高成本酶的用量,被认为是有效的途径之一[13]。
响应面法(response surface methodology,RSM)是一种寻找多因素系统中最佳条件的数学统计方法,被认为是一种全面、简洁、高效的方法,已成功用于高效工艺的开发[14-15]。本研究首先采用单因素试验探究纤维素酶量、酶解时间和酶解转速对氢氧化钠预处理甘蔗渣酶解效果的影响。在单因素试验的基础上,以氢氧化钠预处理甘蔗渣为原料,根据Box-Behnken试验设计,选取纤维素酶量、酶解时间和酶解转速3个因素为影响因子,以甘蔗渣总可发酵糖得率(total fermentable sugar yield,TFSY)作为响应值,采用响应面法探讨和优化氢氧化钠预处理甘蔗渣的酶解工艺条件,以期为木质纤维素碱法预处理与高效酶解糖化技术的构建,提供基础数据和理论参考。
1 材料与方法
1.1 材料与试剂
甘蔗渣:来源于广东中科天元新能源科技有限公司;纤维素酶Cellic CTec 2(酶活为60.4 FPU/mL):美国Sigma-Aldrich公司;四环素:青岛生工生物科技有限公司;制霉菌素:安徽酷尔生物工程有限公司;氢氧化钠(分析纯):南京化学试剂股份有限公司;一水合柠檬酸和二水合柠檬酸三钠(均为分析纯):国药集团化学试剂有限公司。
1.2 仪器与设备
UV-2802紫外可见分光光度计:尤尼柯(上海)仪器有限公司;LS-B50L型立式压力蒸汽灭菌锅:江阴滨江医疗设备有限公司;SPH-100B型空气恒温振荡器:上海世平实验设备有限公司;H1650型台式高速离心机:湖南湘仪实验室仪器开发有限公司;MS2型涡旋混合器:德国IKA公司;LC-15C型高效液相色谱(high performance liquid chromatography,HPLC)仪:日本岛津公司。
1.3 方法
1.3.1 氢氧化钠预处理甘蔗渣的制备
准确称取适量风干的100~200目甘蔗渣(约100 μm),按照料液比1∶10(g∶mL),将其与2%NaOH混匀,于121 ℃条件下处理1 h,冷却至室温,离心去除上清液,固体部分用去离子水洗至pH中性,烘干至恒质量,粉碎,经测定其主要成分含量分别为葡聚糖55.32%、木聚糖26.31%、酸不溶木质素9.83%、酸溶木质素4.01%。
1.3.2 甘蔗渣的酶解
准确称取适量经过氢氧化钠预处理甘蔗渣样品于螺口玻璃瓶中,加入pH 4.8的0.1 mol/L柠檬酸-柠檬酸钠缓冲液(含有四环素和制霉菌素),使底物质量浓度为2g/100mL;再加入适量纤维素酶Cellic CTec 2,进行酶解反应;每隔一定时间取样1 mL,沸水浴10 min进行酶灭活处理,冷却至室温后,12 000 r/min离心5 min收集上清,接着用10%硫酸对其进行酸化处理,再经0.22 μm滤膜过滤,得到甘蔗渣酶解液。
1.3.3 分析检测
参考美国可再生能源实验室(National Renewable Energy Laboratory,NREL)提供的分析方法[16],采用高效液相色谱法进行甘蔗渣酶解液中葡萄糖和木糖含量的测定。
HPLC法分析测定条件:分离柱![]() 87H(300 mm×7.8 mm),柱温箱温度50 ℃;检测器为岛津RID-10A示差折光检测器,检测温度40 ℃;流动相5 mmol/L H2SO4;流速0.6 mL/min;进样量60 μL;运行时间15 min。
87H(300 mm×7.8 mm),柱温箱温度50 ℃;检测器为岛津RID-10A示差折光检测器,检测温度40 ℃;流动相5 mmol/L H2SO4;流速0.6 mL/min;进样量60 μL;运行时间15 min。
1.3.4 计算公式
固体回收率、原始甘蔗渣、总可发酵糖浓度(total fermentable sugarconcentration,TFSC)及总可发酵糖得率(total fermentable sugar yield,TFSY)计算公式如下:

1.3.5 甘蔗渣的酶解工艺条件优化
单因素试验:以总可发酵糖浓度(TFSC)和总可发酵糖得率(TFSY)为评价指标,采用单因素试验对纤维素酶量(18FPU/g、21FPU/g、24FPU/g、27FPU/g、30 FPU/g、33 FPU/g、36 FPU/g)、酶解时间(24 h、36 h、48 h、60 h、72 h、84 h、96 h)、酶解转速(120r/min、140r/min、160r/min、180r/min、200r/min)进行分析。
响应面试验设计:在单因素试验研究基础上,以总可发酵糖得率(TFSY)(Y)作为响应值,以纤维素酶添加量(X1)、酶解时间(X2)和酶解转速(X3)为自变量,设计3因素3水平的Box-Behnken响应面试验。试验因素及水平见表1。
表1 Box-Behnken试验设计因素与水平
Table 1 Factors and levels of Box-Behnken experiments design

为了体现自变量和因变量的关系,采用二次多项式方程进行拟合,预测二次多项式方程形式如下:
式中:Yi为总可发酵糖得率(TFSY),g/g;Xi、Xj为自变量,表示纤维素酶量、酶解时间、酶解转速;β0为截距,βi、βii、βij分别为一次项、二次项及交互项系数。
1.3.6 数据处理与统计分析
试验数据采用SPSS 19.0和OriginPro 9.0进行分析并作图。数据结果采用“平均值±标准差”表示。差异性检验采用独立样品t检验、单因素方差分析(analysis of variance,ANOVA)以及最小显著差检验(least significant difference,LSD)多重比较,其中P<0.05的结果被认为具有统计学意义,所有数据均以“平均值±标准差”表示。
2 结果与分析
2.1 预处理甘蔗渣酶解工艺优化单因素试验
2.1.1 不同纤维素酶添加量对甘蔗渣酶解效果的影响
本研究选用的纤维素酶Cellic CTec 2,除主要具有纤维素酶活外,还具有一定木聚糖酶活性,因此甘蔗渣酶解过程中除产生葡萄糖外还会有部分木糖产生。又因葡萄糖和木糖均可被大多数发酵微生物所利用,故将葡萄糖和木糖的总量分别统称为总可发酵糖浓度和总可发酵糖得率,即TFSC和TFSY。在相同酶解时间和酶解转速的条件下,首先比较了不同纤维素酶量对预处理甘蔗渣酶解效果的影响,结果见图1。由图1可知,随着纤维素酶添加量从18~36 FPU/g的增加,预处理甘蔗渣酶解的TFSC和TFSY均显著增加(P<0.05);当纤维素酶量在33 FPU/g时,TFSC和TFSY均达到最高,分别为17.85 g/L和51.93%;纤维素酶添加量>33 FPU/g之后,TFSC和TFSY虽有所增加,但变化均不显著(P>0.05)。同样的实验现象也出现在前人的研究中[17-18]。纤维素酶在作用于纤维素时,主要分为三步,首先纤维素酶吸附到纤维素的表面,使纤维素水解转化成糖,然后纤维素酶的吸附作用消失。纤维素酶完成这三步之后,其活性减弱,不再具有吸附作用[19]。在一定范围内增加纤维素酶量,能够提高酶解反应速率和产物产量,但是酶的成本显著增加。因此,选择纤维素酶添加量为30 FPU/g、33 FPU/g、36 FPU/g进行响应面试验。
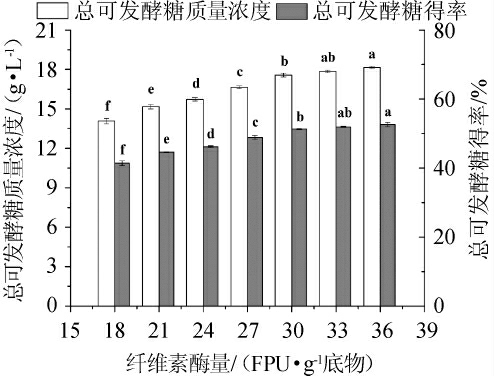
图1 不同纤维素酶添加量对甘蔗渣酶解效果的影响
Fig.1 Effect of different cellulase addition on enzymatic hydrolysis of sugar cane bagasse
不同小写字母表示TFSC之间或者TFSY之间差异显著(P<0.05),相同小写字母表示差异不显著(P>0.05)。下同。
2.1.2 不同酶解时间对甘蔗渣酶解效果的影响
在相同纤维素酶量和酶解转速的条件下,分析比较了不同酶解时间对预处理甘蔗渣酶解效果的影响,结果见图2。由图2可知,随着酶解时间从24 h到84 h,预处理甘蔗渣酶解的TFSC和TFSY均显著增加(P<0.05);当酶解时间为84 h时,TFSC和TFSY均达到最大,分别为18.73 g/L和54.43%;酶解时间>84 h之后,对应TFSC和TFSY变化均不显著(P>0.05),在数值上呈现略微下降的趋势。在酶解过程中,纤维素酶能够在短时间内反应迅速,酶解前期底物浓度增加速率较快,随着反应时间的延长,产物浓度增加则抑制酶促反应速度,导致底物浓度不会再显著增加。因此,选择酶解时间为72 h、84 h、96 h进行响应面试验。
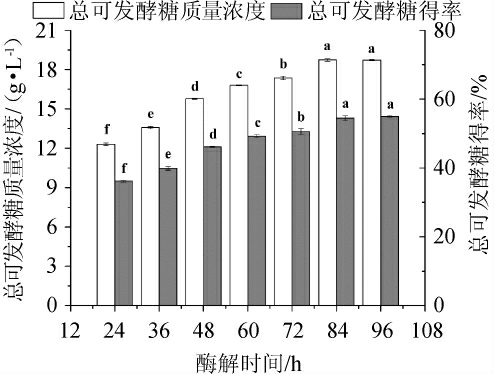
图2 不同酶解时间对甘蔗渣酶解效果的影响
Fig.2 Effect of different enzymatic hydrolysis time on enzymatic hydrolysis of sugar cane bagasse
2.1.3 不同酶解转速对甘蔗渣酶解效果的影响
由图3可知,在相同纤维素酶量和酶解时间的条件下,酶解转速对预处理甘蔗渣酶解效果有较大影响,随着酶解转速从120r/min提升至180r/min,预处理甘蔗渣酶解的TFSC和TFSY均显著增加(P<0.05);当酶解转速达到180 r/min时,TFSC和TFSY均达到最大,分别为18.70 g/L和54.24%;随后继续提高酶解转速,对应TFSC和TFSY均显著降低(P<0.05)。类似的结果也出现在前人的研究中[20]。主要原因可能是适当的转速能保证底物和纤维素酶之间充分的混合,增加有效接触的概率,以及提高反应体系内的热量和质量传递。然而,过高的转速可能降低酶的活性和反应速度。在较高转速下,也会产生底物与底物间剪切力,从而影响酶的活性[21]。因此,选择酶解转速为160 r/min、180 r/min、200 r/min进行响应面试验。
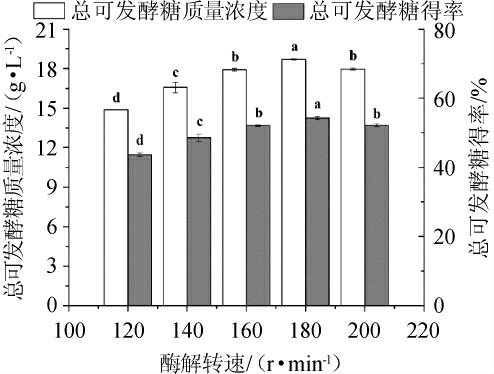
图3 不同酶解转速对甘蔗渣酶解效果的影响
Fig.3 Effect of different enzymatic hydrolysis speed on enzymatic hydrolysis of sugar cane bagasse
2.2 酶解条件优化响应面分析
2.2.1 Box-Behnken试验设计与结果
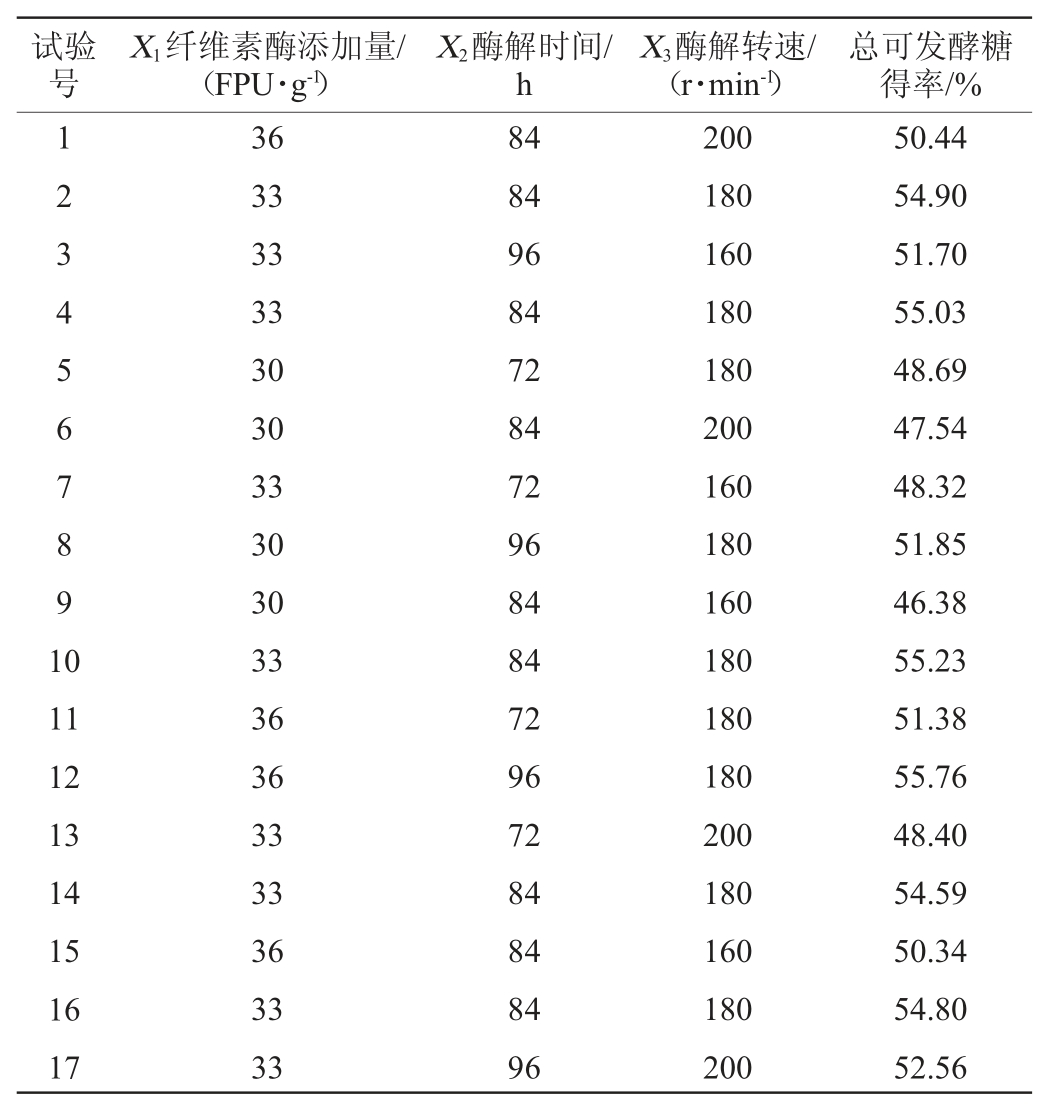
在单因素试验研究的基础上,根据Design-Expert 8.0.6中的Box-Behnken设计原理[22],以总可发酵糖得率(TFSY)(Y)作为响应值,以纤维素酶添加量(X1)、酶解时间(X2)和酶解转速(X3)为自变量,设计了17个试验点的响应面分析试验,其中因素分析试验组12个,误差估计试验组5个。Box-Behnken试验方案和结果见表2。
表2 Box-Behnken试验设计及结果
Table 2 Design and results of Box-Behnken experiments
2.2.2 数学模型的建立
根据Box-Behnken原理设计试验并测得预处理甘蔗渣的TFSY,经Design-Expert 8.0.6统计分析软件处理表2试验数据并进行回归拟合,建立总可发酵糖得率(Y)对纤维素酶添加量(X1)、酶解时间(X2)和酶解转速(X3)的数学模型。模型回归方程如下:
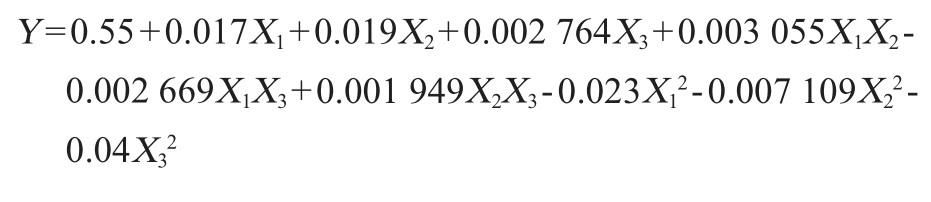
2.2.3 方差分析
该模型决定系数R2为0.998 3,表明模型预测值与实际值相关度较高。校正决定系数R2adj为0.996 2,表明仅有0.38%的总差异不能用该数学模型分析。模型变异系数(coefficient of variation,CV)值为0.36%,小于上限值10%,说明模型的精确度和可信度较高。信噪比为64.63,大于下限值4,说明模型平均预测误差小,拟合度好[23-24]。
经Design-Expert 8.0.6统计分析软件处理表2试验数据并进行方差分析,结果见表3。由表3可知,失拟项的P值为0.940 8>0.05,表明该模型的失拟项不显著,由此说明该模型在被研究的整个回归区域内拟合良好。回归模型的P值<0.000 1,说明回归方程极显著,模型预测值与实际情况拟合度高,可用此模型对氢氧化钠预处理甘蔗渣TFSY的变化情况进行分析和预测。一次项X1、X2、X3、二次项X12、X22、X32对结果影响极显著(P<0.01),交互项X1X2、X1X3对结果影响显著(P<0.05)。根据F值的大小可以判断各因素影响效果的主次,F值越大,则对应因素的影响越主要。从方差分析结果可知,X1(纤维素酶添加量)、X2(酶解时间)和X3(酶解转速)的F值分别为637.72、800.01、17.21,因此3个因素对甘蔗渣TFSY变化影响主次顺序为酶解时间>纤维素酶添加量>酶解转速。
表3 回归模型方差分析
Table 3 Variance analysis of regression model
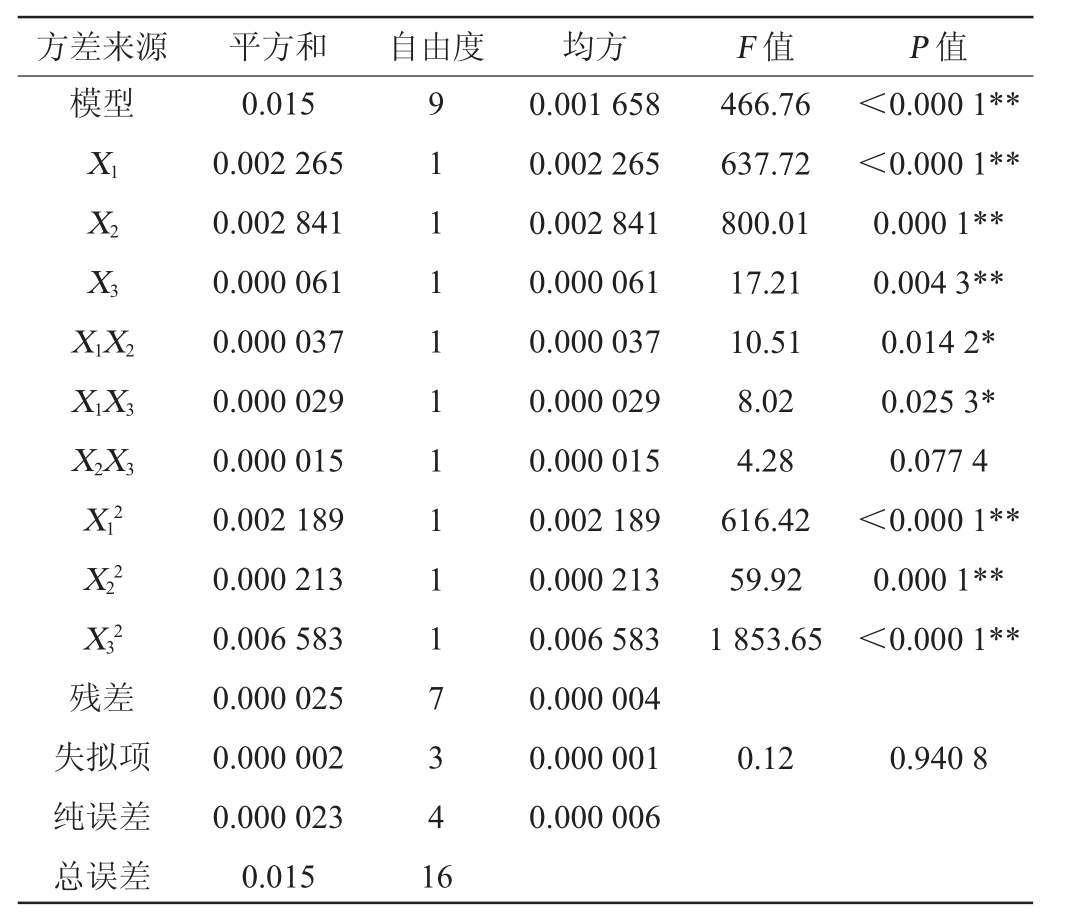
注:“**”表示对结果影响极显著(P<0.01);“*”表示对结果影响显著(P<0.05)。
2.2.4 各因素交互作用对TFSY变化影响的响应面分析
回归模型的三维响应曲面图和等高线图能比较直观地解释各变量和变量之间对响应值的影响。根据上述回归方程,绘制出相应的响应曲面图和等高线,结果见图4。在固定一个变量的情况下,即将三个响应变量中的一个变量固定在其较优值水平,对另外两个变量交互影响TFSY的效应进行分析与评价。由图4可知,各两变量间的交互作用所对应的响应曲面均是向上凸起的形状图,故各曲面会形成一个稳定点,即甘蔗渣的TFSY具有最大值。
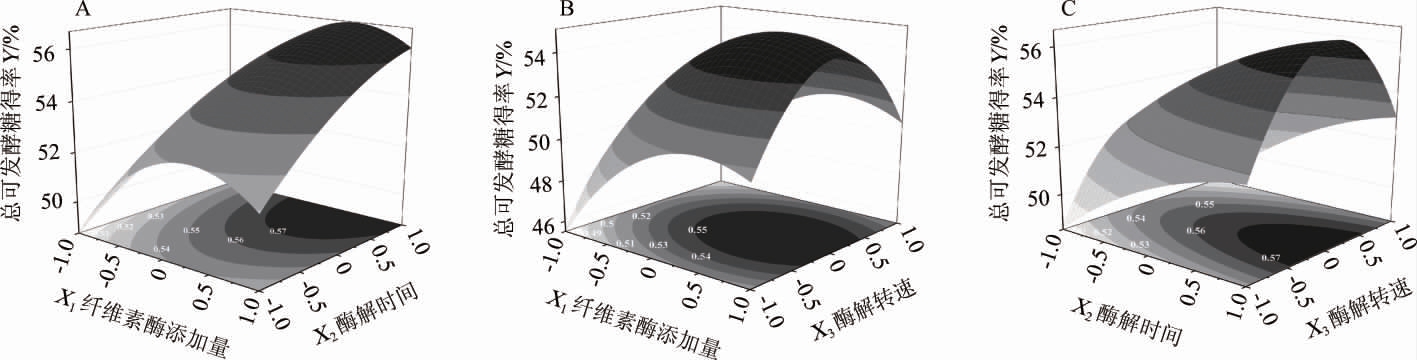
图4 纤维素酶添加量、酶解时间及酶解转速交互作用对预处理甘蔗渣总可发酵糖得率影响的响应曲面及等高线
Fig.4 Response surface plots and counter lines of effects of cellulase addition,enzymatic hydrolysis time and enzymatic hydrolysis speed on total fermentable sugar yield of sugar cane bagasse
由图4A可知,纤维素酶量和酶解时间交互作用对甘蔗渣TFSY影响显著(P<0.05)。随着纤维素酶量的增加和酶解时间的延长,甘蔗渣TFSY均呈现先增加后基本稳定的趋势,当纤维素酶量为31.3 FPU/g底物,酶解时间为96 h时,甘蔗渣TFSY可达最大值。
由图4B可知,纤维素酶量和酶解转速交互作用对甘蔗渣TFSY影响显著(P<0.05)。当纤维素酶量一定时,甘蔗渣TFSY随着酶解转速的增加呈现先增加后降低的趋势,当酶解转速增至180.91 r/min,甘蔗渣TFSY达到最大;当酶解转速一定时,甘蔗渣TFSY随着纤维素酶量的增加呈现先增加后基本稳定的趋势。
由图4C可知,酶解转速和酶解时间交互作用不显著(P>0.05)。当酶解时间一定时,随着酶解转速的增加,甘蔗渣TFSY呈先增加后下降的趋势;当酶解转速一定时,随着酶解时间的延长,甘蔗渣TFSY呈现先增加后趋于稳定。
2.2.5 最佳酶解条件的确定和试验验证
利用Design-Expert 8.0.6软件对上述实验结果进行优化分析,最优酶解工艺条件为:纤维素酶添加量为31.3 FPU/g底物,酶解时间为96 h,酶解转速为180.91 r/min。模型预测条件下,甘蔗渣TFSY预测值为56.52%。为了便于实际操作,修正酶解条件为纤维素酶添加量31 FPU/g 底物,酶解时间为96 h,酶解转速为180 r/min。在此条件下进行3次平行验证试验,得到甘蔗渣TFSY实际值为55.37%,模型预测值与实际验证值相对误差仅为2%,说明该优化模型有较好可靠性,即回归方程能够比较好地反映纤维素酶量、酶解时间及酶解转速变化对预处理甘蔗渣酶解效果的影响[25]。
3 结论
通过单因素和响应面法分析,氢氧化钠预处理甘蔗渣的最佳酶解条件为纤维素酶添加量31 FPU/g 底物,酶解时间96 h,酶解转速180 r/min。总可发酵糖得率为55.37%。本研究建立了氢氧化钠预处理甘蔗渣的酶解工艺条件,初步实现了氢氧化钠预处理甘蔗渣的高效糖化,对研究和开发高效的木质纤维素生物质酶解工艺具有重要指导意义。
[1] KATAKOJWALA R,MOHAN S V.Microcrystalline cellulose production from sugarcane bagasse:Sustainable process development and life cycle assessment[J].J Clean Prod,2020,249:119342.
[2]HUANG Q,YAN Q L,FU J,et al.Comparative study of different alcoholate pretreatments for enhanced enzymatic hydrolysis of sugarcane bagasse[J].Bioresour Technol,2016,211:464-471.
[3] LV X J,XIONG C J,LI S,et al.Vacuum-assisted alkaline pretreatment as an innovative approach for enhancing fermentable sugar yield and decreasing inhibitor production of sugarcane bagasse[J].Bioresour Technol,2017,239:402-411.
[4] PRAJAPATI B P,JANA U K,SURYAWANSHI R K,et al.Sugarcane bagasse saccharification using Aspergillus tubingensis enzymatic cocktail for 2G bio-ethanol production[J].Renewable Energy,2020,152:653-663.
[5] BU J,WANG Y T,DENG M C,et al.Enhanced enzymatic hydrolysis and hydrogen production of sugarcane bagasse pretreated by peroxyformic acid[J].Bioresour Technol,2021,326:124751.
[6]JI Q H,YU X J,YAGOUB A E A,et al.Enhancement of lignin removal and enzymolysis of sugarcane bagasse by ultrasound-assisted ethanol synergized deep eutectic solvent pretreatment[J].Renewable Energy,2021,172:304-316.
[7]FAN Z D,LIN J H,WU J H,et al.Vacuum-assisted black liquor-recycling enhances the sugar yield of sugarcane bagasse and decreases water and alkali consumption[J].Bioresour Technol,2020,309:123349.
[8]ZHU Y T,LIU J,LV W,et al.Revisiting alkaline pretreatment of lignocellulose:understanding the structural evolution of three components[J].Adv Sustain Syst,2020,4(10):2000067.
[9] HAN Y J,CHEN H Z.Improvement of corn stover bioconversion efficiency by using plant glycoside hydrolase[J]. Bioresour Technol,2011,102(7):4787-4792.
[10] NOVY V,NIELSEN F,SEIBOTH B,et al.The influence of feedstock characteristics on enzyme production in Trichoderma reesei:a review on productivity,gene regulation and secretion profiles[J]. Biotechnol Biofuels,2019,12:238.
[11]JUNG Y H,PARK H M,KIM D H,et al.Fed-batch enzymatic saccharification of high solids pretreated lignocellulose for obtaining high titers and high yields of glucose[J].Appl Biochem Biotechnol,2017,182(3):1108-1120.
[12]LIU Y,GUO L J,WANG L Y,et al.Irradiation pretreatment facilitates the achievement of high total sugars concentration from lignocellulose biomass[J].Bioresour Technol,2017,232:270-277.
[13]DYK J S V,PLETSCHKE B I.A review of lignocellulose bioconversion using enzymatic hydrolysis and synergistic cooperation between enzymesfactors affecting enzymes,conversion and synergy[J]. Biotechnol Adv,2012,30(6):1458-1480.
[14]SATHENDRA E R,BASKAR G,PRAVEENKUMAR R,et al.Bioethanol production from palm wood using Trichoderma reesei and Kluveromyces marxianus[J].Bioresour Technol,2019,271:345-352.
[15] SHRIVASTAVA A,TRIPATHI A D,PAUL V,et al.Optimization of spray drying parameters for custard apple (Annona squamosa L.) pulp powder development using response surface methodology (RSM) with improved physicochemical attributes and phytonutrients[J].LWT-Food Sci Technol,2021,151:112091-112101.
[16]SLUITER A,HAMES B,RUIZ R,et al.Determination of structural carbohydrates and lignin in biomass[C]//.Techniocal repeort.Golden Clorado:NREL,2008:42618.
[17]孙占威,陈洪章,王艳辉,等.钢球振荡酶解汽爆麦草的研究[J].北京化工大学学报(自然科学版),2006,33(6):26-30.
[18]王平,刘梦洁,刘超齐,等.响应面法优化预处理秸秆糖化条件的研究[J].饲料工业,2018,39(22):49-54.
[19]CONVERSE A O,MATSUNO R,TANAKA M,et al.A model for enzyme adsorption and hydrolysis of microcrystalline cellulose with slow deactivation of the adsorbed enzyme[J].Biotechnol Bioeng,1988,32(1):38-45.
[20]李文华,温忠文,涂国全.竹质纤维素的酶解糖化条件研究[J].中国酿造,2011,30(6):51-53.
[21]INGESSON H,ZACCHI G,YANG B,et al.The effect of shaking regime on the rate and extent of enzymatic hydrolysis of cellulose[J].J Biotechnol,2001,88(2):177-182.
[22]CHEN C,SHAO Y,TAO Y D,et al.Optimization of dynamic microwaveassisted extraction of Armillaria polysaccharides using RSM,and their biological activity[J].LWT-Food Sci Technol,2015,64(2):1263-1269.
[23]LV X J,LIN J H,LUO L,et al.Enhanced enzymatic saccharification of sugarcane bagasse pretreated by sodium methoxide with glycerol[J].Bioresour Technol,2018,249:226-233.
[24]李建,刘庆玉,郎咸明,等.响应面法优化沼液预处理玉米秸秆条件的研究[J].可再生能源,2016,34(2):292-297.
[25]WANG C Q,WANG H,GU G H.Ultrasound-assisted xanthation of cellulose from lignocellulosic biomass optimized by response surface methodology for Pb(II)sorption[J].Carbohydr Polym,2018,182:21-28.