酱香大曲是以小麦、水和母曲作为生产原料,经过高温发酵和贮存而成,用于生产大曲酱香型白酒的糖化发酵剂[1]。其生产工艺有“制曲黑白黄”一说,即成品曲按照色泽不同分为黄曲、黑曲和白曲,其外观上具有黄曲皮厚,黑曲、白曲皮薄的特点[2]。黄曲酱香浓郁,糖化力较低;黑曲发酵品温高常带有糊味;白曲酱香弱,但其糖化率高[3]。在酱香大曲生产中,黄曲率常作为成品曲块质量分析重要指标之一。通过控制制曲工艺提高黄曲率的研究较普遍,而黄曲与黑、白曲间微生物差异并不明晰,不利于应用微生物技术对酒曲进行改良。
大曲微生物组成结构及代谢决定了大曲的品质,酱香大曲中微生物有细菌、酵母、霉菌以及放线菌。胡宝东等[3]利用传统分离培养方法对黑、白、黄酱香大曲中微生物计数,细菌总数较高,达到107数量级[3]。细菌在酱香大曲发酵初期提供酿造所需的酸性环境,产生蛋白酶、脂肪酶、糖化酶、纤维素酶等丰富多样的酶系,且具有酯化、促美拉德反应和产生吡嗪类物质等能力,从而促进酒中多种风味物质的形成[4-8]。高通量测序技术具备全面的表现样品微生物丰度等优势,近年来普遍被应用于酿酒领域中不同香型大曲、酒醅、酒糟的微生物群落结构分析,基于该技术分析酱香大曲中黑、白、黄曲微生物群落结构的报道较少[9-12]。本研究应用高通量测序分析不同感官特性酱香大曲中细菌群落结构,结合3种大曲理化指标,分析其微生物群落结构与理化、发酵特性的关联性。同时,掌握更多酱香型白酒酿造过程中的细菌资源,为探索利用曲源微生物提升大曲的酱香和糖化力等性能奠定研究基础。
1 材料与方法
1.1 材料与试剂
黄曲(YQ)、黑曲(BQ)、白曲(WQ):贵州省仁怀市某酒厂出仓曲。样品采集时间为2020年11月,取样后分别装入密封袋,运回实验室保藏,备用。
氢氧化钠(分析纯):天津大茂化学试剂厂;乙酸(分析纯):川东化工集团;乙酸钠(分析纯):上海阿拉丁生化科技股份有限公司;脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:美国Zymo Research公司;KOD DNA聚合酶(KOD-401B)(1 U/μL):东洋纺(上海)生物科技有限公司;脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)混合液:东洋纺(上海)生物科技有限公司。
1.2 仪器与设备
FA1204N电子天平:上海菁海仪器有限公司;DHG-9140A电热恒温鼓风干燥箱、HH-8J数显恒温水浴锅:常州润滑电器有限公司;DK-98-Ⅱ电炉:天津市泰斯特仪器有限公司;YXQ-LS-100SII立式压力蒸汽灭菌锅:上海博讯医疗股份有限公司;BCD-640WAGM冷藏柜:青岛海尔股份有限公司。
1.3 方法
1.3.1 不同感官特性酱香大曲理化特性分析
按照轻工行业标准QB/T 4257—2011《酿酒大曲通用分析方法》[13]对三种不同感官特性酱香大曲(黄曲、黑曲和白曲)的水分含量、酸度和液化力进行测定。
1.3.2 酱香型大曲中DNA提取、PCR扩增和测序
将酱香大曲样品送至成都罗宁生物科技有限公司,使用BIOMICS DNA提取试剂盒提取黄曲、黑曲和白曲样品中的DNA。在细菌16S rRNA V4区域进行扩增,扩增引物F(5'-GTGYCAGCMGCCGCGGTAA-3')和R(5'-GGACTACHVGGGTWTCTAAT-3')。聚合酶链式反应(polymerase chain reaction,PCR)扩增用酶为KOD PLUS Neo(KOD-401B),PCR扩增体系(50 μL):5 μL 10×PCR Buffer for KODPlus-Neo,5 μL 2 mmol/L dNTP,5 μL 25 mmol/L MgSO4,1.5 μL上游引物U515F,1.5 μL下游引物U806R,5 μL DNA模板,31 μL超纯水,1 μL KOD-Plus-Neo。PCR扩增条件为:94 ℃预变性1 min;94 ℃变性2 s;54 ℃退火30 s;72 ℃延伸30 s,25~30个循环,72 ℃延伸5 min;4 ℃保温。扩增产物纯化后用2%的琼脂糖凝胶,每个样本进行3次重复,取线性期PCR产物等量混合后建库。进一步在Illumina HiSeq 2500测序平台开展高通量测序。
1.3.3 高通量测序数据处理与分析
高通量测序所得序列通过拼接双端序列、过滤去除低质量序列、使用Uchime算法和Gold数据库去除嵌合体,进而得到有效序列(Effiective Tag)。基于Usearch软件,使用UPARSE算法在97%的一致性水平上进行操作分类单元(operational taxonomic unit,OTU)聚类。并基于UCLUST分类法与Silva分类学数据库进行16S rRNA基因序列比对和注释分析。使用QIIME(V 1.9.0)软件对样品Alpha多样性指数(Alpha diversity)进行分析,用于衡量Alpha多样性指标主要有Chao1、ACE、Shannon和Simpson指数。其中Chao1和ACE指数用于衡量样本中物种的丰度,两者数值与样本物种总数成正比[14]:Chao1主要依据有单条或双条序列OTU数目来判断物种丰度;ACE指数依据有单条序列OTU数目与出现频次低于10次的物种来衡量样本中物种总数。Shannon和Simpson指数用于综合衡量样本物种多样性[14]:Shannon指数表示样本中各物种和物种间在样本中分布的均匀性,Shannon数值与物种均匀性成正比;Simpson指数衡量样本中物种多样性,Simpson指数与样本多样性成正比。
2 结果与分析
2.1 黄曲、黑曲和白曲的感官特性
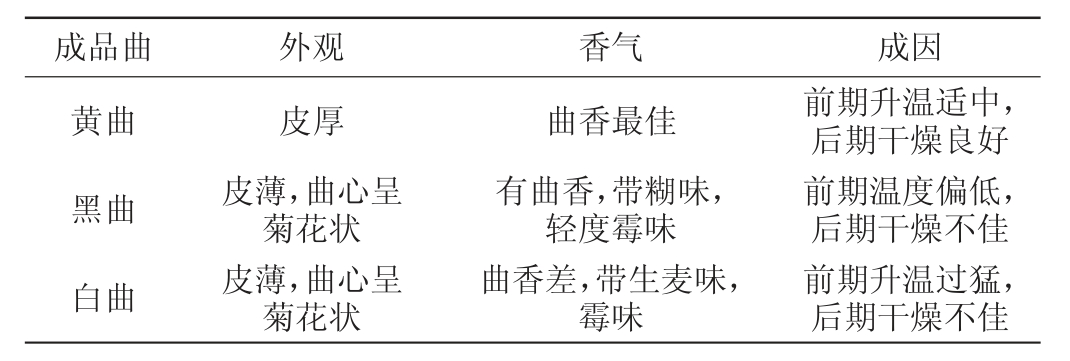
不同感官特性酱香大曲的感官特性差异见表1。由表1可知,黄曲呈金黄色或棕黄色,曲香浓郁;黑曲呈黑色或棕褐色,带有糊味;白曲呈麦粉色,有生麦味。制曲过程中,小麦磨碎度、拌料水分适中,入仓堆积处于发酵仓中层,溶氧较好易形成黄曲。若入仓堆积的曲坯处于发酵仓中下层,溶氧少,湿气重,水分大,曲坯发酵过程中热曲时间长则易形成黑曲。当入仓堆积时,曲坯处于发酵仓上层,门窗密封性不好,水分挥发快,热曲时间短则易形成白曲。
表1 不同感官特性的酱香大曲
Table 1 Sauce-flavor Daqu with different sensory characteristics
2.2 不同感官特性酱香大曲理化特性分析
酱香大曲的理化指标是衡量大曲成熟与否的重要标志,在一定程度上反映大曲品质。3种不同感官特性酱香大曲的理化指标结果见表2。
表2 不同感官特性酱香大曲的理化指标
Table 2 Physicochemical indexes of sauce-flavor Daqu with different sensory characteristics
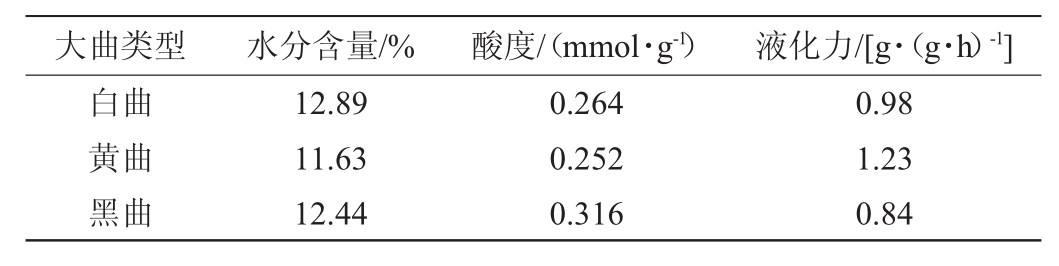
水分含量过高会导致大曲生霉,从而导致大曲的质量降低。由表2可知,所测不同感官特性酱香大曲样品中水分含量由高到低依次为白曲>黑曲>黄曲,水分含量分别为白曲12.89%、黑曲12.44%、黄曲11.63%,均低于13%,符合地方标准DB52/T 871—2014《酱香型白酒酿酒用大曲》要求[15]。
酸度是酱香大曲的关键性指标之一,是微生物综合作用的结果,酸度适当可一定程度上抑制杂菌,还可为有益微生物提供适宜的生长繁殖环境。不同感官特性大曲样品的酸度由高到低依次为黑曲>白曲>黄曲,分别为黑曲0.31 mmol/g、白曲0.262 mmol/g、黄曲0.252 mmol/g。酱香大曲酸度范围应在0.10~0.35 mmol/g,3种酱香大曲样品均符合地方标准DB52/T 871—2014《酱香型白酒酿酒用大曲》要求[15]。
液化力是衡量大曲发酵性能高低的重要指标,液化力高将为产酒、产香奠定物质基础。不同感官特性大曲样品液化力由高到低依次为黄曲>白曲>黑曲,分别为黄曲1.23 g/(g·h)、白曲0.98 g/(g·h)、黑曲0.84 g/(g·h)。
2.2 不同感官特性酱香型大曲细菌多样性分析
酱香型大曲样品提取基因组DNA后,对V4区进行测序,进行双端拼接获得到优质序列,优质序列再经过滤嵌合体后共获得308 645条有效序列,平均长度为297 bp。
韦恩图直观展现了不同感官特性酱香大曲样品中的共有OTU和特有OTU[12]。不同感官特性酱香大曲细菌韦恩图见图1。由图1可知,三种样品共同的OTU有521个,黄曲样品特有的OTU为370个,白曲样品特有OTU为146个,黑曲样品特有OTU为970个。结果表明黄曲YQ、黑曲BQ和白曲WQ样品中的OTU组成既有相似性又有特异性。
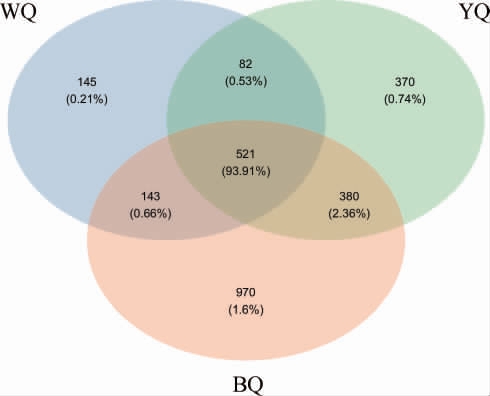
图1 不同感官特性酱香大曲细菌韦恩图
Fig.1 Venn diagram of bacteria of sauce-flavor Daqu with different sensory characteristics
WQ:白曲样品;YQ:黄曲样品;BQ:黑曲样品。下同。
OTU数稀释曲线是以样本中随机抽取一定数量序列数与序列所代表的物种数绘制的曲线。该曲线反映了样本物种丰富度随测序深度的变化趋势,以及持续抽样下新物种出现的速率。不同感官特性酱香大曲OTU数稀释曲线见图2。由图2可知,YQ、WQ和BQ样品的稀释曲线前期急剧上升,随着抽取序列的增加后趋于平缓。表明在抽取序列前期随着抽取序列数增加,有大量细菌物种被检出;当抽取检测大于20 000个序列后,细菌物种不再随测序数量的增加而显著增多,曲线趋于平缓,表明样本测序量充分,测序结果能真实反映不同感官特性酱香大曲的细菌多样性。
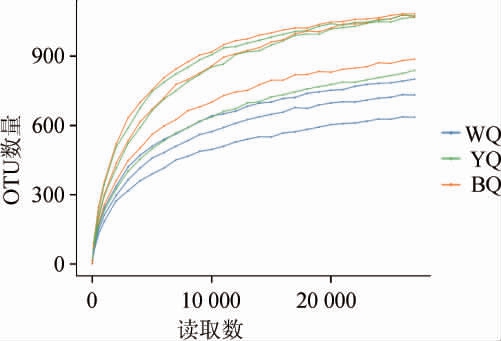
图2 不同感官特性酱香大曲细菌OTU数稀释曲线
Fig.2 OTU numbers rarefaction curves of bacteria of sauce-flavor Daqu with different sensory characteristics
Coverage数值表示样本序列覆盖率:Coverage数值数值与样本中物种被测出的概率成正比,各样本Coverage数值均大于0.99,认为测序结果能够真实的反映样品物种丰度及物种多样性[16]。在97%相似度水平下,大曲样品Alpha多样性指数值统计见表3。由表3可知,三种大曲样品中黑曲BQ样品的Chao1、Shannon和Ace指数均最高,说明黑曲BQ中物种分布较为均匀且检测出物种总数最高;Simpson指数与黄曲YQ接近,说明两者细菌的多样性差异较小。细菌群落多样性由高至低依次为:黑曲BQ>黄曲YQ>白曲WQ,细菌总数由高至低依次为:黑曲BQ>黄曲YQ>白曲WQ。
表3 不同感官特性酱香大曲细菌Alpha多样性指数
Table 3 Bacteria Alpha diversity indexes of sauce-flavor Daqu with different sensory characteristics
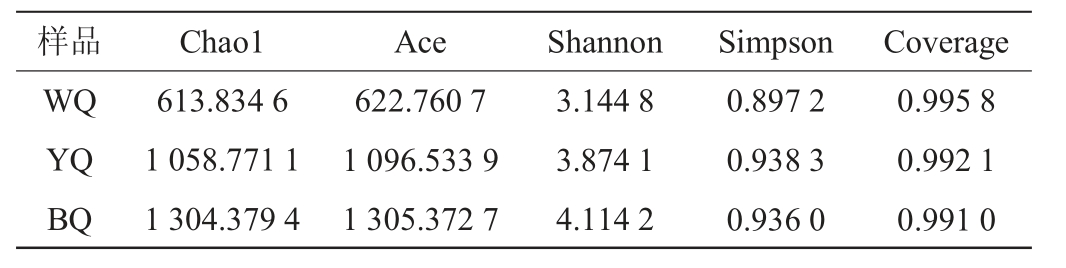
2.3 不同感官特性酱香大曲细菌群落结构分析
黄、黑、白曲属水平上的细菌群落结构分析结果见图3。由图3可知,酱香大曲样品中相对丰度前十的物种有岩石芽孢杆菌属(Scopulibacillus)、糖多孢菌属(Saccharopolyspora)、Desmospora、Kroppenstedtia、乳酸杆菌属(Lactobacillus)、海芽孢杆菌属(Pontibacillus)、罗尔斯顿菌属(Ralstonia)、枝芽孢杆菌属(Virgibacillus)、大洋芽孢杆菌属(Oceanobacillus)、芽孢杆菌属(Bacillus)。
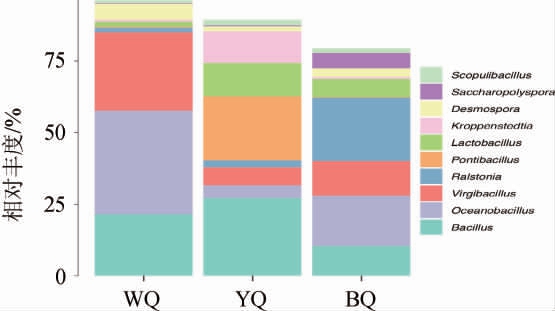
图3 基于属水平不同感官特性酱香大曲细菌群落结构
Fig.3 Bacterial community structure of sauce-flavor Daqu with different sensory characteristics based on genus level
白曲WQ中相对丰度>1%的包括大洋芽孢杆菌属(Oceanobacillus)(36.16%)、枝芽孢杆菌属(Virgibacillus)(27.67%)、芽孢杆菌属(Bacillus)(21.47%)、Desmospora(5.45%)、乳酸杆菌属(Lactobacillus)(1.64%)、罗尔斯顿菌属(Ralstonia)(1.56%)。
黄曲YQ中相对丰度>1%有芽孢杆菌属(Bacillus)(19.48%)、海芽孢杆菌属(Pontibacillus)(14.40%)、乳酸杆菌属(Lactobacillus)(14.02%)、罗尔斯顿菌属(Ralstonia)(11.43%)、Kroppenstedtia(8.90%)、枝芽孢杆菌属(Virgibacillus)(7.40%)、大洋芽孢杆菌属(Oceanobacillus)(4.32%)、Desmospora(3.12%)、岩石芽孢杆菌属(Scopulibacillus)(1.56%)、醋菌属(Acetobacter)(1.15%)、糖多孢菌属(Saccharopolyspora)(1.11%)。
黑曲BQ中相对丰度>1%有罗尔斯顿菌属(Ralstonia)(22.21%)、枝芽孢杆菌属(Virgibacillus)(11.91%)、芽孢杆菌属(Bacillus)(10.47%)、乳酸杆菌属(Lactobacillus)(6.39%)、糖多孢菌属(Saccharopolyspora)(5.39%)、Desmospora(3.03%)、海芽孢杆菌属(Pontibacillus)(2.34%)、岩石芽孢杆菌属(Scopulibacillus)(1.68%)、根瘤杆菌属(Rhizobacter)(1.37%)。
主成分分析(principal component analysis,PCA)通过将测序多维数据进行降维,直观反映所获得主成分得分及变量得分,从而实现样品细菌多样性相似性可视化[9]。不同感官特性酱香大曲组间PCA分析结果见图4。
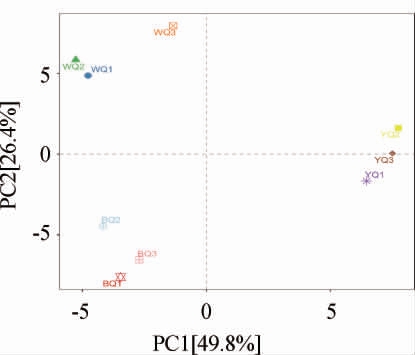
图4 不同感官特性酱香大曲样品细菌属水平群落主成分分析结果
Fig.4 Principal component analysis results of the bacterial genus level community of sauce-flavor Daqu samples with different sensory characteristics
由图4可知,两个主要成分PC1、PC2分别占49.8%,26.4%,共能解释76.2%的物种差异。黄曲YQ与白曲WQ、黑曲BQ样品在横纵坐标上均有明显距离,说明黄曲YQ与白曲WQ、黑曲BQ样品间细菌群落结构在属水平上有较大差异;白曲WQ与黑曲BQ样品在第一主成分上距离较小,说明白曲WQ与黑曲BQ样品间细菌群落结构较为相似。
线性判别分析效应量(linear discriminant analysis effect size,LEfse)可以进行组间类群的差异检验,找到在组间差异显著的物种,也就是对组间差异贡献大的类群。LEfSe的统计结果的显著差异物种线性判别分析(linear discriminant analysis,LDA)值分布柱状图,用以展示每个组内显著富集的物种及其重要性程度。不同感官特性酱香大曲样品细菌显著差异物种线性判别分析见图5。
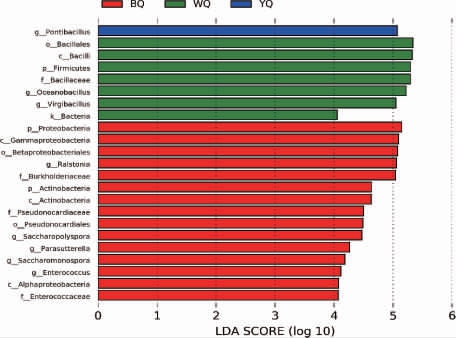
图5 不同感官特性酱香大曲样品细菌显著差异物种线性判别分析
Fig.5 Linear discriminant analysis of bacteria significantly different species of sauce-flavor Daqu samples with different sensory characteristics
由图5可知,从不同感官特性酱香大曲中检出28个细菌类群,其中属于高相对丰度菌属的有:黄曲YQ中的海芽孢杆菌属(Pontibacillus),黑曲BQ中的罗尔斯顿菌属(Ralstonia)、糖多孢菌属(Saccharopolyspora),白曲WQ中的大洋芽孢杆菌属(Oceanobacillus)、枝芽孢杆菌属(Virgibacillus)。造成不同感官特性酱香大曲细菌群落结构差异的主要是海芽孢杆菌属(Pontibacillus)、罗尔斯顿菌属(Ralstonia)、糖多孢菌属(Saccharopolyspora)、大洋芽胞杆菌属(Oceanobacillus)、枝芽孢杆菌属(Virgibacillus)和一些相对丰度较低的菌属。
3 讨论
高通量测序结果显示大曲样品在Silva分类学数据库比对,鉴别出不同感官特性酱香大曲中主导细菌属分别是:白曲WQ中为海洋芽孢杆菌属(Oceanobacillus)、枝芽孢杆菌属(Virgibacillus)和芽孢杆菌属(Bacillus);黄曲YQ中为芽孢杆菌属(Bacillus)、海芽胞杆菌属(Pontibacillus)和乳酸杆菌属(Lactobacillus);黑曲BQ中为罗尔斯顿菌属(Ralstonia)、枝芽孢杆菌属(Virgibacillus)和芽孢杆菌属(Bacillus)。黄曲YQ主导细菌属与白曲WQ、黑曲BQ在种类和丰度有明显差异,白曲WQ和黑曲BQ主导细菌属均包括枝芽孢杆菌属(Virgibacillus)和芽孢杆菌属(Bacillus)。结合主成分分析结果,黄曲YQ与白曲WQ、黑曲BQ中细菌多样性有较大差异性,而白曲WQ和黑曲BQ的细菌菌属多样性较为相似。芽孢杆菌属(Bacillus)是大曲中常见的功能菌,可产生中性、酸性蛋白酶将原料中蛋白质降解为氨基酸和肽类,既为微生物生长提供营养物质,也为美拉德反应提供原料[8]。芽孢杆菌属(Bacillus)被证实具有产吡嗪类风味物质能力,特别是甲基类吡嗪化合物,被认为是酱香型白酒中的关键风味物质之一[19-21]。黄曲YQ中主导细菌属为芽孢杆菌属(Bacillus),其可能与黄曲YQ液化力较高,酱香浓郁相关。有很多研究将大曲中的芽孢杆菌应用于制备酱香强化曲[22-24]。此外,芽孢杆菌属(Bacillus)可产生有机酸、纤维素酶等,适量的有机酸可使酒曲pH达到微酸性为酵母和霉菌创造生存环境,纤维素酶可提高出酒率、增加酯含量[25-27]。
为探究三种不同感官特性酱香大曲中细菌群落结构差异,应用LEfse分析进行组间类群的差异检验,找到组间差异显著的物种。分析结果显示,造成细菌群落结构差异的主要是Pontibacillus、罗尔斯顿菌属(Ralstonia)、糖多孢菌属(Saccharopolyspora)、海洋芽胞杆菌属(Oceanobacillus)、枝芽孢杆菌属(Virgibacillus)和一些丰度较低的菌属。黄曲YQ中造成细菌群落结构差异的菌属是Pontibacillus,该菌属曾被证明具有产生α-淀粉酶能力[28],α-淀粉酶可将淀粉降解为糊精,使淀粉液化,故推测其与黄曲有较好液化力有一定程度相关性。
4 结论
酱香出仓大曲表现为不同感特性,该研究通过理化分析表明,不同感官特性酱香大曲样品中水分含量、酸度均符合酱香成品的相关标准。黄曲YQ酱香浓郁且液化力较高,达到1.23 g/(g·h)。酱香浓郁可能与黄曲YQ中芽孢杆菌属(Bacillus)为主导细菌属相关,而导致黄曲与黑曲、白曲间的液化力差别可能与其差异贡献较大海芽孢杆菌属(Pontibacillus)相关。
基于高通量测序技术结合理化指标分析,初步探究了不同感官特性酱香大曲理化特性差异与细菌多样性与群落结构差异间的关联性。进一步将完善不同感官特性酱香大曲中微生物组学与理化特性相关性研究,获取酱香大曲中功能微生物,为提高酱香大曲发酵性能奠定理论与物质基础。
[1]沈方怡.白酒生产技术全书[M].北京:中国轻工业出版社,2007:365.
[2]贵州省质量技术监督局.DB52/T1298—2018 酱香大曲生产技术规范[S].北京:中国标准出版社,2018.
[3]胡宝东,王晓丹,王婧,等.酱香型大曲生产工艺与大曲品质的关系研究[J].食品工业,2016,37(2):260-264.
[4]LIU X,GUO K L,ZHANG H X.Determination of microbial diversity in Daqu,a fermentation starter culture of Maotai liquor,using nested PCRdenaturing gradient gel electrophoresis[J].World J Microbiol Biotechnol,2012,28(6):2375-2381.
[5]任爱容,黄永光.茅台镇不同主酿区域酱香型白酒酿造大曲中细菌菌群结构分析[J].食品科学,2021,42(4):167-174.
[6]王小平,黄永光,周文美.酱香型白酒大曲细菌菌群结构及功能研究进展[J].中国酿造,2020,39(2):19-25.
[7]CAI H Y,ZHANG T,ZHANG Q,et al.Microbial diversity and chemical analysis of the starters used in traditional Chinese sweet rice wine[J].Food Microbiol,2018,73:319-326.
[8]肖蓓.酱香大曲中细菌类群关系研究与功能细菌筛选[D].贵阳:贵州大学,2015.
[9]吴成,王春晓,王晓丹,等.高通量测序技术在酿酒微生物多样性研究中的应用[J].食品科学,2019,40(3):348-355.
[10] WANG J,ZHONG Q P,YANG Y Y,et al.comparison of bacterial diversity between two traditional starters and the round-Koji-maker starter for traditional Cantonese chi-flavor liquor brewing[J]. Front Microbiol,2018,9:1053.
[11]GOU M,WANG H Z,YUAN H W,et al.Characterization of the microbial community in three types of fermentation starters used for Chinese liquor production[J].J I Brewing,2015,121(4):620-627.
[12]LI H F,LI Z J,QU J H,et al.Bacterial diversity in traditional Jiaozi and sourdough revealed by high-throughput sequencing of 16S rRNA amplicons[J].LWT-Food Sci Technol,2017,81:319-325.
[13]中华人民共和国工业和信息化部,中国轻工业联合会.QB/T 4257—2011 酿酒大曲通用分析方法[S].北京:中国标准出版社,2011.
[14]杨旭,马歌丽,王光路,等.高通量测序解析白酒中高温大曲细菌和真菌群落结构[J].中国酿造,2020,39(6):119-123.
[15]贵州省质量技术监督局.DB52/T 871—2014 酱香型白酒酿酒用大曲[S].北京:中国标准出版社,2014.
[16] ZHANG X,ZHAO J,DU X.Barcoded pyrosequencing analysis of the bacterial community of Daqu for light-flavour Chinese liquor[J]. Lett Appl Microbiol,2014,58(6):549-550.
[17]张芸曌.中高温大曲主发酵期微生物群落与环境因子及理化性质的关联性研究[D].自贡:四川轻化工大学,2019.
[18]凌梦荧.绍兴黄酒麦曲的关键指标筛选及品质评价方法研究[D].无锡:江南大学,2019.
[19]王小平.酱香风味菌株筛选及其发酵代谢香气特性研究[D].贵阳:贵州大学,2020.
[20]钟桂芳,张帆,郭辉祥,等.高温大曲中产四甲基吡嗪细菌的筛选及鉴定[J].中国酿造,2020,39(8):107-111.
[21]孙魁,张娟,滕瑞男,等.白酒中焦香成分研究进展[J].中国酿造,2021,40(5):32-36.
[22]霍颖玙,赵娟,李宪德,等.杨湖强化酱香麦曲的制备工艺研究[J].酿酒科技,2019(2):44-48.
[23]黄晓宁,刘晶晶,韩北忠,等.基于酶学特性筛选大曲来源芽孢杆菌用于强化酿酒[J].食品科学,2021,42(10):218-224.
[24]王霜.产酱香功能芽孢杆菌的筛选及浓酱兼香型白酒复合功能强化曲的研究[D].武汉:武汉轻工大学,2017.
[25]唐佳代,邱树毅,王春晓,等.贵州地区酿酒小曲细菌多样性比较分析[J].中国酿造,2019,38(10):55-59.
[26]王春晓,唐佳代,吴鑫颖,等.酿酒小曲中功能微生物的研究进展[J].食品科学,2019,40(17):309-316.
[27]腾军伟,赵笑,杨亚威,等.酒曲中产凝乳酶微生物菌株的分离筛选及鉴定[J].食品科学,2017,38(16):23-28.
[28]FANG W,XUE S S,DENG P J,et al.AmyZ1:a novel α-amylase from marine bacterium Pontibacillus sp.ZY with high activity toward raw starches[J].Biotechnol Biofuels,2019,12:95.