白酒是我国的一款传统粮食蒸馏酒,历史悠久,在日常生活和国民经济中占有重要地位[1]。中国白酒因为酿造原辅料、酿造工艺和酿造微生物等方面的差异具有不同的风格[2-3]。其中,微生物基础代谢及生物调节产生的多种具有特殊风味的化合物是中国白酒风味特征形成的主要影响因素[4]。王小平等[5]研究发现,在酱香型白酒发酵过程中细菌是主要的生香来源;黄永光等[6]通过对芽孢杆菌发酵特性进行研究,证实了酱香型白酒酱香风味的形成是基于功能群体微生物相互调节、此消彼长的发酵机理。因此,将功能性微生物应用于白酒的工业化生产对白酒品质提升意义重大。
目前,在不同香型白酒中检测到超过1 730种挥发性成分[7],具有玫瑰香气的β-苯乙醇是其中一类重要的香气成分,参与构成清香型白酒和米香型白酒主体香气,也是浓香型白酒、酱香型白酒、豉香型白酒和黄酒等的特征风味物质[8-10]。已有研究表明,酵母是β-苯乙醇的主要产生来源[11-13],如酿酒酵母(Saccharomyces cerevisiae)[14]、库德里阿兹威毕赤酵母(Saccharomyces kudriavzevii)[15]、马克斯克鲁维酵母(Kluyveromyces marxianus)[12,16]等。目前,大部分研究集中在高产β-苯乙醇菌株的筛选,而产β-苯乙醇菌株的筛选鉴定及其用于白酒β-苯乙醇含量提升的研究鲜见报道。
本研究采用传统培养分离法从清香型大曲分离筛选产β-苯乙醇的酵母菌株,通过形态观察及分子生物学技术对其进行菌种鉴定,并采用微量肉汤稀释法对其安全性进行评价后,将该酵母应用于白酒酿造,跟踪发酵过程中香气成分等的变化,以期提高白酒香味和产质量,促进高质量白酒新产品的开发。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
清香型大曲:山西杏花村汾酒厂。
1.1.2 培养基
分离培养基[10]:酵母膏10 g/L,蛋白胨20 g/L,葡萄糖20 g/L,固体培养基再加入20 g/L琼脂,121 ℃灭菌20 min。
发酵培养基[10]:葡萄糖80 g/L,硫酸镁0.5 g/L,磷酸二氢钾5 g/L,L-苯丙氨酸10 g/L,酵母浸粉5 g/L,自然pH,121 ℃灭菌20 min。
活化培养基[10]:葡萄糖20 g/L,蛋白胨20 g/L,酵母膏10 g/L,腺嘌呤0.04 g/L,尿嘧啶0.02 g/L,pH 5.5,121 ℃灭菌20 min。
1.1.3 试剂
硫酸镁、磷酸二氢钾、L-苯丙氨酸、葡萄糖、酵母膏、酵母浸粉、蛋白胨、琼脂、腺嘌呤、尿嘧啶等(均为分析纯):国药集团化学试剂有限公司;2×Tap聚合酶链式反应(polymerase chain reaction,PCR)预混试剂Ⅱ、脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:天根生化科技(北京)有限公司;真菌药敏板YeastOne plate:美国赛默飞公司。
1.2 仪器与设备
XSP-BM-8CAS光学显微镜:上海彼爱姆光学仪器制造有限公司;SPX-150B-Z生化培养箱:上海博迅实业有限公司医疗设备厂;ZWY-211B摇床:上海智诚分析仪器制造有限公司;A200朗基全触屏PCR仪:广州飞迪生物科技有限公司;UV-9000紫外可见分光光度计:上海元析仪器有限公司;7890B气相色谱仪(gas chromatography,GC):美国安捷伦公司。
1.3 实验方法
1.3.1 酵母菌株的分离纯化
无菌条件下称取10 g清香型大曲置于100 mL的生理盐水中,充分振荡混匀,梯度稀释后均匀涂布于分离培养基上,30 ℃培养72 h。采用平板划线法选取菌落形态不同的单菌落进行划线分离,30 ℃培养72 h,通过显微镜观察,挑选出符合酵母菌特征的单菌落转接于斜面培养基中,编号后在4 ℃保存。
1.3.2 产β-苯乙醇酵母菌株的筛选
种子液制备:将分离得到的酵母菌株接种于活化培养基,30 ℃、160 r/min条件下培养16 h。
发酵培养:以10%(V/V)的接种量将种子液接种于发酵培养基中,30 ℃、160 r/min条件下培养54 h,测定发酵液中β-苯乙醇的含量。
1.3.3 产β-苯乙醇酵母菌株的鉴定
(1)形态观察
根据酵母在分离培养基中的生长状态,观察其菌落大小,形态结构。同时制备水浸片,于显微镜下观察细胞形态、特征、大小、出芽情况等。
(2)分子生物学鉴定
采用真菌DNA提取试剂盒提取酵母菌的基因组DNA,以其为模板,通过引物NL1(5'-GCATATCAATAAGCGGAGGAAAAG-3')和NL4(5'-GGTCCGTTTCAAGAAAAG-3')对酵母的26S rDNA基因序列进行PCR扩增。PCR扩增条件:95 ℃预变性5 min;94 ℃变性50 s,55 ℃退火50 s,72 ℃延伸1 min,共32个循环;72 ℃再延伸10 min。PCR扩增体系(50 μL):模板DNA 2.5 μL,引物NL1和NL4(20 μmol/L)各1 μL,2×EasyTaqSuper Mix 23 μL,双蒸水(ddH2O)23 μL。PCR扩增产物用1%的琼脂糖凝胶电泳检测合格后,委托铂尚生物技术(上海)有限公司进行测序。将测序结果提交至美国国立生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库中采用基本局部比对搜索工具(basic local alignment search tool,BLAST)同源性搜索,选取同源性较高的模式菌株的26S rDNA基因序列,使用MEGA.6.0生物学软件中的邻接(neighbor-joining,NJ)法构建系统发育树。
1.3.4 安全性评价
发酵菌株若含有耐药基因,可能进入人体肠道并发生耐药基因的水平转移,导致人体耐药,因此,有必要对发酵菌株进行耐药分析[17]。将筛选得到的酵母菌株委托中国工业微生物菌种保藏管理中心(China center of industrial culture collection,CICC)进行基因安全性分析,使用Blastn2.5.0+软件对预测得到的结果进行耐药性分析。
药物敏感性试验严格按照真菌药敏板YeastOne plate说明书操作,采用微量肉汤稀释法测定最小抑菌浓度(minimum inhibitory concentration,MIC)。文献[18]报道,库德里阿兹威毕赤酵母与克鲁斯假丝酵母(Candida krusei)具有高度同源性,相似度达到99.6%,因此,可借鉴美国临床实验室标准化协会(clinical and laboratory standards institute,CLSI)M27[19]和M60[20]文件建立的折点判读标准判定其对药物的敏感性。对上述文件缺乏的抗菌药物敏感性判定,则参考假丝酵母属的相关文献[21-23]并结合对库德里阿兹威毕赤酵母的耐药基因分析,推断出该菌株的安全性。
1.3.5 酵母菌株FJQC-XJ-4在白酒生产中的应用
该应用实验在山东扳倒井股份有限公司进行,为提高原料利用率,提升白酒质量,采用三排发酵法,三排配料,续糟发酵[24],具体工艺流程如下:
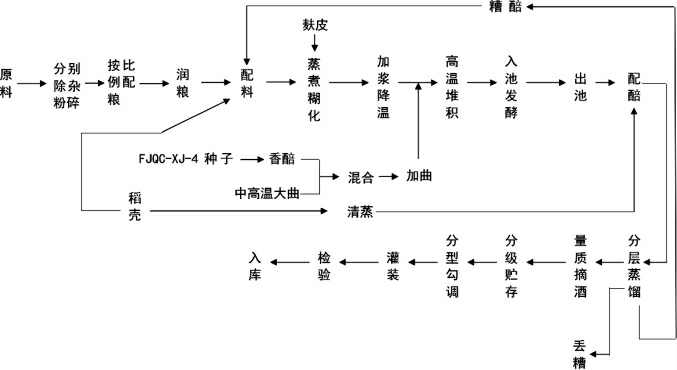
对照组不添加产β-苯乙醇酵母,实验组将筛选得到的酵母菌种子液按照10%的比例拌入粮醅中,制成香醅,以3%的添加量与大曲混合作为糖化发酵剂再与粮醅混合,高温堆积后入池发酵,连续发酵3排,每排30 d,发酵结束后对每排样品进行蒸馏,并对这三排白酒样品进行感官品评。蒸馏时每隔5 min取样一次,记为一个馏分,选取感官评价较好的一排样品测定馏分中的挥发性风味成分,将其馏分编号为1~10。
1.3.6 分析检测
β-苯乙醇含量、挥发性风味物质的测定及白酒的感官评价:参照国家标准GB/T 10345—2007《白酒分析方法》进行[25]。
2 结果与分析
2.1 产β-苯乙醇酵母菌株的分离及筛选
采用涂布平板法和划线分离法,从清香型大曲中共分离得到22株菌株,通过显微镜观察,初步判断其中4株为酵母菌,分别编号为FJQC-XJ-1、FJQC-XJ-2、FJQC-XJ-3、FJQC-XJ-4。通过气相色谱法检测4株分离酵母菌株发酵液中的β-苯乙醇含量发现,酵母菌株FJQC-XJ-4的发酵液中检测到了β-苯乙醇,其含量为7.82 g/L,其他3株酵母菌株均未检测出β-苯乙醇。因此,选取酵母菌株FJQC-XJ-4为目的菌株进行后续实验。
2.2 菌株FJQC-XJ-4的鉴定
2.2.1 形态观察
菌株FJQC-XJ-4在分离培养基平板上于30 ℃培养48 h后,其菌落及细胞形态特征见图1。
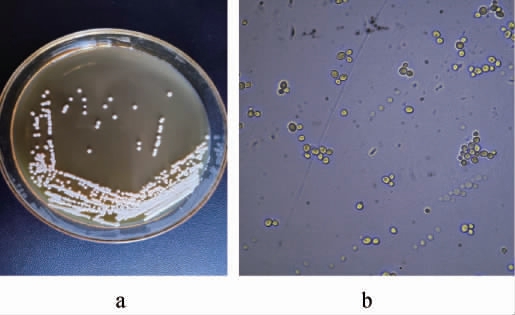
图1 菌株FJQC-XJ-4的菌落(a)及细胞(b)形态
Fig.1 Colony (a) and cell (b) morphology of strain FJQC-XJ-4
由图1可知,菌株FJQC-XJ-4的菌落呈乳白色、奶油状、圆形、表面光滑,细胞呈椭圆形、出芽繁殖、单生或对生。
2.2.2 分子生物学鉴定
基于26S rDNA基因序列菌株FJQC-XJ-4的系统发育树见图2。
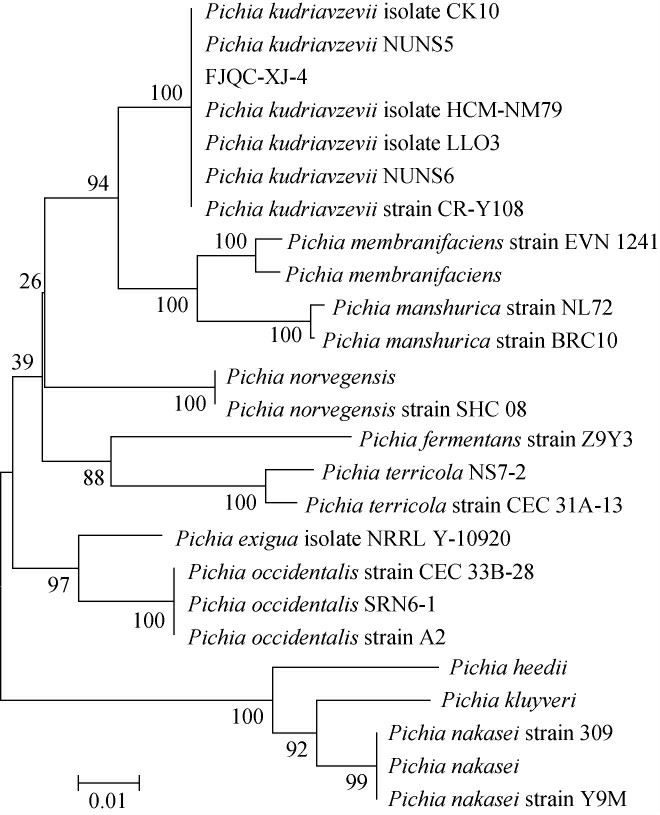
图2 基于26S rDNA基因序列菌株FJQC-XJ-4的系统发育树
Fig.2 Phylogenetic tree of strain FJQC-XJ-4 based on 26S rDNA gene sequence
由图2可知,菌株FJQC-XJ-4与库德里阿兹威(氏)毕赤酵母(Pichia kudriavzevii)聚于一支,具有高度同源性。结合形态观察结果,最终鉴定其为库德里阿兹威(氏)毕赤酵母(Pichia kudriavzevii)。
2.3 酵母菌株FJQC-XJ-4的安全性评价
酵母菌株FJQC-XJ-4中的真菌耐药基因预测结果见表1。
表1 耐药性基因预测结果
Table 1 Prediction results of drug resistance gene

由表1可知,从酵母菌株FJQC-XJ-4中预测得到两个耐药基因,分别为ERG11和CDR1。在Scaffold1上含有靶位酶基因ERG11,该基因过度表达可产生大量的靶酶,导致细胞内药物的浓度不能完全抑制靶酶的活性(氟康唑、伏立康唑、伊曲康唑等唑类药物),从而使真菌产生耐药性[26]。在Scaffold69中含有编码腺苷三磷酸(adenosine triphosphate,ATP)结合盒转运子蛋白基因CDR1可将细胞内的氟胞嘧啶类药物排出细胞外,导致细胞内该药物浓度降低从而不能有效抑制真菌的生长[27]。为进一步考察菌株FJQC-XJ-4的耐药性,测定7种抗真菌药物对其的最小抑菌浓度(MIC)值,并对药敏性进行评判,结果见表2。
由表2可知,菌株FJQC-XJ-4除对5-氟胞嘧啶耐药外,对其他临床常用抗真菌药物为敏感,与该基因组含有ATP结合盒转运子蛋白基因CDR1相吻合。综上,初步确定菌株FJQC-XJ-4为一株安全性酵母,可应用于食品酿造过程中。
表2 7种抗真菌药物对菌株FJQC-XJ-4的MIC值
Table 2 MIC values of 7 antifungal drugs against strain FJQC-XJ-4
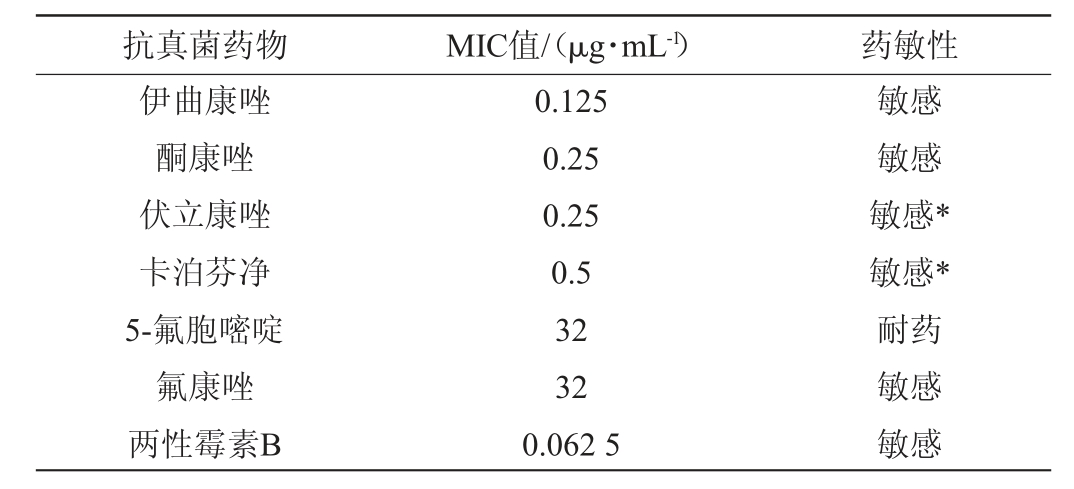
注:“*”表示根据CLSI检测标准进行判定。
2.4 酵母菌株FJQC-XJ-4在白酒生产中的应用
2.4.1 白酒的感官评价
实验组和对照组白酒的感官评价结果见表3。
表3 白酒的感官评价结果
Table 3 Sensory evaluation results of Baijiu

由表3可知,与对照组相比,实验组整体白酒感官稳定,具有粮香、窖香、糟香、酯香协调,口感醇甜、舒顺等特点,说明将产β-苯乙醇酵母FJQC-XJ-4添加于粮醅,并应用在白酒生产中,改善了原酒的品质。由表3亦可知,第二排发酵的白酒品质最佳,窖香浓郁,粮香、糟香、酯香协调,略带甜香,口感醇甜、舒顺,因此对第二排发酵白酒的馏分进行挥发性风味物质测定。
2.4.2 白酒中挥发性风味物质的测定结果
蒸馏是决定酒体质量的一个关键环节,将不同沸点和不同溶解性的微量风味分段蒸出[28]。第二排发酵白酒不同馏分中β-苯乙醇含量的变化见图3。
由图3可知,白酒蒸馏过程中,实验组的β-苯乙醇含量均高于对照组,实验组不同馏分中的β-苯乙醇平均含量为15.11 mg/L,比对照组高12.83%,说明在白酒酿造过程中,酵母菌FJQC-XJ-4的添加对白酒中β-苯乙醇含量的提升产生了促进作用。
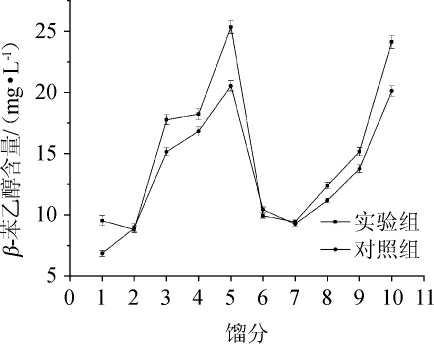
图3 不同馏分中β-苯乙醇含量的变化
Fig.3 Changes of β-phenylethanol content in different distillates
酯类是白酒中占比最大的风味物质,主要有乙酸乙酯、乳酸乙酯、丁酸乙酯、乙酸苯乙酯、苯乙酸乙酯、乙酸异戊酯等[29-30]。高级醇是白酒中重要的芳香组分之一,适量的高级醇可以丰富白酒香气和提升酒的浓厚感与协调感,除β-苯乙醇外,较为常见的有异丁醇、异戊醇和正丁醇等[31]。前期研究发现,与对照组相比,实验组白酒中含量增加较为明显的主要酯类物质有苯乙酸乙酯、乙酸异戊酯和乙酸乙酯,主要高级醇类物质有异丁醇,这些物质在白酒蒸馏过程中的含量变化见图4。由图4可知,实验组10个馏分中苯乙酸乙酯、乙酸异戊酯、乙酸乙酯、异丁醇的平均含量分别为5.35 mg/L、23.76 mg/L、4.99 mg/L、1.22 mg/L,相比于对照组,分别增加47.79%、3.66%、8.22%、29.06%。
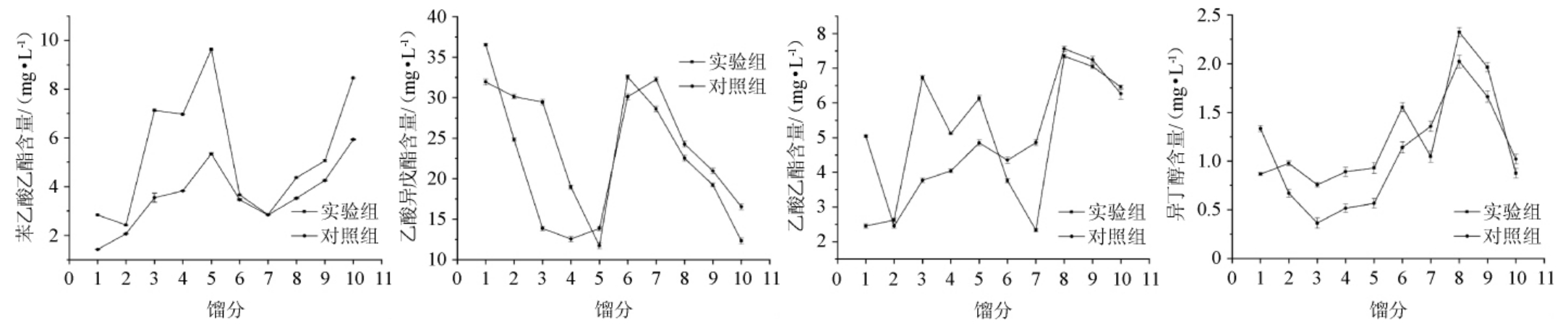
图4 不同馏分中主要风味物质含量的变化
Fig.4 Changes of main flavor substance contents in different distillates
3 结论
本研究采用传统培养分离法从清香型大曲中分离筛选得到一株产β-苯乙醇酵母菌株FJQC-XJ-4,通过形态观察及分子生物学鉴定,确定该菌株为库德里阿兹威(氏)毕赤酵母(Pichia kudriavzevii)。基因安全性分析和药敏测试显示,该菌株安全性较好,适合应用于食品生产。利用该菌株酿造白酒,使白酒中的β-苯乙醇(15.11 mg/L)、苯乙酸乙酯(5.35 mg/L)、乙酸异戊酯(23.76 mg/L)、乙酸乙酯(4.99 mg/L)和异丁醇含量(1.22 mg/L)分别提高12.83%、47.79%、3.66%、8.22%、29.06%,促进了白酒香气成分的生成;并使白酒粮香、窖香、糟香、酯香协调,口感醇甜、舒顺,改善了原酒的品质。
[1]孙宝国,黄明泉,王娟.白酒风味化学与健康功效研究进展[J].中国食品学报,2021,21(5):1-13.
[2]牛云蔚,李雯慧,肖作兵.白酒风味物质分析研究进展[J].食品科学技术学报,2021,39(2):23-31,90.
[3]付欢,陈雪峰,赵燕妮,等.白酒成分分析的研究进展[J].食品与发酵工业,2021,47(21):320-327.
[4]田德雨,闫子茹,危晶晶,等.清香型白酒酿造微生物和风味物质的研究进展[J].中国酿造,2021,40(4):20-25.
[5]王小平,黄永光,周文美.酱香型白酒大曲细菌菌群结构及功能研究进展[J].中国酿造,2020,39(2):19-25.
[6]黄永光,杨国华,张肖克,等.产酱香风味芽孢杆菌类菌株发酵代谢产物及其酶分析研究[J].酿酒科技,2013(1):41-45.
[7]ZHENG Y,SUN B G,ZHAO M,et al.Characterization of the key odorants in Chinese Zhima aroma-type Baijiu by gas chromatography-olfactometry,quantitative measurements,aroma recombination,and omission studies[J].J Agr Food Chem,2016,64(26):5367-5374.
[8] HUA D,PING X.Recent advances in biotechnological production of 2-phenylethanol[J].Biotechnol Adv,2011,29(6):654-660.
[9] ZHU Y P,CHENG Y Q,WANG L J.Improving flavor metabolism of Saccharomyces cerevisiae by mixed culture with Wickerhamomyces anomalus for Chinese Baijiu making[J]. J Biosci Bioeng,2018,126(2):189-195.
[10]许岱,范光森,李秀婷,等.一株高产β-苯乙醇酵母菌的筛选、鉴定及其发酵条件优化[J].食品工业科技,2017,38(5):151-158.
[11]富志磊,范光森,孙宝国,等.老白干酒曲中一株高产β-苯乙醇酵母菌的分离、鉴定及其产香特性研究[J].中国食品学报,2019,19(1):207-215.
[12] JULIANO G,SIMONE H F,TANIA M P,et al.Bioconversion of l-phenylalanine into 2-phenylethanol by Kluyveromyces marxianus in grape must cultures[J].World J Microb Biot,2007,23(9):1273-1279.
[13] HUANG C J,LEE S L,CHOU C C.Production and molar yield of 2-phenylethanol by Pichia fermentans L-5 as affected by some medium components[J].J Biosci Bioeng,2000,90(2):142-147.
[14]CHREPTOWICZ K,WIELECHOWSKA M,GÓWCZYK-ZUBEK J,et al.Production of natural 2-phenylethanol:From biotransformation to purified product[J].Food Bioprod Process,2016,100:275-281.
[15] KAROLINA C,KATARZYNA S M,DARIA K P,et al.Screening of yeasts for the production of 2-phenylethanol (rose aroma) in organic waste-based media[J].Lett Appl Microbiol,2018,66(2):153-160.
[16]牛明福,李亚恒,陈金帅,等.马克斯克鲁维酵母生物转化2-苯乙醇工艺优化及耐高温特性分析[J].食品与发酵工业,2018,44(2):15-20.
[17]黄晓棠,于宏伟,郭润芳.发酵食品工业中的生物安全性评价[J].食品工业科技,2020,41(4):356-360,367.
[18] DOUGLASS A P,OFFEI B,BRAUN G S,et al.Population genomics shows no distinction between pathogenic Candida krusei and environmental Pichia kudriavzevii:One species,four names[J].PLoS Pathogens,2018,14(7):e1007138.
[19] Clinical and Laboratory Standards Institute.Performance standards for antifungal susceptibility testing of yeast,4th ed[S].USA:Clinical and Laboratory Standards Institute,2017.
[20] Clinical and Laboratory Standards Institute.Performance standards for antifungal susceptibility testing of yeast,2nd ed[S].USA:Clinical and Laboratory Standards Institute,2020.
[21]王俊庭,刘勇.497例临床假丝酵母菌菌种分布及耐药性分析[J].中国真菌学杂志,2020,15(2):78-82.
[22]吴思颖,刘竞颖,陈知行,等.某三甲医院临床分离假丝酵母分布及其耐药性[J].中华医院感染学杂志,2021,31(1):33-37.
[23]汪宏良,邹义春,罗卓跃,等.243株假丝酵母菌属MIC结果分析[J].中华医院感染学杂志,2007,17(9):1171-1173.
[24]中国国家标准化管理委员会,中华人民共和国国家市场监督管理总局.GB/T 15109—2021 白酒工业术语[S].北京:中国标准出版社,2021.
[25]中国国家标准化管理委员会,中华人民共和国国家质量监督管理总局.GB/T 10345—2007白酒分析方法[S].北京:中国标准出版社,2007.
[26]王丹,俸家富.热带念珠菌的分布特征及其耐药性与ERG11和UPC2表达的关系[J].中国临床药理学杂志,2020,36(12):1686-1689.
[27] GAUR N A,MANOHARLAL R,SAINI P,et al.Expression of the CDR1 efflux pump in clinical Candida albicans isolates is controlled by a negative regulatory element[J].Biochem Bioph Res Co,2005,332(1):206-214.
[28]李永娇,张宿义,霍丹群,等.浓香型白酒蒸馏过程中金属元素的迁移变化规律[J].食品科学,2016,37(16):156-161.
[29]邢爽.白酒发酵过程中酯类物质形成机理的研究[D].天津:天津科技大学,2018.
[30]王震,叶宏,朱婷婷,等.清香型白酒风味成分的研究进展[J/OL].食品科学:1-28.http://kns.cnki.net/kcms/detail/11.2206.TS.20210618.1918.074.html.
[31]勾文君,方芳.窖泥梭菌扰动减控白酒发酵过程正丁醇生成[J].食品与发酵工业,2021,47(15):43-49.