酱香型白酒是中国传统蒸馏酒[1],因酱香突出、幽雅细腻广受市场欢迎[2]。酱香型白酒风格离不开其独特的高温制曲工艺[3],大曲为白酒酿造提供了功能微生物菌群以及白酒风味物质的前体物质[4]。此外大曲中富含的酶系也促进了白酒的酿造及风味物质的积累,因此大曲的质量直接决定了白酒的产量与质量[5-7]。大曲微生物主要包括细菌[8]、酵母菌[9]和霉菌[10],其中细菌是高温大曲的生香动力,能够利用小麦、高粱等原料代谢生成吡嗪类、酸类、芳香族类物质,同时也是酱香风味的来源[11]。芽孢杆菌属(Bacillus)、乳酸杆菌属(Lactobacillus)、魏斯氏菌属(Weissella)、高温放线菌属(Thermoactinomyces)、糖多孢菌属(Saccharopolyspora)是高温大曲中的主要优势菌[12-14]。吡嗪类物质作为白酒中的健康因子,是酱香型白酒中的关键香气物质,其含量要远高于其他香型白酒,具有烘焙香、坚果香气[15-16]。
芽孢杆菌是代谢吡嗪的主要微生物,同时也能够生成多种促进风味物质代谢的酶。GHA B等[17]将贝莱斯芽孢杆菌(Bacillus velezensis)和枯草芽孢杆菌(Bacillus subtilis)应用于强化大曲,分别对大曲微生物群落、酶活性和挥发性化合物进行了检测分析。结果表明强化大曲相比传统大曲,芽孢杆菌(Bacillus)、乳酸菌、假丝酵母(Candida oleophila)的丰度升高,吡嗪类、醇类和酯类物质显著增加,其中四甲基吡嗪和苯乙醇含量分别提高了91%和70%。ZHANG R等[18]筛选出两株高产吡嗪类、酸类、芳香族化合物的地衣芽孢杆菌,并且固态发酵的风味物质含量要高于液态发酵,将两株芽孢杆菌应用于白酒酿造中。结果表明,接种量为1%的酒样感官评价要明显高于对照组,并且挥发性化合物的含量也要高于对照组。因此,芽孢杆菌菌剂能够应用于大曲生产和白酒酿造,从而改善酱香型大曲和白酒的风味。
本研究从大曲中筛选高产吡嗪类物质的菌株,采用高温培养初筛和固态发酵复筛,结合顶空固相微萃取及气相色谱-质谱联用(headspace solid-phase microextraction and gas chromatography-mass spectrometry,HS-SPME-GC-MS)技术检测细菌代谢产物,从高温大曲中筛选出高产吡嗪细菌并应于大曲生产。使用超高效液相色谱-串联质谱(ultrahigh performance liquid chromatography-tandem mass spectrometry,UPLC-MS/MS)检测强化大曲中吡嗪类物质含量,探究在大曲生产上的应用效果,对于解析菌株代谢、提升大曲吡嗪含量具有重要意义。
1 材料与方法
1.1 材料与试剂
9种吡嗪类物质(2,3-二甲基吡嗪、2,5-二甲基吡嗪、2,6-二甲基吡嗪、2,3,5-三甲基吡嗪、四甲基吡嗪、2-甲基吡嗪、2,3-二乙基吡嗪、2-乙基-6-甲基吡嗪、5-乙基-2,3-二甲基吡嗪)标准品(纯度均≥98%):上海阿拉丁生化科技股份有限公司;细菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:天根生化科技(北京)有限公司。
高温大曲:贵州国台酒业公司。采用九点取样法收集出仓大曲的一次翻仓曲、二次翻仓曲、出仓曲样品,粉粹后过40目筛,-20 ℃保存备用。
牛肉膏蛋白胨液体培养基:称取5 g牛肉膏、蛋白胨5 g、NaCl 2.5 g,加入500 mL蒸馏水。121 ℃灭菌20 min。
牛肉膏蛋白胨琼脂培养基:在牛肉膏蛋白胨液体培养基基础上加入10 g琼脂粉。
细菌固态发酵培养基:粉碎后小麦和水按照料液比1∶1(g∶mL)混匀后浸润8 h,在电锅甑上敞口蒸40 min,冷却后打散,按100 g/瓶分装至250 mL三角瓶,灭菌20 min。
1.2 仪器与设备
DK-S26电热恒温水浴锅:上海森信实验仪器有限公司;BX53生物显微镜:日本OLYMPUS公司;Allegra 64R台式高速冷冻离心机:美国Beckman Coulter公司;SHP-250B生化培养箱:天津市实验仪器有限公司;T100聚合酶链式反应(polymerase chain reaction,PCR)仪:美国BIO-RAD公司;TRACE1310-ISQ气相色谱质谱联用仪:美国Thermo Fisher Scientific公司;AB5000三重四级杆液质联用仪:美国Applied Biosystems公司。
1.3 方法
1.3.1 高产吡嗪菌株的初筛
准确称取25g不同发酵阶段的酱香大曲分别置于225mL生理盐水(0.9%NaCl)中,150 r/min室温摇床30 min,使样品与水充分混合,静置后取上清液1 mL置于9 mL无菌水试管中,得到10-1的稀释液,以此类推制成梯度稀释液。吸取0.1 mL梯度稀释液均匀涂布于牛肉膏蛋白胨琼脂培养基平板进行初步分离,置于37 ℃培养箱中培养1~2 d。根据稀释涂布平板上的单菌菌落特征,挑取形态不同的菌株在平板上划线纯化3~4次,得到单菌落后接于斜面备用。
将分离纯化后的菌株接于牛肉膏蛋白胨琼脂培养基,50 ℃培养箱培养1~3 d,观察菌落生长状况,挑选生长良好的菌株进行下一步复筛。
1.3.2 高产吡嗪菌株的固态发酵复筛
将初筛株细菌接种于牛肉膏蛋白胨液体培养基,37 ℃摇床150 r/min培养18 h。培养好的菌液以10%接种量(10 mL)接入装有100 g细菌固态发酵培养基的三角瓶中,用8层纱布封口。将三角瓶置于高温培养箱中进行梯度升温培养,35~40~45~50~55~60 ℃每个梯度培养1 d[19]。每个样做3个平行,空白对照是加入10 mL空白菌液。发酵结束后,5名专业品评人员分别从外观色泽、香气进行感官闻香评价,从酱香、酸味、杂味等指标给出综合评价分数,满分为10分。
采用HS-SPME-GC-MS技术对菌株代谢产物和出仓大曲的挥发性香气化合物进行检测。取2 g菌株发酵产物或大曲于顶空瓶中,加入10 mL饱和氯化钠溶液,再加入100 mg/L乙酸薄荷酯内标20 μL。HS-SPME条件:顶空瓶置于50 ℃水浴中萃取30 min后插入进样口热解吸3 min。GC条件:采用HP-FFAP石英毛细管柱(50 m×0.20 mm×0.33 μm);升温条件:柱温箱温度50 ℃保持3 min,以3 ℃/min升温至170 ℃,再以6 ℃/min 升温至230 ℃保持5 min,总检测时间50 min;载气为氦气(He)(纯度>99.99%),流速1.5 mL/min;分流比设为不分流;溶剂延迟4 min。MS条件:采用电子电离(electron ionization,EI)源,电子能量70 eV,离子源温度250 ℃,传输线温度250 ℃,质量扫描范围30~550 amu。未知化合物经美国国家标准技术研究所(national institute of standards and technology,NIST)11.0谱库检索,选取匹配度>800的物质,采用内标法计算化合物的含量。
1.3.3 高产吡嗪菌株的鉴定
对复筛得到的菌株接种于牛肉膏蛋白胨琼脂培养基进行形态学观察,革兰氏染色后进行显微镜镜检。
按照DNA提取试剂盒说明书提取菌株基因组DNA,采用细菌通用引物27f(5'-AGAGTTTGATCCTGGCTCAG-3')和1492r(5'-GGTTACCTTGTTACGACTT-3')对16S rRNA序列进行扩增,将PCR产物送至华大基因股份有限公司进行测序。将测序结果提交至NCBI的GenBank数据库中与已知序列进行比对,选取基因序列同源性较高的相关细菌菌株的16S rRNA区域序列作为参比对象,用MEGA7.0进行相似性分析并用邻接(neighbor-joining,NJ)法构建系统发育树。
1.3.4 高产吡嗪菌株在大曲中的应用
将筛得的高产吡嗪细菌用牛肉膏蛋白胨液体培养基活化并培养1 d至108 CFU/mL,固态菌剂组是将种子液接入灭菌小麦培养基中,37 ℃恒温静置发酵7 d,发酵结束后接入生曲中,再加入7%母曲;液态菌剂组是将种子液扩培后直接将菌液接入生曲中,再加入7%母曲;以曲房中不接菌剂的普通大曲作为对照组。每种菌剂做5个平行,待发酵结束后取样。设置两种菌剂方式目的是考察固态菌剂强化大曲和液态菌剂强化大曲差异,固态菌剂和液态菌剂强化大曲流程如下:
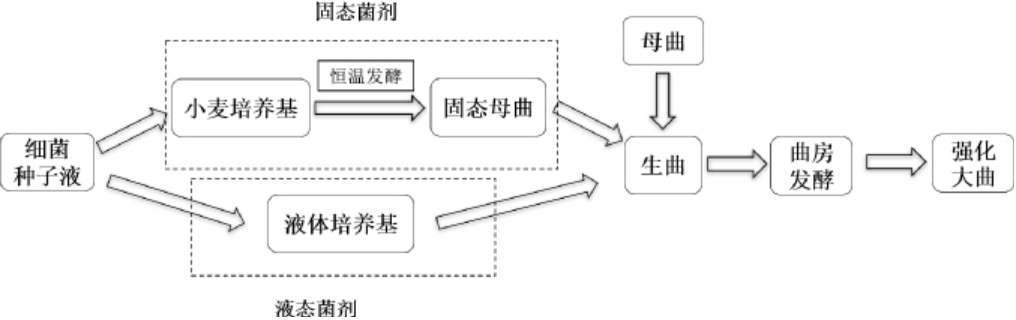
1.3.5 强化大曲吡嗪类物质的测定
采用UPLC-MS/MS对强化大曲的吡嗪类化合物进行定性和定量分析。
标准溶液的配制:用万分之一天平精确称取9种吡嗪标准品各100 mg,用体积分数50%乙醇溶液定容至50 mL。此时,标准溶液质量浓度为2.0 mg/mL。精确吸取9种标准储备液,配制成混合标准溶液,用体积分数50%乙醇溶液稀释并定容。其中2,3-二甲基吡嗪、2,5-二甲基吡嗪、2,6-二甲基吡嗪、2,3,5-三甲基吡嗪、四甲基吡嗪质量浓度均为5 μg/mL,2-甲基吡嗪、2,3-二乙基吡嗪、2-乙基-6-甲基吡嗪、5-乙基-2,3-二甲基吡嗪质量浓度均为0.5 μg/mL。取9个10 mL容量瓶,分别取混合标准溶液0、0.1 mL、0.2 mL、0.5 mL、1.0 mL、2.0 mL、5.0 mL、8.0 mL,用体积分数50%乙醇溶液定容至10 mL。分装至液相小瓶上机检测。以质量浓度(x,ng/mL)为横坐标,特征离子峰面积(y)为纵坐标,绘制标准曲线。
强化大曲样品前处理:准确称取5 g大曲于50 mL离心管中,加入20 mL 体积分数50%乙醇溶液,混匀后26 ℃超声(超声频率50 kHz)提取30 min,室温条件8 000 r/min离心10 min,吸取上清过0.22 μm滤膜进行上机检测。
超高效液相色谱(UPLC)条件:采用Waters Acquity UPLC BEH C18色谱柱(2.1 mm×100 mm×1.7 μm);柱温箱:40 ℃;恒流:柱流速为0.3 mL/min;进样量10 μL;流动相A为0.1%甲酸水溶液,流动相B为甲醇。梯度洗脱条件为0~1.0 min,93%A;1.0~12.0 min,93%~87%A;12.0~12.5 min,87%~0%A;12.5~15.0 min,0%A;15.0~15.5 min,0~93%A;15.5~19.0 min,93%A[20]。
质谱(MS)条件:离子源为常压化学电离源(atmospheric pressure chemical ionization,APCI);毛细管电压3.0 kV;脱溶剂气温度500 ℃;脱溶剂气流量800 L/h;锥孔气流量50 L/h;监测模式:多反应监测(multiple reactionmonitoring,MRM)。锥形电压设定范围为5~50V,碰撞能量设定范围为5~35eV。
2 结果与分析
2.1 高产吡嗪菌株的初筛
从大曲中共分离纯化到58株细菌,接种于牛肉膏蛋白胨培养基50 ℃培养1~3 d,生长良好的菌株有18株,编号为X1~X18,初筛菌株菌落形态见表1。由表1可知,18株菌株均为革兰氏阳性菌,形状大多为圆形,质地较为湿润。
表1 初筛菌株菌落形态描述
Table 1 Description of colony morphology of preliminary screening strains

2.2 高产吡嗪菌株的固态发酵复筛
2.2.1 菌株固态发酵产香实验
将经过初筛所得的18株细菌在固态发酵培养基梯度升温发酵6 d,发酵产物感官评价结果见表2。由表2可知,菌株X1、X2、X4、X6、X8、X9发酵产物感官闻香效果较好,酱味相比其他菌株更加浓郁,此外还有酸味、焦糖味以及轻微花果香气。
表2 高产吡嗪菌株复筛结果
Table 2 Rescreening results of high yield pyrazine strains

2.2.2 菌株代谢产物检测结果
对初筛18株菌株的发酵产物进行HS-SPME-GC-MS检测,初筛菌株发酵产物检出的香气成分主要有吡嗪类、酸类、酯类、醇类、酮类和芳香类物质。菌株X1、X2、X4、X6、X8、X9发酵代谢产物的吡嗪类物质含量要远高于其他菌株,其挥发性香气化合物测定结果结果见表3。由表3可知,菌株X1检出的吡嗪类和酸类物质含量最高,分别为9 276.55 μg/kg和1 054.16 μg/kg。选择高产吡嗪的菌株X1、X2、X4、X6、X8、X9进行大曲生产应用。
表3 6株高产吡嗪菌株代谢产物挥发性香气化合物测定结果
Table 3 Determination results of volatile aroma compounds in metabolites of 6 high-yield pyrazines strains
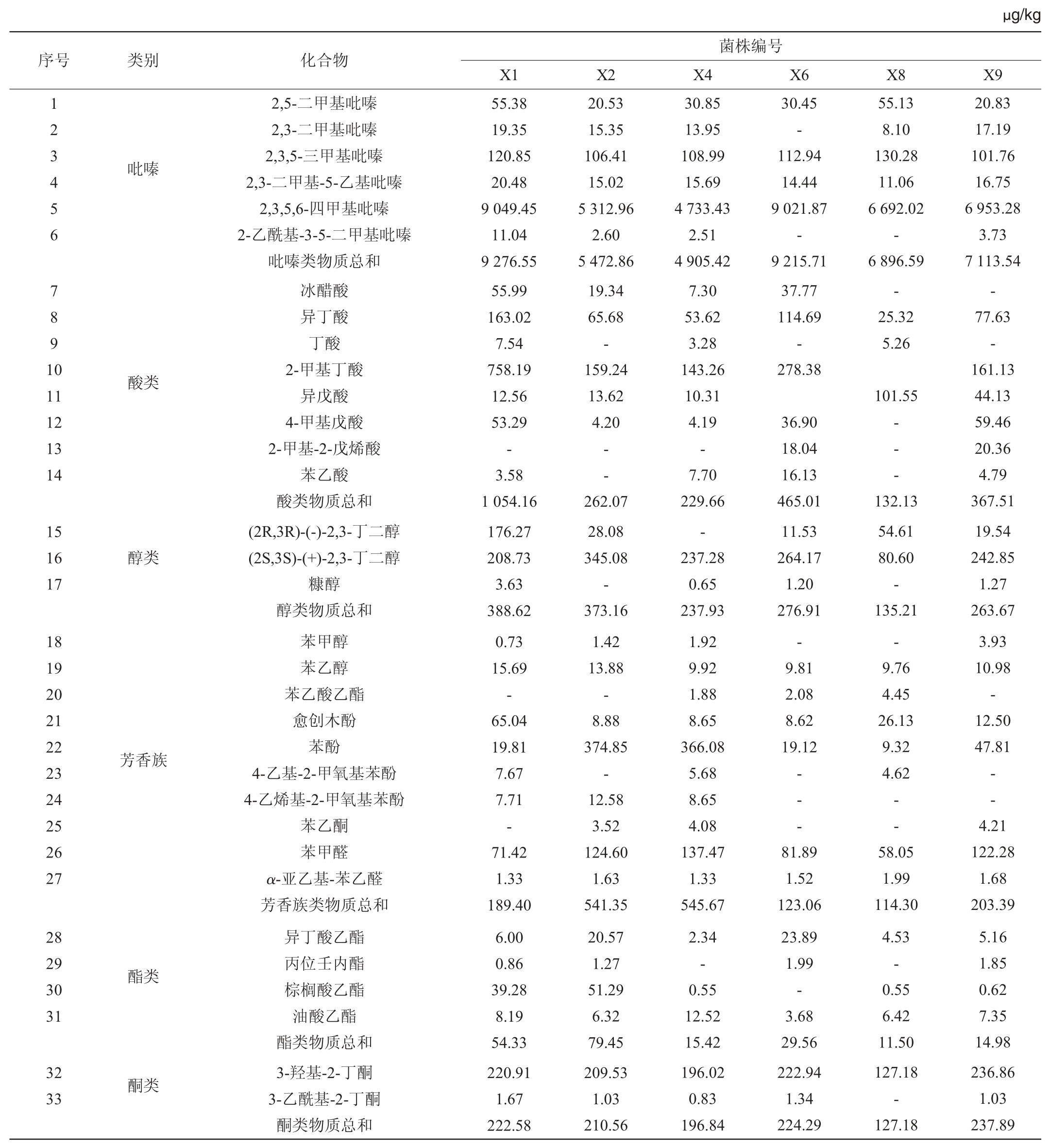
注:“-”表示未检出。
2.2.3 菌株代谢产物与大曲香气的比较
对出仓大曲的香气进行检测,结果见表4。与高产吡嗪菌株代谢产物进行比较分析,结果见图1。由表4和图1可知,高产吡嗪菌株代谢产物和高温大曲分别检出33种和67种挥发性成分,高产吡嗪菌株代谢产物中60.60%的成分在大曲中也能检出,主要有呈酱香和烘焙香的吡嗪类物质[21](2,5-二甲基吡嗪、2,3-二甲基吡嗪、2,3,5-三甲基吡嗪、2,3-二甲基-5-乙基吡嗪、2,3,5,6-四甲基吡嗪)和对大曲和白酒风味较为重要的酸味物质[22](乙酸、异丁酸、异戊酸)。代谢产物还检出苯甲醇、苯乙醇、苯乙酸乙酯、4-乙烯基-2-甲氧基苯酚等具有花香和芳香味的物质[23-24]。此外,2-甲基-2-戊烯酸、丙位壬内酯具有特殊果香气味也能在代谢产物中检出。通过感官闻香和GC-MS检测分析以及与大曲香气的比较分析,发现高产吡嗪菌株发酵主要对大曲贡献酱香、烘焙香、烘焙香以及花果香气。
表4 高温大曲中挥发性香气化合物检测结果
Table 4 Determination results of volatile aroma compounds in high-temperature Daqu

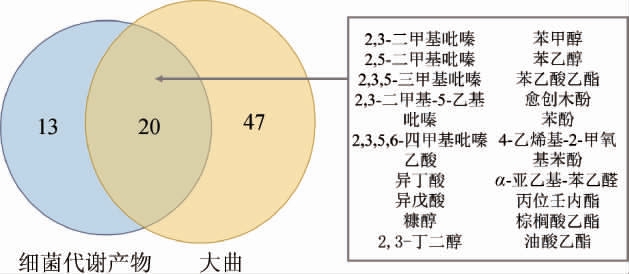
图1 大曲与细菌代谢产物挥发性香气物质维恩图
Fig.1 Venn diagram of volatile aroma components of Daqu and bacterial metabolites
2.3 高产吡嗪菌株的鉴定
2.3.1 菌株形态学观察
由图2可知,通过对高产吡嗪菌株形态学观察和显微镜镜检,发现6株菌均为革兰氏阳性菌、短杆状。
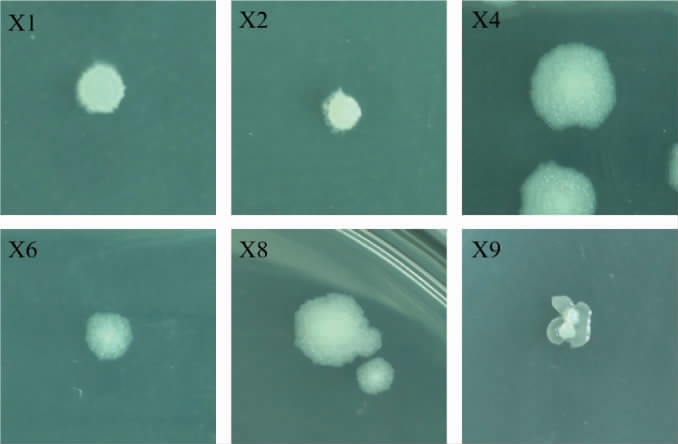
图2 6株高产吡嗪菌株菌落形态
Fig.2 Colony morphology of 6 high-yield pyrazines strains
2.3.2 分子生物学鉴定
对6株高产吡嗪菌株进行16S rDNA测序鉴定,选择同源性高的序列,通过MEGA7.0构建系统发育树,并结合形态学鉴定菌株X1为索诺拉沙漠芽孢杆菌(Bacillus sonorensis)、菌株X2为枯草芽孢杆菌(Bacillus subtilis)、菌株X4和X8为地衣芽孢杆菌(Bacillus licheniformis)、菌株X6为蜡样芽孢杆菌(Bacillus cereus)、菌株X9为解淀粉芽孢杆菌(Bacillus amyloliquefaciens)。
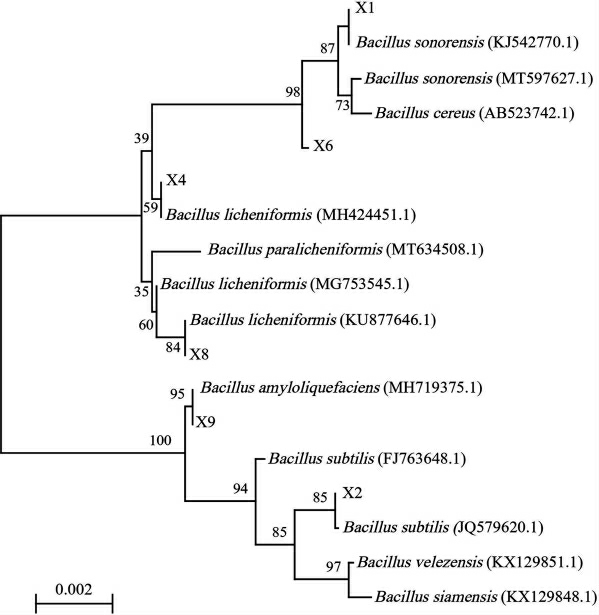
图3 基于16S rDNA基因序列构建的6株高产吡嗪菌株系统发育树
Fig.3 Phylogenetic tree of 6 high-yield pyrazines strains based on 16S rDNA gene sequence
2.4 强化大曲吡嗪类物质的测定
2.4.1 质谱条件的优化
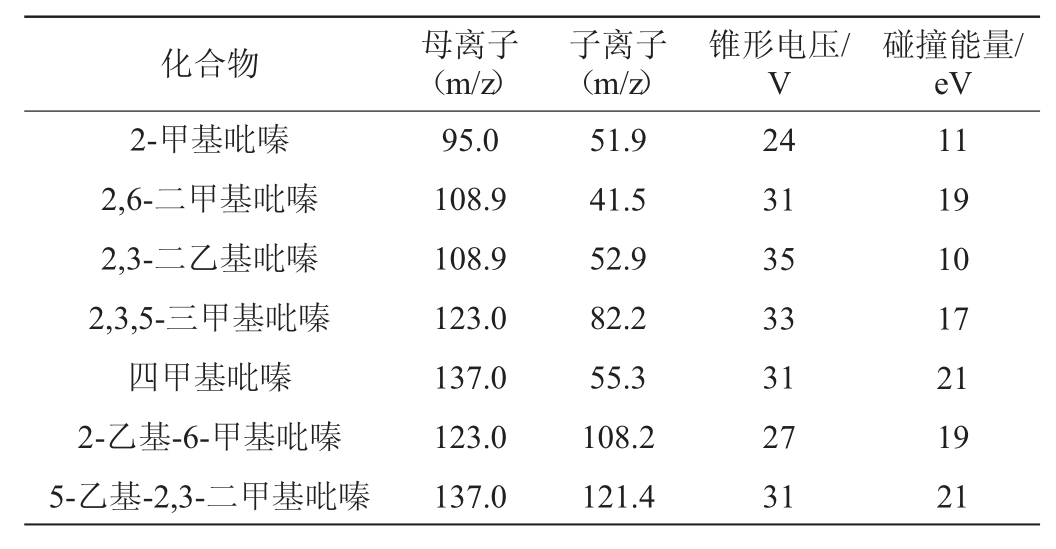
分别将9种吡嗪类标准储备液稀释至0.1 mg/L,上机进行一级质谱全扫描以确定目标吡嗪物质的准分子离子峰。再分别对准分子离子进行二级质谱扫描,优化锥孔电压、碰撞能量、母离子、子离子等质谱条件见表5。在实际检测过程中发现,2,3-二甲基吡嗪,2,5-二甲基吡嗪及2,6-二甲基吡嗪三种同分异构体其特征离子相同,不能进行分离。因此,选取2,6-二甲基吡嗪为代表检测二甲基吡嗪含量。
表5 吡嗪类物质参数优化
Table 5 Parameters optimization of pyrazines
2.4.2 线性范围、检出限和定量限结果
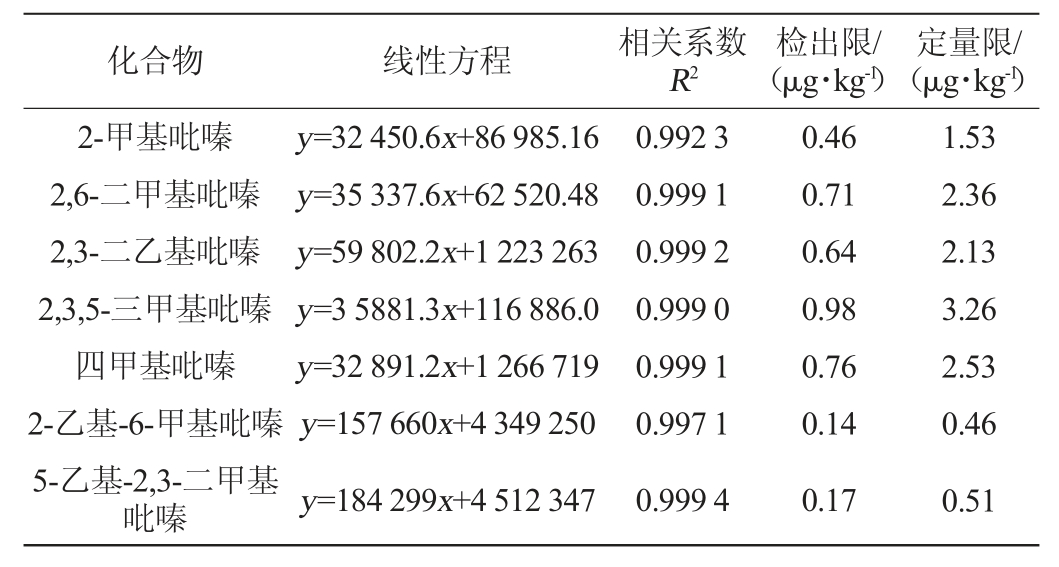
强化大曲吡嗪类物质经UPLC-MS/MS检测,采用外标法建立标准曲线,以质量浓度(x,ng/mL)为横坐标,特征离子峰面积(y)为纵坐标,绘制标准曲线。以3倍信噪比和10倍信噪比对应的质量浓度作为检出限(limit of detection,LOD)和定量限(limit of quantitation,LOQ)。经检测各吡嗪类物质的相关系数R2均>0.99,线性关系较好,且检出限较低,能够满足大曲中吡嗪类物质的测定。
表6 吡嗪类物质分析的线性方程、相关系数、检出限和定量限
Table 6 Linear equation,correlation coefficient,detection limit and quantification limit of pyrazines
2.4.3 强化大曲吡嗪类物质检测结果
由表7可知,从对照大曲(未添加高产吡嗪菌株)和强化大曲(添加高产吡嗪菌株)中共检出6种吡嗪类物质,包括四甲基吡嗪、2,3,5-三甲基吡嗪、2,6-二甲基吡嗪、2-甲基吡嗪、2-乙基-6-甲基吡嗪、5-乙基-2,3-二甲基吡嗪。
表7 6株高产吡嗪菌株强化大曲吡嗪类物质的含量检测结果
Table 7 Determination results of pyrazines contents in Daqu fortified by 6 high-yield pyrazines strains

相比于对照大曲,不同菌剂对于吡嗪类物质含量的影响较大,菌株X1、X2、X8、X9强化大曲吡嗪类物质含量要远高于对照大曲。其中,菌株X1强化大曲吡嗪类物质含量最多,其中四甲基吡嗪、2,3,5-三甲基吡嗪、2,6-二甲基吡嗪含量分别高达23 280.0 μg/kg、4 880.0 μg/kg、8 880.0 μg/kg,分别是对照大曲的3.36倍、3.56倍、3.33倍,这与文献报道的芽孢杆菌能够提高大曲四甲基吡嗪含量的结果一致[25-26]。2-乙基-6-甲基吡嗪、5-乙基-2,3-二甲基吡嗪的含量分别为60.0 μg/kg、284.8 μg/kg,为对照大曲的5.08倍、4.22倍;此外,菌株X2、X8和X9强化大曲的吡嗪物质含量也明显高于对照大曲;而菌株X4和X6强化大曲吡嗪类物质含量较少,要低于对照大曲,在大曲生产上的应用效果较差。此外,菌剂方式对于强化大曲的吡嗪类含量影响也较大,液态菌剂强化大曲产吡嗪效果要普遍优于固态菌剂强化大曲。
3 结论
经过高温培养初筛和固态发酵复筛从高温大曲中得到6株高产吡嗪类物质的菌株,经形态学观察和分子生物学鉴定均为芽孢杆菌(Bacillus)。将6株芽孢杆菌制备成液态和固态菌剂应用于大曲生产发酵,发酵结束后对强化大曲的吡嗪进行UPLC-MS/MS定量检测。结果表明相比于对照大曲,强化大曲的吡嗪类物质含量提升明显,并且液态菌剂的效果要普遍优于固态菌剂。菌株X1强化大曲吡嗪类物质含量最高,四甲基吡嗪、2,3,5-三甲基吡嗪、2,6-二甲基吡嗪含量相比对照大曲分别提升了2.36倍、2.56倍、2.33倍,该菌株在大曲生产上有较高的应用价值,能够显著提高大曲吡嗪类物质含量。
[1] JIN G,ZHU Y,XU Y.Mystery behind Chinese liquor fermentation[J].Trends Food Sci Tech,2017,63(2):18-28.
[2]马宇,黄永光.清酱香型白酒挥发性风味组分及香气特征[J].食品科学,2019,40(20):241-248.
[3]黄魏,程平言,张健.酱香型白酒风味形成的影响因素及主体风味成分研究进展[J].酿酒科技,2020(4):85-93.
[4]李兵,张超,王玉霞,等.白酒大曲功能微生物与酶系研究进展[J].中国酿造,2019,38(6):7-12.
[5] WANG X D,QIU S Y,LI P,et al.Analysis of microbial community structure in traditional and automated Moutai-flavor Daqu[J]. J Am Soc Brew Chem,2019,77(2):140-146.
[6]LIU H,SUN B.Effect of fermentation processing on the flavor of Baijiu[J].J Agr Food Chem,2018,66(22):5425-5432.
[7]DU H,WANG X,ZHANG Y,et al.Exploring the impacts of raw materials and environments on the microbiota in Chinese Daqu starter[J]. Int J Food Microbiol,2019,297(2):32-40.
[8]王小平,黄永光,周文美.酱香型白酒大曲细菌菌群结构及功能研究进展[J].中国酿造,2020,39(2):19-25.
[9]罗方雯,黄永光,涂华彬,等.基于高通量测序技术对茅台镇酱香白酒主酿区域酵母菌群结构多样性的解析[J].食品科学,2020,41(20):127-133.
[10]杨旭,马歌丽,王光路,等.高通量测序解析白酒中高温大曲细菌和真菌群落结构[J].中国酿造,2020,39(6):119-123.
[11]李豆南,邱树毅.酱香大曲微生物菌群结构及微生物功能研究概述[J].中国酿造,2017,36(1):5-11.
[12] WANG X,BAN S,HU B,et al.Bacterial diversity of Moutai-flavour Daqu based on high throughput sequencing method[J]. J I Brewing,2017,123(1):138-143.
[13] WANG X D,QIU S Y,LI P,et al.Analysis of microbial community structure in traditional and automated Moutai-flavor Daqu[J].J Am Soc Brew Chem,2019,77(2):140-146.
[14]戴奕杰,李宗军,田志强.酱香型白酒大曲和糟醅的细菌多样性分析[J].食品科学,2019,40(4):152-159.
[15]ZHAO T,NI D,HU G,et al.6-(2-formyl-5-methyl-1H-pyrrol1yl) hexanoic acid as a novel retronasal burnt aroma compound in soy sauce aroma type Baijiu[J].J Agr Food Chem,2019,67(28):7916-7925.
[16]ZHANG W,SI G,DU H,et al.Directional design of a starter to assemble the initial microbial fermentation community of Baijiu[J].Food Res Int,2020,134:109255.
[17] GHA B,YI D C,JHA B,et al.Alteration of microbial community for improving flavor character of Daqu by inoculation with Bacillus velezensis and Bacillus subtilis[J].LWT-Food Sci Tech,2019,111(4):1-8.
[18]ZHANG R,WU Q,XU Y.Aroma characteristics of Moutai-flavour liquor produced with Bacillus licheniformis by solid-state fermentation[J].Lett Appl Microbiol,2013,57(1):11-18.
[19]王晓丹,王婧,朱国军,等.酱香大曲中产四甲基吡嗪细菌的分离鉴定及其功能性研究[J].中国酿造,2017,36(1):55-60.
[20] YAN Y,CHEN S,HE Y,et al.Quantitation of pyrazines in Baijiu and during production process by a rapid and sensitive direct injection UPLCMS/MS approach[J].LWT-Food Sci Tech,2020,128:109371.
[21]孙宝国,黄明泉,王娟.白酒风味化学与健康功效研究进展[J].中国食品学报,2021,21(5):1-13.
[22]唐平,山其木格,王丽,等.白酒风味化学研究方法及酱香型白酒风味化学研究进展[J].食品科学,2020,41(17):315-324.
[23]张小龙,邱树毅,王晓丹,等.酱香型大曲中挥发性成分与微生物代谢关系[J].中国酿造,2020,39(12):51-57.
[24]陈树兵,刘忠义,陈颖,等.液相色谱-串联质谱测定葡萄酒中4-乙基苯酚和4-乙基愈创木酚[J].食品安全质量检测学报,2018,9(16):4407-4411.
[25] ZHANG W,SI G,RAO Z,et al.High yield of tetramethylpyrazine in functional Fuqu using Bacillus amyloliquefaciens[J].Food Biosci,2019,31:100435.
[26]WANG P,WU Q,XU Y,et al.Bacillus licheniformis affects the microbial community and metabolic profile in the spontaneous fermentation of Daqu starter for Chinese liquor making[J].Int J Food Microbiol,2017,250(5):59-67.