白酒作为世界六大蒸馏酒之一,是中国消费市场的主流酒类。酒精代谢是一个复杂而广泛的过程,它直接或间接地影响着身体各个器官(如胃、肠、肝等)的功能,同时也影响着能量循环和物质代谢。有研究表明,酗酒会损害肝脏和心脏,增加癌症的机率,也会导致抑郁和暴力[1],而适度饮酒对心脏和循环系统有好处,可以预防糖尿病和胆结石[2]。乙醇对包括肝脏和胃肠在内的几乎所有器官系统都会造成损伤,除直接作用外,乙醇诱导的效应还通过氧化(如乙醛、活性氧)和非氧化(如磷脂酰乙醇、脂肪酸乙酯)代谢产物与甲基化过程中的损伤[3]。最近的研究表明,乙醇诱导表观遗传改变,特别是乙酰化、组蛋白甲基化和脱氧核糖核酸(deoxyribonucleic acid,DNA)低甲基化和高甲基化,表观遗传效应主要归因于乙醇的氧化和非氧化代谢以及蛋氨酸代谢失调引起的乙醇代谢应激[4]。白酒含有体积分数98%的乙醇和水以及2%的微量成分(包括杂醇、有机酸、酯类等),但不同白酒具有不同香型和口感以及不同的醉酒效果正是因为这2%的微量成分[5]。关于微量成分对白酒风味影响已经有较多研究[6-7],但对白酒醉酒影响的研究还有待深入。为了量化白酒产品的醉酒效果,WU Z Q等[8]建立了一种利用小鼠模型评价酒类产品致醉程度(intoxicating degree,ID)的方法,为研究杂醇对酒类产品中毒程度的影响提供了可行的方法。后续有实验模拟传统白酒的正丙醇、异丁醇、异戊醇、有机酸及相应的乙酯与乙醇的比例,制备出配方酒,揭示了醇酸酯比率(the ratio of alcohols and acids and esters,RAAE)对ID的影响[9]。本研究将进一步研究杂醇、有机酸、酯类等微量成分对酒后小鼠的乙醇代谢、行为能力以及急性酒精性肝损伤的影响,探究白酒中对代谢有益成分及含量比例,为健康低醉白酒的生产提供数据参考。
1 材料与方法
1.1 材料与试剂
实验小鼠(雄性成年无特定病原体(specific pathogen free,SPF)级昆明小鼠,体质量18~22 g):湖南斯莱克景达实验动物有限公司,小鼠于25~28 ℃、相对湿度60%、自然光照环境中适应性饲养一周,饲养期间自由进食饮水。实验前一晚小鼠禁食不禁水。所有的动物实验都按广东省动物实验管理条例(2010年10月1日)要求进行。
无水乙醇、叔丁醇(均为色谱纯):天津市科密欧化学试剂有限公司;正丙醇、异丁醇、异戊醇、乙酸、乳酸、正丁酸、正己酸、乙酸乙酯、乳酸乙酯、丁酸乙酯、己酸乙酯(均为色谱纯)、肝素钠(效价≥180 U/mg):上海晶纯生化科技股份有限公司。
总蛋白定量测试盒、乙醇脱氢酶(alcohol dehydrogenase,ADH)测试盒、乙醛脱氢酶(acetaldehyde dehydrogenase,ALDH)测试盒、过氧化氢酶(catalase,CAT)测试盒、丙二醛(malonaldehyde,MDA)测试盒、总超氧化物歧化酶(superoxide dismutase,SOD)测试盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-PX)测试盒:南京建成生物工程研究所。
1.2 仪器与设备
Morris水迷宫:上海欣软信息科技有限公司;GC-2014C气相色谱分析仪(gaschromatography,GC)、WondaCapWAX色谱柱(30 m×0.25 mm×0.25 μm):日本岛津公司;TGL-16G型高速离心机:上海安亭科学仪器厂;5804R冷冻离心机:德国Eppendorf公司;SpectraMax M5多功能酶标仪:美国Thermo Fisher Scientific公司;WFZ UV-2802S紫外可见分光光度计:上海尤尼柯仪器有限公司;BS224S分析天平:赛多利斯科学仪器有限公司;HH-S 水浴锅:上海程造仪器设备有限公司;KQ-400KDE型超声清洗仪:昆山市超声仪器有限公司。
1.3 方法
1.3.1 酒样配制
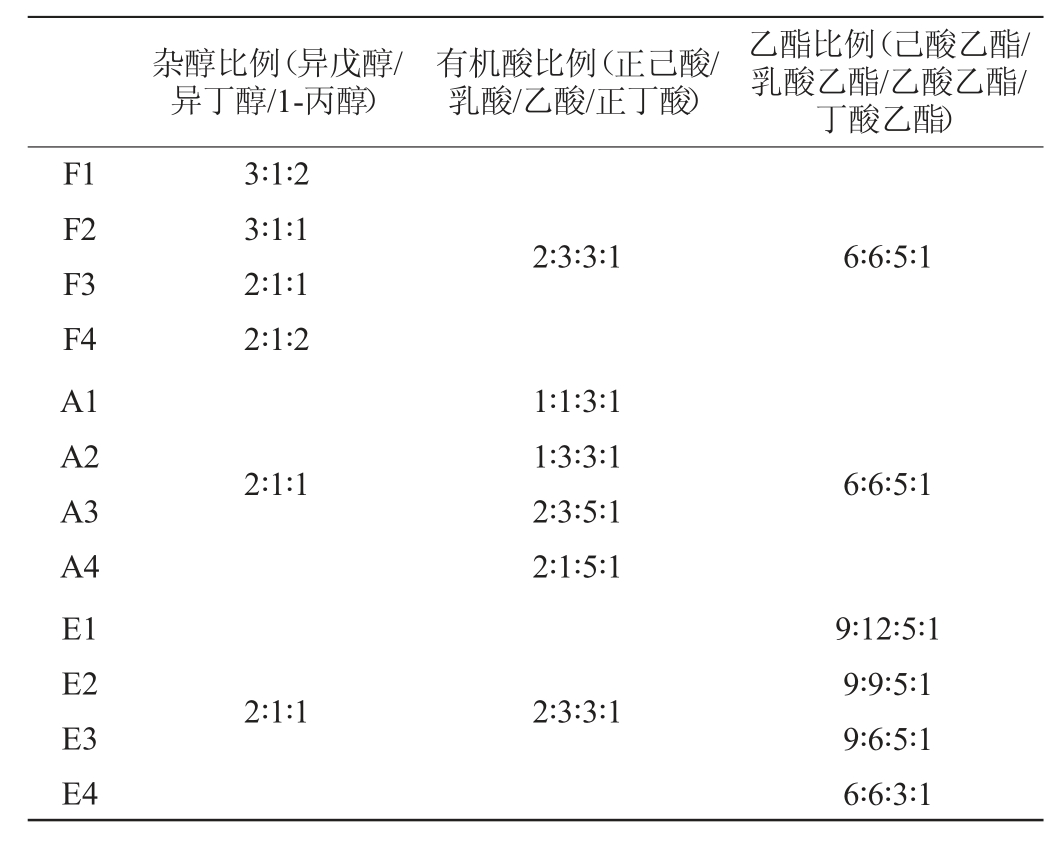
空白对照组为52%vol乙醇溶液,实验组为将乙醇与杂醇、有机酸和乙酯类按比例混合,制备出12种配方相似于商品白酒的配制酒(formulated liquors,FLs)其各组分比例见表1,配方依据是测定的13种商品白酒产品中特征成分的平均含量,主要含3种杂醇(异戊醇/异丁醇/1-丙醇),4种有机酸(正己酸/乳酸/乙酸/正丁酸)及酸对应的4种乙酯类成分(己酸乙酯/乳酸乙酯/乙酸乙酯/丁酸乙酯),杂醇含量设定为1.5 g/L,醇/酸/酯的比例设定为1∶2∶3,乙醇含量统一为52%vol。
表1 配制酒中各组分比例
Table 1 Proportion of each component in formulated liquor
1.3.2 血液乙醇含量测定
将312只小鼠随机进行分组,共分为13组,每组24只,每组小鼠灌胃相同剂量FLs或52%vol乙醇溶液4 g/kg体质量且只灌胃一次。每组小鼠再随机进行分组,共分为8组,每组3只,每组小鼠分别在灌胃后30 min、60 min、70 min、80 min、90 min、120 min、180 min、240 min用尾静脉穿刺法采集血液100 μL,收集于含10 μL肝素钠溶液的离心管中,再加入500 μL乙腈、50 μL叔丁醇内标溶液(500 mg/L)和340 μL水混匀,12 000 r/min离心10 min,取上层液体经0.22 μm尼龙膜过滤至气相瓶中等待测试。
血液乙醇浓度(blood alcohol concentration,BAC)采用气相色谱法进行测定,仪器采用岛津气相色谱系统,检测器为火焰离子化检测器(flame ionization detector,FID),色谱柱为WondaCap WAX 色谱柱(30 m×0.25 mm×0.25 μm)。进样器和探测器的温度设定为250 ℃。色谱柱升温程序为初始温度48 ℃,以3 ℃/min升温至55 ℃,后以30 ℃/min升温至200 ℃,孵育2 min后结束测试。载气为高纯度氮气(N2),分析时维持在1.43 mL/min,样本进样后分流比为10∶1。
1.3.3 记忆和行为能力的测定
采用Morris水迷宫法探究醇酸酯比对小鼠空间学习记忆能力的影响。Morris水迷宫主要由水池(直径120 cm)和平台(直径9 cm)组成,辅以录像装置、分析软件和加热装置。实验时要将水池中水灌至高于平台1.5 cm处,水温用加热器保持在25.5~27.0 ℃。水池四周贴上不同的视觉标志,壁上有视觉标志,以帮助小鼠记忆并寻找逃生平台。实验过程中平台位置不变,实验者也应站在同一位置减少对实验影响。房间的光线应为散射光以避免在水上反射影响实验。小鼠先进行连续3 d的认知学习,每只小鼠从一个随机的位置放入迷宫中开始训练,若60 s内小鼠没有找到水下平台,则将其放在平台上15 s以加强记忆;若60 s内小鼠找到平台,则将小鼠取出擦干,放入垫有干燥垫料的塑料笼中。每只小鼠训练完成10 min后进行下一次训练,每天4次。
在第4天正式进行实验,将52只小鼠随机分为13组,每组4只,每组小鼠灌胃相同剂量FLs或52%vol乙醇溶液4 g/kg体质量且只灌胃一次。每只小鼠分别在灌胃后1 h、2 h、3 h、4 h后从一个随机的位置放入迷宫中,计时60 s,直至小鼠找到平台或时间到60 s,将小鼠取出擦干,放入垫有干燥垫料的塑料笼中。录像装置将全程记录小鼠实验过程,实验后用分析软件处理得到所要参数,主要为游泳速度(velocity,V)和小鼠找到平台时间即逃逸潜伏期(escape latency,ELT)(若60 s后小鼠未找到平台则记为60 s)。为减少由时间造成的实验影响,训练与实验均安排在每天相同的时间进行。
1.3.4 酒精代谢酶测定
将52只小鼠随机分为13组,每组4只,每组小鼠灌胃相同剂量FLs或52%vol乙醇溶液4 g/kg体质量且只灌胃一次。灌胃2 h后,将小鼠采用颈椎脱臼法处死,立即取肝脏。
取0.1 g肝脏组织于装有生理盐水冷溶液(0.9%NaCl)的离心管中,用匀浆机打磨成10%组织匀浆,在4 ℃、1 000×g条件下离心15 min,取上清液,用生理盐水(0.9%NaCl)冷溶液分别稀释为1%、0.25%肝组织匀浆,备用。根据试剂盒说明测定样品总蛋白含量、乙醇脱氢酶(ADH)活性,乙醛脱氢酶(ALDH)活性,过氧化氢酶(CAT)活性。
1.3.5 急性酒精性肝损伤测定
将52只小鼠随机分为13组,每组4只,每组小鼠灌胃相同剂量FLs或52%vol乙醇溶液4 g/kg体质量且只灌胃一次。灌胃6 h后,将小鼠采用颈椎脱臼法处死,立即取肝脏。
取0.1 g肝脏组织于含有生理盐水(0.9%NaCl)冷溶液的离心管中,用匀浆机打磨成10%组织匀浆,在4 ℃、1 000×g条件下离心15min,取上清液,用生理盐水冷溶液(0.9%NaCl)分别稀释为1%、0.25%肝组织匀浆,备用。根据试剂盒说明测定样品总蛋白含量、丙二醛(MDA)含量、超氧化物气化酶(SOD)活力、谷胱甘肽过氧化物(GSH-Px)活力。
1.3.6 数据统计分析
血液乙醇浓度测定实验重复测定3次,记忆和行为能力测定、酒精代谢酶测定以及急性酒精性肝损伤测定实验重复测定4次。数据均以“平均值±标准差”表示。
结果采用药物代谢动力学软件Phoenix WinNonlin 6.1计算血液乙醇达峰浓度(maximum concentration,Cmax)、血液乙醇浓度—时间曲线下面积(area under curve,AUC)以及血液乙醇清除率(clearance rate,CL),采用IBM SPSS 26.0软件进行组间差异显著性分析,采用Origin 9.0软件进行作图。
2 结果与分析
2.1 不同醇酸酯比例对小鼠血液乙醇含量的影响
BAC通常被用作酒精中毒的法定或医疗指标,有报道称BAC对人类行为和损伤有渐进性影响[10]。不同醇酸酯比例对小鼠血液乙醇含量的影响见表2。
表2 不同醇酸酯比例对小鼠血液乙醇含量的影响
Table 2 Effect of differents alcohols,acids and esters ratios on ethanol contents in mice blood
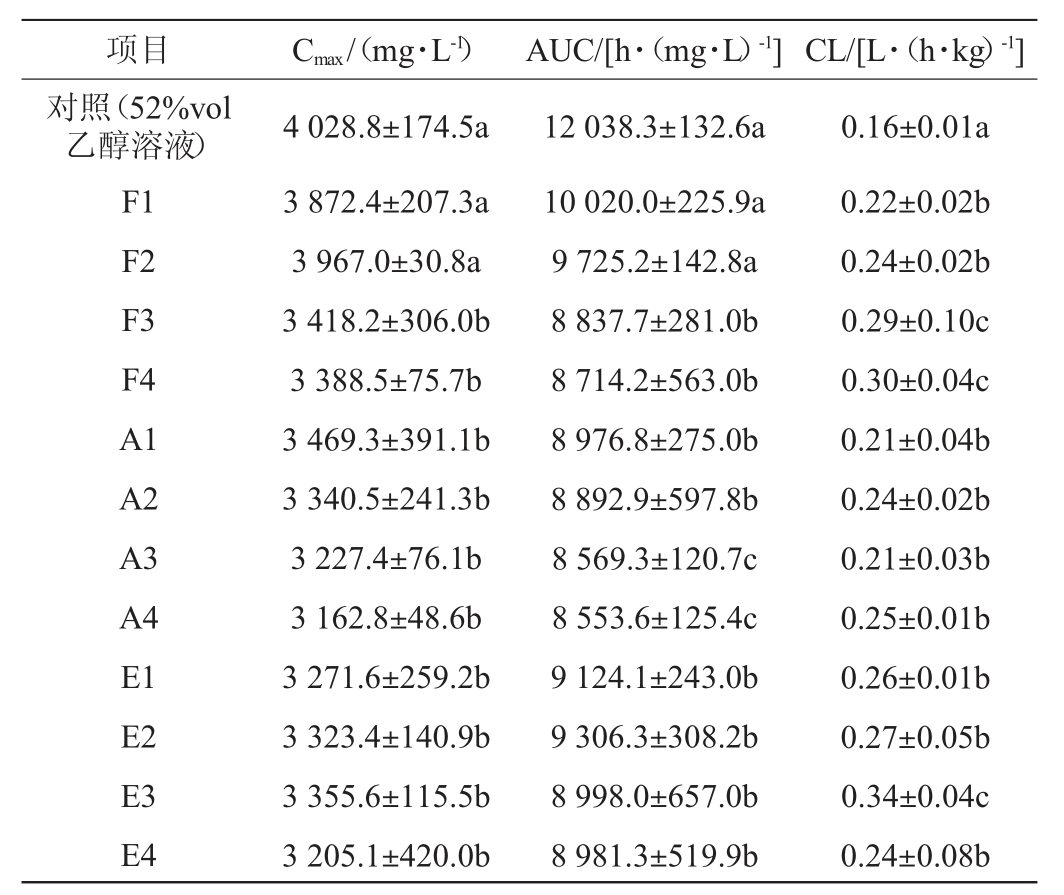
注:不同小写字母表示同组数据间差异显著(P<0.05)。
由表2可知,与对照组(52%vol乙醇溶液)相比,配制酒样小鼠血液乙醇的Cmax和AUC降低,CL显著升高(P<0.05),说明其代谢增强。乙醇在人体内的代谢是一个复杂而漫长的过程,进入人体后首先在胃和肠道吸收小部分,大部分进入肝脏进行主要代谢,还有小部分随汗液和尿液排出体外。乙醇在肝脏中的代谢分为三类:其中主要的一部分是通过ADH催化转化成乙醛,乙醛再通过ALDH催化转化成乙酸,而剩余部分则分别由过氧化氢酶和微粒体乙醇氧化系统处理[11]。ADH在人体内有多种同工酶,研究表明,随着人体内乙醇含量增加,I类ADH(ADH1)迅速降低,并一直维持在较低水平,而Ⅲ类ADH(ADH3)则相反,并且Ⅲ类ADH(ADH3)可被疏水性物质激活,所以在乙醇代谢过程中起着非常重要的作用,充分补偿了ADH1的减少[12]。
与F1、F2相比,F3、F4组小鼠血液乙醇的Cmax和AUC显著降低(P<0.05),CL显著升高(P<0.05),说明异戊醇含量对乙醇在人体中的代谢会有显著影响。杂醇是白酒的风味成分,但乙醇与其相互作用会增强酒精饮料的肝毒性,促进肝组织的损伤并进一步使其暴露于乙醇[13]。有报道称,杂醇会抑制氧的吸收,降低肝脏的呼吸商,影响氧化还原状态,进而抑制三羧酸循环,而因为三羧酸循环阻滞,由醇代谢生成的有机酸不能进一步氧化[14]。随着碳链长度的增加,杂醇毒性逐渐增加[15],此外,异戊醛是各种线粒体底物(包括乙醛)氧化的最有效抑制剂[16],在人体内积累将严重损害人体健康。因此高浓度的杂醇尤其是异戊醇将影响体内乙醇代谢速率。
与A1、A2(低己酸、乙酸比例)组相比,A3、A4(高己酸、乙酸比例)组小鼠血液乙醇的Cmax和AUC略有下降,表明己酸和乙酸可能对乙醇的代谢影响权重较大。正己酸是一种6-碳链羧酸,属于中链脂肪酸(medium-chain fatty acid,MCFA),与长链脂肪酸相比,它能更有效的被氧化,促进新陈代谢的平衡。它可以作为控制肝脂肪变性和肝胰岛素抵抗的一种有效的营养工具,并且不会导致细胞毒性活性氧的积累或与氧化应激有关的损伤[17]。具有强大的抗脂质生成功能的己酸,能有利于维持脂质分解代谢的相对代谢平衡,保护氧化应激导致的线粒体膜破裂,对保护肝损伤起到重要作用[18-19]。肠道微生物活动的基本代谢产物中的丁酸和乙酸均属于短链脂肪酸(short-chain fatty acids,SCFAs),它们不仅可通过G-蛋白偶联受体发挥作用,更可通过组蛋白去乙酰化酶作为表观遗传调节因子广泛影响代谢[20]。丁酸在肠道跨上皮液体转运中起调节作用,能改善粘膜炎症和氧化状态,具有加强上皮防御屏障,调节内脏敏感性和肠道运动的作用[21-22]。乙酸通过上调肝脏中与脂肪酸氧化相关蛋白的基因,抑制体内脂肪和肝脏脂质的积累,同时具有增强血管舒张的功能[23-24];磷酸腺苷蛋白激酶(adenosine 5'-monophosphate(AMP)-activated protein kinase,AMPK)是生物能量代谢调节的关键分子,能诱导合成某些长寿蛋白质[25],用于心血管、高血糖[26]和脂肪氧化[23]保护,而肝脏AMPK可通过中等浓度的乙酸激活起到保护健康的作用。
乙酸对应酯组成的变化对小鼠血液乙醇的Cmax和AUC没有影响,仅E3组的CL与其他组相比显著升高。
2.2 不同醇酸酯比例对小鼠记忆和行为能力的影响
根据酒后小鼠在水迷宫实验中的逃避潜伏期和游泳速度,可判断小鼠认知记忆和行为能力,结果如图1所示。
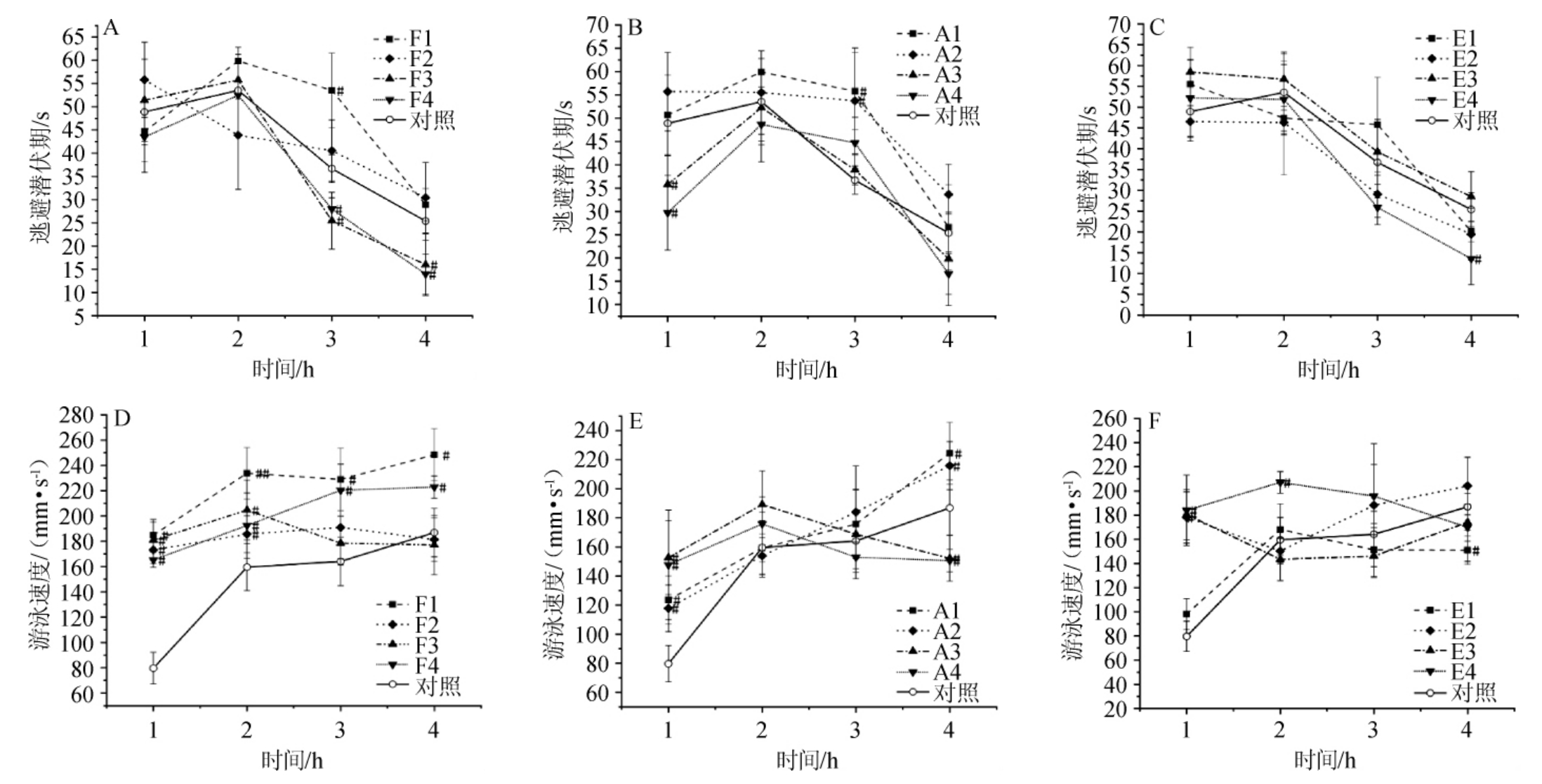
图1 不同醇酸酯比例对小鼠记忆能力和行为能力的影响
Fig.1 Effect of different alcohols,acids and esters ratios on memory ability and behavior ability of mice
与对照组比较,“#”表示差异显著(P<0.05),“##”表示差异极显著(P<0.01),“###”表示差异非常显著(P<0.001)。
由图1可知,在3 h和4 h时比较小鼠逃避潜伏期,F3组[(25.4±6.1)s、(16.0±6.7)s]和F4组[(28.0±2.4)s、(14.0±4.3)s]与对照组[(36.7±3.0)s、(25.4±4.1)s]、F1组[(53.6±8.0)s、(28.9±3.5)s]以及F2组[(40.6±6.6)s、(30.4±7.6)s]相比,均有显著缩短(P<0.05),因F3、F4组酒样异戊醇含量更高,说明异戊醇对小鼠认知记忆有明显的抑制作用。在1 h和2 h时整个不同比例杂醇实验组小鼠的游泳速度与对照组有显著增加(P<0.05),且在2 h时,F1组[(233.9±20.3)mm/s]与对照组[(159.5±18.6)mm/s]相比游泳速度极显著增加(P<0.01),因F1 组中杂醇含量最高,说明杂醇含量高有利于增强小鼠的运动能力;在3 h和4 h时比较游泳速度,F1组[(228.9±24.8)mm/s、(248.4±20.6)mm/s]、F4组[(220.3±20.6)mm/s、(222.9±8.7)mm/s]与对照组[(164.1±19.2)mm/s、(186.9±19.1)mm/s]、F2[(191.0±29.8)mm/s、(181.4±17.2)mm/s]以及F3组[(178.5±12.3)mm/s、(177.1±23.5)mm/s]相比均有显著增加(P<0.05),而F1、F4组的正丙醇含量较高,说明正丙醇对运动能力有刺激作用。杂醇在白酒中是不可或缺的香味物质,但会对中枢神经系统产生直接而持久的影响[16],从而导致负面强烈的醉酒效应,实验组与对照组相比游泳速度明显提高可能是受杂醇的影响,而高异戊醇含量组与其他组的比较则说明其对记忆能力有较强的负作用。
在不同比例酸的实验组中,在1 h时和3 h时对比逃避潜伏期,A3组[(35.8±6.2)s、(38.9±3.2)s]、A4组[(29.7±8.0)s、(44.7±5.5)s]与A1组[(50.7±8.6)s、(55.8±8.3)s]、A2组[(55.7±8.4)s、(53.7±11.3)s]相比显著缩短(P<0.05),说明乙酸对认知记忆有正向影响;而对比1 h时游泳速度,A3组[(152.6±25.4)mm/s)、A4组[(147.7±37.7)mm/s]不仅与对照组[(79.6±12.5)mm/s]有显著增加(P<0.05),与A1组[(123.5±16.4)mm/s]、A2组[(117.8±16.1)mm/s]比较也有显著增加(P<0.05),说明运动能力随乙酸含量的增加而增强。有报道称,代谢酶乙酰辅酶A合成酶2(acetyl-CoA synthase 2,ACSS2)会直接调节哺乳动物神经元的组蛋白乙酰化和空间记忆[27],ACSS2通过直接结合染色质将乙酸代谢与神经元基因调控联系起来,并确定了这种机制在海马记忆巩固中的重要作用。来自肝脏中酒精代谢的乙酸盐被运输到大脑,并很容易并入ACSS2依赖的组蛋白乙酰化,另外乙酸可以诱导在原代海马神经元中包括信号转导和学习记忆方面的基因表达[28],而实验结果也表明乙酸对记忆能力和行为能力方面的积极影响。
在不同比例酯的实验组中,对比逃逸潜伏期,只有E4组[(13.6±6.3)s]在4 h时与对照组[(25.4±4.1)s]有显著性缩短(P<0.05),而实验组之间没有显著性差异(P>0.05),说明此范围内的酯类对小鼠认知能力无明显影响;但对比在1 h和4 h时游泳速度,E1组[(98.2±12.6)mm/s、(151.0±11.6)mm/s]与其他组显著降低(P<0.05),说明高酯含量对小鼠的运动能力有负面作用。
2.3 醇酸酯比例对乙醇代谢酶及急性酒精肝损伤的影响
酒精代谢主要在肝脏中进行,而肝脏中主要由ADH为主,过氧化氢酶和微粒体酒精氧化系统为辅的三大途径代谢,酒后小鼠的乙醇代谢酶及急性酒精肝损伤结果见图2。
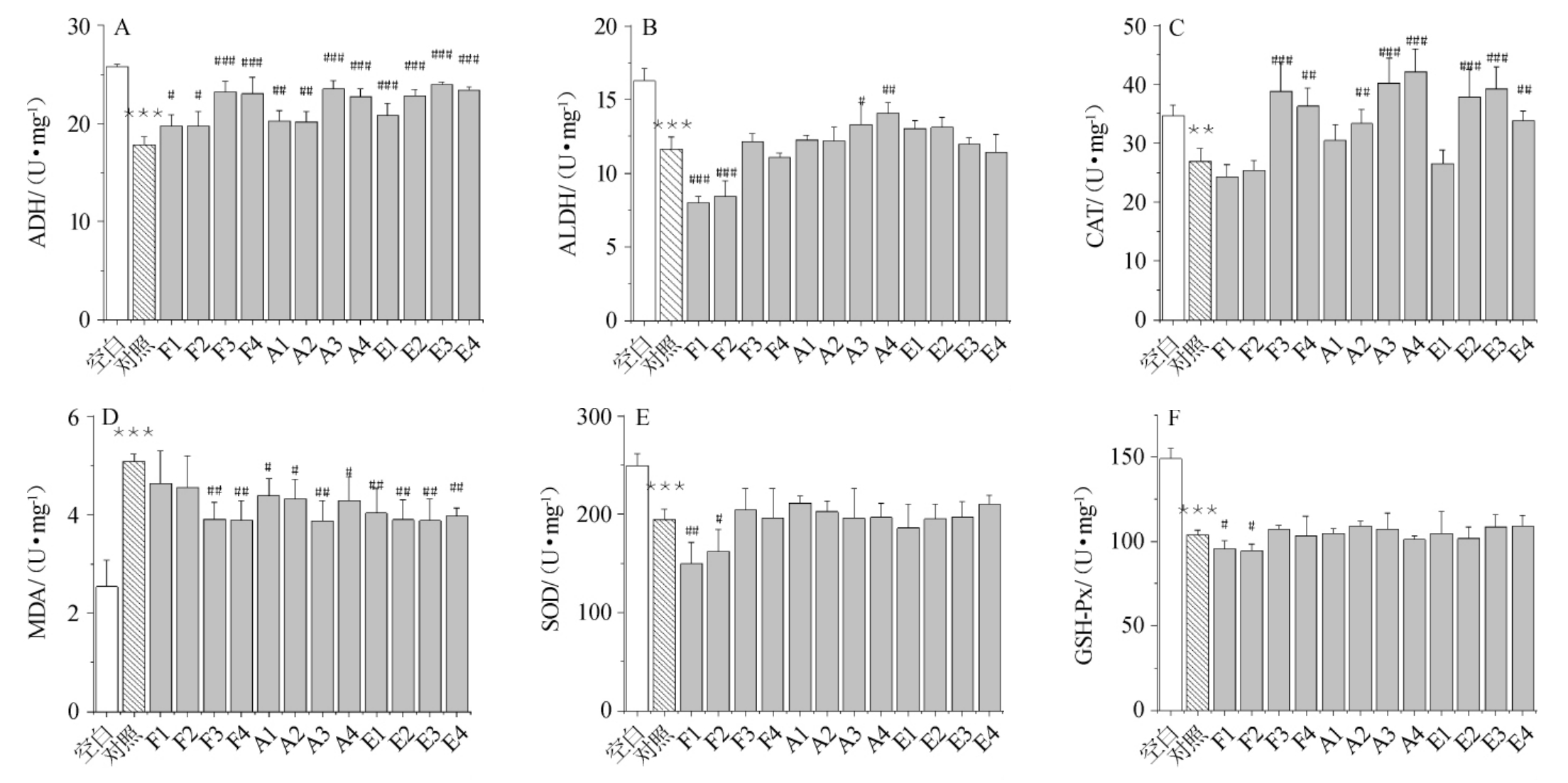
图2 不同醇酸酯比例下小鼠乙醇代谢酶和乙醇诱导氧化应激变化
Fig.2 Variation of ethanol metabolizing enzymes and ethanol induced oxidative stress under different alcohols,acids and esters ratios
与空白组比较,“*”表示差异显著(P<0.05),“**”表示差异极显著(P<0.01),“***”表示差异非常显著(P<0.001)。
与对照组比较,“#”表示差异显著(P<0.05),“##”表示差异极显著(P<0.01),“###”表示差异非常显著(P<0.001)。
在不同比例杂醇的实验组中,F3、F4与F1、F2相比在ADH、ALDH和CAT活性均有显著增强(P<0.05),表明异戊醇降低了乙醇代谢相关酶的活性,这与之前代谢参数结果一致。在不同比例酸的实验组中,A3、A4的ADH、ALDH和CAT活性与A1、A2的相比显著增强(P<0.05),说明乙酸提高了乙醇代谢相关酶的活性。在不同比例酯的实验组中,E1较其他组在ADH和CAT的酶活性低,高酯含量会降低ADH和CAT的酶活性。
乙醇代谢是一个剧烈的氧化还原过程,反应中会产生较多的活性氧簇(reactive oxygen species,ROS),ROS会进一步导致氧化应激和肝细胞损伤,MDA浓度是一个很好的反映脂质过氧化的程度指标,而抗氧化酶,如SOD、CAT等,在细胞抗氧化应激中起重要作用。F3、F4与F1、F2相比在MDA含量有显著减少(P<0.05),在SOD、GSH-Px活性有显著增强(P<0.05),说明异戊醇会加重乙醇诱导的脂质过氧化,降低SOD、GSH活性。而酸和酯组成的变化对乙醇代谢酶及急性酒精肝损伤不明显。
3 结论
根据市场上13种商品酒的主要成分及其比例配制出12种不同醇酸酯比例酒样进行小鼠实验,研究醇酸酯的比例对小鼠乙醇代谢、行为能力、记忆能力、乙醇代谢酶及急性酒精性肝损伤保护的影响。结果表明,过高的杂醇尤其是异戊醇含量会抑制乙醇脱氢酶和乙醛脱氢酶活性,从而影响乙醇在体内的代谢,同时也会降低小鼠记忆能力,因此应尽量控制杂醇油尤其是高分子量杂醇的含量。适度高浓度的乙酸有利于促进乙醇代谢,同时阻止其他组分对乙醇脱氢酶和乙醛脱氢酶活性的抑制作用,且会刺激小鼠记忆能力,显著降低潜伏逃脱时间,可适当增加其在白酒中的含量。酯比例的变化在实验中影响较小。该研究成果可为高质量白酒的生产提供有益指导。
[1]CHAUDHARY S,FORREST E H.Alcohol and the liver[J]. Medicine,2019,47(11):723-727.
[2]孙宝国,李贺贺,胡萧梅,等.健康白酒的发展趋势[J].中国食品学报,2016,16(8):1-6.
[3] YAN S,KHAMBU B,HONG H,et al.Autophagy,metabolism,and alcohol-related liver disease:Novel modulators and functions[J]. Int J Mol Sci,2019,20(20):5029.
[4] ZAKHARI S.Alcohol metabolism and epigenetics changes[J]. Alcohol Res,2013,35(1):6-16.
[5]郭学武,范恩帝,马冰涛,等.中国白酒中微量成分研究进展[J].食品科学,2020,41(11):267-276.
[6]霍嘉颖,黄明泉,孙宝国,等.中国白酒中功能因子研究进展[J].酿酒科技,2017(9):17-23.
[7]周金虎,管健,魏浩林,等.白酒中健康因子的研究进展[J].酿酒科技,2017(7):90-94.
[8]WU Z Q,TIAN X F,HE S G,et al.Evaluation of intoxicating effects of liquor products on drunken mice[J]. Medchemcomm,2017,8(1):122-129.
[9] JIA X,TIAN X F,HE S G,et al.Evaluating the intoxicating degree of liquor products with combinations of fusel alcohols,acids,and esters[J].Molecules,2018,23(6):1239.
[10]VERGIS N,ATKINSON S R,THURSZ M R.The future of therapy for alcoholic hepatitis-beyond corticosteroids[J]. J Hepatol,2019,70(4):785-787.
[11]REN T,MACKOWIAK B,LIN Y,et al.Hepatic injury and inflammation alter ethanol metabolism and drinking behavior[J].Food Chem Toxicol,2019,136:111070.
[12] HASEBA T,DUESTER G,SHIMIZUET A,et al. In vivo contribution of Class III alcohol dehydrogenase(ADH3)to alcohol metabolism through activation by cytoplasmic solution hydrophobicity[J]. Biochimica et Biophysica Acta (BBA)-Molecular Basis of Disease,2006,1762(3):276-283.
[13] PENEDA J,BAPTISTA A,LOPES J M.Interaction of the contents of alcoholic beverages in the promotion of liver damage [J].Acta Médica Portuguesa,1994,6(12):577-581.
[14] YOU M,ARTEEL G E.Effect of ethanol on lipid metabolism[J]. J Hepatol,2019,70(2):237-248.
[15]HORI H,FUJII W,HATANAKA Y,et al.Effects of fusel oil on animal hangover models[J].Alcohol Clin Exp Res,2010,27(8 Suppl):37S-41S.
[16] HOYT L R,ATHER J L,RANDALL M J,et al.Ethanol and other short-chain alcohols inhibit NLRP3 inflammasome activation through protein tyrosine phosphatase stimulation[J]. J Immunol,2016,197(4):1322-1334.
[17] SABRI R,GAETAN R,TOMMY M,et al.Hexanoic,octanoic and decanoic acids promote basal and insulin-induced phosphorylation of the Akt-mTOR axis and a balanced lipid metabolism in the HepG2 hepatoma cell line[J].Molecules,2018,23(9):2315.
[18]DINAN T G,CRYAN J F.The Microbiome-gut-brain axis in health and disease[J].Gastroenterol Clin N,2017,46(1):77-89.
[19]WANG B,LI L,JING F,et al.Effects of long-chain and medium-chain fatty acids on apoptosis and oxidative stress in human liver cells with steatosis[J].J Food Sci,2016,81(1-3):794-800.
[20] STILLING R M,DINAN T G,CRYAN J F.Microbial genes,brain &behaviour-epigenetic regulation of the gut-brain axis[J]. Genes Brain Behav,2014,13(1):69-86.
[21]CANANI R B,DI COSTANZO M,LEONE L,et al.Potential beneficial effects of butyrate in intestinal and extraintestinal diseases[J]. World J Gastroen,2011,17(12):1519-1528.
[22]SAMANTHA Y,NICOLE R,SUCHITA P,et al.Human gut bacteria as potent class I histone deacetylase inhibitors in vitro through production of butyric acid and valeric acid[J]. Plos One,2018,13(7):e0201073.
[23] KONDO T,KISHI M,FUSHIMI T,et al.Acetic acid upregulates the expression of genes for fatty acid oxidation enzymes in liver to suppress body fat accumulation[J].J Agr Food Chem,2009,57(13):5982-5986.
[24] SAKAKIBARA S,MURAKAMI R,TAKAHASHI M,et al.Vinegar intake enhances flow-mediated vasodilatation via upregulation of endothelial nitric oxide synthase activity[J].Biosci Biotechnol Biochem,2010,74(5):1055-1061.
[25] YOU M,MATSUMOTO M,PACOLD C M,et al.The role of AMPactivated protein kinase in the action of ethanol in the liver[J].Gastroenterology,2004,127(6):1798-1808.
[26]SAKAKIBARA S,YAMAUCHI T,OSHIMA Y,et al.Acetic acid activates hepatic AMPK and reduces hyperglycemia in diabetic KK-A(y)mice[J].Biochem Biophys Res Commun,2006,344(2):597-604.
[27] MEWS P,DONAHUE G,DRAKE A M,et al.Acetyl-CoA synthetase regulates histone acetylation and hippocampal memory[J].Nature,2017,546(7658):381-386.
[28] MEWS P,EGERVARI G,NATIVIO R,et al.Alcohol metabolism contributes to brain histone acetylation[J].Nature,2019,574(7780):717.