酱油酿造主要有高盐稀态和低盐固态两种工艺类型[1]。高盐稀态酱油通常以豆粕等蛋白质原料和炒小麦等淀粉质原料,经高温蒸煮变性,在曲霉分泌的酶系下进行酶解,以及细菌、酵母等微生物作用下长期发酵以形成风味鲜美、口感醇厚的调味品[2]。
在酱油发酵过程中常添加的鲁氏接合酵母(Zygosaccharomyces rouxii)是一株耐盐产醇酵母,菌落呈白色粘稠状,光学显微镜下观察呈梭状。鲁氏接合酵母具有较强的耐盐能力,是酱油发酵过程中醇类物质的主要代谢者,在代谢产生大量的高级醇、芳香杂醇类物质的同时,还能将糖类物质转化为多元醇和糖醇类物质[3]。研究进一步表明了鲁氏接合酵母代谢产生的乙醇、高级醇等醇类物质对形成酱油的风味有很重要的作用[4]。
随着传统发酵食品生产用菌产业的不断发展壮大及研究不断深入,发酵菌种自身的安全性也受到越来越多的关注。虽然鲁氏接合酵母作为传统菌种用于酱油发酵已有较长的历史,但对于它自身的安全性研究却涉及较少,实验室前期对酵母代谢物进行了分析发现无有害代谢物,由于部分酵母会裂解在发酵中的酱醪中,后随离心提取成成品酱油[5-6]。所以在前期实验基础上进行鲁式接合酵母的动物实验进一步进行安全评价。因此,该研究利用小鼠实验初步考察了鲁氏接合酵母的急性和亚慢性毒性,为传统发酵菌株鲁氏接合酵母的安全性评价提供了一定的依据。
1 材料与方法
1.1 材料与试剂
鲁氏接合酵母(Zygosaccharomyces rouxii)2.181:天津科技大学食品营养与安全国家重点实验室菌种保藏中心。
无特定病原体(specificpathogenfree,SPF)级昆明(KM)小鼠(雌雄各半,体质量20~22 g):购买于斯贝福(北京)生物技术有限公司。
氯化钠(分析纯):博欧特(天津)化工贸易有限公司;75%乙醇(分析纯)、肝素钠(分析纯)、酵母膏胨葡萄糖琼脂培养基:索莱宝科技(北京)有限公司。
1.2 仪器与设备
TD200020电子天平:天津天马衡基仪器有限公司;UTP-313分析天平:上海花潮电器有限公司;LS-B50L立式压力蒸汽灭菌锅:河北实验仪器厂;LRH-250-A生化培养箱:上海一恒仪器有限公司;L550离心机:湘仪离心机(湖南)仪器有限公司;1-14小型台式离心机:德国Sigma公司;无菌操作台:苏净集团安泰公司;BX51光学显微镜:日本SANYO公司;G50电动组织研磨器:Gospell Digital Technology有限公司。
1.3 方法
1.3.1 急性毒性实验
(1)实验动物
KM小鼠32只,雌雄各半,体质量20~22 g。
(2)给药剂量及分组
按照酱油人均消费量的1 000倍来计算,本次实验最大剂量为7.5×1010 CFU/g[7]。
将小鼠随机分4组,每组8只(雌雄各半),每日给药情况分别为对照组(N):生理盐水;低剂量组(L):7.5×109CFU/mL鲁氏接合酵母;中剂量组(M):3.75×1010 CFU/mL鲁氏接合酵母;高剂量组(H):7.5×1010 CFU/mL鲁氏接合酵母。剂量0.2 mL,连续给药7 d,记录小鼠的毒性反应和死亡情况,计算半数致死量(median lethal dose,LD50)。
(3)评价指标
记录小鼠体质量,采食量,隔12 h观察小鼠精神、状态等指标;解剖前称小鼠体质量,剖检时称心脏、肝脏、脾脏、肾脏和胸腺的湿质量,计算各组小鼠脏器系数[8],其计算公式如下:
(4)菌株易位实验
连续给药7 d后,处死并解剖小鼠,在无菌条件下,取小鼠的心脏、肝脏、脾脏、肾脏加入适量的无菌生理盐水,利用电动组织研磨器制成组织匀浆液。每组三个平行,取100 μL组织匀浆液分别涂布于YPD培养基上,30 ℃培养48 h,观察菌落生成情况[9]。若生长出鲁式接合酵母菌落即为发生菌株易位:若无,即为无菌株易位。
1.3.2 亚慢性实验
(1)实验动物
KM小鼠32只,雌雄各半,体质量20~22 g。
(2)给药剂量及分组
将小鼠随机分4组,每组8只,雌雄各半。对照组(N)给药生理盐水,实验组给予鲁氏接合酵母,按照低(L)、中(M)、高(H)浓度分别设置为7.5×108 CFU/mL、3.75×109 CFU/mL、7.5×109 CFU/mL。连续灌胃30 d,每日剂量0.2 mL,每5 d称质量1次。
(3)检测项目与方法
①普通指标:每天观察每只动物的生理反应及死亡情况,记录中毒症状、持续时间和恢复期等;对死亡小鼠尸检,并记录相关情况,若肉眼变化不明显应做病理切片[10]。
②饲料食用量和饮水量:每天称饲料质量,计算对照组及低中高剂量组每组每天小鼠的饮食量及饮水量。
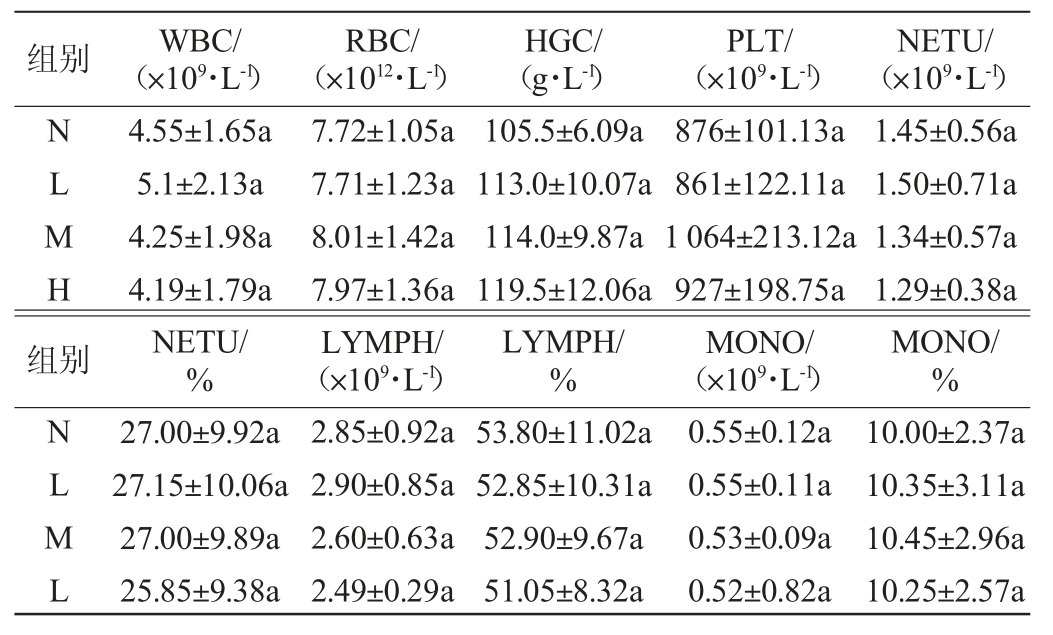
③血常规指标:禁食禁水12 h后,腹股动脉取0.5 mL左右血液,抗凝血处理后24 h内,使用血液细胞分析仪检测白细胞数(white blood cell,WBC)、红细胞数(red blood cell,RBC)、血红蛋白数(hemoglobin,HGB)、血小板数(platelet,PLT)、单核细胞数(monocyte,MONO)、中性粒细胞数(neutrophil,NETU)、淋巴细胞数(lymphocyte,LYMPH),剩余血液留用[11]。
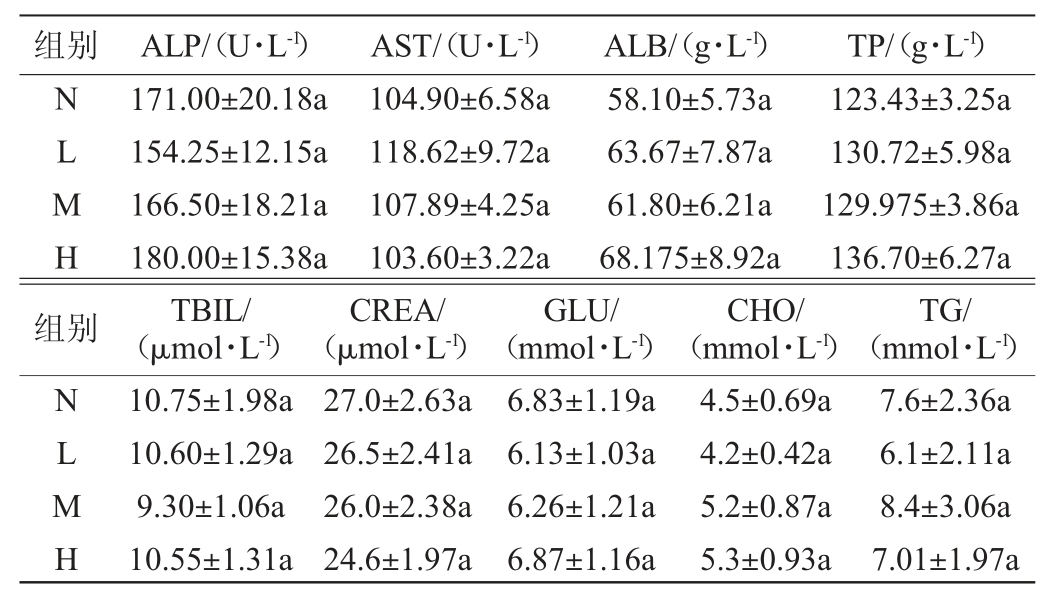
④血生化指标:抗凝处理血液1 500 r/min离心制备血清,用血液生化分析仪检测总蛋白(total protein,TP)、肌醇(creatinine,CREA)、谷丙转氨酶(alanine transaminase,ALT)、碱性磷酸酶(alkaline phosphatase,ALP)、谷草转氨酶(aspartate transaminase,AST)、白蛋白(albumin,ALB)、总胆红素(total bilirubin,TBIL)、葡萄糖(glucose,GLU)、总胆固醇(total cholesterol,CHO)等含量[12]。
⑤机体指标:解剖后的小鼠,取0.1 g肝脏,使用还原型谷胱甘肽检测试剂盒测定谷胱甘肽(glutathione,GSH)的浓度[13];使用丙二醛试剂盒检测(malonic dialdehyde,MDA)浓度[14]。
⑥脏器系数:对断颈处死的小鼠进行剖检,记录有异常的脏器,计算各脏器系数。
⑦脏器组织观察:取对照组、高剂量组的心脏、脾脏、肝脏、肾脏,用福尔马林固定、再进行脱水、包埋、横切、伊红染色、封固、最后显微镜观察[15]。
1.3.3 数据统计与分析
用Excel 2010整理实验数据,Stats进行统计分析,用单因素方差分析组间差异,结果以“平均值±标准差”来表示[16-19]。
2 结果与分析
2.1 急性毒性实验
2.1.1 体质量变化
不同剂量的鲁氏接合酵母菌对小鼠体质量的影响见表1。由表1可知,从体质量增长率来看,各分组之间差异不显著(P>0.05),表明鲁氏接合酵母菌无急毒性[20]。给药前(0 d)和剖检前(7 d)称量小鼠体质量,各分组间小鼠体质量差异不显著(P>0.05)。低、中、高剂量组的体质量增长率均高于对照组(P>0.05)。结果表明,小鼠在给药前后精神正常、毛色正常、饮食、饮水正常、自主活动、排泄无异常及行为表现正常,未出现中毒和死亡现象。本实验未测出鲁氏接合酵母的LD50。实验前和实验结束时,分别对低、中、高剂量组和对照组实验动物进行眼部检查未发现变化。
表1 不同剂量的鲁氏接合酵母对小鼠体质量的影响
Table 1 Effect of different doses of Zygosaccharomyces rouxii on the body weight of mice
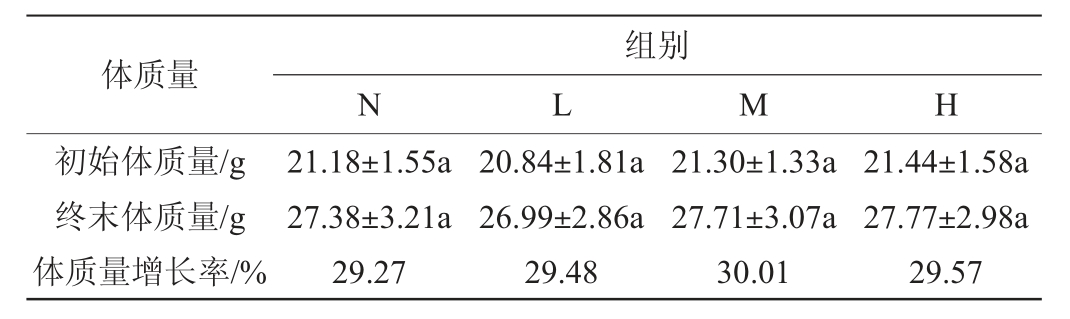
注:不同字母代表差异显著(P<0.05),下同。
2.1.2 脏器系数变化
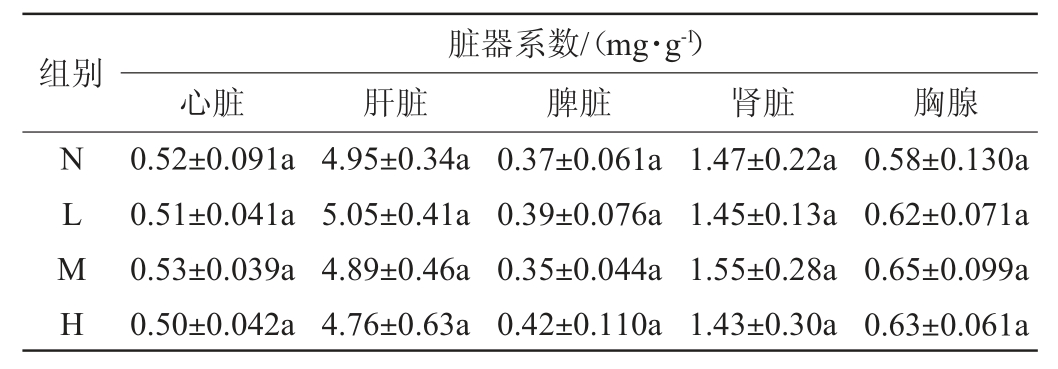
不同剂量的鲁氏接合酵母对小鼠脏器系数的影响见表2。由表2可知,解剖小鼠,观察各主要脏器,未出现病理变化,由各组小数脏器系数可知,各分组间小鼠脏器系数差异不显著(P>0.05)。
表2 不同剂量的鲁氏接合酵母对小鼠脏器系数的影响
Table 2 Effect of different doses of Zygosaccharomyces rouxii on the organ coefficient of mice
2.1.3 菌株易位实验
菌株易位是指胃肠道内活菌透过黏膜,进入无菌的组织或器官。不同剂量菌株对各器官匀浆液的易位实验结果见图1。由图1可知,涂布小鼠心脏、肝脏、肾脏、脾脏组织匀浆液的培养基未见菌落长出,表示饲喂不同剂量的鲁氏接合酵母菌均未发生菌株易位现象[21-23]。
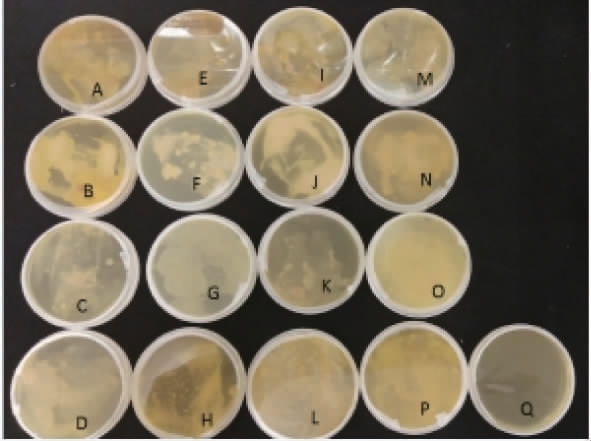
图1 菌株易位实验结果
Fig.1 Results of strain translocation experiments
A~D、E~H、I~L、M~P分别为对照组、低、中、高剂量组的心脏、肝脏、脾脏、肾脏匀浆液;Q为生理盐水。
2.2 亚慢性毒性实验
2.2.1 体质量变化
经过30 d连续喂养实验,各组小鼠在实验期内未观察到任何中毒症状和异常反应,小鼠的一般体征、行为、活动、毛发、粪便均无不良反应,未出现死亡现象。各组小鼠体质量变化情况见图2。由图2可知,各组小鼠体质量持续增长,且差异不明显,表明不同剂量的鲁氏接合酵母不会对小鼠的表观特征和生长造成异常反应。
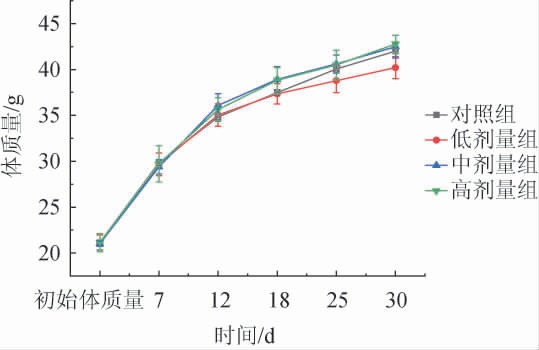
图2 小鼠体质量变化情况
Fig.2 Changes of body mass of mice
2.2.2 饲料食用量及饮水量
不同剂量鲁氏接合酵母菌对小鼠每天饮食量及饮水量影响的测定结果见表3。由表3可知,各组小鼠在亚慢性实验饲养期间,低中高剂量组与对照组相比,每组小鼠每天的饮食量及饮水量并没有明显差异(P>0.05)。说明不同剂量鲁氏接合酵母对小鼠的饮食饮水量无明显影响。
表3 不同剂量鲁氏接合酵母对小鼠每天饮食量及饮水量的影响
Table 3 Effect of different doses of Zygosaccharomyces rouxii on the daily diet and water intake of mice

2.2.3 血常规指标
机体在正常情况下,血液中细胞的数量和比例在相对稳定的范围内,不同的细胞在机体中承担着不同的功能。血液在机体内由循环系统规律地流经全身,与机体内不同组织和器官紧密接触,来调节机体内渗透和酸碱平衡及其他生理活动,并维持机体内外环境平衡。通过检测血常规指标不仅了解到血液系统的生理和病理变化,还能掌握机体器官的病理变化[24]。不同剂量的鲁氏接合酵母菌对小鼠血常规指标的影响见表4。由表4可知,在饲养结束之后,检测小鼠血液常规指标,各分组间小鼠的血常规各指标值没有显著差异(P>0.05)。表示饲喂不同剂量鲁氏接合酵母对小鼠血液学指标没有明显影响。
表4 不同剂量鲁氏接合酵母对小鼠血常规指标的影响
Table 4 Effects of different doses of Zygosaccharomyces rouxii on blood routine indexes in mice
2.2.4 血生化指标
通过检测血生化指标可以了解到菌株对机体脏器功能是否有影响,还能掌握菌株选择作用的靶器官和系统,为病理学研究提供线索,亦阐明菌株毒性作用机理提供依据。TP、ALP、AST等是检测机体肝功重要指标,CHO、GLU等是检测血糖血酯重要指标、CREA是检测肾功重要指标[25],不同剂量鲁氏接合酵母菌对小鼠血生化指标的影响见表5。由表5可知,不同剂量的鲁氏接合酵母对小鼠血生化指标影响不显著(P>0.05)。因此,饲喂不同剂量鲁氏接合酵母对小鼠肝功、肾功和血糖血脂无显著影响。
表5 不同剂量鲁氏接合酵母对小鼠血生化指标的影响
Table 5 Effect of different doses of Zygosaccharomyces rouxii on blood biochemical indexes in mice
2.2.5 机体指标
氧自由基作用于酯类的不饱和脂肪酸产生,酯质过氧化物逐渐分解为包括丙二醛(malonic dialdehyde,MDA)在内的一系列复杂的化合物,通过检测MDA含量可以了解自由基对机体细胞的攻击程度。还原型谷胱甘肽在动物肝脏中含量较为丰富,其主要依靠半胱氨酸侧链基团上的一个活泼的巯基发挥的抗氧化能力和清除自由基能力[26]。临床上主要应用GSH作为保肝的重要药物成分[27]。不同剂量的鲁氏酵接合母对肝组织MDA及GSH含量的影响见图3。由图3可知,与对照组相比,灌胃不同剂量的鲁氏接合酵母对小鼠肝组织中MDA和GSH含量无显著影响(P>0.05)。鲁氏接合酵母对小鼠细胞损伤、肝脏损伤无明显影响。
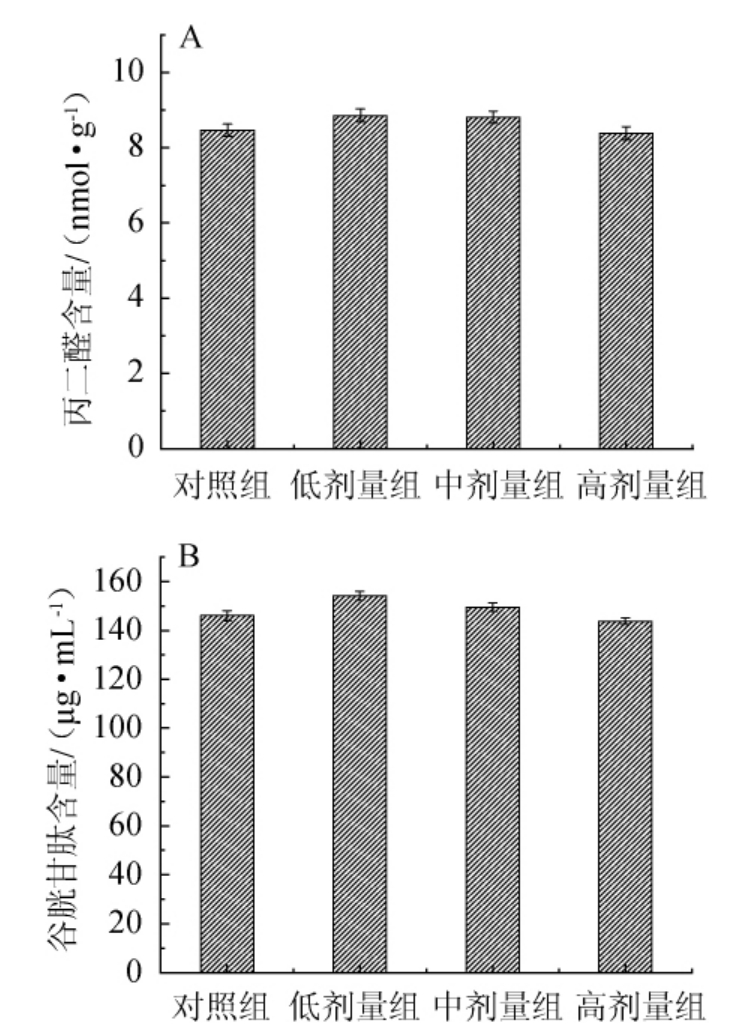
图3 不同剂量鲁氏接合酵母对肝组织丙二醛含量(A)及谷胱甘肽含量(B)的影响
Fig.3 Effects of different doses of Zygosaccharomyces rouxii on malonic dialdehyde content (A) and glutathione content (B)in liver tissues
2.2.6 脏器系数
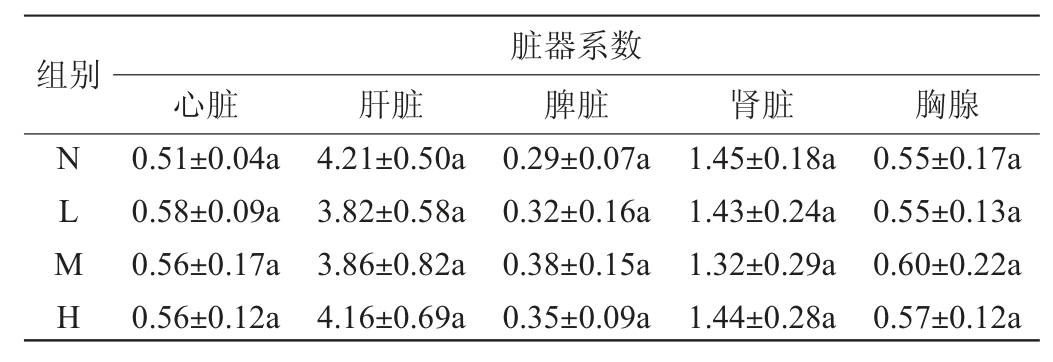
脏器系数是脏器湿质量与机体体质量的比值,反映机体健康状况的指标,也是提供受试药物靶器官的指标。实验动物的脏器受毒害作用后,发生病理性变化,可引起脏器质量改变。不同剂量的鲁氏接合酵母菌对小鼠脏器系数的影响见表6。由表6可知,各分组间动物的脏器系数差异并不显著(P>0.05)。表明灌胃鲁氏酵母对小鼠脏器无明显影响。
表6 不同剂量鲁氏接合酵母对小鼠脏器系数的影响
Table 6 Effect of different doses of Zygosaccharomyces rouxii on the organ indexes of mice
2.2.7 组织切片染色结果
各组小鼠的心、肝、脾、肾的组织切片染色结果见图4。由图4可知,与对照组相比,连续灌胃30 d的鲁氏接合酵母的高剂量组并没有引起心、肝、脾和肾组织的病理变化。心肌纤维排列整齐,核呈卵圆形居中。肝细胞正常,汇管区无异常。脾脏的红髓和白髓正常。肾小球、肾小管及间质无病理变化。因此,一定剂量范围内的鲁氏接合酵母对小鼠没有明显的毒副作用。
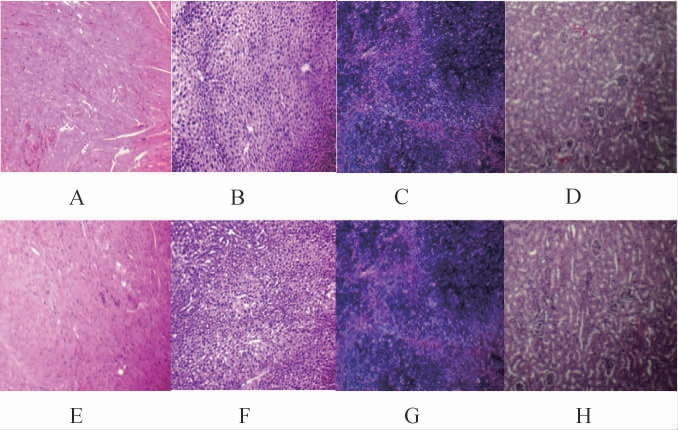
图4 小鼠脏器组织切片染色结果
Fig.4 Staining results of mouse viscera organ tissue section
A~D为对照组,E~H为高剂量组的心、肝、脾、肾的组织切片(10×)。
3 结论
该实验以酱油发酵用菌鲁氏接合酵母为研究对象,通过小鼠急性和亚慢性毒性实验来评价菌株的安全性。急性毒性实验结果表明,在一定的浓度范围内,未测出鲁氏接合酵母的LD50,从体质量增重率和脏器系数来看,各组间无显著差异(P>0.05),无菌株易位现象。亚慢性毒性实验结果表明各组小鼠在实验期内未观察到任何中毒症状和明显异常反应,小鼠的一般体征、行为、饮食、粪便无不良现象,各组体质量正常增长,与对照组相比,低、中、高剂量组的一般指标、血常规指标、血生化指标及机体指标无明显差异(P>0.05)。与对照组相比,高剂量组主要脏器组织无明显病理变化。实验结果表明在一定的剂量范围内鲁氏接合酵母对小鼠没有明显的毒副作用。该研究为传统发酵菌种的安全性评价提供一定的依据。
[1]曹宝忠.改进低盐固态发酵酱油生产技术提高产品品质[J].中国酿造,2011,30(1):155-159.
[2]高听明,董修涛,陈仕伟.基于改善酱油风味的微生物及工艺研究[J].中国食品,2021(13):132.
[3]张珊.耐盐酵母的添加对高盐稀态酱油的影响[D].天津:天津科技大学,2018.
[4]方冠宇,姜佳丽,蒋予箭.多菌混合发酵对酱油的风味物质形成及感官指标的影响[J].中国食品学报,2019,19(9):154-163.
[5]刘爽,张倩,杜船,等.酱油发酵用菌鲁氏接合酵母的安全性[J].食品与发酵工业,2021,47(3):66-71.
[6]张丽.高盐稀态酱油发酵过程中添加酵母的研究[D].贵阳:贵州大学,2019.
[7]刘浩宇.酱油发展现状及安全性分析[J].北京城市学院学报,2008(4):91-95.
[8]DUTTA A,DAHIYA A,PRAKASH A,et al.Acute toxicity of diallyl sulfide derived from Allium sativum(garlic)in mice and its possible mechanisms[J].Phytomedicine Plus,2021,1(3):10084.
[9]郭艳,林黎.鱼油姜黄提取物急性毒性和亚急性毒性实验研究[J].食品与发酵科技,2021,57(2):115-118,165.
[10]YANG H,JIA X D.Safety evaluation of Se-methylselenocysteine as nutritional selenium supplement:acute toxicity,genotoxicity and subchronic toxicity[J].Regulat Toxicol Pharmacol,2014,70(3):720-727.
[11]蔡小艳,赖志强,王士长,等.山毛豆对小白鼠的亚慢性毒性试验研究[J].中国畜牧兽医,2010,37(10):39-42.
[12]SASONGKO H,SUGIANTORO R S W,ADVAITA N,et al.Acute oral toxicity test of eel(Anguilla bicolor)oil in mice liver and kidney cells[J].J Physics,2021,1912(1):012046.
[13]马吉瑶,邹晓,郑程远,等.小米酒对小鼠血清中相关抗氧化酶活性的影响[J].食品研究与开发,2021,42(15):15-19.
[14]王雪芹,林海君,鞠世影,等.两株粪肠球菌的安全性评价[J].食品工业科技,2014,35(8):166-169,175.
[15]朱福余,袁暾,张杰,等.含植入物不脱钙骨组织病理切片技术在骨组织形态学研究中的应用[J].医疗装备,2020,33(19):30-34.
[16]郭艳,王睿,蒋中仁.保健酒急性毒性和亚急性毒性实验研究[J].酿酒科技,2021(4):37-41,47.
[17]SHANG X F,MIAO X L,DAI L X,et al.Acaricidal activity of strophanthidin derivatives against Psoroptes cuniculi and their inhibitory effect on Na+-K+-ATPase[J].Veterin Parasitol,2021,296:109498.
[18]付鹤,王纯洁,敖日格乐,等.蒙兽药巴特尔-7的急性和亚慢性毒理学研究[J].饲料研究,2021,44(10):64-68.
[19]王勇,张志勇,张炯怡,等.白及清肺养胃口服液经口给药小鼠急性毒性试验研究[J].食品安全导刊,2021(16):70-72.
[20]WEI S M.Characterization of tea tree oil nanoemulsion and its acute and subchronic toxicity[J]. Regulat Toxicol Pharmacol,2021,18:104999-104999.
[21]宋静颐,张明,刘松玲,等.副干酪乳杆菌L9安全性评价[J].中国奶牛,2015(21):27-31.
[22]王景会,李达,姜媛媛,等.枯草芽孢杆菌JAASB4的安全性评价[J].吉林农业科学,2015,40(5):102-103,112.
[23]SICURO B,PASTORINO P,BARBERO R,et al.Prevalence and antibiotic sensitivity of bacteria isolated from imported ornamental fish in Italy:A translocation of resistant strains?[J].Prevent Veterin Med,2020,175:104880.
[24]尤鑫.探讨健康儿童静脉血与末梢血血常规和网织红细胞相关参数检测结果的差异[J].临床研究,2021,29(7):133-135.
[25]程乐宁.肾病综合征患者血清β2-MG、肾功能指标、凝血功能指标测定及其相关性分析[J].四川解剖学杂志,2019,27(4):10-11.
[26]王家传,余学问,徐华,等.丹红注射液改善神经干细胞移植治疗脑缺血损伤效果的机制研究[J].器官移植,2021,12(4):428-435.
[27]葛炜炜,曹刚,吴育,等.还原型谷胱甘肽对酒精性脂肪肝斑马鱼的保肝作用研究[J].药物评价研究,2021,44(8):1594-1599.