白酒属于世界六大蒸馏酒之一,是我国特有的传统酒精饮料,已经有数千年的文化历史[1]。白酒文化的起源可以追溯到龙山文化时期,其多种微生物自然接种、长时间、开放式的固态发酵独特工艺,造就了我国白酒不同于西方蒸馏酒纯种液态发酵的风格特征[2]。新中国成立后,白酒产业得到党和政府的高度重视,从提高产量、质量,改进生产工艺与设备等方面组织了多次技术攻关,取得了丰硕成果。如20世纪60年代后的白酒微生物技术以及后来的现代微生物技术[3-4];20世纪70-80年代的白酒机械化和低度白酒生产技术[5];20世纪90年代的固液结合白酒生产技术[6];21世纪初的“中国白酒169计划”(白酒风味及其微生物新技术)、“中国白酒158计划”(白酒机械化、自动化和智能化)和“中国白酒3C计划”(品质诚实、服务诚心、产业诚信)[7]。这一系列的研究,使我国白酒产量从1949年的10.4万kL提高到2017年的1 200万kL;产值近6 000亿元,约占国内生产总值的0.5%左右。
随着白酒产业的迅速发展,我国对白酒产品的质量也提出了更高的要求。其中白酒生产全过程中的安全风险物质是衡量白酒质量安全的关键指标,一般将其分为外源性和内源性两类[8]。内源性风险物质是指白酒在酿造发酵过程中生成的有害副产物,主要包括氨基甲酸乙酯(ethyl carbamate,EC)、氰化物、甲醇和生物胺等,其特点是无法完全避免,只能在了解物质发酵生成机理的基础上尽量减少白酒生产过程中相关副产物的产生,并控制该类副产物由原酒迁移到成品酒中的含量,从而降低内源性风险物质对人体健康的潜在危害[9]。
氨基甲酸乙酯(EC)俗称尿烷、乙基尿烷,是酒精饮料(白酒、葡萄酒、啤酒、清酒、黄酒等)在生产和贮存过程中产生的一种天然副产物[10-11]。在日常生活中,酒精饮料是人体直接摄入EC的重要来源。(联合国)食品添加剂法规委员会(Codex Committee on Food Additive,CCFA)指出[12],人体从酒精饮品中摄入的EC含量平均为65 ng/(kg·d),约为通过食物摄入量的近5倍。EC在2007年已被世界卫生组织国际癌症研究机构(International Agency for Research on Cancer,IARC)归为2A类致癌物[13]。可见,饮料酒既是大多数人摄入EC最主要的途径,也是危害人体健康的EC的最直接来源。发酵和蒸馏是白酒酿造的两个重要环节[14],此前已有大量关于黄酒或葡萄原酒以及成品酒中EC含量的研究报道,发现影响EC含量的因素是复杂多样的,其中酿造的环境因素被认为是影响EC含量的主要原因[15-16]。随着研究的深入,越来越多的研究者发现微生物也是影响酒中EC含量的不可忽视的因素[17]。系统的研究中国白酒发酵过程中EC形成原因对我国白酒的饮用安全性以及白酒产业的可持续健康发展是有利的。因此本研究以浓香型白酒发酵糟醅为主要研究对象,持续监测发酵过程中的EC含量,环境因子以及微生物的群落变化,以确定浓香型白酒发酵过程中理化因素及微生物与EC含量的关系,为探索控制白酒中EC含量的措施提供参考数据。
1 材料与方法
1.1 材料与试剂
酒醅样本:中国四川省某知名白酒企业随机选取三个平行窖池,分别于0 d、7 d、15 d、25 d、45 d、70 d、95 d这7个酒糟发酵节点,参照GUAN T W等[18]的方法,在窖池上、中层等距离取样,每个窖池共6个平行样,每个发酵时间节点样本由18个样本混合均匀而成。采用无菌袋运输样本回实验室,4 ℃冰箱保存备用。
实验试剂均为国产分析纯。
1.2 仪器与设备
PHS-320酸度计:上海仪电科学仪器有限公司;BZF-50真空干燥箱:上海博讯实业有限公司;BSA224S-CW万分之一天平:赛多利斯科学仪器有限公司;2020NX气相色谱-质谱联用仪(gas chromatography-mass spectrometry,GC-MS):日本岛津公司;PowerSoil脱氧核糖核酸(deoxyribonucleic acid,DNA)Isolation Kit试剂盒:上海生工生物工程股份有限公司;聚合酶链式反应(polymerasechain reaction,PCR)Purification Kit试剂盒:赛默飞世尔科技有限公司。
1.3 方法
1.3.1 氨基甲酸乙酯含量测定
参照参考文献[15]的方法测定酒醅的EC含量:将20 g酒醅样品与100 μL 1.0 g/L的d5-EC混匀,静置过夜。次日添加蒸馏水稀释混匀,超声(功率60 W,超声频率40 kHz)浸提1 h后离心。取浸提液20 μL与0.1 g氯化钠混合到离心管中。3 000 r/min旋转1 min后,将混合物倒入硅藻土固相萃取柱中静置10 min。使用10 mL正己烷进行淋洗后,用10 mL 5%乙酸乙酯-乙醚溶液以约1 mL/min流速进行洗脱。收集的洗脱液经过滤、无水硫酸钠脱水,收集于10 mL刻度试管中。室温条件下用氮气缓缓吹至约0.5 mL,用甲醇定容至1 mL制成测定液,供GC-MS分析。进样口温度为200 ℃,氦气(He)流速为1 mL/min。
MS传输线温度为250 ℃,MS源温度为230 ℃。选择m/z 64(氨基甲酸酯-d5)和m/z 62(氨基甲酸酯-d5)进行定量分析。EC监测离子为m/z 44、m/z 62、m/z 89,内标监测离子为m/z 44、m/z 64、m/z 76。
1.3.2 环境因子的动态变化
(1)温度的测定
采用探针式温度计检测窖池中层酒糟的温度,每个发酵节点在同一时段记录三个平行窖池的温度数据。
(2)水分的测定
在每个发酵节点称取约10 g酒醅样品(m),读取质量m1,在105 ℃条件下将样品烘干至质量恒定,随后冷却至室温,再次称质量(m2)。水分含量计算公式如下:
(3)pH的测定
在每个发酵节点准确称取酒醅样本10 g与50 mL去离子水混合均匀,静置后用pH计测定酒醅样品的pH值。
(4)乙醇含量的测定
在每个发酵节点准确称取酒醅50g置于500mL圆底烧瓶中,加入150 mL蒸馏水,加热取馏出液。按照GB 5009.225—2016《食品安全国家标准酒中乙醇浓度的测定》,检测馏出液的酒精度。
1.3.3 发酵过程中微生物分析
准确称取酒醅样品8 g,采用PowerSoil DNA Isolation Kit试剂盒提取酒醅DNA,具体操作按说明书使用。PCR所用的引物为515F/806R以及ITS5-1737F/ITS2-2043R。PCR扩增程序为:94 ℃预变性5 min;(94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s)32 个循环;72 ℃保持5 min。PCR产物采用PCR Purification Kit试剂盒进行纯化[19]。纯化后的PCR产物由上海生物工程股份有限公司完成高通量测序。所有原始数据保存在美国国家生物技术信息中心(national center for biotechnology information,NCBI)数据库,登陆号为PRJNA 622890。原始数据通过Qiime-pipeline(v.1.8.0)进行处理。选取置信度为80%的阈值对每个操作分类单元(operational taxonomic unit,OTU)的代表序列进行分类,得到每个OTU的属水平分类。
2 结果与分析
2.1 浓香型白酒发酵过程中EC含量变化
浓香型白酒中EC含量在发酵期间的变化趋势见图1。
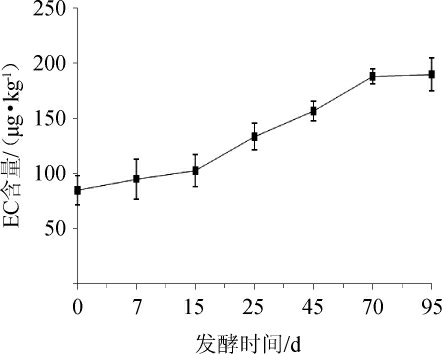
图1 浓香型白酒发酵过程中氨基甲酸乙酯含量变化
Fig.1 Changes of ethyl carbamate content during strong-flavor Baijiu fermentation
由图1可知,EC含量随着发酵时间的延长呈先缓升后快速增加,再达到稳定的趋势,EC的积累主要发生在白酒发酵的中后期。发酵前15 d,EC积累速率较慢,EC含量从85.12 μg/kg增至102.78 μg/kg;15 d之后,EC生成速率逐渐加快;至发酵70 d时,酒醅中EC含量达到188.34 μg/kg;此后(70~95 d)EC含量维持在相对稳定的水平。此结果与梁晨[20]通过对酱香型白酒和芝麻香型白酒发酵30 d的追踪得出的EC含量总体变化趋势一致。
2.2 浓香型白酒发酵期间环境因子变化分析
浓香型白酒发酵期间温度和pH变化见图2,水分和乙醇含量的变化见图3。
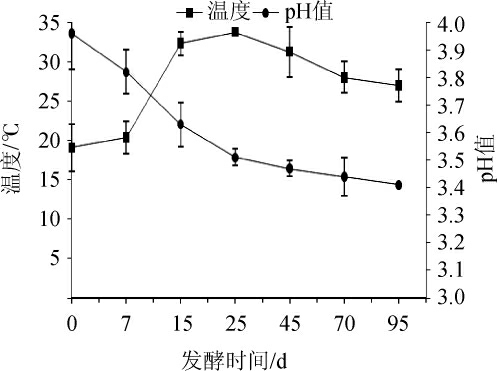
图2 浓香型白酒发酵过程中温度和pH值的变化
Fig.2 Changes of temperature and pH during strong-flavor Baijiu fermentation
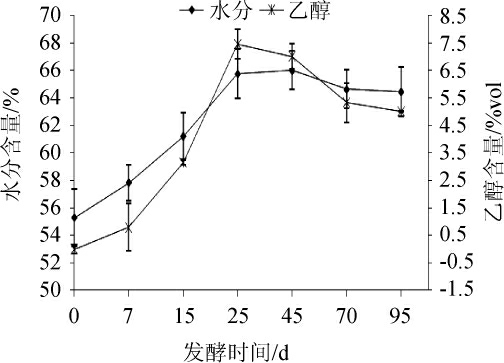
图3 浓香型白酒发酵过程中水分和乙醇含量的变化
Fig.3 Changes of moisture and ethanol content during strong-flavor Baijiu fermentation
由图2可知,0~7 d是发酵微生物初适应阶段,在此过程中温度变化缓慢,从19.09 ℃升至20.38 ℃;随后发酵体系开始迅速升温,在发酵第25天时温度达到最高(33.76 ℃);在发酵的中后期(25~95 d),表现出降温趋势,但温度仍高于初始发酵期间,最终(95 d)温度为26.99 ℃。浓香型白酒发酵期间pH值呈现整体下降趋势。在发酵0~25 d,pH值下降速率较快,从pH3.96降至3.51;此后,pH值下降速率缓慢,至发酵结束时,pH值为3.34。
由图3可知,浓香型白酒发酵过程中水分含量在发酵前期(0~25 d)呈稳定上升趋势,在第25天时,水分含量为65.78%;之后水分含量维持基本恒定状态,到发酵结束时,水分含量为64%。浓香型白酒发酵过程中乙醇含量变化趋势与水分含量基本一致。发酵前25 d乙醇含量不断提高,在第25天达到最大值,为7.46%vol;此后乙醇含量呈下降趋势直至发酵结束(5.02%vol),数量变值在2%以内。
2.3 浓香型白酒发酵期间微生物群落分析
本研究采用高通量测序技术对浓香型白酒发酵过程中细菌、真菌类群构成进行了揭示,并对其在属水平上的注释结果进行了分析,结果见图4、图5。
浓香型白酒发酵中属水平上丰度较高的细菌群落分布见图4。由图4可知,与数据库比较后,10个主要的高丰度细菌群落分别为乳杆菌属(Lactobacillus)、魏斯氏菌属(Weissella)、芽孢杆菌属(Bacillus)、片球菌属(Pediococcus)、科萨克氏菌属(Kosakonia)、葡萄球菌属(Staphylococcus)、泛菌属(Pantoea)、发酵单胞菌属(Fermentimonas)以及未被培养的厌氧绳菌属(Anaerolineaceae)和拟杆菌属(Bac teroides)。乳杆菌属是整个发酵期间的优势菌属,占比为5.14%~87.79%。并且随着发酵时间的增加,Lactobacillus逐渐占据绝对主导地位。此外,魏斯氏菌属在发酵前15 d占据优势(2.06~12.08%),此后相对丰度持续减小,到发酵后期仅为0.34%。芽孢杆菌属、片球菌属、科萨克氏菌属以及泛菌属在白酒发酵期间的相对丰度变化趋势与Weissella基本一致,随着发酵的进行,相对丰度都持续下降。值得注意的是,葡萄球菌属在未发酵时(D0),其相对丰度占比(5.57%)较高,发酵期间丰度低(0.13%~0.79%),而发酵末期丰度有较大提升,达到2.18%。
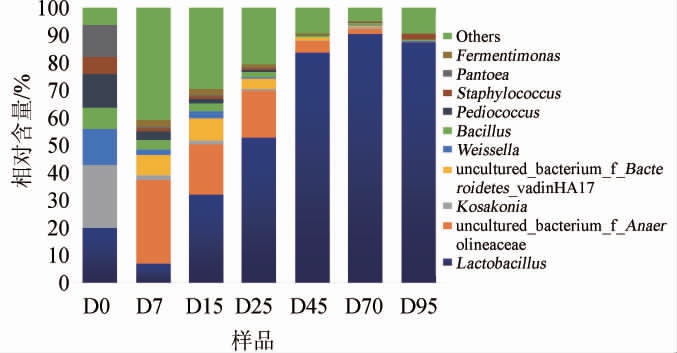
图4 浓香型白酒发酵过程中优势细菌属相对含量
Fig.4 Relative contents of dominant bacteria genus during strongflavor Baijiu fermentation
由图5可知,与数据库对比发现,浓香型白酒发酵过程中有7个主要的真菌群相对丰度较高。包括哈萨克斯坦酵母属(Kazachstania)、嗜热子囊菌属(Thermoascus)、曲霉属(Aspergillus)、酿酒酵母属(Saccharomyces)、嗜热酵母属(Thermomyces)、德巴利酵母属(Debaryomyces)和未分类的属。其中哈萨克斯坦酵母属占比为0.01%~74%,但是随着发酵时间的延长其相对丰度呈持续下降的趋势。嗜热子囊菌属以及曲霉属的相对丰度都随着发酵的进行有所减少。此外,嗜热酵母属和德巴利酵母属几乎只存在于发酵末期。酿酒酵母属(0~24%)在整个发酵期间也占据优势地位,并且在发酵中期其相对丰度呈上升趋势。
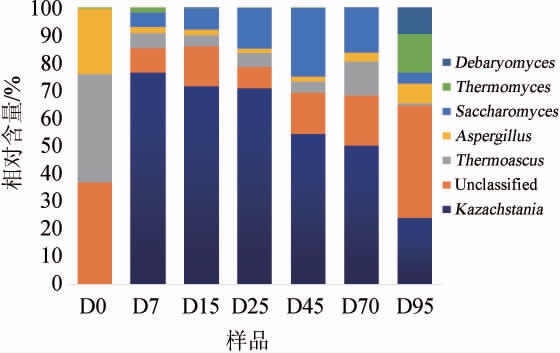
图5 浓香型白酒发酵过程中优势真菌属相对含量
Fig.5 Relative content of dominant fungi genus during strong-flavor Baijiu fermentation
2.4 EC含量与发酵环境因子的相关性分析
为揭示环境因子对发酵期间EC含量的影响,利用Pearson量化两者之间的相关性,结果见图6。由图6可知,EC含量的变化主要由pH以及水分含量驱动,两者与EC含量的相关性系数分别为0.9和0.83,水分含量呈正相关,而pH值呈负相关。相比之下,温度和乙醇含量对EC的形成起到一定的促进作用,但效果并不显著,相关系数分别为0.48和0.71。
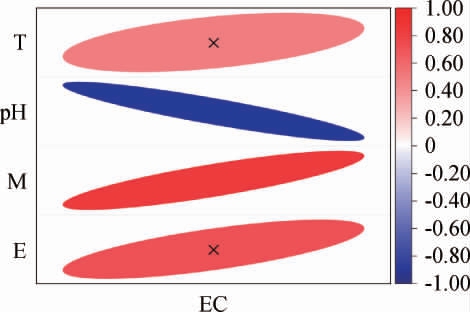
图6 浓香型白酒发酵过程中环境因子对氨基甲酸乙酯含量的影响
Fig.6 Effects of environmental factors on ethyl carbamate content during strong-flavor Baijiu fermentation
T:温度;M:水分;E:乙醇含量。
之前的研究表明,较低的发酵温度对减少EC的前体物质与乙醇反应速率上起到积极影响[21],并有研究者认为温度是影响EC含量至关重要的原因,然而本研究得出相反的结论。考虑到各研究选择的发酵周期不一,推测温度对于长周期发酵下的EC含量并无显著影响。pH对EC含量的影响可能在于pH对EC前体尿素的作用,pH值越高,尿素的去除率越高[22],因此pH可通过对尿素的影响从而起到调控EC含量的作用。目前暂未发现发酵过程中水分含量和乙醇含量与EC的相关性研究,本实验结果表明水分含量的增加会促进EC的积累,因此可调节发酵窖池里的水分含量来控制EC的合成。
2.5 EC含量与发酵微生物的相关性分析
如图7所示,总体来说,大部分白酒发酵过程中的优势微生物菌属对EC的积累无显著影响作用。Pearson分析表明,乳酸菌属(Lactobacillus)以及芽孢杆菌属(Bacillus)是响应EC变化的主要细菌属(图7A),其中Lactobacillus的丰度与EC含量呈显著正相关,相关系数为0.97。与之相反的是芽孢杆菌属,其丰度越高,发酵体系中产生的EC越少,相关系数为0.78。在真菌群落中,酿酒酵母菌属(Saccharomyces)是唯一能显著推动EC形成的菌属(图7B),两者之间的相关系数高达0.96。
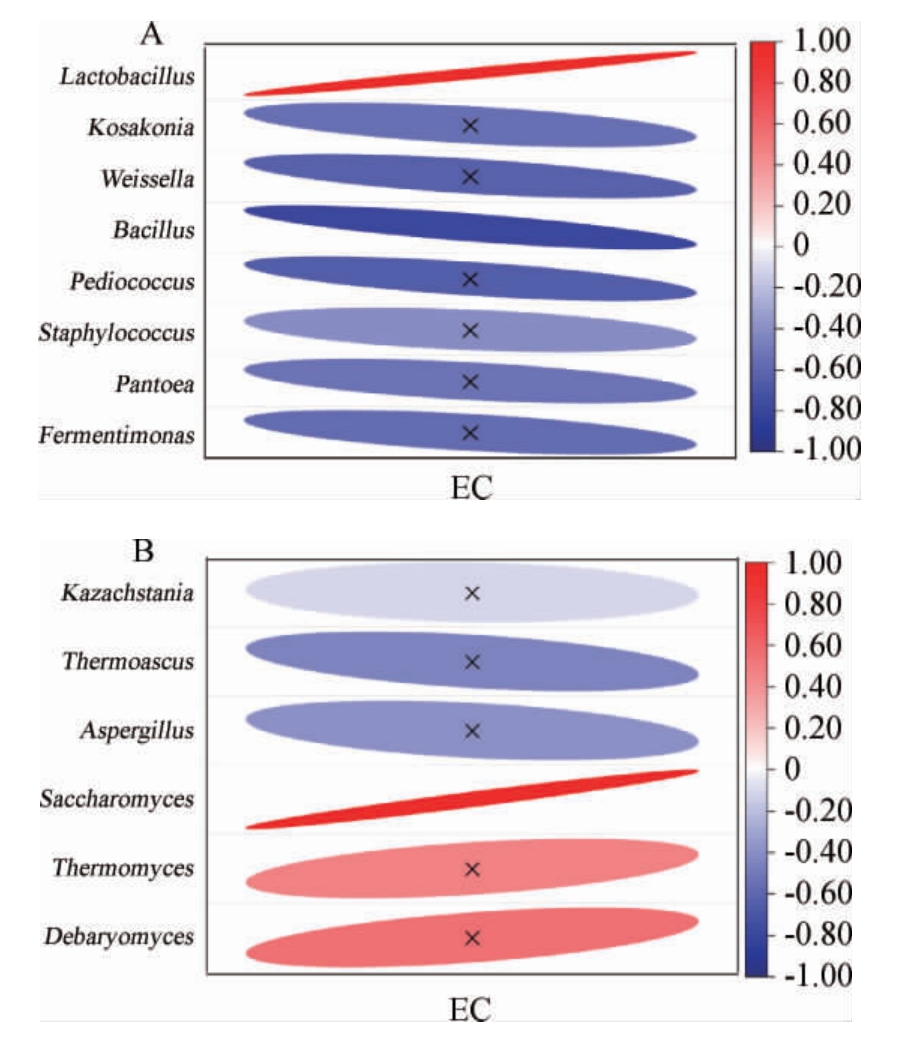
图7 浓香型白酒发酵过程中细菌(A)和真菌(B)群落变化对氨基甲酸乙酯含量的影响
Fig.7 Effects of bacterial (A) and fungal (B) community changes on ethyl carbamate content during fermentation of strong-flavor Baijiu fermentation
本研究结果符合众多学者对微生物和EC相关性的研究。EC 的前体瓜氨酸可以被乳酸菌通过精氨酸脱亚胺酶途径代谢,而酿酒酵母通过鸟氨酸循环积累尿素,导致EC增加[23],因此,乳酸菌属以及芽孢杆菌属与发酵过程中EC含量呈显著正相关。值得注意的是,本研究发现芽孢杆菌属与EC含量呈显著正相关,这可能归因于芽孢杆菌属产脲酶能力较强[24-25],从而分解尿素,减少前体对积累EC的贡献,然而具体原因仍然需要更深入的探究。此外,未来可着手于添加芽孢杆菌属对白酒EC含量以及风味影响的研究。
3 结论
本研究对浓香型白酒发酵过程中氨基甲酸乙酯(EC)的含量、环境因子及微生物群落进行了连续追踪监测,分析了环境因子及微生物群落与EC含量之间的相关性。发现EC含量随着发酵时间的延长呈先缓升后快速增加,再达到稳定的趋势,EC的积累主要发生在白酒发酵的中后期。发酵过程中,pH和水分含量是影响EC含量的显著因素,其中pH与EC呈负相关,相关系数为0.9,而水分则与EC的积累呈正相关,相关系数为0.83;温度和乙醇含量对EC的形成有一定的促进作用,但效果并不显著,相关系数分别为0.48和0.71。此外,发酵体系中乳杆菌属(Lactobacillus)和和酿酒酵母属(Saccharomyces)与EC含量的相关系数为0.97和0.96,两者的丰度越高,EC越容易积累;芽孢杆菌属(Bacillus)则对EC的合成起到反作用,与EC含量的相关系数为0.78,随着芽孢杆菌属(Bacillus)的相对丰度增加,EC的形成受到抑制。由此可见,在白酒的发酵期间可通过人为调控pH值及水分含量以控制EC含量,此外上调芽孢杆菌属在发酵微生物中的比例,可达到降低EC含量的目的。
[1]JIN G Y,ZHU Y,XU Y.Mystery behind Chinese liquor fermentation[J].Trends Food Sci Technol,2017,63:18-28.
[2]ZHENG X W,HAN B Z.Baijiu(白酒),Chinese liquor:History,classification and manufacture[J].J Ethnic Foods,2016,3(1):19-25.
[3]徐岩,范文来,陈双,等.风味技术导向中国白酒微生物代谢调控研究[C].2015年国际酒文化学术研讨会集,2015:3-33.
[4]郭晓莉,张欣.现代生物学技术对白酒酿造微生物的影响[J].食品安全导刊,2019(6):157.
[5]刘选成,张东跃,赵德义,等.数字化酿造工艺管理系统在浓香型白酒机械化、自动化和智能化酿造生产中的应用[J].酿酒科技,2018(11):70-74,79.
[6]张金萍.固液结合发酵酿酒工艺研究[J].生物技术世界,2013(11):39.
[7]江源.中国白酒大曲研究计划讨论会在会稽山召开[J].酿酒科技,2018(7):103.
[8]FRAIS S,YMM N G,GULABIVALA K.Some factors affecting the concentration of available chlorine in commercial sources of sodium hypochlorite[J].Int Endod J,2010,34(3):https://doi.org/10.1046/j.1365-2591.2001.00371.x.
[9]王涛,张文学,邹强,等.我国蒸馏白酒中内生性风险物质现状浅析[J].中国酿造,2019,38(5):13-17.
[10]Food and Agriculture Organization of the United Nations,WORLD Health Organization.Evaluation of certain contaminants in food[C]//Seventysecond meeting of the Joint FAO/WHO Expert Committee on Food Additives.Rome:WHO Technical Report Series,2010:1-166.
[11]FANG F,QIU Y Y,DU G C,et al.Evaluation of ethyl carbamate formation in Luzhou-flavor spirit during distillation and storage processes[J].Food Biosci,2018,23:137-141.
[12]LEE J B,KIM M K,KIM B K,et al.Analysis of ethyl carbamate in plum wines produced in Korea[J].Food Sci Biotechnol,2018,27(1):277-282.
[13] IARC Working Group on the Evaluation of Carcinogenic Risks to Humans.Alcohol consumption and ethyl carbamate[J].IARC monographs on the evaluation of carcinogenic risks to humans,2010,96:3-1383.
[14] TANG Q X,HE G Q,HUANG J,et al.Characterizing relationship of microbial diversity and metabolite in Sichuan Xiaoqu[J].Front Microbiol,2019,4(10):doi:10.3389/fmicb.2019.00696.
[15]LIU Y P,DONG B,QIN Z S,et al.Ethyl carbamate levels in wine and spirits from markets in Hebei Province,China[J].Food Addit Contam B,2011,4(1):1-5.
[16] RIACHI L G,SANTOS A,MOREIRA R F A,et al.A review of ethyl carbamate and polycyclic aromatic hydrocarbon contamination risk in cachaca and other Brazilian sugarcane spirits[J].Food Chem,2014,149(7):159-169.
[17]MCADAM K,VAS C,KIMPTON H,et al.Ethyl carbamate in Swedish and American smokeless tobacco products and some factors affecting its concentration[J].Chem Cent J,2018,12(1):64-72.
[18]GUAN T W,LIN Y J,CHEN K B,et al.Physicochemical factors affecting microbiota dynamics during traditional solid-state fermentation of Chinese strong-flavor Baijiu[J].Front Microbiol,2020,11:2090.
[19]CAPORASO J G,LAUBER C L,WALTERS W A,et al.Global patterns of 16S rRNA diversity at a depth of millions of sequences per sample[J].PNAS,2011,108(25):4516-4522.
[20]梁晨.固态白酒发酵中氨基甲酸乙酯变化规律及相关微生物代谢特征研究[D].无锡:江南大学,2016.
[21]DU H,SONG Z W,XU Y.Ethyl carbamate formation regulated by lactic acid bacteria and nonconventional yeasts in solid-state fermentation of Chinese Moutai-flavor liquor[J].J Agric Food Chem,2018,66(1):387-392.
[22]高雅.黄酒中氨基甲酸乙酯降低措施研究[D].合肥:合肥工业大学,2017.
[23]WANG H,HUANG Y G,HUANG Y L.Microbiome diversity and evolution in stacking fermentation during different rounds of Jiang-flavoured Baijiu brewing[J].LWT-Food Sci Technol,2021,143:111119.
[24]刘庆涛.Bacillus paralicheniformis酸性脲酶表达、分子改造及用于黄酒中氨基甲酸乙酯消减[D].无锡:江南大学,2019.
[25]胡利伟,轩贝贝,戴华鑫,等.宏转录组测序揭示褐土脲酶基因的表达丰度和细菌来源[J].烟草科技,2020,53(11):7-14.