功能性便秘是一种临床上常见的胃肠道疾病,根据2011年美国流行病学调查发现,全世界便秘的发病率高达16%左右,在中国有20%~30%的人口被便秘困扰[1-2]。功能性便秘的发病率正在逐年呈上升趋势,由于易受饮食、环境、情绪等多种因素影响,主要发病人群集中在老年人和女性患者[3-5],其临床症状主要表现为排便困难、每周排便次数少于3次,粪便干硬,而且常伴有腹痛、腹胀等症状[6]。此外,还会导致人体肠道动力及菌群失调,肠道敏感性降低[7];肿瘤等疾病压迫肠道,肠蠕动受机械性阻碍;肠平滑肌张力降低,排便肌群活动障碍,蠕动减弱[8];肠道菌群紊乱[9]。长期便秘将会导致肠壁损伤,肠道中毒素聚集堆积,从而引起一系列全身性并发症[10]。目前对于便秘的治疗主要是药物治疗,西药包括溶剂型泻剂、刺激性泻剂、盐类泻剂、渗透性泻剂、促动力药等,长期服用均会产生一定的副作用;中药有单味的番泻叶、白芍及复方中药麻仁丸、牛黄上清丸等,虽没有明显副作用,但起效作用较慢[11]。
益生菌是活的微生物,主要定植于身体肠道、生殖系统内,当摄入足够量时对宿主健康起有益作用,可维持宿主肠道菌群稳态、保护肠黏膜上皮结构、参与机体免疫和代谢调节[12-14]。乳杆菌属中的大多数菌株都具有益生作用,其中最具有代表性的菌株是植物乳杆菌(Lactobacillus plantarum)[15]。植物乳杆菌是一种革兰氏阳性发酵乳杆菌,是一种兼性厌氧、不运动、无芽孢的杆菌或长杆菌[16]。有研究表明,植物乳杆菌具有免疫调节、抑制致病菌、降低血清胆固醇含量、改善功能性便秘、调节肠道内菌群平衡等作用[17-18]。
本实验旨在通过动物实验,研究植物乳杆菌(Lactobacillus plantarum)HCS03-001改善功能性便秘、调节肠道菌群平衡的生理活性,并初步探讨其机制,为治疗便秘产品的开发提供更多选择及植物乳杆菌HCS03-001的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与菌株
90只昆明(KM)小鼠(雄性,18~22 g):辽宁长生生物技术有限公司,饲养条件:保持安静、清洁、通风和适宜光照,温度保持在(23±2)℃,湿度为40%~70%,明暗交替周期为12 h,保证动物自由饮水和充分进食,饮水和饲料均经无菌处理。
植物乳杆菌(Lactobacillus plantarum)HCS03-001冻干粉(1×1011 CFU/g):汉臣氏(沈阳)儿童制品有限公司研发部。
1.1.2 培养基
肠杆菌培养基(伊红美蓝琼脂培养基)、乳酸菌选择培养基、肠球菌培养基(叠氮钠-结晶紫-七叶苷琼脂培养基)、产气荚膜梭菌培养基:北京奥博星生物技术有限责任公司。
1.1.3 试剂
盐酸洛哌丁胺胶囊(盐酸洛哌丁胺含量为2 mg/粒):西安杨森制药有限公司;阿拉伯树胶粉(分析纯):上海源叶生物有限公司;活性炭粉:浙江兴达活性炭有限公司。其他试剂均为国产分析纯或生化试剂。
1.2 仪器与设备
SW-CJ-2D超净工作台:苏州净化设备有限公司;DHP-500BS恒温培养箱:北京市永光明医疗仪器有限公司;LDZX-50KBS压力蒸汽灭菌锅:上海申安医疗器械厂;PHS-25酸碱指示剂:上海雷磁仪器有限公司;XSP-10CH显微镜、JA2003N电子天平:上海佑科仪器仪表有限公司。
1.3 方法
1.3.1 植物乳杆菌HCS03-001对小鼠功能性便秘的影响
(1)动物分组
将经过适应环境3~5 d的雄性KM小鼠按体质量(bw)随机分成5组,每组10只,分别为对照组、便秘模型组(即盐酸洛哌丁胺组)和植物乳杆菌低(1g/(kgbw·d))、中(2g/(kgbw·d))、高(4 g/(kg bw·d))剂量组。采用等体积(20 mL/(kg bw·d))灌胃法,溶剂对照组和便秘模型组用蒸馏水代替。各实验组连续灌胃14 d,期间自由饮水、自由进食标准饲料。
(2)小肠推进实验
墨汁配制方法:将阿拉伯胶5 g与40 mL蒸馏水混合煮沸至澄清透明,再与2.50 g活性炭粉混合均匀煮沸3次,冷却,蒸馏水定容至50 mL,置于4 ℃冰箱保存,备用。
连续灌胃14 d后,所有小鼠均禁食不禁水饲养16 h。结束后,除溶剂对照组外,其余各组均经口灌胃5 mg/kg bw盐酸洛哌丁胺,造便秘模型,若便秘模型组的小肠墨汁推进率显著低于对照组,说明小鼠便秘模型成立。建模0.5 h后,5个实验组小鼠分别灌胃10 mL/kg bw墨汁,计时20 min后处死小鼠,解剖,测量小肠全长及自胃部下端幽门处到墨水运动前沿的距离,并计算墨汁推进率,其计算公式如下:
1.3.2 植物乳杆菌HCS03-001对小鼠肠道菌群的影响
(1)动物分组
动物平衡饲养3 d后,按体质量随机分为4组,每组10只,分别为溶剂对照组和植物乳杆菌低(1 g/(kg bw·d))、中(2 g/(kg bw·d))、高(4 g/(kg bw·d))3个剂量组。3个剂量组每天按照10 mL/kg bw灌胃,连续灌胃14 d,溶剂对照组等体积灌胃灭菌后的纯水。各组实验动物灌胃期间自由进食、饮水。
(2)粪便样品的采集与处理
灌胃第0天及第14天,无菌收集各组小鼠新鲜粪便。分别称取小鼠粪便0.1 g混匀于10 mL无菌生理盐水中,制成粪便混悬液。
(3)肠道菌群的检测
取上述混悬液1 mL,无菌加入至9 mL无菌生理盐水中,反复吹打混合均匀,制成均匀液体,按10倍梯度进行稀释,选取合适稀释度的混悬液1 mL接种于无菌平皿,每个稀释度做2个平皿。然后分别倒入肠杆菌培养基、乳酸菌选择培养基、肠球菌培养基、产气荚膜梭菌培养基20 mL,转动平皿混匀后,放入相应温度培养箱内按指定时间培养。
培养结束后,选取菌落数合适,无蔓延生长的平皿菌落进行计数。根据灌胃前后活菌数的变化情况,来反映植物乳杆菌HCS03-001对小鼠肠道菌群的影响。试验结果以菌落对数值表示(lg CFU/g)。
1.3.3 数据统计分析
应用软件SPSS 22.0进行数据处理分析,结果以“平均值±标准差”表示。
2 结果与分析
2.1 植物乳杆菌HCS03-001对小鼠小肠墨汁推进率的影响
植物乳杆菌HCS03-001对小鼠小肠墨汁推进率的影响见表1。
由表1可知,与溶剂对照组(73.92%)相比,便秘模型组小鼠的小肠墨汁推进率(40.06%)显著降低(P<0.05),说明小鼠便秘模型构建成功。与便秘模型组相比,植物乳杆菌HCS03-001各剂量组小鼠的小肠墨汁推进率均提高,分别为42.21%、53.40%、55.12%,其中中、高剂量组小鼠的小肠墨汁推进率显著提高(P<0.05),说明植物乳杆菌HCS03-001对盐酸洛哌丁胺造模的小鼠便秘模型有一定的促进肠蠕动的作用。
表1 植物乳杆菌HCS03-001对小鼠小肠墨汁推进率的影响
Table 1 Effect of Lactobacillus plantarum HCS03-001 on intestinal ink progradation rate of mouse

注:不同字母表示差异显著(P<0.05)。
2.2 植物乳杆菌HCS03-001对小鼠肠道菌群的影响
2.2.1 植物乳杆菌HCS03-001对小鼠肠道肠杆菌的影响
植物乳杆菌HCS03-001对小鼠肠道肠杆菌数的影响见表2。
表2 植物乳杆菌HCS03-001对小鼠肠道肠杆菌数的影响
Table 2 Effect of Lactobacillus plantarum HCS03-001 on the number of Enterobacter in mouse gut

注:相同字母表示与溶剂对照组相比活菌数差异不显著(P>0.05)。下同。
由表2可知,第0天,各组小鼠肠道中肠杆菌活菌数无明显差异(P>0.05);灌胃14 d后,溶剂对照组小鼠肠道中肠杆菌活菌数基本保持不变,而植物乳杆菌HCS03-001各剂量组与溶剂对照组相比,肠杆菌数量均有所降低,但无明显差异(P>0.05)。
2.2.2 植物乳杆菌HCS03-001对小鼠肠道乳杆菌的影响
植物乳杆菌HCS03-001对小鼠肠道乳杆菌的影响见表3。由表3可知,第0天,各组小鼠肠道中乳杆菌活菌数无明显差异(P>0.05);灌胃14 d后,溶剂对照组小鼠肠道中乳杆菌活菌数基本保持不变,而植物乳杆菌HCS03-001各剂量组与溶剂对照组相比乳杆菌活菌数均有所增加,且除低剂量组外,中、高剂量组增加明显(P<0.05)。
表3 植物乳杆菌HCS03-001对小鼠肠道乳杆菌数的影响
Table 3 Effect of Lactobacillus plantarum HCS03-001 on the number of Lactobacillus in mouse gut

注:不同字母表示与溶剂对照组相比活菌数差异显著(P<0.05)。下同。
2.2.3 植物乳杆菌HCS03-001对小鼠肠道肠球菌数的影响植物乳杆菌HCS03-001对小鼠肠道肠球菌数的影响见表4。
表4 植物乳杆菌HCS03-001对小鼠肠道肠球菌数的影响
Table 4 Effect of Lactobacillus plantarum HCS03-001 on the number of Enterococcus in mouse gut

由表4可知,第0天,各组小鼠肠道中肠球菌活菌数无明显差异(P>0.05);灌胃14 d后,溶剂对照组小鼠肠道中肠球菌活菌数基本保持不变,而植物乳杆菌HCS03-001各剂量组与溶剂对照组相比肠球菌活菌数有所下降,且除低剂量组外,中、高剂量组下降明显(P<0.05)。
2.2.4 植物乳杆菌HCS03-001对小鼠肠道产气荚膜梭菌数的影响
植物乳杆菌HCS03-001对小鼠肠道产气荚膜梭菌数的影响见表5。
表5 植物乳杆菌HCS03-001对小鼠肠道产气荚膜梭菌数的影响
Table 5 Effect of Lactobacillus plantarum HCS03-001 on the number of Clostridium perfringens in mouse gut
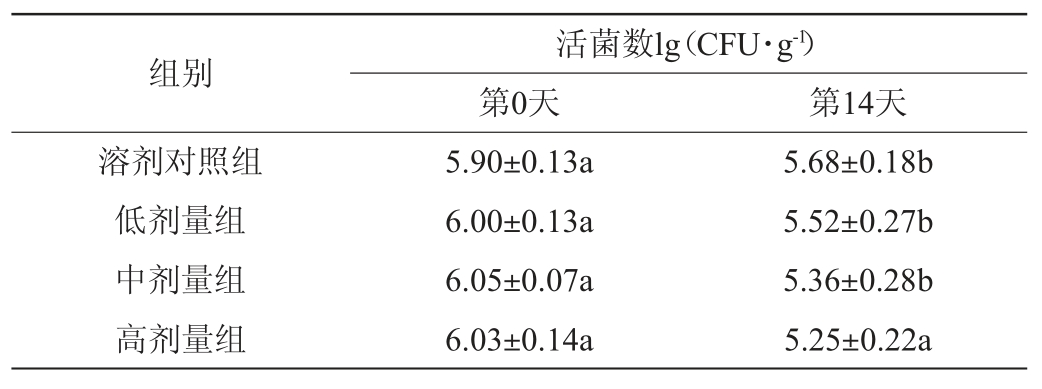
由表5可知,第0天,各组小鼠肠道中产气荚膜梭菌活菌数无明显差异(P>0.05);灌胃14 d后,溶剂对照组小鼠肠道中产气荚膜梭菌活菌数基本保持不变,而植物乳杆菌HCS03-001各剂量组与溶剂对照组相比产气荚膜梭菌活菌数均下降,且高剂量组下降明显(P<0.05)。
综上所述,植物乳杆菌HCS03-001可提高小鼠肠道内乳杆菌活菌数,降低小鼠肠道内肠球菌和产气荚膜梭菌的活菌数。
3 讨论
3.1 植物乳杆菌对小鼠功能性便秘的影响
便秘作为一种常见的功能性胃肠道疾病,是许多疾病的诱导因素之一,它的存在已严重的影响了人们的身体健康与生活质量[19]。由于便秘困扰,大便滞留在机体肠道内,导致肠道中有害菌产生的有害物质难以排出体外,随着血液循环到达全身各器官而造成机体损害,导致严重的健康问题[20]。根据盐酸洛哌丁胺的药理,其可通过抑制肠道蠕动导致小鼠便秘,因此不会造成小鼠器质性病变,故本实验采用盐酸洛哌丁胺建立功能性便秘模型。便秘的形成主要与肠道蠕动不足、肠道益生菌数量下降等有关,植物乳杆菌可以定植在肠道内,并且能够抑制有害菌的生长,提高有益菌含量,润肠通便及改善肠道菌群。本实验通过测定小鼠小肠墨汁推进率,探究植物乳杆菌对小鼠功能性便秘的影响。结果发现,2 g/(kg bw·d)、4 g/(kg bw·d)剂量下的植物乳杆菌HCS03-001可表现出促进肠蠕动的功能,因此后续还可以考察小鼠排便数量及时间进一步确认该株菌的益生功能。
3.2 植物乳杆菌对小鼠肠道菌群的影响
人体健康的重要指标之一就是肠道菌群平衡,它不仅仅是可以和机体来进行信息与物质的交换,还会影响机体营养吸收和正常代谢[21-22]。如绝大多数的乳杆菌都具有多种糖基水解酶,能够分解和发酵多糖,将其变成易于机体吸收的简单小分子糖类[23],并产生挥发性脂肪酸,这些小分子糖类和短链脂肪酸在结肠部位被吸收利用可以作为机体日常所需的能源。本研究采用平板计数法研究了植物乳杆菌对小鼠肠道菌群的影响,结果显示,连续灌胃不同剂量的植物乳杆菌HCS03-001 14 d后,3个剂量组小鼠肠道内益生菌乳杆菌数量增长,同时肠杆菌、肠球菌和产气荚膜梭菌的生长受到抑制。结果表明,植物乳杆菌HCS03-001有改善肠道菌群的作用。推测植物乳杆菌改善肠道菌群的作用机理可能包括以下两点[24-25]:一是植物乳杆菌能产生大量的短链脂肪酸降低肠道pH值环境、促进乳杆菌增殖,同时还可以抑制产气荚膜梭菌、肠杆菌和肠球菌的生长;二是添加植物乳杆菌可以加速小鼠肠道蠕动,缩短肠道内容物在肠道内停留的时间,使其可以迅速排出体外,并在此过程中排出肠道内的有害菌及其发酵产生的胺、吲哚、酚类等不良产物,从而起到改善小鼠肠道菌群的作用。
4 结论
本研究利用盐酸洛哌丁胺建立功能性便秘模型,通过测定小鼠小肠墨汁推进率发现,植物乳杆菌HCS03-001在中、高剂量下,可以显著提高小鼠小肠墨汁推进率(P<0.05)。通过选择性培养基平板计数法研究发现,植物乳杆菌HCS03-001高剂量可显著降低产气荚膜梭菌、肠球菌的活菌数(P<0.05)、降低肠道内肠杆菌(P>0.05),同时显著促进乳杆菌的增殖(P<0.05)。说明植物乳杆菌HCS03-001具有改善小鼠便秘、调节肠道菌群的功能。
[1] SHIN J E,JUNG H K,LEE T H,et al.Guidelines for the diagnosis and treatment of chronic functional constipation in Korea,2015 revised edition[J].J Neurogastroent Motil,2016,22(3):383-411.
[2]MUGIE S M,BENNINGA M A,LORENZO C D.Epidemiology of constipation in children and adults:a systematic review[J]. Best Pract Res Cl Ga,2011,25(1):3-18.
[3]刘桂章.功能性便秘体质的辨识及中医治疗[J].临床医学,2012,32(1):126-126.
[4]PKALAME A M,BAHNA H.Evaluation of constipation[J].Clin Colon Rect Surg,2012,25(1):5-11.
[5]李延青,于岩波.功能性便秘的诊断与治疗[J].中国实用内科杂志,2011,31(2):158-160.
[6]中华医学会消化病学分会胃肠动力学组,中华医学会外科学分会结直肠肛门外科学组.中国慢性便秘诊治指南(2013,武汉)[J].胃肠病学,2013,18(10):605-612.
[7]丁姮月,孙宏文.肠道菌群与腹泻型肠易激综合征相关性的研究进展[J].中国微生态学杂志,2019(1):119-125.
[8]刘海宁,陈玉琢,吴昊,等.肠道菌群与功能性便秘的研究进展[J].复旦学报(医学版),2015,42(4):564-568.
[9]GE X L,ZHAO W,DING C,et al.Potential role of fecal microbiota from patients with slow transit constipation in the regulation of gastrointestinal motility[J].Sci Rep,2017,7(1):1-11.
[10]刘广进.浅谈肛肠冲洗器治疗便秘、肛裂和痔疮[J].当代医学(学术版),2007(4):41-42.
[11]王琳琳.双歧杆菌对便秘的影响及其作用机理研究[D].无锡:江南大学,2017.
[12]SINGH T P,KAUR G,MALIK R K,et al.Characterization of intestinal Lactobacillus reuteri strains as potential probioties[J].Prob Antim Protein,2021,4(1):47-58.
[13] WANG X,WU Q L,DENG K,et al.A novel method for screening of potential probiotics for high adhesion capability[J]. J Dairy Sci,2015,98(7):4310-4317.
[14]WALLER P A,GEPAL P K,LEYER G J,et a1.Dose-response effect of Bifidobacterium lactis HN019 on whole gut transit time and function al gastrointestinal symptoms in adults[J]. Scand J Gastroenterol,2011,46(9):1057-1064.
[15]曹承旭,郭晶晶,乌日娜,等.植物乳杆菌的生理功能和组学研究进展[J].乳业科学与技术,2018,41(1):33-39.
[16]WASSENAAR T M,KLEIN G.Safety aspects and implications of regulation of probiotic bacteria in food and food supplements[J].J Food Protect,2008,71(8):1734-1741.
[17]尹玲,彭辉,张铭辉,等.益生菌的肠道保健机制[J].中国当代医药,2013,20(22):15-17.
[18]张翼.膳食诱导肥胖大鼠的肠道菌群结构研究[D].上海:上海交通大学,2009.
[19]崔龙.便秘治疗的再认识[J].临床外科杂志,2016,24(6):411-412.
[20]白冰瑶,刘新愚,周茜,等.红枣膳食纤维改善小鼠功能性便秘及调节肠道菌群功能[J].食品科学,2016,37(23):254-259.
[21]翟奇啸,田丰伟,王刚,等.肠道微生物与人体健康的研究进展[J].食品科学,2013,34(15):337-341.
[22]BUTT H L.Overdriving the intestinal microbial flora[J]. Adv Integr Med,2014,1(1):63.
[23]曹永强,张健,赵雯,等.植物乳杆菌胞外多糖的分离纯化及其乳化特性[J].食品科学,2016,37(17):7-13.
[24]李川.植物乳杆菌Ncull6的益生功能及其作用机制[D].南昌:南昌大学,2015.
[25]伍万强,王琳琳,赵建新,等.植物乳杆菌生理特性及益生功能研究进展[J].食品与发酵工艺,2019,45(1):1-13.