中国具有悠久的饮酒文化历史,尽管有报告表明少量饮酒可以降低死亡率[1],但是过量饮酒会严重损害人体健康,对人体的肝脏造成伤害[2],引发酒精性肝病。酒精性肝病(alcoholic liver disease,ALD)表现多样,初期通常表现为脂肪肝,进而可发展成酒精性肝炎、酒精性肝纤维化和酒精性肝硬化[3]。在严重酗酒时可诱发广泛肝细胞坏死甚或肝功能衰竭。酒精性肝病是西方国家最常见的肝病,现在也成为我国常见的肝病之一。目前治疗ALD的药物研究进展缓慢,糖皮质激素是常用的治疗药物,但是由于其副作用较大,临床应用受到了极大的限制[4]。因此,寻找毒副作用小、具有肝保护作用的活性物质对于ALD的预防与治疗有重大的科学意义与临床应用价值。
有研究表明,摄入体内的酒精90%在肝脏中通过乙醇脱氢酶(alcohol dehydrogenase,ADH)和乙醛脱氢酶(aldehyde dehydrogenase,ALDH)的作用下被分解代谢[5],当摄入的酒精量超出人体内ADH和ALDH活性容许量时,乙醇及其代谢物乙醛就会滞留在体内,对机体产生不利影响[6]。HOU R L等[7]研究表明活性氧簇(reactiveoxygen species,ROS)和氧化应激是诱发ALD的主要病理学机制。酒精在通过肝脏代谢的过程中会产生活性氧簇(ROS)[8],通过靶向作用于肝细胞的脱氧核糖核酸(deoxyribonucleic acid,DNA)、脂质和蛋白质等重要生物成分,诱发氧化应激反应并由此导致肝细胞的损伤甚至死亡。有报告称ADH和ALDH可减轻氧化应激[9]。
食醋是历史悠久的调味料之一,除了具有调味功能之外,食醋还具有抑制血压升高和促进钙吸收等保健功能。醋是醋酸菌利用酒精发酵制得的,酒精在人体中的代谢过程与醋酸发酵过程类似,是由醋酸菌利用ADH和ALDH进行的[10]。关于其功能性成分,近几年来已有醋酸、枸橼酸等有机酸以及多酚类的报告[11-12]。张锦华等[13]对镇江香醋和山西陈醋的研究表明,食醋抗氧化活性的主要贡献组分是多酚类物质,两者呈显著正相关,食醋抗氧化能力也与食醋中美拉德反应的产物——类黑精含量具有正相关性。同时镇江香醋可以延缓亚油酸氧化过程,香醋浓缩物不仅能抑制Cu2+诱导的低密度脂蛋白(low density lipoprotein,LDL)氧化修饰,还能阻断己修饰的LDL继续氧化。KONDO S等[14]对高血压大鼠的研究表明醋酸处理可明显降低血压、血管紧张肽原酶,证明了食醋具有辅助调节血压的功能。
另一方面,在传统制法的醋中,也有一些醋不实施过滤,残存有醋酸菌菌体。已有相关研究阐明具有ADH和ALDH活性的醋酸菌粉末与乙醇同时摄入可降低人体呼气和血液中的乙醇浓度,减轻摄取乙醇对肝脏造成的损伤[9]。近年来,还有报告指出醋酸菌菌体也能作为全新的活性主体发挥功能[13]。在醋的酿造工序中醋酸菌会被过滤除去废弃,但是从实现可持续发展目标的观点出发,探索醋酸菌保健功能的意义也十分重大。
本文主要对醋酸菌菌体的免疫调节、肠道菌群调节及减轻酒精性肝损伤等全新保健功能及其作用机制进行综述介绍。能够减轻酒精性肝损伤的天然成分有数种,但是它们的作用大都是凭借抗氧化能力发挥的,而醋酸菌粉末的独到之处是能够降低呼气和血液中的酒精浓度。因此将醋酸菌粉末与具有抗氧化作用的天然成分相结合,有望发挥加成效果,从而进一步减轻因过量饮酒导致的肝脏脂肪蓄积和氧化应激现象。与此同时,通过深入、详细地探讨醋酸菌的免疫调节作用,有望为近一步探索醋酸菌保健功能、开发新型食醋产品提供理论指导。
1 醋酸菌特征及新功能
醋酸细菌是一种专性需氧细菌革兰氏阴性菌,表现出一种独特的代谢形式,通过这种形式,它们通常通过膜结合脱氢酶部分氧化糖或乙醇等多种底物生产醋酸[14]。因其具有较强的乙醇氧化能力和乙酸合成能力,且具有较强的耐酸性,常用于醋发酵。醋酸菌在显微镜下,一般以单个、成对或成链出现,呈椭圆或杆状、直形或弯曲。一般不产芽孢和荚膜,菌落呈灰色,一般不产生色素但少数菌株产水溶性色素。醋酸菌不形成芽孢,菌体周生或端生鞭毛,因而具有运动能力。生长最优pH值是5.0~6.5,而它们能够在更低pH值(3~4)下生长。除少量种属中的菌株具有一定的耐热性,绝大部分的醋酸菌最适生长温度在28~30 ℃之间。以醋化醋酸杆菌(Acetobacter aceti)为代表的醋酸杆菌属能氧化乙酸盐和乳酸盐,能氧化乙醇产乙酸,泛醌为Q-9型。以液化葡糖醋杆菌(Gluconacetobacter liquefaciens)为典型菌株的葡糖醋杆菌属能氧化葡糖酸盐和醋酸盐,能氧化酒精产醋,辅酶Q为Q-10型。
醋酸菌是重要的工业用菌之一。醋酸菌在工业生产中主要用于酿造食醋、酵素及果醋饮料。目前,食用酵素酿造的优良菌株分为醋酸杆菌属和葡萄糖杆菌属两个属。植物酵素采用现代生物发酵技术,以水果、药食同源中药材等植物为主要原料,利用微生物深层液态发酵而成,醋酸菌除能将乙醇氧化为醋酸外,也能够氧化糖类、糖醇、有机酸等物质,其口味独特、营养价值丰富并具有一定的保健功能。
有报告指出,口服摄取醋酸菌菌体可以减轻酒精性肝损伤[15-16]。醋酸菌减轻酒精性肝损伤的作用机理是通过ADH、ALDH降低酒精及乙醛浓度[17],并利用抗氧化作用去除活性氧[18]。中国农业大学程永强课题组探究了含醋酸菌粉末的食品(acetic acid bacterial powder-containing food,AF)对急性酒精性肝损伤的缓解作用[19],利用美国癌症研究所(institute ofcancer research,ICR)小鼠(雄性,20~22 g),随机分为对照组、乙醇组和乙醇+AF组。乙醇组按12 mL/kg口服给予体积分数为50%乙醇。乙醇+AF组中按小鼠体质量分别进行低、中、高3种不同剂量的AF灌胃处理(0.033 g/kg、0.067 g/kg、0.200 g/kg)。通过测量肝损伤的血清标志物、氧化应激标志物、甘油三酸酯(triglyceride,TG),并进行肝组织病理学观察,从而比较不同浓度AF对肝脏损伤的缓解作用。结果表明,与对照组相比,通过乙醇摄入可以观察到血清丙氨酸氨基转移酶(alanine aminotransferase,ALT)水平升高和肝脏还原型谷胱甘肽(glutathione,GSH)水平降低。通过摄入0.200 mg/kg的AF可以缓解相应指标的变化。摄入乙醇引起肝脏TG水平升高和组织病理学评分降低,而AF给药可缓解肝脏TG水平升高织病理学评分降低。结果表明,摄入AF可减轻急性酒精性肝损伤。
2 醋酸菌作用机制分析
2.1 与LPS有关的受体
脂多糖(lipopolysaccharide,LPS)是革兰氏阴性菌的主要组成成分,适量的LPS可以激发机体的免疫反应从而正向调节其免疫功能,但是髙浓度的LPS则会引起机体严重的炎性反应,故LPS对机体的免疫功能具有双重的调节作用。大量文献表明,在LPS介导的信号转导通路中,有脂多糖结合蛋白(lipopolysaccharide binding protein,LBP)、白细胞分化抗原(cluster of differentiation 14,CD14)等多种与LPS的双重作用有关的受体[20]。当胞外信号传至胞内后,激活转接分子髓样分化因子(molecular myeloid differentiation,MyD88),白介素1受体关联激酶-1(interleukin-1 receptor-associated kinases,IRAK-1)、IRAK-4通过MyD88和MyD88转接蛋白类似物聚集到受体复合物中,使IRAK-1发生磷酸化并从复合物中解离,随后肿瘤坏死因子受体相关因子-6(tumor necrosis factor-associated factor,TRAF-6)接受到信号完成活化。活化后的TRAF-6通过激活核因子-kB诱导激酶(nuclear factor-kB-inducing kinase,NIK)和转化生长因子-β-活化激酶1(transforming growth factor-β-activated kinase1,TAK1)进行信号转导,激活相应的核因子-kB(nuclear factor-kB,NF-kB)和丝裂原活化蛋白激酶(mitogenactivated protein kinases,MAPK)两条通路,如图1所示[21]。
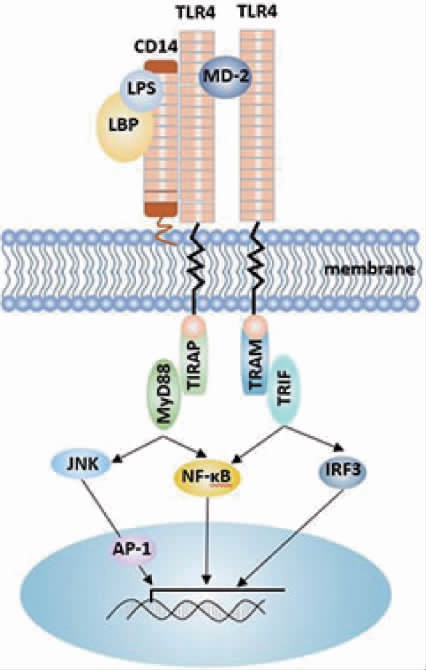
图1 脂多糖介导的信号通路作用机制
Fig.1 Action mechanism of lipopolysaccharide mediated signaling pathway
NF-kB通路是通过NIK激活NF-kB抑制蛋白激酶(inhibitor of kappa-B kinase,IKK),诱导IKK发生磷酸化,从而解除NF-kB的抑制,NF-kB从胞浆中释放至细胞核启动相关基因转录。MAPK通路是通过TAK1激活C-Jun N-氨基端激酶(c-Jun N-terminal kinase,JNK)、p38等最后激活转录因子(activating protein-1,AP-1),诱导相关细胞因子基因的表达[22]。
2.1.1 脂多糖结合蛋白
脂多糖结合蛋白(LBP)是一种急性期反应蛋白,先由肝脏和肠上皮细胞合成分泌成单链多肽,再经糖基化后形成糖蛋白。LBP主要存在于人和动物的血清中,不同的动物种属之间具有高度的同源性。LBP的生物学功能具有双重效应,低浓度时启动致炎位点,增强机体的致敏性、引发机体的促炎效应;高浓度时则启动抗炎位点,增强机体的抗炎效应从而发挥抑制炎症、保护机体的作用。
当机体处于炎症急性期便产生一种自身调节机制来防止过度免疫,从而来保护机体。此时,血浆中的LBP会急剧升高,高浓度的LBP可以抑制LPS介导的炎性细胞因子的释放,从而使细胞信号转导的激活受到抑制[23]。机体中的高密度脂蛋白(high-density lipoprotein,HDL)具有中和LPS的作用,在一定浓度内,HDL浓度的增加可以有效增强LPS损伤的保护作用,而且高浓度的LBP可以促进LPS与HDL的结合。LBP是一种脂转运分子,当LPS/LBP达到一定的比例时,LBP会使LPS多聚体发生解聚,催化LPS单体向HDL转运并组成复合体,从而降低LPS的毒性。但是,LPS与HDL结合的速率要比LPS与其膜受体CD14(membrane CD14,mCD14)分子结合的速率低得多,所以在HDL中和高浓度LPS引起的刺激效应之前就已发生严重的炎症反应。与此同时LBP还可以促进磷脂与mCD14分子结合,抑制LPS与mCD14的分子结合,从而抑制LPS诱导的反应。
2.1.2 CD14分子
CD14分子是LPS的关键受体之一,它的N段富含亮氨酸重复单位,能够特异性识别LPS,并且对LPS具有高亲和性。CD14分子属于细胞表面糖蛋白,主要功能是在LBP分子的协助下与LPS结合活化LPS从而介导细胞对LPS的反应,在相应细胞的应答中发挥关键作用。CD14分子有两种存在方式:mCD14和可溶性的受体CD14(soluble CD14,sCD14)。mCD14分子主要存在于单核巨噬细胞表面,少部分存在于中性粒细胞表面,在不同组织中的单核巨噬细胞表面,其表达水平有一定的差异。
当机体发生急性炎症时,sCD14分子的浓度会急剧升高从而抑制过度的全身性反应,对机体产生保护,这样的一种对机体的保护机制与LBP所引发的保护机制相似。对于单核巨噬细胞,高浓度的sCD14可以促使髓源性细胞表面上与mCD14结合的LPS发生解离进入血液,然后血液中的LPS与sCD14结合来减弱LPS对细胞的激活反应[20];也可以通过LBP的作用,促进LPS的转运从而加快LPS的排出。另外,当sCD14浓度过高时,还可以形成LPS-LBP-sCD14三联复合体,形成的三联复合体与细胞膜上的受体结合产生内化而被清除。
2.2 免疫调节功能
醋酸菌在菌体外具有脂多糖(LPS),大量文献表明,LPS具有免疫调节的功能。众所周知,摄入酒精会降低机体的细胞免疫力。有报告指出,口服摄入LPS会激发机体的自然免疫力[19]。通过各种试验,就醋酸菌对免疫调节的影响进行了评价。对小鼠巨噬细胞系J774.1添加醋酸菌并进行培养,结果发现,IL-12的产生有所增加[20]。此外,对BALB/c小鼠喂食含有10%醋酸菌的饲料,结果发现,脾脏原代培养细胞中干扰素-γ(interferon-γ,IFN-γ)的产生有所增加。进而,对人自然杀伤(natural killer,NK)细胞细胞系KHYG-1添加醋酸菌100 μg/mL进行预培养,然后作为效应细胞,与K562细胞进行共培养,评价NK细胞的细胞毒性,结果发现,醋酸菌使得NK细胞的细胞毒性显著提高[21]。还有报告指出,IFN-γ及NK活性降低会促进肝纤维化的发展[22],而醋酸菌可能会经由IFN-γ或NK细胞减轻酒精性肝损伤。并且,LPS会激活Treg细胞[23],醋酸菌可以减轻与过敏有关的鼻子症状[24-26],从而判断醋酸菌有可能会控制炎症过度反应。酒精性肝损伤与免疫之间存在密切关联,因此,醋酸菌的免疫调节功能可能有助于减轻酒精性肝损伤。
参与细胞免疫的因子(NK细胞或IFN-γ)对酒精所致的肝纤维化能起到预防作用。由此可以判断,细胞免疫调节就是醋酸菌减轻酒精性肝损伤的新机理。另外,我们都知道,摄入酒精会增加感染的风险[27],还会使引发过敏症状的IgE增加[28]。针对这类由酒精引起的免疫系统紊乱问题,醋酸菌也有可能会减轻相关症状。
冯彩玲等[3]研究了不同剂量(100 μg/mL、200 μg/mL和400 μg/mL)的牛樟芝粗多糖(crude polysaccharide,CP)和醇提物后的水提物(water extract after extraction by ethanol,WEE)对酒精诱导的HepG2细胞氧化损伤的保护作用。研究结果表明:WEE和CP能提高细胞的抗氧化应激能力,降低胞内ROS,对酒精诱导的HepG2细胞氧化损伤起到明显的保护作用,提示多糖是牛樟芝解酒保肝的重要活性成分之一。GAO B等[29]研究发现,菌丝糖蛋白能抑制氧化应激,对脂多糖诱导的大鼠肝损伤起到明显的保护作用。
免疫低下动物中病原体诱导的几种炎症模型表明,Treg对于预防有害的免疫反应是必要的。之前有研究证明Treg对炎症趋化因子特别敏感,发现细菌代谢产物可以直接激活Treg并增强其效应器功能。Toll样受体(Toll-like receptors,TLR)是先天免疫系统的经典组成部分,在分化决定族抗原4(cluster ofdifferentiation 4,CD4-T)-T淋巴细胞亚群中选择性表达,具有调节适应性免疫反应的功能,其比例相当高。在细菌感染期间,通过TLR对Treg的非特异性激活被抗原的特异性识别放大。此外,特定的迟发型超敏反应和移植物抗宿主反应,以及移植物排斥和经典免疫,都被证明通过用不同剂量的脂多糖预处理小鼠而被下调或消除。所以脂多糖能够促进Treg的存活和增殖并增强其抑制功能,从而判断醋酸菌的免疫调节功能是通过LPS的介导实现的。
2.3 肠道菌群调节功能
哺乳动物生来基本上是无菌的,但是在出生后上皮表面很快就被数量惊人的细菌占据。哺乳动物的肠道有一个巨大而复杂的微生物群落,最广泛的微生物群落位于远端肠道,肠道菌群的数量是人体体细胞和生殖细胞总数的约10倍。对无菌小鼠的研究表明,肠道菌群在免疫系统的发展中起着至关重要的作用[30-32]。
已经证明,在绿色荧光小鼠中,肠道相关淋巴组织(gut-associated lymphoid tissue,GALT)是最大的免疫器官。绿色荧光动物的固有层CD4+T细胞、产生免疫球蛋白A(immunoglobulin A,IgA)的B细胞和上皮内T细胞的含量均有减少[32-33]。对比实验还表明,肠上皮细胞的基因表达谱是由肠道菌群的存在形成的,上调的基因有助于肠表面抗菌分子的分泌和肠道血管生成的调节[34-35]。肠道菌群不仅影响GALT,而且影响全身的免疫。绿色荧光小鼠血清免疫球蛋白水平降低,其肠系膜淋巴结和脾脏更小,细胞更少[36]。目前虽然尚不清楚肠道微生物群和微生物成分是否在Tregs的发育和功能中起作用[37-38],但是Tregs被认为是建立免疫稳态的关键因素。已经证明具有调节功能的细胞是表达Foxp3的CD4+T细胞[39]。调节性T细胞(Tregs)通过抑制免疫系统的激活,来保持免疫系统的稳态和对自身抗原和无害外源抗原的耐受性[40]。这些细胞的耗竭或功能丧失会导致炎症性疾病[41]。
大量的肠道微生物群及其产物与肠粘膜的上皮表面密切接触。免疫(无菌)模型是阐明肠道微生物群功能的重要工具,尤其是它们对粘膜和系统免疫的影响。无菌动物没有活细菌,但它们的无菌食品含有微生物成分和其他免疫原性成分。通过对肠道菌群的存在和含有各种细菌污染物的无菌饮食的质量(通过LPS含量来测量)是否会影响无免疫小鼠免疫系统的成熟的研究表明,肠道菌群的存在,以及在较小程度上无菌饮食的存在,推动了B细胞和T细胞的扩张。最突出的是CD4+T细胞的扩增。此外,还观察到肠道菌群的存在和富含脂多糖的无菌饮食都会影响脾细胞的体外细胞因子谱。肠道菌群和富含脂多糖的饮食都增加白细胞介素-12的产生,减少白细胞介素-4的产生。与此同时,肠道菌群的存在增加了白细胞介素-10和干扰素-γ的产生。所以活的肠道菌群和无菌饮食中所含的微生物成分(脂多糖)能够通过刺激免疫系统的发育和扩张来发挥调节功能。
3 未来展望
食醋作为调味料之一,其特殊的发酵方式和工艺使其产品具有独特的风味特征,并含有包括酚类在内的抗氧化性成分。除了具有调味功能之外,食醋还具有抗氧化清除自由基,辅助降血压、血糖、血脂和促进钙吸收等保健功能。目前对香醋的活性功能研究较多,但是对食醋中的醋酸菌体功能研究较少,作为醋酸菌的全新功能性及作用机理,本文介绍了其减轻酒精性肝损伤的作用、免疫调节作用和肠道菌群调节作用。研究报告称能够减轻酒精性肝损伤的天然成分有数种,但是它们的作用大都是凭借抗氧化能力发挥的。而醋酸菌粉末与其他天然成分相比,其独到之处是能够降低呼气和血液中的酒精浓度。将醋酸菌粉末与具有抗氧化作用的天然成分相结合,有望发挥加乘效果,从而进一步减轻因过量饮酒导致的肝脏脂肪蓄积和氧化应激现象。
免疫系统与感染症及过敏性疾病密切相关,人们都希望能在发病前对这些疾病加以预防。因此,通过食品成分实现免疫平衡的意义十分深远。通过深入、详细地探讨醋酸菌的免疫调节作用,有望未来能将醋酸菌应用到更加高效的功能性食品中。
[1] SAITO E,INOUE M,SAWADA N,et al.Impact of alcohol intake and drinking patterns on mortality from all causes and major causes of death in a Japanese population[J].J Epidemiol,2018,28(3):140-148.
[2] World Health Organization.Global status report on alcohol and health 2014[R].Geneva:WHO:2014.
[3]冯彩玲,杨彬君,吴岩斌,等.牛樟芝提取物调控Nrf2/HO-1 通路对酒精性肝损伤的保护作用[J].菌物学报,2021,40(9):2433-2444.
[4]LIU X,HOU R L,YAN J J,et al.Purification and characterization of Inonotus hispidus exopolysaccharide and its protective effect on acute alcoholic liver injury in mice[J].Int J Biol Macromol,2019,129:41-49.
[5] ZAKHARI S.Overview:how is alcohol metabolized by the body?[J].Alcohol Res Health,2006,29(4):245-254.
[6]STEPHENS R,LING J,HEFFERNAN T M,et al.A review of the literature on the cognitive effects of alcohol hangover[J].Alcohol Alcoholism,2008,43(2):163-170.
[7] HOU R L,LIU X,YAN J J,et al.Characterization of natural melanin from Auricularia auricula and its hepatoprotective effect on acute alcohol liver injury in mice[J].Food Funct,2019,10(2):1017-1027.
[8]ABDELMEGEED M A,BANERJEE A,JANG S,et al.CYP2E1 potentiates binge alcohol-induced gut leakiness,steatohepatitis,and apoptosis[J].Free Rad Biol Med,2013,65:1238-1245.
[9]SINGH S,BROCKER C,KOPPAKA V,et al.Aldehyde dehydrogenases in cellular responses to oxidative/electrophilic stress[J]. Free Rad Biol Med,2013,56:89-101.
[10]BARTOWSKY E J,HENSCHKE P A.Acetic acid bacteria spoilage of bottled red wine-a review[J].Int J Food Microbiol,2008,125(1):60-70.
[11]IIZUKA M,TANI M,KISHIMOTO Y,et al.Inhibitory effects of balsamic vinegar on LDL oxidation and lipid accumulation in THP-1 macrophages[J].J Nutr Sci Vitaminol,2010,56(6):421-427.
[12]MITROU P,PETSIOU E,PAPAKONSTANTINOU E,et al.The role of acetic acid on glucose uptake and blood flow rates in the skeletal muscle in humans with impaired glucose tolerance[J]. Eur J Clin Nutr,2015,69(6):734-739.
[13]张锦华,李涛,路欣,等.老陈醋类黑精的多酚含量与其抗氧化活性相关性[J].食品与发酵工业,2016,42(7):141-146,152.
[14]KONDO S,TAYAMA K,TSUKAMOTO Y,et al.Antihypertensive effects of acetic acid and vinegar on spontaneously hypertensive rats[J].Biosci Biotech Bioch,2001,65(12):2690-2694.
[15] LIN D H,JIANG X X,ZHAO Y,et al. Komagataeibacter hansenii CGMCC 3917 alleviates alcohol-induced liver injury by regulating fatty acid metabolism and intestinal microbiota diversity in mice[J]. Food Funct,2020,11(5):4591-4604.
[16]QIU X M,ZHANG Y,HONG H S.Classification of acetic acid bacteria and their acid resistant mechanism[J].AMB Express,2021,11(1):29.
[17] CHEN X X,TIAN S M,CHENG Y Q.Effect of acetic acid bacterial powder-containing food on acute alcoholic liver injury in ICR mice[J].Food Ferement Ind,2020,46(13):114-118.
[18]田思敏,陈小雪,韩北忠.醋酸菌粉末对ICR小鼠的酒精性肝脂质蓄积和氧化应激的影响研究[J].中国酿造,2020,39(4):28-31.
[19]陈小雪,田思敏,程永强.含醋酸菌粉末的食品对ICR小鼠的酒精性肝损伤的影响[J].食品与发酵工业,2020,46(13):114-118.
[20]张晓音,吴旻,李雨萌,等.脂多糖的效应及其机理研究进展[J].动物医学进展,2015,36(12):133-136.
[21]邹玉莲,杨勇,李娴静,等.内毒素耐受的机制研究[J].现代生物医学进展,2014,14(34):6778-6781,6785.
[22]WANG H W,WU T,QI J Y,et al.Salidroside attenuates LPS-stimulated activation of THP-1 cell-derived macrophages through down-regulation of MAPK/NF-κB signaling pathways[J].J Huazhong U Sci-Med,2013,33(4):463-469.
[23]孙佳,夏海鸣.脂多糖相关受体及其介导的信号转导通路[J].医学综述,2010,16(3):324-327.
[24] NISHIYAMA H.Effect of acetic acid bacteria containing food on ethanol concentration in expiration and blood while healthy adult males drinking[J].New Remedies Clin,2017,66:250-258.
[25] JIANG X X,LIN D H,SHAO H J,et al.Antioxidant properties of Komagataeibacter hansenii CGMCC 3917 and its ameliorative effects on alcohol-induced liver injury in mice[J].CyTA-J Food,2019,17(1):355-364.
[26] HRNCIR T,STEPANKOVA R,KOZAKOVA H,et al.Gut microbiota and lipopolysaccharide content of the diet influence development of regulatory T cells:Studies in germ-free mice[J].BMC Immunol,2008,9:65.
[27] KIMURA M,OE M,OKUYAMA Y,et al.TLR4 reactivity of gluconacetobacter(Gluconacetobacter hansenii GK-1)and their synergistic action with Lactobacillus in producing antiallergic effects[J].Pharmacol Ther,2019,47(12):2001-2006.
[28]KIMURA M,Effects of acetic acid bacteria(Gluconacetobacter hansenii GK-1)on immune system[J].Jpn Soc Med Use Funct Food,2021,14(1):216-222.
[29] GAO B,SEKI E,BRENNER D A,et al.Innate immunity in alcoholic liver disease[J].Am J Physiol-GASTR L,2011,300(4):516-525.
[30]CARAMALHO I,LOPES-CARVALHO T,OSTLER D,et al.Regulatory T cells selectively express toll-like receptors and are activated by lipopolysaccharide[J].J Exp Med,2003,197(4):403-411.
[31]INAGAWA H,NISHIZAWA T,KOCHI C,et al.Pollen allergy suppression effect by the oral administration of acetic acid bacteria(Gluconacetobacter hansenii)[J].Anticancer Res,2019,39(8):4511-4516.
[32] KAMIJYO F,YOSHIOKA S.Acetic acid bacteria (Gluconacetobacter hansenii GK-1)relieves nasal discomforts of Japanese cedar pollinosis-a randomized double-blinded placebo-controlled study[J].Jpn Pharmacol Ther,2019,47:1993-1999.
[33] YOSHIOKA S,KAMIJYO F.Acetic acid bacteria (Gluconacetobacter hansenii GK-1)relieves nasal discomforts-a randomized double-blinded placebo-controlled study[J].Jpn Pharmacol Ther,2019,47:461-467.
[34]TREVEJO N G,KOLLS J K,WIT M.Alcohol use as a risk factor in infections and healing[J].Alcohol Res Curr Rev,2015,37(2):177-184.
[35] ROH D,LEE D H,LEE S K,et al.Sex difference in IgE sensitization associated with alcohol consumption in the general population[J]. Sci Rep,2019,9(1):12131.
[36]KER Y B,PENG C C,CHANG W L,et al.Hepatoprotective bioactivity of the glycoprotein,antrodan,isolated from Antrodia cinnamomea mycelia[J].PLoS One,2014,9(4):e93191.
[37] WOSTMANN B S,PLEASANTS J R,BEALMEAR P,et al.Serum proteins and lymphoid tissues in germ-free mice fed a chemically defined,water soluble,low molecular weight diet[J]. Immunology,1970,19(3):443-448.
[38] CEBRA J J.Influences of microbiota on intestinal immune system development[J].Am J Clin Nutr,1999,69(5):1046S-1051S.
[39]CRABBÉ P A,NASH D R,BAZIN H,et al.Immunohistochemical observations on lymphoid tissues from conventional and germ-free mice[J].Lab Invest,1970,22(5):448-457.
[40]WILLIAMS A M,PROBERT C S J,STEPANKOVA R,et al.Effects of microflora on the neonatal development of gut mucosal T cells and myeloid cells in the mouse[J].Immunology,2006,119(4):470-478.
[41]HOOPER L V,GORDON J I.Commensal host-bacterial relationships in the gut[J].Science,2001,292(5519):1115-1118.
[42]HOOPER L V,STAPPENBECK T S,HONG C V,et al.Angiogenins:a new class of microbicidal proteins involved in innate immunity[J]. Nat Immunol,2003,4(3):269-273.
[43]MAZMANIAN S K,LIU C H,TZIANABOS A O,et al.An immunomodulatory molecule of symbiotic bacteria directs maturation of the host immune system[J].Cell,2005,122(1):107-118.
[44] ANNACKER O,BURLEN-DEFRANOUX O,PIMENTA-ARAUJO R,et al.Regulatory CD4 T cells control the size of the peripheral activated/memory CD4 T cell compartment[J].J Immunol,2000,164(7):3573-3580.
[45] OSTMAN S,RSAK C,WOLD A E,et al.Impaired regulatory T cell function in germ-free mice[J].Eur J Immunol,2006,36(9):2336-2346.
[46] HORI S,NOMURA T,SAKAGUCHI S.Control of regulatory T cell development by the transcription factor Foxp3[J]. Science,2003,299(5609):1057-1061.
[47]JIANG Q,COFFIELD V M,KONDO M,et al.TSLP is involved in expansion of early thymocyte progenitors[J].BMC Immunol,2007,8:11.
[48] SINGH B,READ S,ASSEMAN C,et al.Control of intestinal inflammation by regulatory T cells[J].Immunol Rev,2001,182(11):190-200.