酱香型白酒是中国三大典型香型之一,在中国食品产业发展中占有非常重要的地位。2020年,遵义规模以上企业白酒产量达到24.5万kL,工业增加值达1 129亿元,占全市工业增加值的77%[1],对贵州的经济建设贡献极大,是名副其实的传统经济支柱产业。而酱香型白酒又因其“四高两长”的独特的酿造工艺(即高温制曲、高温堆积、高温发酵、高温流酒和生产周期长、贮存期长),拥有独特的风格特征,始终占据着高端白酒的市场规模。其中,高温堆积是酱香型白酒特有的酿造工艺,大量酿造环境中的微生物在此过程中富集,为窖池发酵提供了大量的微生物储备、酶类资源和香味物质及其前体物质[2],保证酱香型白酒的产量与品质。因此,酱香型白酒的生产领域一直存在着“无堆积,不产酒”的说法[3]。堆积发酵采用开放式的固态发酵模式,微生物是其过程的主导者。其中,真菌在此过程中提供了源源不断的酶类资源,为糖化和发酵提供动力,特别是酵母菌,其数量和种类在堆积前后有大幅增加[4],这在很大程度上弥补了高温大曲中酵母数量少而导致的发酵力不足的缺陷,保证了酱香型白酒的正常生产。因此,堆积发酵中真菌的菌群结构一直以来是众多学者研究的重点[5-7]。黄永光等[8]通过分离培养基分析堆积酒醅不同层面的酵母群落结构,发现堆积上层的酵母数量要多于中下层,堆积中心的酵母数量在发酵初期多于表层,而发酵后期则因氧含量等参数变化导致外层酵母多于中心点,该结果初步揭示了堆积过程中的酵母群落结构的变化。然而,通过可培养只能认识发酵酒醅中1%~10%的微生物,远远不能准确反映发酵体系中的微生物群落结构变化。因此,必须应用现代研究技术分析酿造微生物体系,而高通量测序技术近年来被广泛应用于解析微生物群落结构变化[9]。
在酱香型白酒堆积发酵过程中,黄蕴利等[10]采用高通量测序方法研究了酱香型白酒第二轮次发酵酒醅中的微生物群落结构,发现堆积酒醅中的优势真菌属主要为嗜热子囊菌属(Thermoascus)、嗜热真菌属(Thermomyces)、假丝酵母属(Candida)和曲霉属(Aspergillus);郭敏等[11]运用高通量测序方法研究了酱香型白酒第三轮次和第七轮次的发酵酒醅微生物群落结构,三轮次的优势真菌属为嗜热子囊菌属(Thermoascus)和嗜热真菌属(Thermomyces),七轮次酒醅的优势细菌属为隐球菌属(Cryptococcus),且两个轮次酒醅的微生态多样性存在差异。上述研究初步揭示了酱香型白酒堆积发酵过程中的微生物菌群结构,但主要集中在单一的轮次或者传统的酿造过程。而酱香型白酒的堆积发酵工艺因一直沿袭传统的人工上堆模式,劳动强度大,可控性较差,容易受环境因素和人为操作差异的影响。而其他香型,如浓香型[15]、清香型[16]白酒的机械化表明,机械化酿造不仅降低了劳动强度,还保证了酿造质量的可控性。因此,在机械化发展的大趋势下,酱香型白酒需要改变生产方式、降低生产成本、提高产品品质、发展安全高产的机械化酿造模式,实现跨越式发展。其中,机械化堆积发酵过程中细菌的微生物菌群结构本课题组已经进行了详细的报道[12]。
基于此,本研究以酱香型白酒酿造机械化酿造堆积发酵过程中的发酵酒醅为样品,利用高通量测序技术对酱香型白酒机械化堆积发酵过程中真菌菌群结构特征及其与发酵环境因子的内在机制进行了系统研究,全面的解析酱香型白酒机械化酿造时,堆积发酵过程的真菌结构和主导性真菌菌群结构的变化规律,进一步为研究其发酵机理提供科学依据,同时也为酱香型白酒机械化酿造提供理论参考。
1 材料与方法
1.1 材料与试剂
样品:采集于贵州XJ公司酱香型白酒机械化制酒车间1~7轮次堆积发酵的酒醅,标记为1DJ~7DJ;脱氧核糖核酸(deoxyribonucleic acid,DNA)试剂盒:美国OmegaBio-Tek公司;聚合酶链式反应(polymerase chain reaction,PCR)扩增引物:北京全式金生物技术有限公司;凝胶提取试剂盒:美国Axygen Biosciences公司。
1.2 仪器与设备
HeraeusMultifugeX1R台式高速冷冻离心机:德国Sigma公司;E002092超净工作台:苏州市金净净化设备科技有限公司;HH-4数显恒温水浴锅:国华电器有限公司;HQ-60-II涡旋振荡器;ABI Gene AmpR 9700 PCR仪:美国伯乐公司;DYY-8C电泳仪:北京六一仪器厂;JS-680C凝胶成像系统:上海培清科技有限公司;Zealway G154DW高压蒸汽灭菌锅:美国Thermo Fisher Scientific公司。
1.3 实验方法
1.3.1 样品采集
样品的采集参考王欢等[12]方法。采集周期为1 d,从收堆后开始采集,直至堆积发酵堆的表层的酒醅温度达50 ℃时结束。由于不同轮次酒醅堆积时间不同,最终1~7轮次酒醅分别堆积3 d、6 d、6 d、4 d、3 d、2 d、2 d。以一轮次为例说明取样情况,如图1所示,采取同一天的A点(堆积发酵堆上层中点),B、C点(中层堆中心和堆表层部位的内表层),D、E点(下层堆中心和堆表层部位的内表层)后,立即用无菌袋包装,并将采集的所有样品均匀混合,-20 ℃保存。再将上述同一轮次酒醅的采集样品等份量混合均为1个样品(一天所采5个单样品等量混合均匀代表一天采集酒醅的样品,再将每一轮次酒醅每一天采集的样品再次等量混合均匀作为该轮次堆积样品),最终,1~7轮次酒醅共获得7个最终混合样品(本研究1~7轮次酒醅总共取样26 d,编号为1DJ~7DJ,每轮次取5个点,共采集酒醅样品130个小样)。

图1 堆积酒醅取样示意图
Fig. 1 Schematic diagram of sampling of stacked fermented grains
1.3.2 DNA提取
DNA提取前处理的方法与文献[12]一致。具体的酒醅总DNA提取步骤参考土壤DNA提取试剂盒(E.Z.N.A.Soil DNA Kit)操作说明书。
1.3.3 聚合酶链式反应扩增及Illumina Hi Seq高通量测序
采用引物ITS1F(5'-CTTGGTCATTTAGAGGAAGAGAA-3')和ITS2R(5'-GCTGCGTTCTTCATCGATGC-3')PCR扩增ITS区基因序列。PCR扩增体系(20 μL):0.8 μL正向引物,0.8 μL反向引物,2 μL 10×Buffer,2 μL脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphates,dNTP),0.2 μL rTaq DNA聚合酶,2 μL模板DNA和12.2 μL无菌双蒸水(ddH2O)。PCR扩增条件:95 ℃预变性3 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s,共循环35次;72 ℃再延伸10 min。随后,用2%琼脂糖凝胶电泳检测PCR产物。随后将DNA送至上海美吉使用Illumina HiSeq平台(中国上海美吉生物技术有限公司)进行高通量测序。
1.3.4 理化指标的测定
水分测定采用烘干法,采用酸碱滴定法测定酸度,采用斐林试剂法测定淀粉、还原糖。具体参照文献[12]。
1.3.5 数据处理
基于Illumina Miseq测序平台中的R语言绘制群落组成图、Heatmap图、冗余分析图,柱状图利用Origin 9.0软件进行绘制。
2 结果与分析
2.1 酱香型白酒不同轮次酒醅理化指标分析结果
酱香型白酒的理化指标是鉴定不同轮次酒醅是否发酵成熟的标准,反映着酱酒的品质高低,而理化指标是主要受生产工艺和发酵时间的影响,不同轮次的工艺参数不一致,因此对不同轮次的堆积酒醅理化指标进行了测定,深入解析理化指标引起的群落多样性的变化,结果见图2。
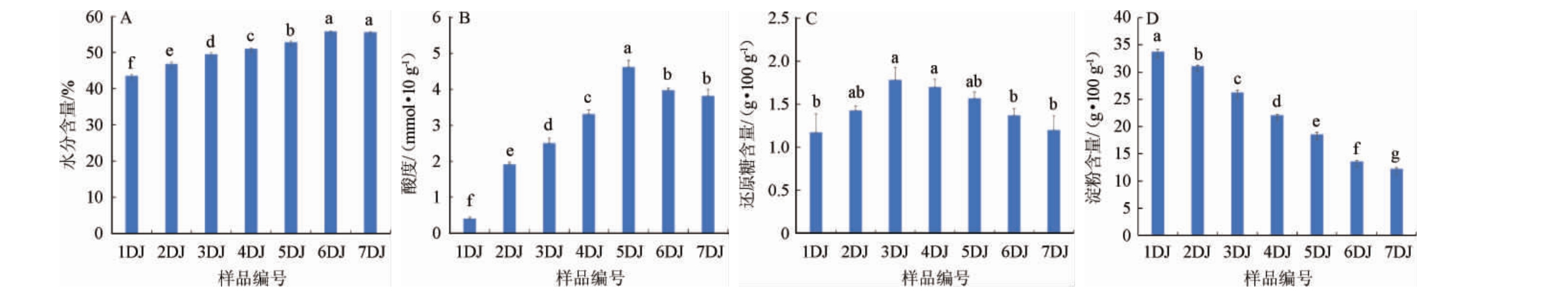
图2 酒醅样品理化指标的变化
Fig. 2 Change of physicochemical indexes of Jiupei samples
不同字母表示差异性显著(P<0.05)。
如图2A所示,糟醅水分含量随着轮次的增加显著地增加(P<0.05),在第6轮次时达到最大值,而后保持平衡。酸度主要是产酸菌进行有机酸的代谢、生成其他酸性物质进而营造酸性环境。其在防止杂菌污染的同时,可将有机酸类物质作为主要风味物质,且为酯类物质的生成提供丰富的前体[13]。张健等[14]发现,总酸与白酒香气强度和协调性呈强正相关。如图2B所示,与水分含量相似,酱香型白酒堆积发酵过程中酸度先增加后降低,在第5轮次达到最高值,第6轮次显著降低而后保持稳定。还原糖经淀粉酶、糖化酶等分解淀粉而生成,是微生物发酵的主要能量来源,酱香型白酒酿造是边糖化边发酵的过程,酒醅中还原糖的含量在一定程度上可以反应酒醅发酵速度以及发酵情况,是衡量发酵质量的重要指标之一。如图2C所示,2~5轮次酒醅的还原糖含量较高,且彼此没有显著性差异(P>0.05),而3、4轮次与1、6、7轮次存在显著性差异,这也与实际生产中的发酵质量相吻合。淀粉是酒精及其他代谢产物的物质基础,酒醅的淀粉含量能有效反映出原料中淀粉是否利用充分及酒醅是否需要继续发酵,如图2D所示,随着轮次的增加,淀粉含量显著降低(P<0.05),这是因为随着发酵轮次的增加,淀粉不断的被分解成小分子物质供微生物利用,这也与生产实践相吻合。
2.2 真菌群落组成分析
2.2.1 在门水平上的分布
基于Illumina Miseq测序在机械化酿造7个轮次酒醅中共检出真菌4个门,102个属,185个OTU,酒醅样品中真菌群落结构在门水平上的分布结果见图3。
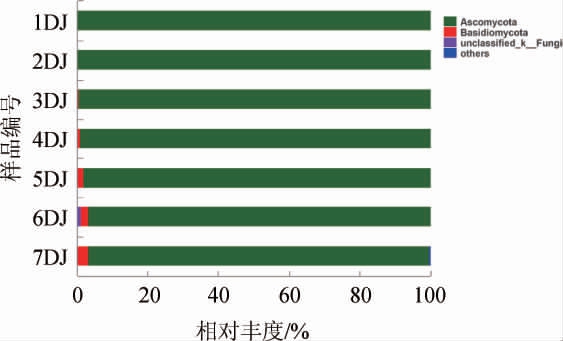
图3 酒醅样品中真菌群落结构在门水平上的分布
Fig. 3 Fungal community structure of Jiupei samples at phylum level
如图3所示,子囊菌门(Ascomycota)在不同轮次酒醅堆积发酵过程中占绝对优势地位(相对丰度占96.57%~99.99%),且随着轮次的增加而减少。此外,研究表明Ascomycota是酱香型[15]、清香型[16]、浓香型[17]酿造酒醅的主要真菌,说明该菌门是中国白酒发酵过程中的关键真菌微生物种群。担子菌门(Basidiomycota)在前三轮次酒醅基本未检出,从第四轮次开始含量增加。
2.2.2 在属水平上的分布
酒醅样品中真菌群落结构在属水平上的分布见图4。由图4可知,从机械化酿造1~7轮次堆积发酵过程共检出真菌102个真菌属,而成品曲中检出60个真菌属[18],说明在堆积发酵过程富集了42个真菌属。
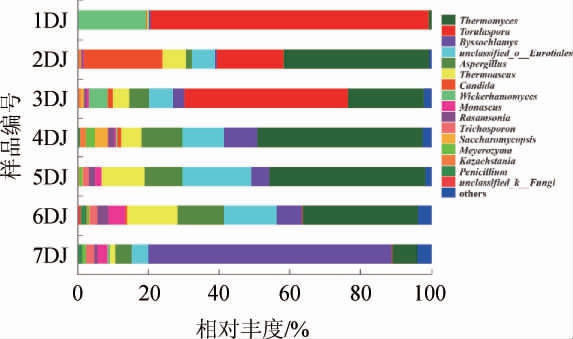
图4 酒醅样品中真菌群落结构在属水平上的分布
Fig. 4 Fungal community structure of Jiupei samples at genus level
1~7轮次酒醅中分别检出23、34、62、35、40、35和50个属,说明7个轮次堆积发酵酒醅样本中的主要真菌群落组成存在较大的差异。其中,一轮次堆积发酵酒醅中的优势真菌属(>1%)有2个,分别为有孢圆酵母属(Torulaspora)和威克汉姆酵母属(Wickerhamomyces);二轮次有6个,包括嗜热真菌属(Thermomyces)、假丝酵母属(Candida)、有孢圆酵母属(Torulaspora)等,三轮次有8个,包括有孢圆酵母属(Torulaspora)、嗜热真菌属(Thermomyces)等;四轮次有9个,包含嗜热真菌属(Thermomyces)、曲霉属(Aspergillus)等;五轮次有9个,为嗜热真菌属(Thermomyces)、嗜热子囊菌属(Thermoascus)等;六轮次有10个,分别为嗜热真菌属(Thermomyces)、嗜热子囊菌属(Thermoascus)、曲霉属(Aspergillus)等;七轮次有8个,包括丝衣霉属(Byssochlamys)、嗜热真菌属(Thermomyces)、曲霉属(Aspergillus)等。
各个轮次堆积酒醅中没有共有的优势菌属,但嗜热真菌属(Thermomyces)、嗜热子囊菌属(Thermoascus)、曲霉属(Aspergillus)、有孢圆酵母属(Torulaspora)、丝衣霉属(Byssochlamys)、假丝酵母属(Candida)和威克汉姆酵母属(Wickerhamomyces)的相对丰度较高(>10%)。且嗜热真菌属(Thermomyces)是酱香型白酒大曲[19]中的优势真菌,是白酒酿造过程中重要酶类的来源,可促进微生物的生长繁殖以及产酒生香[4]。嗜热子囊菌属(Thermoascus)能够产生热稳定的水解酶,降解原料中的淀粉或纤维素,是白酒酿造过程不可或缺的重要菌属[20]。曲霉属(Aspergillus)为酱香型白酒酒醅、酱香大曲[21]的优势菌属,能产生多种酶类,可调控大曲和酒醅的糖化力、酯化力、液化力,是公认的功能菌。同时其可通过代谢有机酸、脂肪酸,促成芳香酯类物质的生成,以提升和改善酒体风味[22]。孢圆酵母属(Torulaspora)能产生大量的高级醇、酯类物质、酸类物质等,可明显提高酒中乙基酯类的含量,增加酒体的果香味[23],其在酱香型白酒[24]中均检测出。丝衣霉属(Byssochlamys)随着发酵轮次的进行逐渐增多(0.34%~69.03%),产生该现象的原因可能是发酵酒醅的酸度变化为该菌的生长提供了适宜的条件[25]。Byssochlamys能产生耐热的子囊孢子[26],该菌属在酱香型白酒酿造酒醅中[10]和大曲中均可检出[27]。假丝酵母属(Candida)在机械化酿造堆积的二轮次中丰度较高,在第五轮次中则几乎未检测出,温度的变化是导致该现象的主要原因[28],Candida是酱香型白酒堆积和窖池发酵酒醅优势真菌属[10],对提升酒体品质具有重要作用。威克汉姆酵母属(Wickerhamomyces)只在一轮次的堆积酒醅中丰度较高,是重要的生香酵母属,耐高酸度[29]且产酯能力强[30],主要来源于大曲的添加。综合其丰度和功能,上述真菌属被认为是酱香型白酒机械化堆积过程中的重要真菌属,说明在酱香型白酒堆积发酵过程存在稳定的微生物结构演替,从而为酒醅的发酵提供内在的动力。
由于各轮次发酵酒醅的不断蒸煮糊化以及发酵环境的改变,使得7个轮次酒醅中的微生物群落结构存在一定的差异。其中一、二轮次堆积酒醅样品中的真菌种类相对较少,而从三轮次开始,真菌群落逐渐增多;另外,1~3个轮次堆积酒醅中的真菌主要以酵母菌为主,4~7轮次中则以霉菌为主,产生这种现象的原因可能是酒醅经过机械化的输送和堆积,在很大程度上会增大其水分含量和糟醅黏性,使得发酵后期的酵母生长受到抑制。七个轮次机械化堆积的发酵时间以及发酵环境不同,导致其微生物结构组成不同,这也是形成不同酒体风格的重要原因之一。
2.3 环境因子对酒醅真菌群落组成结构的影响
微生物的生命活动离不开环境因子的调控,因而环境因子对于酱香型白酒机械化酿造过程中的真菌菌群结构组成有着密切的关系,环境因子对酒醅真菌群落结构的影响见图5。
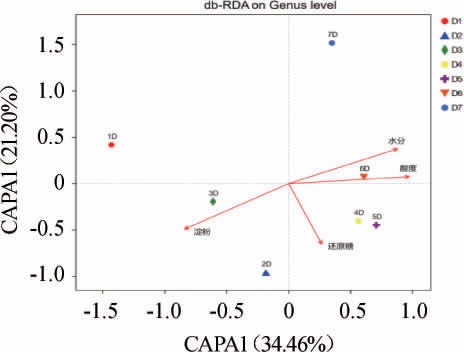
图5 环境因子对酒醅样品真菌群落结构的影响
Fig. 5 Effects of environmental factors on fungal communities of Jiupei samples
由图5可知,水分、酸度、还原糖、淀粉含量对微生物群落结构有着重要的影响,其中淀粉含量与酸度和水分负相关(环境因子箭头间的夹角为钝角),淀粉和还原糖之间以及还原糖与水分之间关联性不强(环境因子箭头间的夹角接近直角),而水分和酸度含量、还原糖和酸度呈现正相关(环境因子箭头间的夹角为锐角),且微生物受淀粉含量、水分和酸度的影响较大(投影点距离原点的距离较远)。其中,不同轮次的真菌菌群结构受淀粉含量影响较大,随着轮次的增加,与淀粉含量的相关性从正相关走向负相关,这主要是因为上一节中说明在不同轮次中存在稳定的霉菌结构,其可直接利用淀粉,分解淀粉为小分子物质为其他微生物提供养料,随着发酵轮次的增加,酒醅中的淀粉已经消耗殆尽,发酵进入尾声,没有更多的发酵底物供给微生物生长。1~3轮次酒醅发酵的微生物结构与水分负相关,而4~7轮次酒醅与水分正相关。这是因为不同轮次酒醅发酵过程的环境温度在逐步增加,且随着轮次的增加,酒醅不断的蒸煮,其保水能力变弱。1~3轮次酒醅发酵过程微生物菌群结构与酸度呈负相关,而4~7轮次酒醅与酸度呈正相关,随着发酵的进行,产酸微生物代谢酸类化合物使得酸度不断的增加。一轮次和七轮次酒醅的微生菌群结构与还原糖含量呈负相关,其他轮次对于微生物的结构的影响较小。生产实践表明,一轮次和七轮次的酒质不好这也许与还原糖的含量有关。
2.4 环境因子与微生物关联性分析
为进一步探究环境因子对哪些菌属的影响较大,进而方便控制参数来保证发酵的正常运行。将微生物菌属与环境因子进行关联性分析,真菌群落与环境因子的相关性热图见图6。
由图6可知,大部分菌属与水分、酸度及还原糖呈正相关,而与淀粉含量呈负相关。其中,红曲霉属(Monascus)、Rasamsonia、Trichosporon、Penicillium、Microascus与水分和酸度呈显著或极显著正相关(P<0.01),而与淀粉含量呈显著负相关(P<0.05)。红曲霉属(Monascus)是酱香型白酒酿造中主要霉菌,具有一定的糖化发酵力和较强的酯化力,在发酵过程中能产生多种酶类,如蛋白酶、淀粉酶、糖化酶等,对提高出酒率、增加酯类化合物的生成具有积极影响。同时,还可产生多种对人体有益的次级代谢产物,如红曲色素、γ-氨基丁酸等[31]。Rasamsonia在酱香型白酒大曲中检出,该菌属能耐高温,有利于淀粉的分解[32]。Trichosporon是酱香型白酒酿造过程中公认的产多元醇的功能酵母[33],Penicillium在酱香型白酒在传统酿造过程中均能检测到,其产生的酶种类较丰富且齐全,主要是蛋白酶、纤维素酶、酯化酶,此外还其代谢物大多具有抑菌作用[34]。Microascus在酱香型白酒大曲中检出[35]。而丰度较大的菌属,如Thermomyces、Thermoascus、Aspergillus、Candida 和Wickerhamomyces,其受环境因子的影响较小。而Torulaspora与酸度呈负相关,Byssochlamys与淀粉呈负相关。上述结果表明,在机械化酿造堆积发酵过程中,重要真菌属和优势菌属受环境因子的调控不大,从而保证发酵的底物充足,而不同轮次又存在着与水分、淀粉含量和酸度紧密相关的菌属,其随着环境的变化而变化,从而动态的调控着酿造发酵的正常进行。
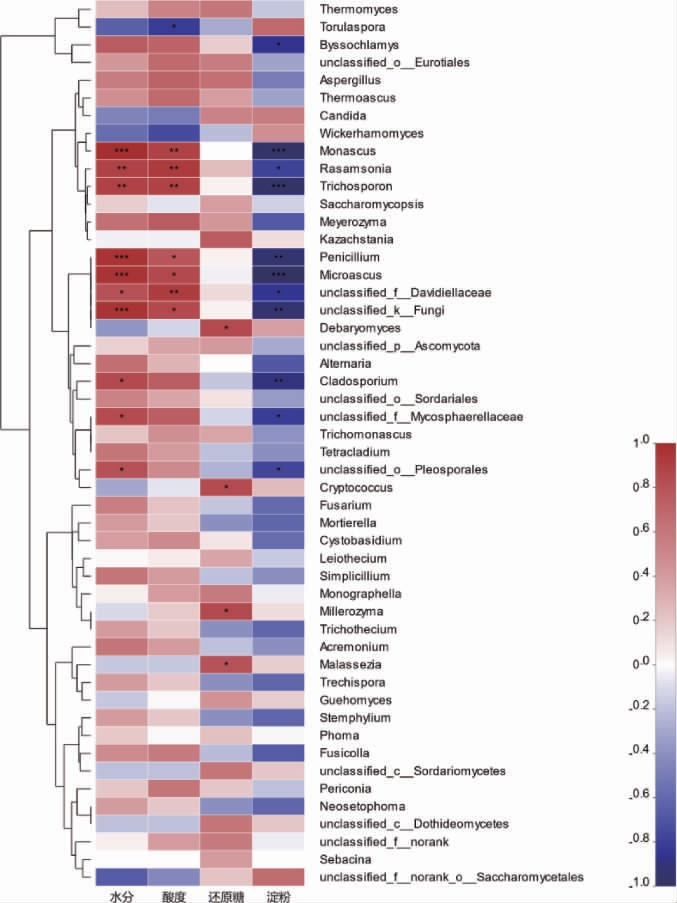
图6 真菌群落与环境因子的相关性热图
Fig. 6 Heatmap of correlation between fungal communities and environmental factors
“*”表示显著相关(0.01<P≤0.05),“**”表示极显著相关(0.001<P≤0.01),“***”表示高度显著相关(P≤0.001)。
3结论
本研究利用高通量测序及数理分析方法系统性的研究酱香型白酒机械化酿造不同轮次堆积发酵酒醅中的真菌菌群结构特征,七个轮次酒醅中共检出真菌4个门,102个属,185个OTU。Thermomyces、Thermoascus、Aspergillus、Torulaspora、Byssochlamys、Candida 和Wickerhamomyces 被认为是酱香型白酒机械化堆积过程中的重要真菌属。酱香型白酒机械化酿造过程中的真菌微生物受淀粉含量、水分和酸度的影响较大。其中随着轮次的增加,真菌的菌群结构与淀粉含量的相关性从正相关变为负相关,1~3轮次发酵酒醅的微生物结构与水分和酸度负相关,而4~7轮次发酵酒醅与水分和酸度正相关。一轮次和七轮次酒醅的微生菌群结构与还原糖含量呈负相关,其他轮次对于微生物的结构的影响较小。在机械化酿造堆积发酵过程中,重要的菌属受环境因子的调控不大,但不同轮次存在着与水分、淀粉含量和酸度紧密相关的菌属,保证动态的调控酿造发酵过程。本研究通过高通量测序技术系统解析了机械化酿造堆积酒醅中的主要真菌群落结构变化,揭示了机械化堆积在真菌群落结构组成,为全面实现酱香型白酒机械化酿造提供了理论依据。
[1]张志刚,晓文,佳龙,等.遵义2020 年1—6 月规模以上白酒企业实现产值525.05 亿元[J].酿酒科技,2020(11):85.
[2] HUANG Y, WANG Y, XU Y. Purification and characterisation of an acid protease from the Aspergillus hennebergii HX08 and its potential in traditional fermentation[J].J I Brewing,2017,123:432-441.
[3]尚柯.酱香型白酒高温堆积工艺机理的初步研究[D].乌鲁木齐:新疆农业大学,2016.
[4]吴徐建.酱香型白酒固态发酵过程中酵母与细菌群落结构变化规律的研究[D].无锡:江南大学,2013.
[5]王晓丹,庞博,陆安谋,等.酱香型白酒堆积过程中酵母变化趋势研究[J].食品工业,2014(12):42-44.
[6]韩兴林,潘学森,尚柯,等.酱香高温堆积酒醅中原核微生物构成的分析[J].酿酒,2017,44(1):22-27.
[7]张建敏,黄永光,周文美,等.一株酱香型白酒堆积发酵酒醅中Streptomyces flocculus 菌株的分离与鉴定[J].酿酒科技,2014(6):16-19.
[8]黄永光,谌永前,吴广黔,等.酱香白酒堆积发酵过程酒醅中酵母菌的分析研究[J].酿酒科技,2013(6):8-13.
[9]LEE M,SONG J H,PARK J M,et al.Bacterial diversity in Korean temple kimchi fermentation[J].Food Res Int,2019,126:108592.
[10]黄蕴利,黄永光,胡建峰,等.酱香型白酒第二轮次酒发酵过程微生物多样性研究[J].中国酿造,2017,36(9):30-35.
[11]郭敏,黄永光,邱树毅,等.高通量测序在酱香白酒微生态多样性研究中的应用[J].中国酿造,2017,36(5):146-151.
[12]王欢,席德州,黄永光,等.酱香型白酒机械化酿造不同轮次堆积发酵细菌菌群结构多样性研究[J].食品科学,2020,41(2):1-13.
[13]汤道文,朱永侠,谢玉球.白酒总酸测定的问题探讨[J].酿酒科技,2006(2):97-98.
[14]张健,高海燕,赵镭,等.白酒理化指标及其与香气品质的关系[J].食品科学,2010,31(10):283-286.
[15]SONG Z,DU H,ZHANG Y,et al.Unraveling core functional microbiota in traditional solid-state fermentation by high-throughput amplicons and metatranscriptomics sequencing[J].Front Microbiol,2017,8:1-14.
[16]LI X R,MA E B,YAN L Z,et al.Bacterial and fungal diversity in the traditional Chinese liquor fermentation process[J]. Int J Food Microbiol,2011,146(1):31-37.
[17]ZHANG W X,QIAO Z W,TANG Y Q,et al.Analysis of the fungal community in zaopei during the production of Chinese Luzhou-flavour liquor[J].J I Brewing,2012,113(1):21-27.
[18]DU H,WANG X,ZHANG Y,et al.Exploring the impacts of raw materials and environments on the microbiota in Chinese Daqu starter[J].Int J Food Microbiol,2019,297:32-40.
[19]郭敏.基于高通量测序对酱香大曲制曲微生态多样性的研究[D].贵阳:贵州大学,2018.
[20] JAIN K K, BHANJA D T, KUMAR S, et al. Production of thermostable hydrolases(cellulases and xylanase)from Thermoascus aurantiacus RCKK:a potential fungus[J].Bioprocess Biosystem Eng,2015,38(4):787-796.
[21]黄永光.酱香型白酒酿造中Aspergillus hennebergii 及其分泌酸性蛋白酶的研究[D].无锡:江南大学,2014.
[22]DORNIN S,HÖLZEL C S,JANKE T,et al.PCR-SSCP-based reconstruction of the original fungal flora of heat-processed meat products[J]. Int J Food Microbiol,2013,162(1):71-81.
[23]原苗苗,姜凯凯,孙玉霞,等.戴尔有孢圆酵母对葡萄酒香气的影响[J].食品科学,2018,39(4):99-104.
[24]邵明凯,王海燕,徐岩,等.酱香型白酒发酵中酵母群落结构及其对风味组分的影响[J].微生物学通报,2014,41(12):2466-2473.
[25]PUEL O,TADRIST S,GALTIER P,et al.Byssochlamys nivea as a source of mycophenolic acid[J].Appl Environ Microbiol,2005,71(1):550.
[26]HOUBRAKEN J,SAMSON R J.Byssochlamys:significance of heat resistance and mycotoxin production[J].Adv Exp Med Biol,2006,571:211.
[27]胡佳音,周森,赵卫鹏,等.清、浓、酱三种大曲真菌多样性初步分析[J].酿酒科技,2016(8):87-90.
[28] TAN T,ZHANG M,WANG B, et al. Screening of high lipase producing Candida sp.and production of lipase by fermentation[J].Process Biochem,2003,39(4):459-465.
[29]YOU L,WANG S,ZHOU R,et al.Characteristics of yeast flora in Chinese strong-flavoured liquor fermentation in the Yibin region of China[J].J I Brewing,2016,122(3):517-523.
[30]周靖.红曲霉在白酒产业中的应用现状及展望[J].酿酒科技,2019(3):107-109.
[31]李雪梅,沈兴海,段震文,等.红曲霉代谢产物的研究进展[J].中草药,2011,42(5):1018-1025.
[32]YI Z,JIN Y,XIAO Y,et al.Unraveling the contribution of high temperature stage to jiang-flavor Daqu,a liquor starter for production of Chinese jiangflavor Baijiu, with special reference to metatranscriptomics[J]. Front Microbiol,2019,doi:10.3389/fmicb.2019.00472.
[33]白小燕,邱树毅,雷安亮,等.酱香白酒酿造过程中产多元醇功能酵母的筛选[J].中国酿造,2017,36(5):58-62.
[34]徐佳,邱树毅,胡宝东,等.酱香型白酒酿造过程中霉菌的功能性研究[J].酿酒,2015,42(5):32-38.
[35] CHEN B, WU Q, XU Y. Filamentous fungal diversity and community structure associated with the solid state fermentation of Chinese Maotai-flavor liquor[J].Int J Food Microbiol,2014,179:80-84.
