哺乳动物在刚出生时,其胃肠道微生物是一个极其复杂的系统,并且在不同物种甚至个体之间都有极大的不同[1-2]。乳酸菌是一种可发酵糖类物质、以乳酸为主要代谢产物的细菌,因其对人类有潜在的益生作用为人们广泛研究[3-5]。如今许多研究涉及乳酸菌的益生性,如乳酸菌与宿主肠粘膜相互作用而引起的免疫刺激和调节作用,以及提高宿主抗致病性渗透等功能[6-7]。乳酸菌在动物胃肠道系统中广泛存在,并且在维持动物健康和生长方面有重要作用[8]。
海南黑山羊历史悠久,品质优良,因其味道鲜美、口味独特以及膻味小等特点深受当地及两广地区消费者的喜爱[9]。黑山羊作为反刍动物,体内微生物种类丰富,焦金真等[10]研究了浏阳黑山羊胃肠道不同部位微生物数量的分布特征,结果表明瘤胃中微生物数量最多,盲肠、结肠、直肠居中,回肠次之,十二指肠和空肠最少。袁静[11]采用脉冲场凝胶电泳等技术构建黑山羊瘤胃未培养微生物BAC宏基因组文库,筛选到了纤维素酶克隆。张万昌等[12]从黑山羊瘤胃液中筛选到3株代表乳酸菌,分别是耐久肠球菌(Enterococcus durans)、植物乳杆菌(Lactobacillus plantarum)、干酪乳杆菌(Lactobacillus casei)。
本研究从海南省澄迈县黑山羊小肠和直肠中分离、纯化乳酸菌,采用形态观察、生理生化试验和分子生物学方法进行鉴定,并探究其生长性能、产酸性能,酸、温度、盐耐受性能及对致病菌的抑菌能力,旨在筛选出优良的乳酸菌,为黑山羊的养殖提供良好的菌种资源。
1 材料与方法
1.1 材料与试剂
1.1.1 材料和菌株
黑山羊小肠与直肠:海南省澄迈县黑山羊养殖场。
金黄色葡萄球菌(Staphylococcus aureus)、单核细胞增生李斯特氏菌(Listeria monocytogenes)、大肠埃希氏菌(Escherichia coli)、枯草芽孢杆菌(Bacillus subtilis):海南大学食品科学与工程学院食品生物技术实验室。
1.1.2 试剂
乙酸钠、磷酸氢二钾、氯化钠(均为分析纯)、二甲基亚砜(化学纯):广州化学试剂厂。
1.1.3 培养基
MRS液(固)体培养基:广东环凯微生物科技有限公司;营养琼脂培养基、营养肉汤培养基:北京奥博星生物技术有限责任公司。
1.2 仪器与设备
SW-CJ-17-D超净工作台:苏州佳宝净化工程设备有限公司;PHS-3E型精密pH计:上海雷磁仪器厂;MDF-382E型超低温冰箱:日本三洋电机株式会社;YM50FGN全自动高压灭菌锅:上海沪誉贸易有限公司;XSP-C204光学显微镜:重庆光电仪器有限公司;SKP-01电热恒温培养箱:湖北省黄石恒丰医疗器械有限公司;LC-LX-HR185高速冷冻离心机:桂林市仪器设备有限公司。
1.3 方法
1.3.1 乳酸菌的分离
在无菌条件下分别吸取黑山羊小肠与直肠的肠道液,用无菌生理盐水进行梯度稀释,选取10-3、10-4、10-5 3个稀释梯度,各吸取100 μL涂布于含有1.5%碳酸钙的MRS固体培养基上,37 ℃厌氧培养48 h。挑取溶钙圈明显且较大的单菌落划线于MRS固体培养基上,37 ℃培养48 h,反复纯化多次,将纯化得到的单菌落在-80 ℃保存。
1.3.2 乳酸菌的鉴定
形态观察[13-14]:观察单菌落的色泽、形态、大小,并进行革兰氏染色实验和过氧化氢酶触实验,初步确定菌株是否为疑似乳酸菌菌株。
生理生化实验[15-19]:对所筛选的疑似乳酸菌进行葡萄糖产气试验、明胶液化试验、硝酸盐还原试验,以确定菌种种属的划分。
分子生物学鉴定:根据生理生化结果和形态学特征将菌株进行分组,并选取代表菌株送至华大公司进行测序,将测序结果提交至美国国家生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库采用基本局部比对搜索工具(basic local alignment search tool,BLAST)进行比对搜索,选择序列同源性较高的菌株的16S rRNA基因序列,采用MEGA5软件中的邻接(neighborjoining,NJ)法构建系统发育树[20],分析分离菌株与已知菌株的同源性。
1.3.3 生长曲线及产酸曲线的测定
将供试菌种以1%(V/V)的接种量接入MRS液体培养基中,每株供试菌做3组平行,置于37 ℃恒温培养,每隔2 h取样,测定各菌种发酵液的pH以及OD600nm值[12],绘制产酸曲线和生长曲线[21]。
1.3.4 耐受性测定
将供试菌种以1%(V/V)的接种量接种于MRS液体培养基中,分别在5 ℃、10 ℃、15 ℃、45 ℃、50 ℃条件下培养48 h,观察生长状况。
将供试菌种以1%(V/V)的接种量接种于不同pH值(2.5、3.0、3.5、4.0、4.5和7.0)的MRS液体培养基中,37 ℃条件下培养48 h,观察其生长状况。
将供试菌种以1%(V/V)的接种量接入含不同NaCl含量(3.0%、6.5%)的MRS液体培养基中,37 ℃条件下培养48 h,观察其生长状况。
1.3.5 抑菌能力的测定
指示菌株的活化:将大肠杆菌、金黄色葡萄球菌、单核细胞增生李斯特氏菌和沙门氏菌分别划线于营养琼脂培养基,37 ℃培养48 h。然后挑取单菌落接种于营养肉汤培养基中,37 ℃、180 r/min条件下培养24 h。将菌体浓度调整为1×107 CFU/mL作为指示菌悬液。
上清液的制备:以1%(V/V)的接种量将乳酸菌种子液接种于MRS液体培养基中,37 ℃条件下静置培养12 h,10 000 r/min离心2 min后取上清液,4 ℃保存备用[22]。
牛津杯法测定抑菌性能[4,23-24]:向培养皿中倾注15 mL灭菌后的2%营养琼脂培养基,水平静置凝固后,接种100 μL指示菌菌液,涂布均匀后备用。用镊子将牛津杯垂直培养基表面均匀放置,牛津杯中加入100 μL乳酸菌上清液,4 ℃扩散2 h后37 ℃恒温培养24 h。根据抑菌圈直径大小判断菌株抑菌性能。抑菌圈直径>7 mm时,判定为有抑菌作用。
2 结果与分析
2.1 乳酸菌的形态特征与生理生化试验结果
从海南黑山羊小肠和直肠中共分离得到32株有明显溶钙圈的菌株,革兰氏染色呈阳性,H2O2触酶试验呈阴性,初步确定为乳酸菌。菌株在MRS固体培养基上均呈现为圆形、中央凸起、表面光滑湿润、边缘整齐的白色小菌落。将乳酸菌菌株进行一系列生理生化鉴定试验,根据其形态特征和生理生化特性将32株菌株分成5类,分别为A类(8株菌)、B类(8株菌)、C类(6株菌)、D类(6株菌)、E类(4株菌),选取A类的代表菌株HCS6-1(细胞呈短杆状)、B类的代表菌株HCA6-2(细胞呈短杆状)、C类的代表菌株HCA5-3(细胞呈短杆状,成对存在)、D类的代表菌株HCS4-1(细胞呈椭圆状)及E类的代表菌株HCS4-3(细胞呈不规则的短棒状)进行进一步研究。5株代表菌株的生理生化试验结果见表1。由表1可知,5株代表菌株均不产气,明胶液化试验及硝酸盐还原试验均呈阴性。
表1 5株代表菌株的生理生化试验结果
Table 1 Physiology and biochemistry test results of 5 representative strains
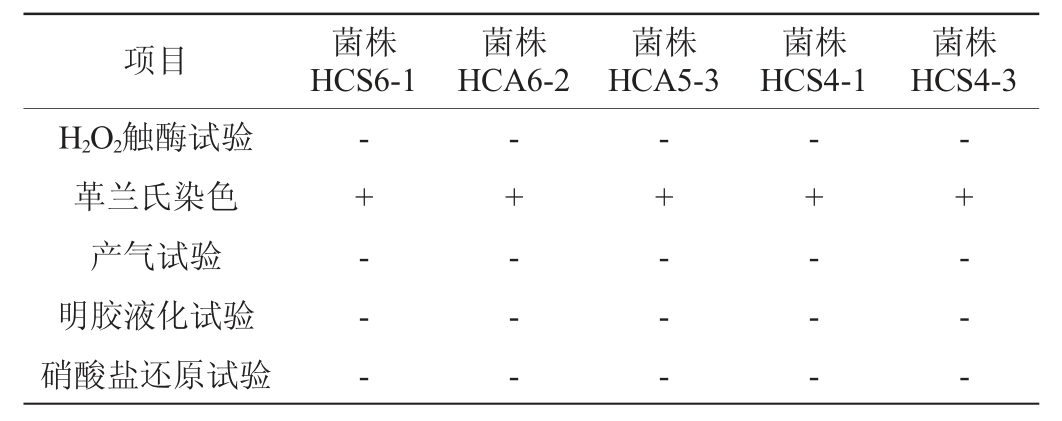
注:“+”表示结果呈阳性或产气,“-”表示结果呈阴性或不产气。
2.2 乳酸菌的分子生物学鉴定
5株代表菌株的系统发育树见图1,由图1可知,菌株HCS4-1、HCA5-3与发酵乳杆菌B35(GenBank登录号:LC094437.1)聚于一枝,亲缘关系最近,故将这两株菌株鉴定为发酵乳杆菌(Lactobacillus fermentum)。菌株HCS4-3与融合魏斯氏菌F213(GenBank登录号:MW035598.1)聚于一枝,亲缘关系最近,因此,将其鉴定为融合魏斯氏菌(Weissella confusa)。菌株HCS6-1、HCA6-2与植物乳杆菌BS16(GenBank登录号:JX968493.1)聚于一枝,亲缘关系最近,因此,将其鉴定为植物乳杆菌(Lactobacillus plantarum)。
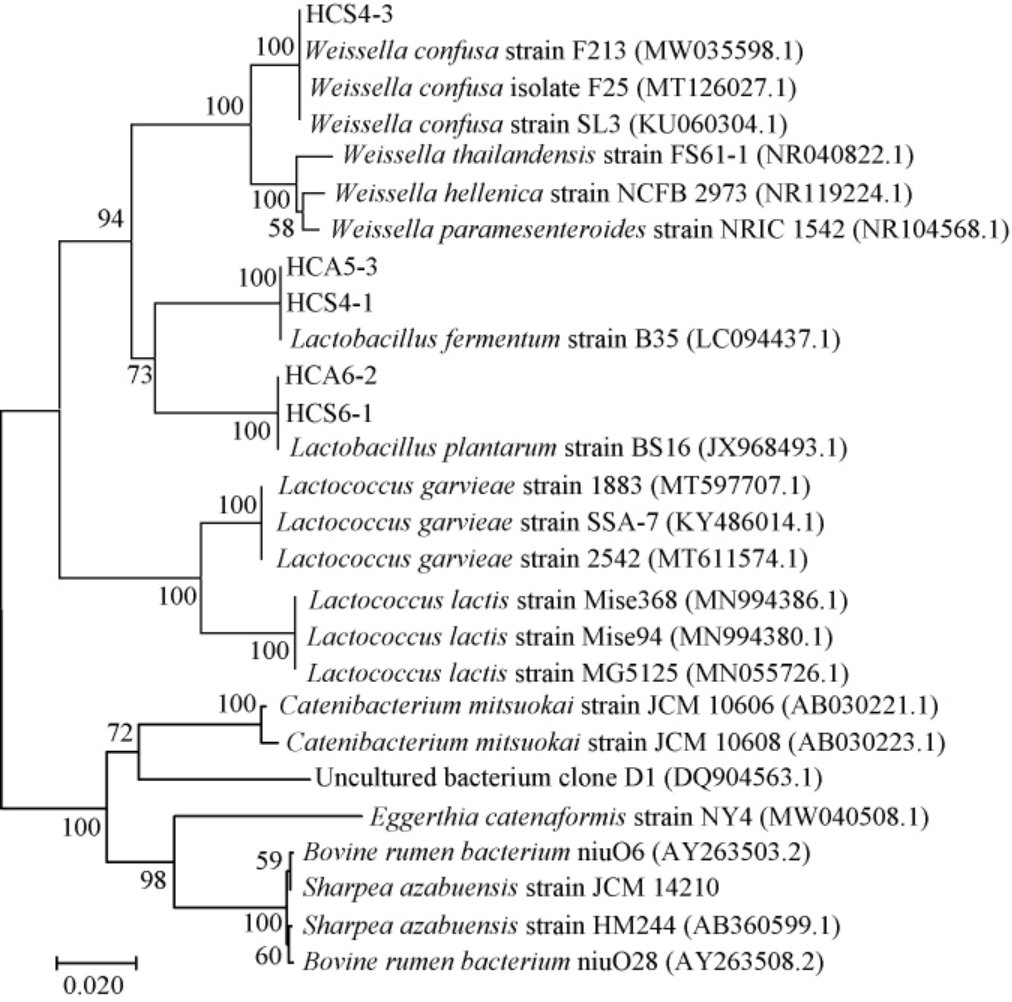
图1 基于16S rDNA基因序列5株代表菌株的系统发育树
Fig.1 Phylogenetic tree of 5 representative strains based on 16S rDNA gene sequences
2.3 乳酸菌生长曲线的测定结果
5株代表菌株的生长曲线见图2。
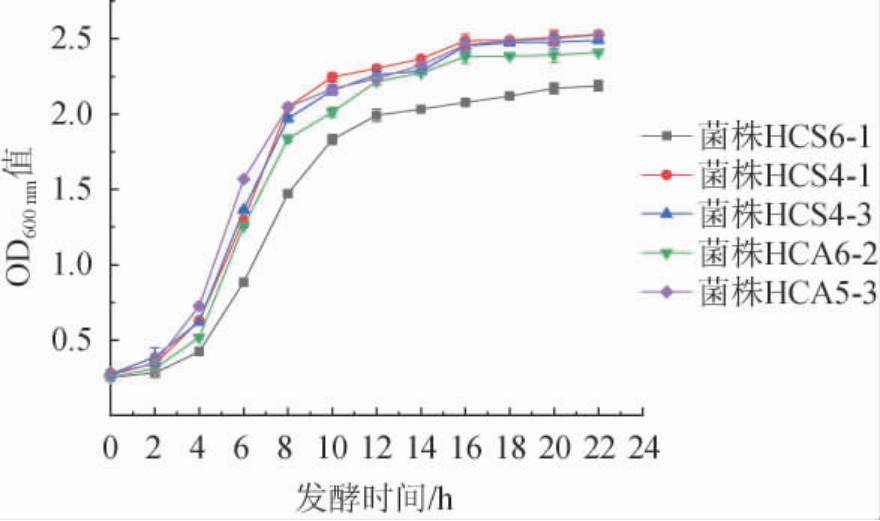
图2 5株代表菌株的生长曲线
Fig.2 Growth curve of 5 representative strains
由图2可知,5株代表菌株的生长趋势一致,迟滞期为0~4 h,菌株生长缓慢;4 h后进入对数生长期,菌种快速生长;到12 h后,进入稳定期,生长速率减缓;16 h后生长基本趋于稳定,整体趋向“S”型。由图2亦可知,相比其他菌种,菌株HCA5-3在对数期长势较快,菌株HCS6-1在对数生长期生长较平缓,达到稳定期后,菌株HCA5-3长势最好,菌株HCS6-1长势较差。
2.4 乳酸菌产酸曲线测定结果
5株代表菌株的产酸曲线见图3。
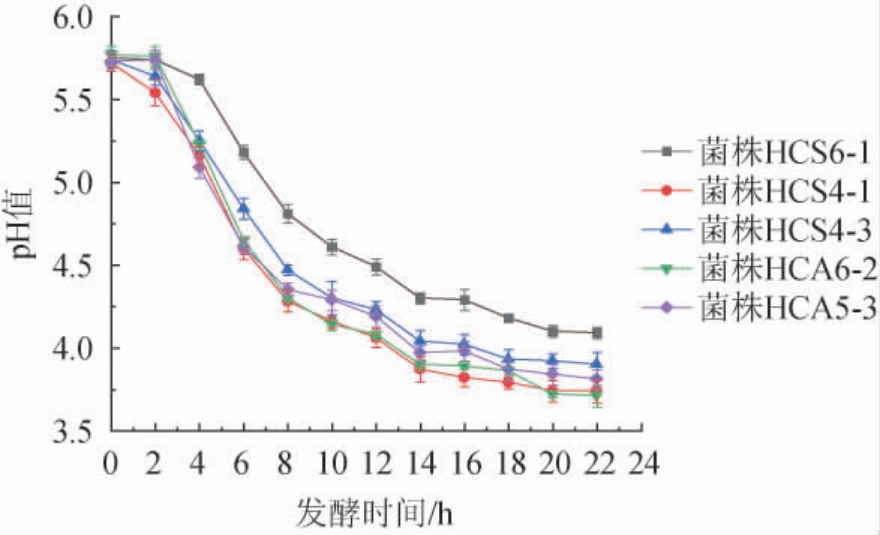
图3 5株代表菌株的产酸曲线
Fig.3 Acid production curve of 5 representative strains
由图3可知,发酵2~8 h,5株代表菌株产酸量明显增加,在14 h后进入稳定期,产酸效率减小,20 h后产酸量基本保持不变,pH基本保持恒定,整体呈现“S”型。其中菌株HCS4-1较其他菌株产酸速率较快,菌株HCA6-2产酸能力较强。
2.5 乳酸菌耐受性测定
5株代表菌株的酸、温度及盐耐受性见表2。
表2 5株代表菌株的耐受性
Table 2 Tolerance of 5 representative strains
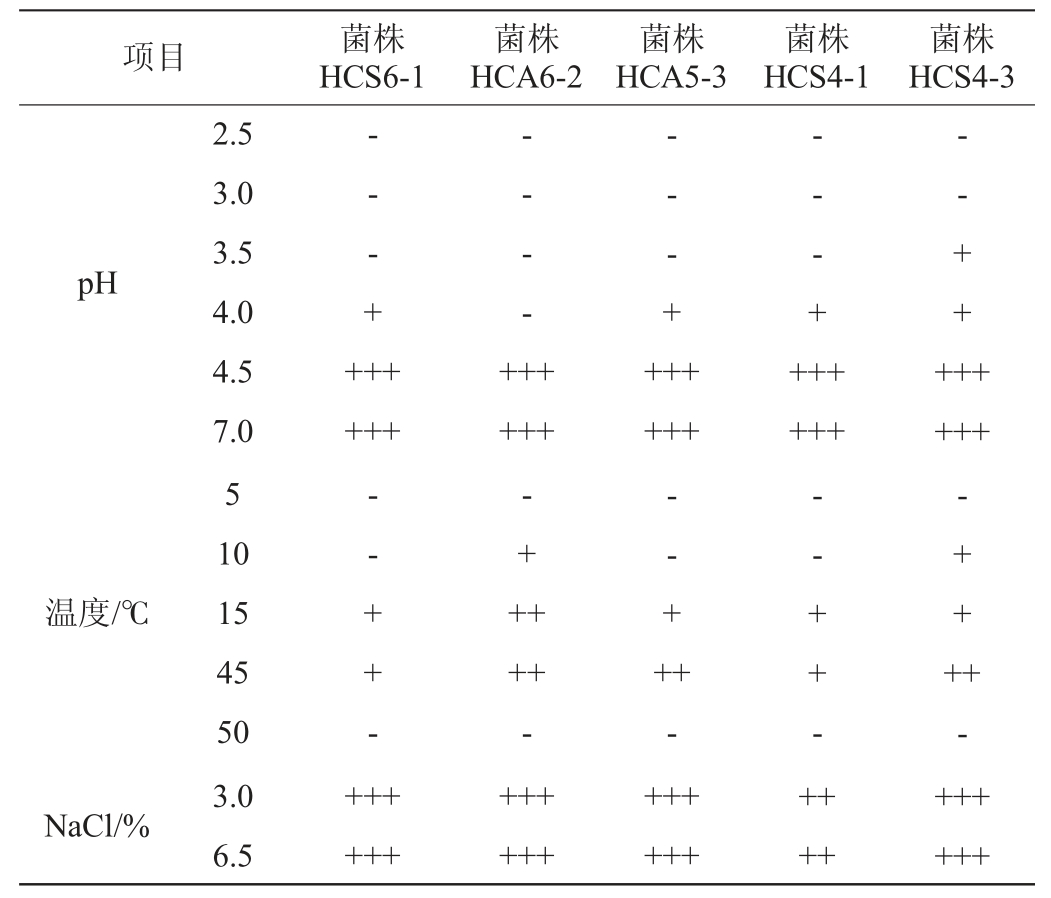
注:“-”表示不生长,“+”表示生长微弱,“++”表示生长良好,“+++”表示生长较好。
由表2可知,在耐酸试验中,随着环境pH值的升高,菌种生长状况逐渐变好。当pH<3.0之前,5株代表菌株均不能正常生长;当pH为3.5时,菌株HCS4-3生长微弱,其他代表菌株不能正常生长;当pH为4.0时,菌株HCA6-2不能正常生长,其他代表菌株均能微弱生长;当pH>4.0之后,5株代表菌株均生长较好。在耐温试验中,所有菌株在5 ℃、50 ℃环境不能正常生长,菌株HCA6-2、HCA5-3和HCS4-3在45 ℃时生长良好,耐高温能力较强,菌株HCA6-2、HCS4-3在10 ℃环境下可以微弱生长,有较好的耐低温能力。在耐盐试验中,所有菌株在3.0% NaCl和6.5% NaCl环境下长势较好,耐盐性能优良。结果表明,菌株HCS4-3耐酸性(pH为3.5)较好;菌株HCA6-2、HCA5-3和HCS4-3耐高温(45 ℃)能力较强,菌株HCA6-2、HCS4-3耐低温(10 ℃)能力较强;所有菌株耐盐性能较好。
2.6 乳酸菌抑菌能力的测定
5株代表菌株对大肠杆菌、金黄色葡萄球菌、沙门氏菌、单核细胞增生李斯特氏菌的抑菌能力见表3。
表3 5株代表菌株的抑菌能力
Table 3 Antibacterial activity of 5 representative strains
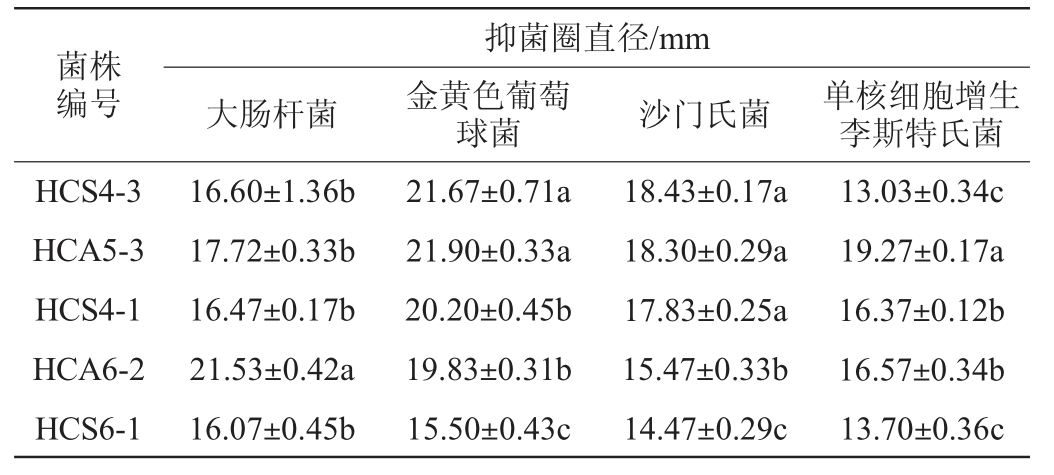
注:不同小写字母表示同列数据间的差异显著(P<0.05)。
由表3可知,5株代表菌株对致病菌的抑菌圈直径均>13 mm,抑菌效果明显。其中,菌株HCA6-2对大肠杆菌的抑菌效果较好,显著高于其他菌株(P<0.05),菌株HCA5-3对金黄色葡萄球菌、沙门氏菌、单核细胞增生李斯特氏菌的抑菌效果较好(P<0.05),显著高于其他菌株。
综上,菌株HCA5-3、HCS4-1、HCA6-2在生长、产酸、耐受性以及抑菌性能方面表现优良,后续可作为黑山羊饲料添加剂应用到青贮饲料以及畜牧养殖中[25]。
3 结论
本研究从海南省澄迈县黑山羊小肠与直肠中共分离到32株乳酸菌,根据菌株形态及生理生化试验结果将32株乳酸菌归为5类,从中选取5株代表菌株进行分子生物学鉴定。经鉴定,2株为发酵乳杆菌(Lactobacillus fermentum),2株为植物乳杆菌(Lactobacillus plantarum),1株为融合魏斯氏菌(Weissella confusa)。5株代表菌株中,菌株HCA5-3长势较好,菌株HCS4-1产酸速率较快,菌株HCA6-2产酸能力较强。耐受性试验中,菌株HCS4-3可以在pH 3.5环境下生长,耐酸能力较好;菌株HCA6-2、HCA5-3和HCS4-3在45 ℃环境下生长良好,耐高温能力较强,菌株HCA6-2、HCS4-3在10 ℃环境下可以生长,耐低温能力较强;5株菌株在6.5% NaCl环境下长势基本较好。在抑菌试验中,5株代表菌株对致病菌均有抑制作用,其中,菌株HCA5-3对金黄色葡萄球菌、沙门氏菌、单核细胞增生李斯特氏菌有较好的抑制作用,菌株HCA6-2对大肠杆菌有较好的抑菌效果。
[1]QIN J,LI R,RAES J,et al.A human gut microbial gene catalogue established by metagenomic sequencing[J].Nature,2010,464(7285):59-65.
[2]TSUCHIDA S,KAKOOZA S,MBEHANG NGUEMA P P,et al.Characteristics of gorilla-specific Lactobacillus isolated from captive and wild gorillas[J].Microorganisms,2018,6(3):86.
[3]LANDETE J M.A review of food-grade vectors in lactic acid bacteria:from the laboratory to their application[J].Crit Rev Biotechnol,2017,37(3):296-308.
[4]LI M,WANG Y,CUI H,et al.Characterization of lactic acid bacteria isolated from the gastrointestinal tract of a wild boar as potential probiotics[J].Front Vet Sci,2020,7:49.
[5]李瑞,张旺东,李建飞,等.双峰驼源乳酸菌的分离鉴定与生物学特性分析[J].动物医学进展,2021,42(2):80-87.
[6]RIBOULET-BISSON E,STURME M H,JEFFERY I B,et al.Effect of Lactobacillus salivarius bacteriocin Abp118 on the mouse and pig intestinal microbiota[J].PloS One,2012,7(2):e31113.
[7]WANG A,RAN C,WANG Y,et al.Use of probiotics in aquaculture of China-a review of the past decade[J].Fish Shellfish Immun,2019,86:734-755.
[8]QIN J,LI Y,CAI Z,et al.A metagenome-wide association study of gut microbiota in type 2 diabetes[J].Nature,2012,490(7418):55-60.
[9]叶玉秀,雷湘兰,程文科,等.海南黑山羊研究进展与产业发展思路[J].热带农业科学,2016,36(10):114-118.
[10]焦金真,王芃芃,汤少勋,等.浏阳黑山羊胃肠道不同部位重要功能微生物的数量分布特征研究[J].畜牧兽医学报,2013,44(10):1590-1599.
[11]袁静.黑山羊胃肠微生物宏基因组文库构建及多样性研究[D].长沙:湖南农业大学,2012.
[12]张万昌,谭海生,杨劲松,等.海南黑山羊瘤胃液中乳酸菌的分离和鉴定[J].中国酿造,2017,36(12):83-87.
[13]LIU W J,BAO Q H,QING M J,et al.Isolation and identification of lactic acid bacteria from Tarag in Eastern Inner Mongolia of China by 16S rRNA sequences and DGGE analysis[J].Microbiol Res,2012,167(2):110-115.
[14]凌代文.乳酸细菌分类鉴定及实验方法[M].北京:中国轻工业出版社,1999:23.
[15]刘俊峰,尹雪,郭雪峰.新疆阿勒泰地区酸奶疙瘩中乳酸菌的分离和鉴定[J].中国酿造,2017,36(9):116-119.
[16]YANG J,CAO Y,CAI Y,et al.Natural populations of lactic acid bacteria isolated from vegetable residues and silage fermentation[J]. J Dairy Sci,2010,93(7):3136-3145.
[17]ALI G,LIU Q,YUAN X,et al.Characteristics of lactic acid bacteria isolates and their effects on the fermentation quality of acacia(Sophora japonica L.)leaf silage at low temperatures[J].Grassland Sci,2017,63(3):141-149.
[18]GULFAM A,GUO G,TAJEBE S,et al.Characteristics of lactic acid bacteria isolates and their effect on the fermentation quality of Napier grass silage at three high temperatures[J]. J Sci Food Agr,2017,97(6):1931-1938.
[19]ZHANG Q,YU Z.Characterization,identification and application of lactic acid bacteria isolated from Leymus chinensis silage[J].Grassland Sci,2017,63(2):111-117.
[20]TAMURA K,PETERSON D,PETERSON N,et al.MEGA5:molecular evolutionary genetics analysis using maximum likelihood,evolutionary distance,and maximum parsimony methods[J].Mol Biol Evol,2011,28(10):2731-2739.
[21]YANG J,TAN H,CAI Y.Characteristics of lactic acid bacteria isolates and their effect on silage fermentation of fruit residues[J]. J Dairy Sci,2016,99(7):5325-5334.
[22]赵山山,杨园园,周玉岩,等.贵州泡菜中乳酸菌的分离鉴定及其在泡菜发酵中的应用[J].中国酿造,2020,39(12):113-119.
[23]王欣,赵巍,甄玉国.不同来源乳酸菌的筛选及其抑菌效果比较[J].食品科技,2014,39(10):22-26.
[24]MUHAMMAD Z,RAMZAN R,ABDELAZEZ A,et al.Assessment of the antimicrobial potentiality and functionality of Lactobacillus plantarum strains isolated from the conventional inner Mongolian fermented cheese against food borne pathogens[J].Pathogens,2019,8(2):71.
[25]MUCK R,NADEAU E,MCALLISTER T,et al.Silage review:Recent advances and future uses of silage additives[J]. J Dairy Sci,2018,101(5):3980-4000.