醋酸菌是指以氧气为终端电子受体,氧化糖(主要是单糖和双糖)、醇和糖醇生成相应的有机酸、醛、酮等物质的革兰氏阴性细菌的总称[1-2]。醋酸菌因具有产生醋酸的能力而得名,被广泛用于食醋的生产。许多醋酸菌可产生维生素C、细菌纤维素、果聚糖等有益代谢产物,如氧化葡糖杆菌(Gluconobacter oxydans)中的很多菌株可用于葡萄糖酸生产[3],醋杆菌(Acetobacter)、葡糖醋杆菌(Gluconacetobacter)和驹形杆菌(Komagataeibacter)等均可产生细菌纤维素[4],公崎杆菌(Kozakia)和新朝井杆菌(Neoasaia)等可合成果聚糖[5]。最近,陈福生等[6]报道了葡糖醋杆菌FBFS97可以产活性物质苯乳酸(phenyllactic acid,PLA),并对其产PLA的能力进行了初步研究。
PLA化学名为2-羟基-3苯基丙酸或β-苯乳酸、3-苯基乳酸,分子式为C9H10O3。其对多种食源性致病菌[7-10]、腐败霉菌[11-13]都具有抑菌作用,也是一种可生物降解塑料—聚苯乳酸以及一些药物(如恩格列酮、司他丁和抗艾滋病药物)的合成前体[14-15]。因此,在食品、饲料、医药等领域有着巨大的应用潜力。
PLA可以通过化学和生物方法合成。生物合成法因具有副产物少、环境友好、合成过程可控等优势,成为许多学者努力的方向。已报道的可以合成PLA的微生物有白地霉[16]、丙酸菌[17]、乳酸菌[18-21]等。由于乳酸菌是公认安全的微生物,生物法合成PLA的研究主要围绕乳酸菌进行。
本研究通过单因素试验、Plackett-Burman试验、最陡爬坡试验以及响应面法优化葡糖醋杆菌FBFS97产PLA的发酵培养基和发酵条件,以提高PLA产量,为其推广应用奠定基础。
1 材料与方法
1.1 材料与试剂
葡糖醋杆菌(Gluconacetobacter sp.)FBFS97:由本实验室保存[6]。苯乳酸(分析纯):上海梯希爱化成工业发展有限公司;其他化学试剂均为国产分析纯。
种子培养基:葡萄糖10 g/L,酵母粉10 g/L,pH 5.6。121 ℃高压蒸汽灭菌20 min。
初始发酵培养基:葡萄糖100 g/L,酵母粉10 g/L,pH 5.6。121 ℃高压蒸汽灭菌20 min。
1.2 仪器与设备
LC-20AT高效液相色谱仪(high performance liquid chromatography,HPLC):日本岛津公司;Spursil C18-EP色谱柱(4.6 mm×250 mm):岛津(上海)实验器材有限公司。
1.3 方法
1.3.1 葡糖醋杆菌FBFS97种子液制备
将冻存的葡糖醋杆菌FBFS97接种于种子培养基,30 ℃、150 r/min振荡培养24 h,作为种子液备用。
1.3.2 发酵条件对葡糖醋杆菌FBFS97产PLA的影响单因素试验
以葡糖醋杆菌FBFS97为试验菌株,初始发酵培养基为基础,分别考察培养基组成的碳源(葡萄糖、果糖、蔗糖、麦芽糖浆、甘油、乳糖),氮源(酵母粉、玉米浆粉、豆粉、蛋白胨、牛肉膏、NH4NO3、(NH4)2SO4),无机盐(柠檬酸钠、K2HPO4、ZnSO4·7H2O、MnSO4、MgSO4·7H2O、FeSO4·7H2O、CuSO4·5H2O)添加量1.0 g/L,pH(3、4、5、6、7)以及发酵温度(15 ℃、20 ℃、25 ℃、30 ℃、35 ℃)、装液量(20 mL/250mL、40 mL/250 mL、60mL/250mL、80mL/250mL、100mL/250mL、120mL/250mL)对葡糖醋杆菌FBFS97产PLA的影响。
1.3.3 Plackett-Burman试验
在单因素试验的基础上,以果糖、酵母粉、K2HPO4添加量及pH、发酵温度和装液量为自变量,每个因素取两个水平,PLA产量为响应值,筛选出对PLA产量影响较为显著的因素。Plackett-Burman试验设计因素与水平见表1。
表1 Plackett-Burman试验因素与水平
Table 1 Factors and levels of Plackett-Burman experiment

1.3.4 最陡爬坡试验设计
根据Plackett-Burman试验结果,将显著影响因子根据正负效应往最优方向进行调整,设计合理步长,逼近最强响应区域。
1.3.5 发酵条件优化响应面试验
根据最陡爬坡试验结果,以酵母粉、pH、装液量为评价因素,以PLA产量(Y)为响应值,利用Design Expert 8.06软件进行Box-Behnken试验设计。根据响应面试验得出的最佳发酵条件,进行摇瓶发酵培养,确定优化结果。
1.3.6 测定方法
将培养液8 000 r/min离心5 min,上清液0.22 μm滤膜过滤后,采用HPLC法测定PLA的含量。每次试验设3个平行。
高效液相色谱工作条件[22]:流动相为0.1%的甲酸水溶液(A)和乙腈(B);采用梯度洗脱:0~15 min,80% A;15~20 min,10% A;20.01~25 min,80% A;流速1 mL/min;进样量10 μL;柱温40 ℃;检测器为二极管阵列检测器;检测波长210 nm。
以苯乳酸标准品作为外标,进行定量分析。
2 结果与分析
2.1 单因素试验结果
探究碳源、氮源、无机盐、pH、发酵温度和装液量6个单因素对葡糖醋杆菌FBFS97合成PLA的影响,结果见图1。由图1可知,以葡萄糖、果糖、蔗糖、麦芽糖浆、甘油、乳糖作为候选碳源,筛选出最优碳源为果糖,PLA产量为103.33 mg/L;以酵母粉、玉米浆粉、豆粉、蛋白胨、牛肉膏、NH4NO3、(NH4)2SO4为候选氮源,筛选出最优氮源为酵母粉,PLA产量为77.84 mg/L;以柠檬酸钠、K2HPO4、ZnSO4·7H2O、MnSO4、MgSO4·7H2O、FeSO4·7H2O、CuSO4·5H2O为候选无机盐,筛选出最优无机盐为K2HPO4,PLA产量为86.1 mg/L;最佳发酵条件为pH 5.0、发酵温度25 ℃、装液量40 mL/250 mL,相应条件时PLA产量分别为66.71 mg/L、71.22 mg/L和51.06 mg/L。上述结果与醋酸菌的特性以及PLA合成途径的影响因素相符。醋酸菌最适生长温度约30 ℃,超过34 ℃几乎不生长,少数醋酸菌可以耐受42 ℃的高温[23]。装液量与发酵液的溶氧量有关,醋酸菌是好氧细菌,O2有利于醋酸菌生长与代谢,并对发酵速率影响显著[24]。果糖在PLA生物合成过程中可充当电子受体,促进PLA的合成[25]。K2HPO4能显著提高乳酸片球菌CRL 1753产PLA能力[26],因为钾离子对PLA合成相关的莽草酸途径中的多种酶具有激活作用[27]。
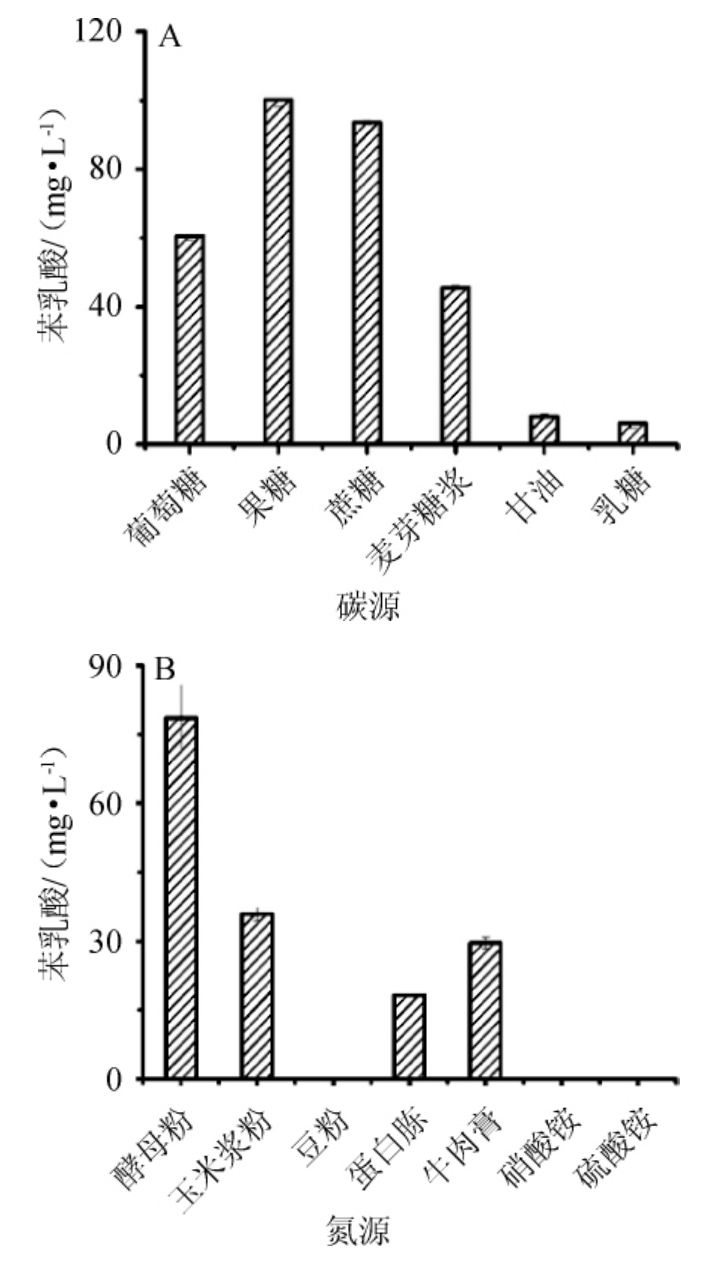
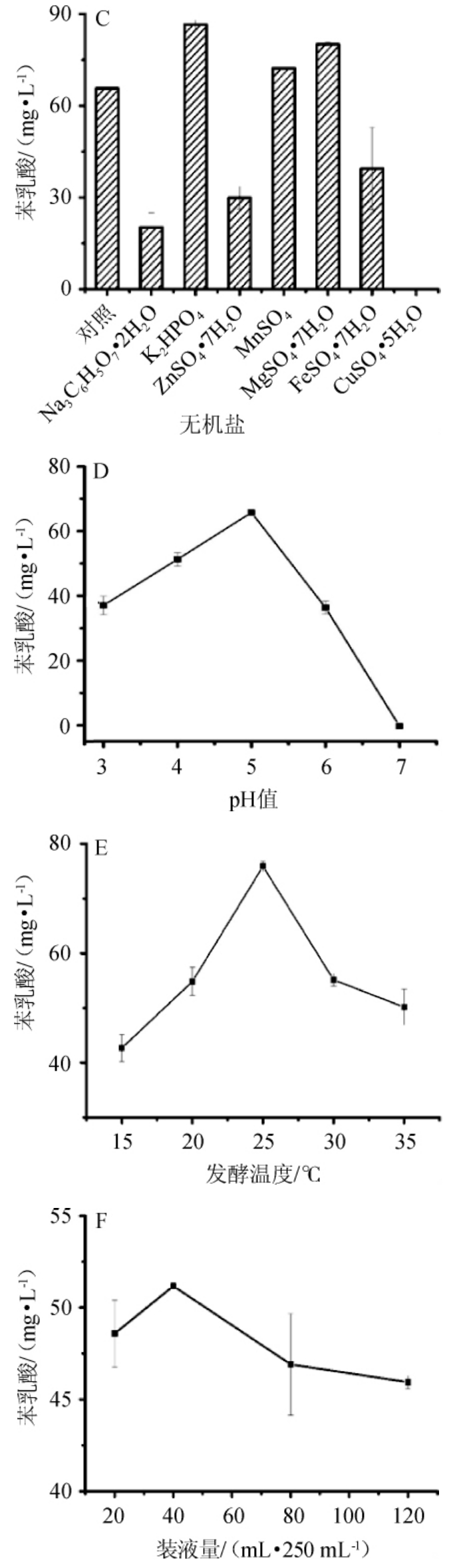
图1 碳源(A)、氮源(B)、无机盐(C)、pH值(D)、发酵温度(E)、装液量(F)对葡糖醋杆菌FBFS97产苯乳酸的影响
Fig.1 Effect of carbon source (A),nitrogen source (B),inorganic salt(C),pH (D),fermentation temperature (E),loaded liquid (F) on phenyllactic acid production by Gluconacetobacter sp.FBFS97
2.2 Plackett-Burman试验结果
Plackett-Burman试验结果见表2,采用Design Expert 8.0.6软件对各试验因素做主效应分析,结果见表3。由表3可知,对PLA产量影响的因素从大到小的排序分别为B(酵母粉)、D(pH)、F(装液量),其他因素对结果影响不显著(P>0.05)。
表2 Plackett-Burman试验设计及结果
Table 2 Design and results of Plackett-Burman experiments
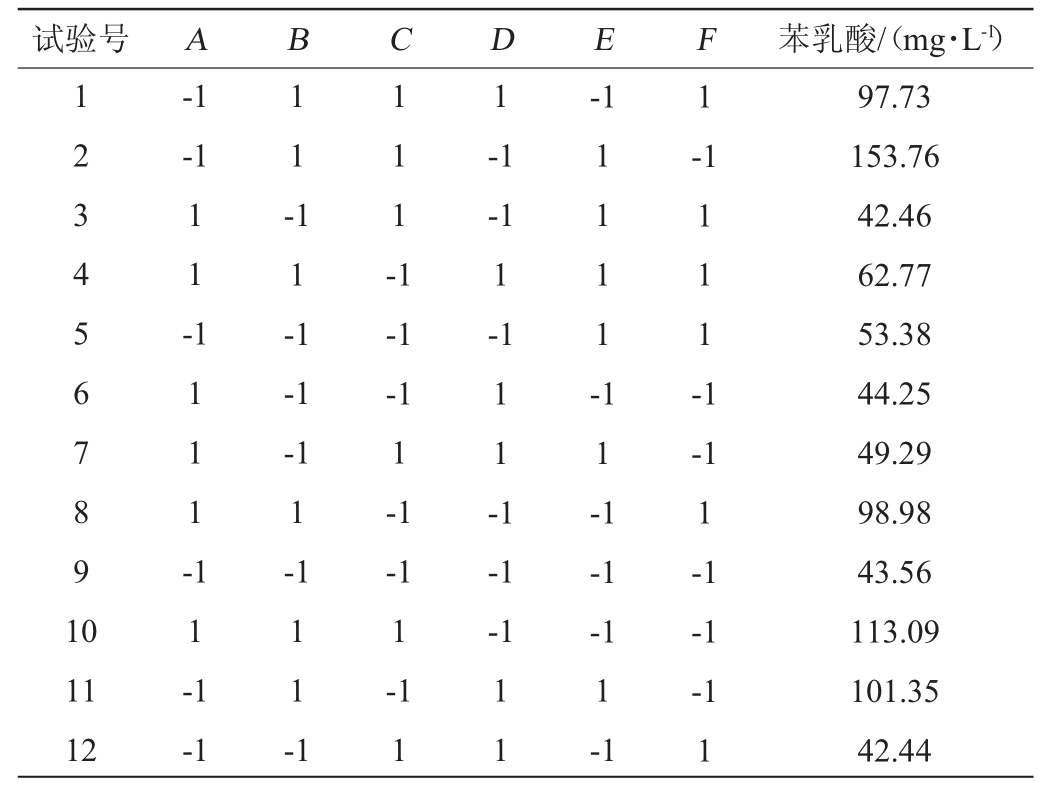
表3 Plackett-Burman试验方差分析及主效应分析
Table 3 Variance analysis and main effect analysis of Plackett-Burman experiments
注:“*”表示对结果影响显著(P<0.05),“**”表示对结果影响极显著(P<0.01)。
2.3 最陡爬坡试验结果
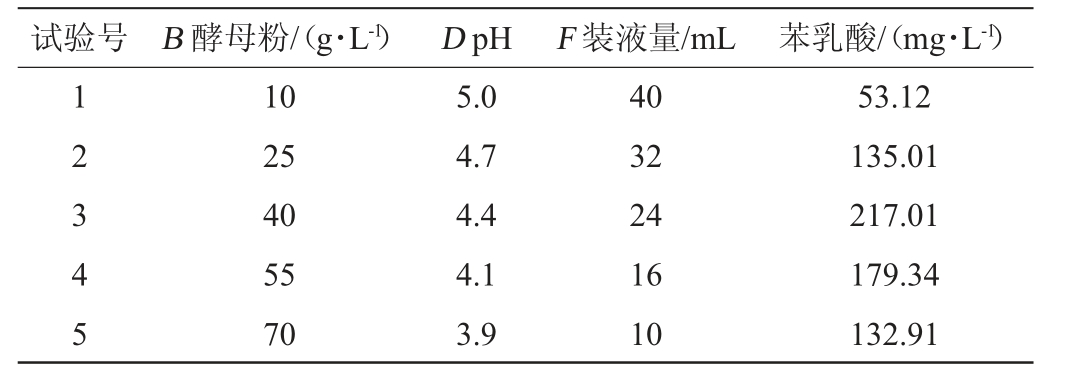
根据Plackett-Burman试验结果,B因素呈正效应,D和F因素呈负效应。设计最陡爬坡试验,结果见表4。由表4可知,在第3组试验的条件下,PLA产量最大,故以第3组试验的条件作为响应面试验因素的中心点。
表4 最陡爬坡试验设计及结果
Table 4 Design and results of the steepest climbing experiments
2.4 响应面试验结果
根据最陡爬坡试验得到的中心点,应用Design-Expert 8.0.6软件,采用Box-Behnken设计方案对PLA发酵进行3因子3水平的响应面分析,以酵母粉(A)、pH(B)、装液量(C)为自变量,以PLA产量(Y)为响应值,试验设计方案及结果见表5。对表5数据进行多元回归拟合,并对该模型及相关参数进行方差分析,结果见表6。
表5 Box-Behnken试验设计及结果
Table 5 Design and results of Box-Behnken experiments
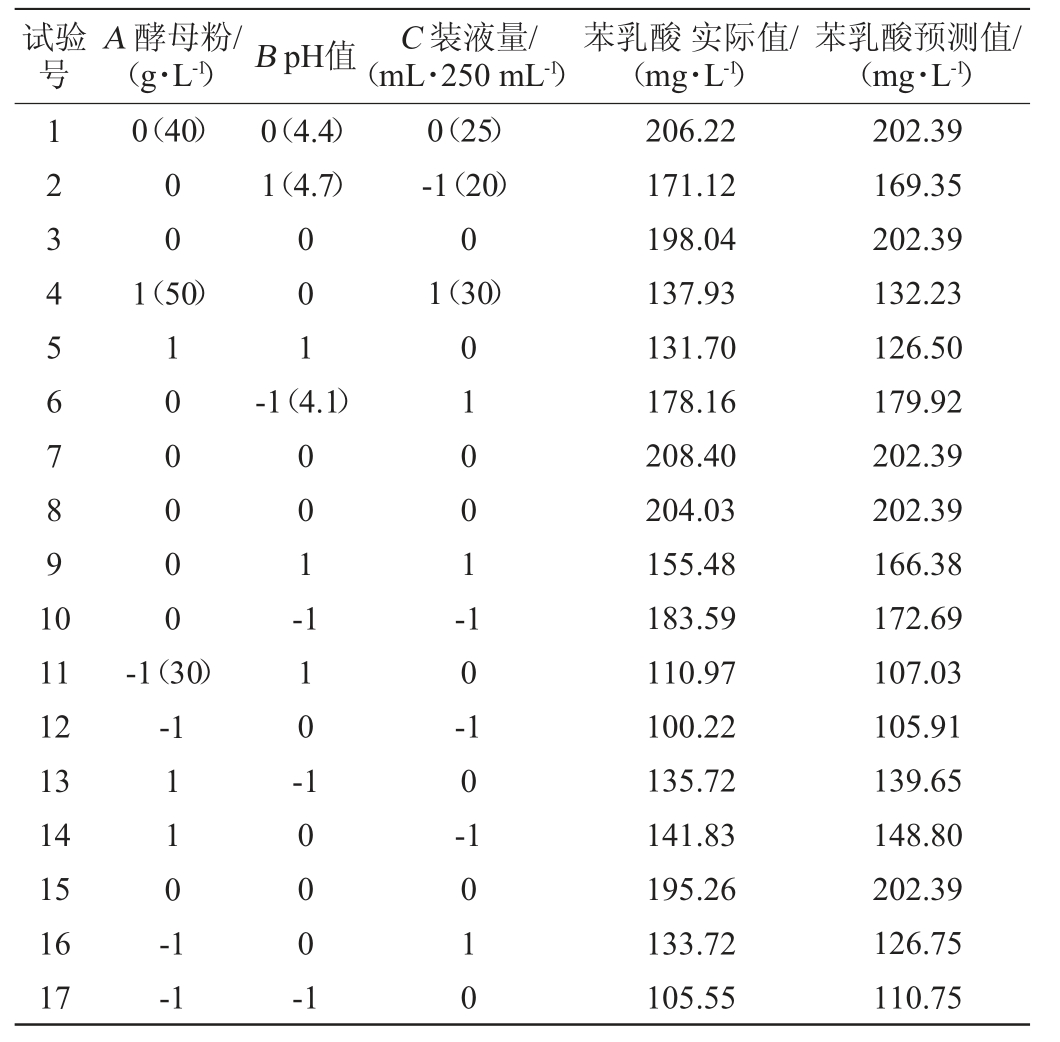
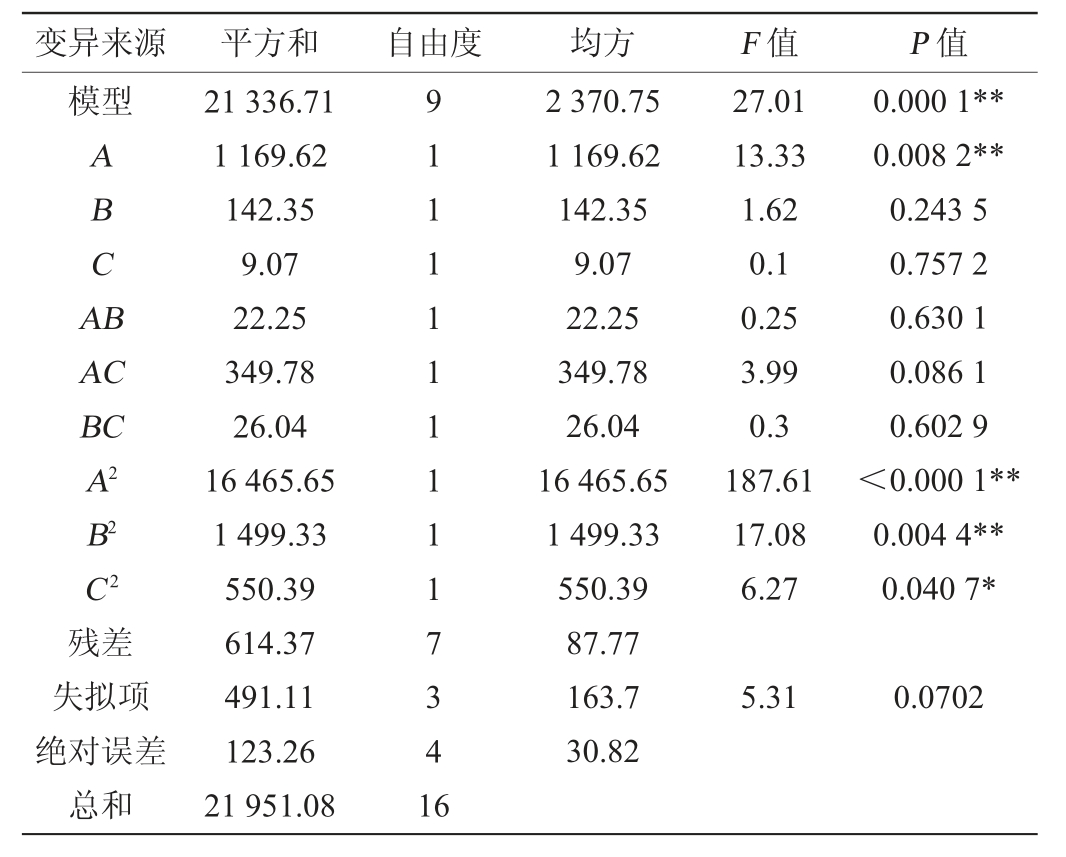
表6 响应面试验回归模型方差分析
Table 6 Variance analysis of regression model of response surface experiments
注:“*”表示对结果影响显著(P<0.05);“**”表示对结果影响极显著(P<0.01)。
对表5数据进行响应面二次回归拟合,得到二次多项回归方程:Y=202.39+12.09A-4.22B+1.07C-2.36AB-9.35AC-2.55BC-62.53A2-18.87B2-11.43C2
由表6可知,回归模型极显著(P<0.01),失拟项不显著(P>0.05),表明回归模型与实际值非常吻合。该模型的决定系数R2为0.972,表明该回归方程与实际拟合度较好,预测值与实际值的相关性好。一次项A对产PLA具有极显著影响(P<0.01);交互项影响均不显著(P>0.05)。构建酵母粉与pH、装液量三者相互影响的响应面及等高线,结果见图2。
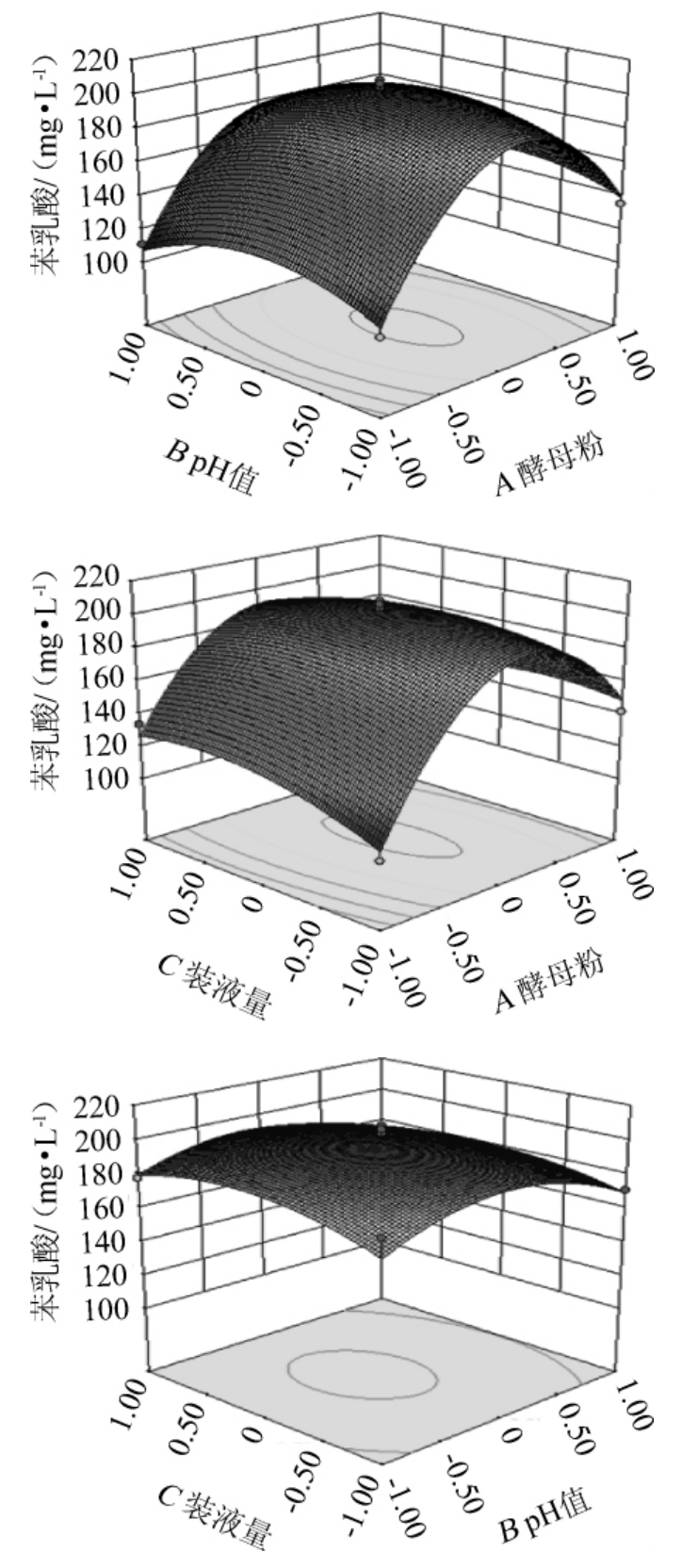
图2 酵母粉、pH值和装液量交互作用对苯乳酸产量影响的响应面及等高线
Fig.2 Response surface plots and contour lines of effects of interaction between yeast powder,pH and loaded liquid on phenyllactic acid production
由模型和软件分析得到葡糖醋杆菌FBFS97产苯乳酸的最优发酵条件:培养基组成为果糖100 g/L、酵母粉40 g/L、K2HPO4 1.2 g/L,在pH为4.4,装液量24 mL/250 mL发酵,温度为28 ℃条件下150 r/min振荡培养8 d,PLA产量达217 mg/L,是优化前的3.52倍。
3 结论
采用响应面法对葡糖醋杆菌FBFS97发酵产PLA的培养基组成及发酵条件进行优化,优化后的培养基成分为果糖100 g/L、酵母粉40 g/L、K2HPO4 1.2 g/L,pH为4.4;发酵条件为装液量24 mL/250 mL,于28 ℃、150 r/min振荡培养8 d。在此优化条件下,PLA产量达217 mg/L,是优化前的3.52倍。
[1]DE ROOS J,DE VUYST L.Acetic acid bacteria in fermented foods and beverages[J].Curr Opin Biotech,2018,49:115-119.
[2]王斌,陈福生.醋酸菌的分类进展[J].中国酿造,2014,33(12):1-10.
[3]SAINZ F,NAVARRO D,MATEO E,et al.Comparison of D-gluconic acid production in selected strains of acetic acid bacteria[J].Int J Food Microbiol,2016,222:40-47.
[4]LIN S P,LOIRA CALVAR I,CATCHMARK J M,et al.Biosynthesis,production and applications of bacterial cellulose[J]. Cellulose,2013,20(5):2191-2219.
[5]GOMES R J,BORGES M F,ROSA M D F.Acetic acid bacteria in the food industry:Systematics,characteristics and applications[J]. Food Technol Biotech,2018,56(2):139-151.
[6]陈福生,陈亨业.一株高产苯乳酸的葡糖醋杆菌及其苯乳酸的制备方法:CN201610853578.0[P].2016-09-27.
[7]NING Y W,YAN A H,YANG K,et al.Phenyllactic acid against Listeria monocytogenes and Escherichia coli by dual mechanisms[J]. Food Chem,2017,228:533-540.
[8]CHATTERJEE M,D'MORRIS S,PAUL V,et al.Mechanistic understanding of phenyllactic acid mediated inhibition of quorum sensing and biofilm development in Pseudomonas aeruginosa[J]. Appl Microb Cell Physiol,2017,101:8223-8236.
[9]ZHENG R,ZHAO T,HUNG Y C,et al.Evaluation of bactericidal effects of phenyllactic acid on Escherichia coli O157:H7 and Salmonella typhimurium on beef meat[J].J Food Protect,2019,82(12):2016-2022.
[10]LIU F,SUN Z L,WANG F T,et al.Inhibition of biofilm formation and exopolysaccharide synthesis of Enterococcus faecalis by phenyllactic acid[J].Food Microbiol,2019,86:103344.
[11]CROWLEY S,MAHONY J,SINDEREN D V.Current perspectives on antifungal lactic acid bacteria as natural bio-preservatives[J].Trends Food Sci Tech,2013,33:93-109.
[12]FAN W,REN H,WANG Y,et al.Orthogonal array design for optimization of phenyllactic acid-sodium alginate blend coating and its effect on the browning and quality of minimally processed lily bulbs[J].J Sci Food Agr,2019,99(6):2835-2845.
[13]GUIMARÃES A,SANTIAGO A,JOSÉ A,et al.Anti-aflatoxigenic effect of organic acids produced by Lactobacillus plantarum[J].Int J Food Microbiol,2018,264:31-38.
[14]FUJITA T,NGUYEN H D,ITO T,et al.Microbial monomers custom-synthesized to build true bio-derived aromatic polymers[J].Biotechnol Prod Process Eng,2013,97:8887-8894.
[15]LI J F,LI X Q,LIU Y,et al.Directed modification of L-LcLDH1,an L-lactate dehydrogenase from Lactobacillus casei,to improve its specific activity and catalytic efficiency towards phenylpyruvic acid[J].J Biotechnol,2018,281:193-198.
[16]DIEULEVEUX V,GUÉGUEN M.Antimicrobial effects of D-3-phenyllactic acid on Listeria monocytogenes in TSB-YE medium,milk,and cheese[J].J Food Protect,1998,61:1281-1285.
[17]LIND H,JONSSON H,SCHNÜRER J.Antifungal effect of dairy propionibacteria-contribution of organic acids[J].Int J Food Microbiol,2005,98:157-165.
[18]LAVERMICOCCA P,VALERIO F,EVIDENTE A,et al.Purification and characterization of novel antifungal compounds from the sourdough Lactobacillus plantarum strain 21B[J].Appl Environ Microbiol,2000,66:4084-4090.
[19]李兴峰,江波,潘蓓蕾,等.苯丙氨酸及苯丙酮酸对Lactobacillus sp.SK007 合成苯乳酸的影响[J].过程工程学报,2007(7):152-156.
[20]MU W,YU S,ZHU L,et al.Recent research on 3-phenyllactic acid,a broadspectrum antimicrobial compound[J].Appl Microbiol Biot,2012,95(5):1155-1163.
[21]WU W,DENG G,LIU C,et al.Optimization and multiomic basis of phenyllacticacidoverproductionbyLactobacillusplantarum[J].J Agr Food Chem,2020,68,1741-1749.
[22]吴仁蔚,陈亨业,郭俊陆,等.食醋中苯乳酸的提取、鉴定及含量比较[J].中国酿造,2020,39(1):66-70.
[23]SAICHANA N,MATSUSHITA K,ADACHI O,et al.Acetic acid bacteria:A group of bacteria with versatile biotechnological applications[J].Biotechnol Adv,2015,33:1260-1271.
[24]GULLO M,VERZELLONI E,CANONICO M.Aerobic submerged fermentation by acetic acid bacteria for vinegar production:Process and biotechnological aspects[J].Process Biochem,2014,49(10):1571-1579.
[25]DALLAGNOL A M,CATALÁN C A N,MERCADO M I,et al.Effect of biosynthetic intermediates and citrate on the phenyllactic and hydroxyphenyllactic acids production by Lactobacillus plantarum CRL 778[J].J Appl Microbiol,2011,111(6):1447-1455.
[26]YANINA B A,GRACIELA F D V,LUCIANA G C.Optimization of phenyllactic acid production by Pediococcus acidilactici CRL 1753.Application of the formulated bio-preserver culture in bread[J]. Biol Control,2018,123:137-143.
[27]张传志.重组谷氨酸棒杆菌发酵L-苯丙氨酸培养基的优化[J].微生物学通报,2015,42(1):74-84.